Что значит полярный в химии
Полярные вещества
Поля́рные вещества́ в химии — вещества, молекулы которых обладают электрическим дипольным моментом. Для полярных веществ, в сравнении с неполярными, характерны высокая диэлектрическая проницаемость (более 10 в жидкой фазе), повышенные температура кипения и температура плавления.
Дипольный момент обычно возникает вследствие разной электроотрицательности составляющих молекулу атомов, из-за чего связи в молекуле приобретают полярность. Однако, для приобретения дипольного момента требуется не только полярность связей, но и соответственное их расположение в пространстве. Молекулы, имеющие форму, подобную молекулам метана либо двуокиси углерода, являются неполярными.
Полярные растворители наиболее охотно растворяют полярные вещества, а также обладают способностью сольватировать ионы. Примерами полярного растворителя являются вода, спирты и другие вещества.
См. также
Полезное
Смотреть что такое «Полярные вещества» в других словарях:
Полярные сияния* — в средних и высоких широтах ночью можно видеть световое явление, в северном полушарии появляющееся обыкновенно на северной стороне небосклона, которое называют северным сиянием (народное название на сев. России сполох. Aurore boré ale, Nordlicht … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Полярные сияния — в средних и высоких широтах ночью можно видеть световое явление, в северном полушарии появляющееся обыкновенно на северной стороне небосклона, которое называют северным сиянием (народное название на сев. России сполох. Aurore boréale, Nordlicht,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Полярные струйные течения — Полярное струйное течение, или джет часто наблюдаемое в космосе явление, когда из компактного объекта вдоль его оси вращения выбрасываются потоки вещества. Причиной обычно служат динамические взаимодействия внутри аккреционного диска. Когда… … Википедия
Поверхностно-активные вещества — (a. surfactants; н. grenzflachenaktive Stoffe, oberflachenaktive Stoffe; ф. substances tensio actives; и. surfac tantes), вещества c асимметричной мол. структурой, молекулы к рых имеют дифильное строение, т.e. содержат лиофильные и… … Геологическая энциклопедия
ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА — вещества, способные адсорбироваться на поверхности раздела двух фаз, понижая её поверхностное натяжение. К П. а. в. относятся органич. соединения с асимметричной мол. структурой, молекулы к рых содержат ат. группы, резко различающиеся характером… … Физическая энциклопедия
Поверхностно-активные вещества ПАВ — ► surfactant species Вещества с асимметричной молекулярной структурой, молекулы которых имеют дифильное строение, т. е. содержат лиофильные и лиофобные (обычно гидрофильные полярные группы и гидрофобные радикалы) атомные группы. Дифильная… … Нефтегазовая микроэнциклопедия
Пассивный транспорт — Пассивный транспорт перенос веществ по градиенту концентрации из области высокой концентрации в область низкой, без затрат энергии (например, диффузия, осмос). Диффузия пассивное перемещение вещества из участка большей концентрации к… … Википедия
Собиратель — (a. collector; н. Sammler; ф. collecteur; и. coagulante, sustancia para hidrofobizacion particulas en el proceso de flotacion) органич. соединение, предназначенное для гидрофобизации минеральных частиц, гл. обр. при флотации п. и. C.… … Геологическая энциклопедия
Гемато-энцефалический барьер — Взаимоотношение клеток ткани мозга и капилляра: 1. Эпендима 2. Нейрон 3. Аксон 4. Шванновская клетка 5. Астроцит 6 … Википедия
Активный уголь — активированный уголь, получают из ископаемых или древесных углей удалением смолистых веществ и созданием разветвленной сети пор. Обладает высокоразвитой поверхностью, благодаря этому поглощает (адсорбирует) многие вещества (особенно… … Большая советская энциклопедия
Полярные и неполярные молекулы — строение, свойства и примеры
Полярные и неполярные молекулы – две группы, на которые подразделяются все диэлектрики.
Полярные по-другому называются дипольными. А неполярные являются нейтральными или бездипольными.
Что такое полярность в химии
Полярность – свойство, показывающее изменение распределения электронной плотности около ядер, если сравнивать с изначальным ее распределением в образующих данную связь нейтральных частицах.

Поляризуемость — способность поляризоваться под воздействием электрического поля.
Мерой полярности называется электрический момент диполя. В нейтральных соединениях он равен нулю. Его значение зависит от разности электроотрицательностей элементов.
Длина диполя — расстояние между его полюсами. Данная характеристика также влияет на степень полярности.
Любое соединение состоит из ядра (положительные частицы) и электронов (отрицательные частицы). И положительные, и отрицательные частицы имеют свой электрический центр тяжести.
Если центры тяжести частиц совпадают, то соединение считается неполярным. Если же полюса не накладываются друг на друга, то в этом случае речь идет о дипольной связи.
Примеры полярных молекул
Эта связь образуется, если вещество состоит из атомов разных элементов и ассиметрична (имеются неспаренные электроны). Такие соединения имеют угловую, изогнутую геометрическую форму.
Например, это такие газы как NH3, SO2, NO2 и жидкость – вода.
Примеры неполярных молекул
В качестве примера таких связей можно привести молекулы, состоящие из одинаковых атомов: H2, Cl2, O2, N2, F2 и т. д.
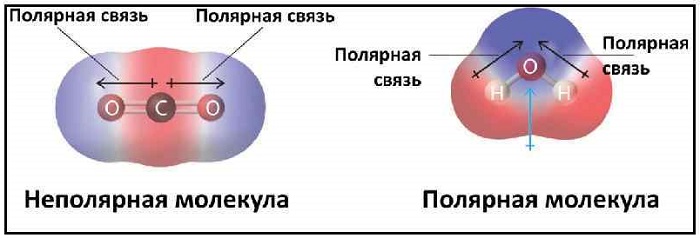
Эта связь также может встречаться в соединениях, состоящих из атомов разных элементов и при этом являющихся симметричными (линейные, тетраэдрические и т. д.). Такими веществами являются: BeH2, BF3, CH4, CO2(углекислый газ) и SO3.
При нейтральной связи электронное облако равномерно распределяется между ядрами всех атомов данного вещества. Поэтому ядра действуют на него в равной мере.
Как определить полярность молекулы и от чего она зависит
Чтобы определить, является ковалентная связь дипольной или нет, необходимо посмотреть на химическую формулу вещества.

Если молекула состоит из атомов одного и того же вещества, то она в любом случае нейтральна.
Если же молекулярное строение является сложным, то речь может идти как о полярной, так и неполярной ковалентной связи. Это зависит от геометрической формы.
Полярные и неполярные молекулы (Пример)
ЧТО ТАКОЕ ПОЛЯРНЫЕ И НЕПОЛЯРНЫЕ МОЛЕКУЛЫ
Во всякой молекуле имеются как положительно заряженные частицы — ядра атомов, так и отрицательно заряженные — электроны. Для каждого рода частиц (или, вернее, зарядов) можно найти такую точку, которая будет являться как бы их «электрическим центром тяжести».
Эти точки называются полюсами молекулы. Если в молекуле электрические центры тяжести положительных и отрицательных зарядов совпадут, то молекула будет неполярной.
Пример неполярной молекулы
Но если молекула построена несимметрично, например состоит из двух разнородных атомов, то, как мы уже говорили, общая пара электронов может быть в большей или меньшей степени смещена в сторону одного из атомов. Очевидно, что в этом случае, вследствие неравномерного распределения положительных и отрицательных зарядов внутри молекулы, их электрические центры тяжести не совпадут и получится полярная молекула (рис.).
Полярные молекулы это
Полярные молекулы являются диполями. Этим термином обозначают вообще всякую электронейтральную систему, т. е. систему, состоящую из положительных и отрицательных зарядов, распределенных таким образом, что их электрические центры тяжести не совпадают.
Расстояние между электрическими центрами тяжести тех и других зарядов (между полюсами диполя) называется длиной диполя. Длина диполя характеризует степень полярности молекулы. Понятно, что для различных полярных молекул длина диполя различна; чем она больше, тем резче выражена полярность молекулы.

На практике степень полярности тех или иных молекул устанавливают путем измерения так называемого дипольного момента молекулы т, который определяется как произведение длины диполя l на заряд его полюса е:
Дипольные моменты
Дипольные моменты некоторых веществ
Хлористый водород……. 1,04
Двуокись углерода……. 0
Йодистый водород…….. 0,38
Окись углерода ……. 0,11
Определение величин дипольных моментов позволяет сделать много интересных выводов относительно строения различных молекул. Рассмотрим некоторые из этих выводов.

Как и следовало ожидать, дипольные моменты молекул водорода и азота равны нулю; молекулы этих веществ совершенно симметричны и, следовательно, электрические заряды в них распределены равномерно. Отсутствие полярности у двуокиси углерода и у сероуглерода показывает, что их молекулы также построены симметрично. Строение молекул этих веществ схематически изображено на рис. 2.
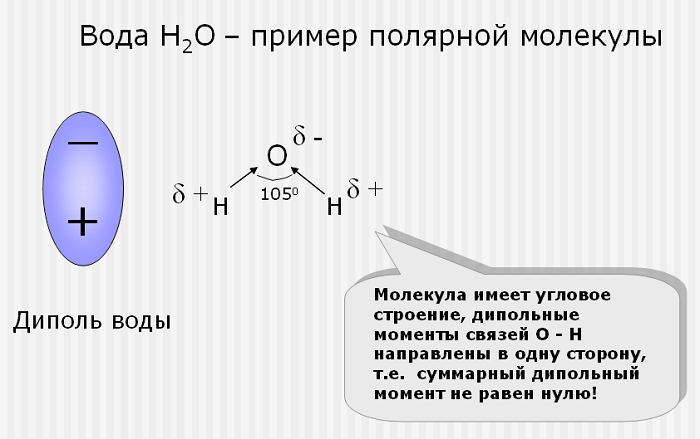
Несколько неожиданным является наличие довольно большого дипольного момента у воды. Так как формула воды аналогична формулам двуокиси углерода и сероуглерода, то следовало ожидать, что её молекулы будут построены так же симметрично, как и молекулы CS2 и СО2.
Однако ввиду экспериментально установленной полярности молекул воды (полярности молекул) это предположение приходится отбросить. В настоящее время молекуле воды приписывают несимметричное строение (рис. 3): два атома водорода соединены с атомом кислорода так, что их связи образуют угол около 105°. Аналогичное расположение атомных ядер имеется и в других молекулах такого же типа (H2S, SO2), обладающих дипольными моментами.
Полярностью молекул воды объясняются многие ее физические свойства.
Вы читаете, статья на тему Полярные и неполярные молекулы
Похожие страницы:
Понравилась статья поделись ей
Полярные и неполярные молекулы – две группы, на которые подразделяются все диэлектрики.
Полярные по-другому называются дипольными. А неполярные являются нейтральными или бездипольными.
Что такое полярность в химии
Полярность – свойство, показывающее изменение распределения электронной плотности около ядер, если сравнивать с изначальным ее распределением в образующих данную связь нейтральных частицах.
Поляризуемость — способность поляризоваться под воздействием электрического поля.
Мерой полярности называется электрический момент диполя. В нейтральных соединениях он равен нулю. Его значение зависит от разности электроотрицательностей элементов.
Длина диполя — расстояние между его полюсами. Данная характеристика также влияет на степень полярности.
Любое соединение состоит из ядра (положительные частицы) и электронов (отрицательные частицы). И положительные, и отрицательные частицы имеют свой электрический центр тяжести.
Если центры тяжести частиц совпадают, то соединение считается неполярным. Если же полюса не накладываются друг на друга, то в этом случае речь идет о дипольной связи.
Примеры полярных молекул
Эта связь образуется, если вещество состоит из атомов разных элементов и ассиметрична (имеются неспаренные электроны). Такие соединения имеют угловую, изогнутую геометрическую форму.
Примеры неполярных молекул
Эта связь также может встречаться в соединениях, состоящих из атомов разных элементов и при этом являющихся симметричными (линейные, тетраэдрические и т. д.). Такими веществами являются: BeH2, BF3, CH4, CO2(углекислый газ) и SO3.
При нейтральной связи электронное облако равномерно распределяется между ядрами всех атомов данного вещества. Поэтому ядра действуют на него в равной мере.
Как определить полярность молекулы и от чего она зависит
Чтобы определить, является ковалентная связь дипольной или нет, необходимо посмотреть на химическую формулу вещества.
Если молекула состоит из атомов одного и того же вещества, то она в любом случае нейтральна.
Если же молекулярное строение является сложным, то речь может идти как о полярной, так и неполярной ковалентной связи. Это зависит от геометрической формы.
Химическая связь. Типы химической связи
Диссоциация хлорида натрия в воде
Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
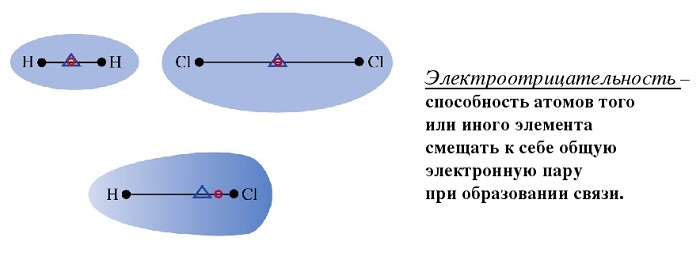
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Основные типы химических связей — ковалентная, ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Основные свойства ковалентных связей
Эти свойства связи влияют на химические и физические свойства веществ.
Насыщаемость — это способность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется валентностью.
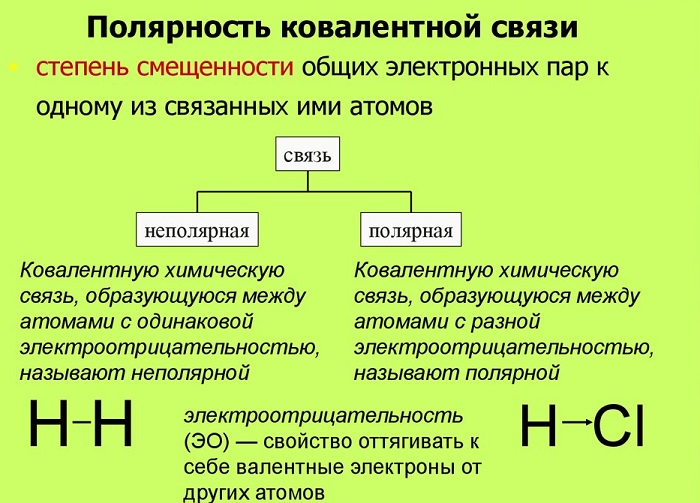
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.
Ковалентная неполярная химическая связь
Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Ковалентная полярная химическая связь
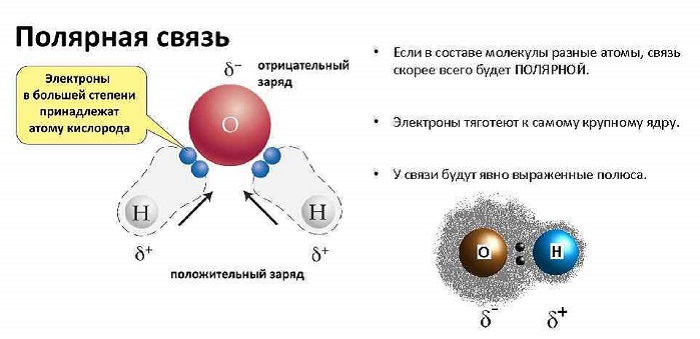
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
2. Донорно-акцепторный механизм образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару ( донор ), а другой атом предоставляет вакантную орбиталь для этой пары ( акцептор ). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;
– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например , в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Ионная химическая связь
Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.
+11 Na ) 2 ) 8 ) 1 — 1e = +11 Na + ) 2 ) 8
+17 Cl ) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Обратите внимание:
Наглядно обобщим различие между ковалентными и ионным типами связи:
Металлическая химическая связь
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Межмолекулярные взаимодействия
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение температуры кипения.