Что значит получен рост нормальной микрофлоры
Гинекологический мазок «на флору»: на что смотреть, и как понять
Большинству женщин мазок «на флору» знаком, как самый «простой» гинекологический анализ. Однако исследование куда «полезнее», чем может казаться. И всего несколько (а то и одно) отклонений способны подсветить значимые проблемы, еще до появления каких-либо симптомов. Так как же понять полученные результаты? Рассказываем по пунктам.
1. Эпителий
Как известно, любой живой объект в природе имеет ограниченный срок жизни, по истечении которого он погибает «от старости».
Эпителий в гинекологическом мазке – это и есть слущенные «старые» клетки слизистой оболочки влагалища, цервикального или уретры (в зависимости от оцениваемого локуса). Которые могут присутствовать в материале в умеренных количествах.
Превышение нормативных пределов («много» или «обильно») может указывать на:
Уменьшение или отсутствие эпителия в мазке – на атрофические изменения, недостаток эстрадиола или избыток андрогенов.
Кроме того, ввиду зависимости эпителия от уровня половых гормонов, его количество в материале может сильно меняться в зависимости от дня цикла, начиная с единичного «в поле зрения» в самом начале – до умеренного и даже большого количества ближе к овуляции и во время нее.
А появление в мазке так называемых «ключевых клеток» (эпителий, «облепленный» мелкими кокковыми бактериями) – является маркером бактериального вагиноза.
2. Лейкоциты
«Норма» лейкоцитов в мазке также сильно зависит от стадии цикла и уровня половых гормонов, а также исследуемого локуса.
Так, за «максимум» для:
Повышение показателя – очевидно, свидетельствует о воспалении, а полное отсутствие может иметь место в норме в самом начале цикла.
Слизь
Результат «отсутствует», «мало» или «умеренно» для этого показателя является нормой, что тоже связано с индивидуальными особенностями гормонального фона и циклом.
А вот «много» слизи в мазке – может свидетельствовать о том, что мазок взят в середине цикла, дисбиотических изменениях или избытке эстрогенов. Поэтому требует внимания специалиста или, как минимум, контроля в динамике.
Флора
Преобладающей флорой женских половых путей в норме у женщин репродуктивного возраста, как известно, являются лактобактерии (или палочки Дедерлейна). Количество которых может быть от умеренного до обильного, в том зависимости, в том числе, от фазы менструального цикла.
Патологические элементы
Присутствия мицелия грибов, трихомонад, диплококков (в том числе и возбудитель гонореи), лептотрикса, мобилункуса и прочих патогенных микроорганизмов в нормальном мазке не допускается, даже в минимальном количестве. А их выявление – серьезный повод незамедлительно обратиться за лечением.
Новые функции кишечной микрофлоры
«Мы есть то, что мы едим» (Гиппократ).
Автор
Редакторы
Статья на конкурс «био/мол/текст»: «Мы есть то, что мы едим». Так говорил Гиппократ. Но мог ли он себе представить, насколько он был прав? Судя по последним научным данным, потребляемая пища очень сильно влияет на нашу кишечную микрофлору, которая в конечном счете влияет на наш организм. Причем влияет вполне осязаемо — например, меняя наш вес! Получается замкнутый круг: человек — микрофлора — человек.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2016.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Спонсор публикации этой статьи — Алексей Петрович Семеняка.
Давно известна роль кишечной микрофлоры в регуляции многих процессов организма. К примеру, она формирует защитный барьер слизистой оболочки кишечника, стимулирует иммунную систему [1], нейтрализует токсины, продуцирует витамины, переваривает клетчатку и многое-многое другое. Но наука, как известно, не стоит на месте, и появляются новые данные. Так, например, теперь рассматривается взаимосвязь между состоянием кишечной микрофлоры и ожирением, а также развитием сахарного диабета (СД) 2-го типа!
Что такое нормофлора и каковы ее функции
Напомним, что представляет собой нормальная микрофлора человека. Нормофлора (микрофлора в нормальном состоянии, или эубиоз) — это совокупность микробных популяций отдельных органов и систем, характеризующаяся определенным качественным и количественным составом и поддерживающая биохимическое и иммунологическое равновесие, необходимое для сохранения здоровья человека.
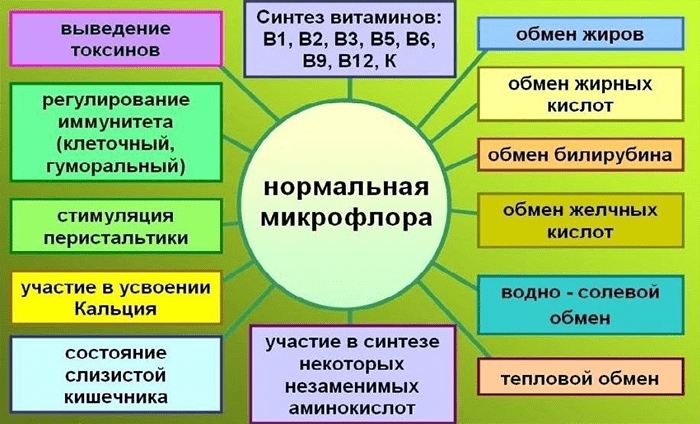
Кишечный микробиом, упоминаемый некоторыми авторами как отдельный орган, несет ответственность за метаболические процессы в организме (рис. 1). Бактерии инактивируют ферменты, гормоны, токсины, разлагают желчные кислоты, нейтрализуют аллергены, образуют молочную кислоту, что помогает пищеварению, способствуют всасыванию витаминов D и B12, кальция и железа в кишечнике, а также синтезируют витамины B1, B2, B6, B12, H, К, C, никотиновую, пантотеновую и фолиевую кислоты [2]. Микрофлора определяет в значительной степени не только физическую составляющую человеческой жизни, но и психическую. Обнаружено, что отходы жизнедеятельности бактерий могут непосредственно влиять на мозг. Например, как минимум два типа кишечных бактерий производят γ-аминомасляную кислоту (ГАМК) [3] — нейромедиатор, ответственный за своевременное гашение процессов возбуждения в центральной нервной системе, а возможно, и помогающий поддерживать нормальный сон и усваивать глюкозу [4]. А последние научные разработки касаются связи состава кишечной микробиоты с проявлением аутизма и депрессии.
Рисунок 1. Основные функции нормальной микрофлоры.
Метаболическая активность кишечной микробиоты, помимо удовлетворения собственных нужд бактерий, способствует извлечению калорий из потребляемой хозяином пищи, помогает запасать эту энергию в его жировых депо, то есть формировать жировую ткань. В экспериментах с гнотобиотическими (безмикробными) и заселенными определенными бактериями мышами было показано, что кишечная микрофлора обеспечивает разложение неперевариваемых хозяином полисахаридов пищи до усваиваемых форм — но это сложно назвать новостью. Находкой же стало то, что этот процесс сопровождался усилением всасывания моносахаридов из кишечника и их поступления в воротную вену — возможно, благодаря повышению плотности капиллярной сети в слизистой оболочке тонкой кишки под влиянием микробиоты. Это вело к усилению печеночного липогенеза, то есть синтеза жирных кислот из углеводов. Дело в том, что клетки печени реагируют на повышение уровня глюкозы и инсулина в крови экспрессией генов транскрипционных факторов ChREBP и SREBP-1, которые активируют гены биосинтеза триглицеридов, то есть жиров. Усиление выработки этих транскрипционных факторов и наблюдали после заселения мышиных кишечников микробиотой. Кроме того, кишечные бактерии помогали размещать новопроизведенные триглицериды в жировых клетках (адипоцитах), вмешиваясь в работу хозяйских генов: микрофлора увеличивала активность необходимой для этого липопротеинлипазы, подавляя в эпителии тонкого кишечника синтез ее ингибитора.
Однако здесь стоит напомнить, что речь шла о мышах, о конкретном энтеротипе их микрофлоры (биоценозе, в котором преобладают определенные группы бактерий) и вообще о базовых функциях микробиоты. Поэтому не нужно на основании этой работы делать вывод о вредном влиянии любых кишечных бактерий на хозяина, просто именно так появилась гипотеза о множественных и взаимосвязанных механизмах влияния кишечной микробиоты на энергетический обмен хозяина, а с ней и надежда на то, что коррекция этого влияния поможет справиться с эпидемией ожирения [5]. Авторы работы предположили, что микробный «биореактор» у одного индивида может быть более энергоэффективным, чем у другого. И факторы, влияющие на это, мы еще затронем.
Микрофлора у людей с нормальным весом и с ожирением различается
Недавние эксперименты показали, что изменения микрофлоры относятся к причинам ожирения, а не к его следствиям. Если кишечник гнотобиотических мышей заселить микробиотой мышей с ожирением, животные будут набирать вес быстрее, чем в случае пересадки бактерий от худых мышей. Более того, по составу микробиоты можно с 90-процентной вероятностью предсказать, есть ли у человека ожирение [6]. Только представьте! А теперь вообразите, что, изменяя состав кишечной микрофлоры человека, можно будет регулировать его вес (рис. 2).
Рисунок 2. Чем примечателен состав микрофлоры кишечника тучного человека?
Многократно выявляли, что при ожирении увеличивается количество представителей типа Firmicutes (например, Clostridium coccoides, C. leptum) и семейства Enterobacteriaceae (Esherichia coli). В то же время снижается количество представителей типа Bacteroidetes (Bacteroides, Prevotella), сокращаются популяции бактерий родов Bifidobacterium и Lactobacillus [7]. Ранее было показано, что высокожировая диета способствует воспалению слизистой оболочки кишечника, опосредованному снижением численности лактобактерий. Это воспаление предрасполагает к развитию ожирения и инсулинорезистентности, то есть СД 2-го типа. В 2016 году в экспериментах с мышами удалось установить связь между этими состояниями и дефицитом конкретных штаммов Lactobacillus reuteri в пейеровых бляшках. Дело в том, что богатая жирами пища обеспечивает отбор бактериальных штаммов, устойчивых к окислительному стрессу. А такими оказались как раз лактобациллы, выделяющие провоспалительные цитокины. И наоборот, вытеснялись из популяции «хорошие» штаммы L. reuteri — продуценты противовоспалительных веществ [8].
Как уже упоминалось, анализ кишечного микробиома выявил резкое уменьшение доли Bacteroidetes и увеличение доли Firmicutes у мышей с наследственным ожирением по сравнению с обычными мышами [9]. Такие же изменения нередко наблюдали и у людей: в одном исследовании 12 пациентов с ожирением отличались от контрольной группы худых сниженным содержанием бактерий Bacteroidetes и повышенным — Firmicutes. Затем пациентов перевели на низкокалорийную диету (питание с ограничением жиров и углеводов) и в течение года следили за изменением состава их кишечной микрофлоры. Оказалось, что диета значительно сокращала численность Firmicutes и повышала долю Bacteroidetes, но самое главное — эти изменения коррелировали со степенью снижения массы тела [9]. Тем не менее взаимосвязь индекса массы тела с пропорцией Bacteroidetes/ Firmicutes пока нельзя назвать доказанной [10].
Изменения обмена веществ
В рамках проекта MetaHIT, посвященного изучению кишечного метагенома, то есть совокупности геномов всех обитателей кишечника, было обследовано 124 европейца [11]. Суммарное количество генов кишечного микробиома в 150 раз (!) превышало количество генов человека. Но стоит отметить, что избыток жирной пищи вел к сокращению бактериального разнообразия: у тучных людей было в среднем на шесть видов бактерий меньше, чем у лиц с нормальной массой тела. Результаты метагеномного анализа разделили участников эксперимента на две группы: носителей «малого генома» (low gene count) и носителей «большого генома» (high gene count). Малый геном — это метагеном, в котором относительно мало генов различных видов бактерий: разница между «малым» и «большим» геномами по количеству генов достигала в среднем 40%. У большинства лиц с бедным кишечным метагеномом преобладали Bacteroides, а с богатым — Methanobrevibacter. При этом две описанные категории людей сильно различались представленностью в их микробиоте групп, формирующих провоспалительный (Bacteroides, Ruminococcus gnavus) или противовоспалительный (Faecalibacterium prausnitzii, Roseburia inulinivorans) фон. Первых гораздо чаще находили у лиц с бедным метагеномом.
Результаты проекта MetaHIT однозначно говорят о том, что обилие кишечной микрофлоры человека коррелирует с его метаболическими маркерами, при этом гены бактерий играют чуть ли не бóльшую роль в патогенезе ожирения, чем наши собственные.
Среди обладателей «малого генома» (23% от всех участников) было больше людей с избыточным весом. Для этой группы в целом были характерны нарушения в ответе тканей на действие инсулина, что вело к повышению его концентрации в крови. У таких людей выявлялось и статистически достоверное снижение содержания так называемого «хорошего холестерина» — липопротеинов высокой плотности, переносящих холестерин от различных тканей к печени для дальнейшей трансформации и утилизации. Также отмечалась тенденция к повышению в крови уровня триглицеридов, свободных жирных кислот и гормона лептина, высокие концентрации которого рассматриваются как независимый фактор риска развития сердечно-сосудистых патологий и тромбозов. (К основным факторам риска относят также специфические варианты липидного профиля, высокое артериальное давление, хронический воспалительный фон и курение.)
В ряде исследований показано, что у людей, в рационе которых преобладают растительные компоненты, в микробиоме доминируют бактерии, расщепляющие полисахариды, — а это как раз представители типа Bacteroidetes, часть которых защищает хозяина от развития локального и системного воспаления. В то же время у любителей растительной пищи снижается количество фирмикутов, а также энтеробактерий, которых нередко называют «патобионтами»: они способны создавать воспалительную среду благодаря липополисахариду своей внешней мембраны и повышению проницаемости кишечного эпителия, что ведет к масштабному проникновению молекул липополисахарида в кровоток и провокации метаболической эндотоксемии, а возможно, и тяги к регулярному перееданию. Кстати, именно так развиваются события на фоне высокожировой диеты. Вегетарианский же рацион, напротив, большинство исследований связывает со сниженным риском развития метаболического синдрома и связанных с ним «болезней цивилизации» [7].
Захватывающую историю о заселении бактериями человеческого организма и ведущей роли колонизаторов в становлении «правильных» иммунных реакций хозяина рассказывает другая конкурсная статья: «Микробиом кишечника: мир внутри нас» [13]. — Ред.
Кишечные бактерии способны снижать уровень триглицеридов в крови, улучшать глюкозный и липидный метаболизм также за счет непосредственного участия в циркуляции желчных кислот, а уменьшать жировые запасы — путем активации уже упоминавшегося ингибитора липопротеинлипазы [10]. Но пока сложно делать какие-то выводы: слишком уж противоречивы иногда результаты экспериментов. Составить представление о противоречиях и их причинах, а главное — о возможных механизмах, связывающих деятельность микробиоты с метаболизмом хозяина, поможет новый обзор [10].
Роль микрофлоры в развитии СД 1-го и 2-го типов
Лечение и профилактика СД 2-го типа тесно связаны с нормализацией веса. А она требует изменения характера питания (соотношения макро- и микронутриентов) в сочетании с увеличением физической активности: то есть важно создать условия некоторого энергетического дефицита, когда калорий тратится больше, чем поступает [14]. И хотя роль микробиоценоза кишечника в регуляции энергетического обмена ясна не до конца, уже сейчас понятно, что воздействие на микрофлору определенно может способствовать устранению ожирения и компенсации СД 2-го типа.
И, как ни странно, подобное воздействие способно переломить и тревожную ситуацию с заболеванием, в корне отличающимся патогенетически, — СД 1-го типа. Это аутоиммунное заболевание, связанное с агрессией Т-лимфоцитов против β-клеток поджелудочной железы, которые вырабатывают инсулин. Если в случае СД 2-го типа повышение уровня глюкозы в крови происходит вследствие нечувствительности тканей к инсулину (которая мешает клеткам усваивать глюкозу), то при СД 1-го типа просто не хватает самогό инсулина. Для развития этого заболевания требуется стечение ряда обстоятельств — генетических и средовых, а в числе последних, как оказалось, огромную роль играют перестройки кишечного микробиома. Нормофлора кишечника сразу после заселения тренирует иммунную систему хозяина, чтобы та различала своих и чужих, бурно реагировала на чужих, но вовремя останавливалась [13]. Видимо, при СД 1-го типа что-то в этой цепочке ломается.
В одном из экспериментов с крысами, предрасположенными к СД 1-го типа, выявили различия в составе кишечной микрофлоры у животных с уже развившимся диабетом и без него [15]. У последних обнаружили более низкое содержание, как ни странно, представителей типа Bacteroidetes — того, что в ряде исследований от метаболических расстройств, скорее, защищал. Но, как мы знаем, эффекты бактерий радикально разнятся не то что от типа к типу, а даже от штамма к штамму. Применение антибиотиков у этих крыс предотвращало развитие диабета. Исследователи предположили, что изменения кишечной микрофлоры, вызванные приемом антибиотиков, приводят к снижению общей антигенной нагрузки и последующего воспаления, которое может способствовать разрушению β-клеток поджелудочной железы. Однако, как водится, в ряде других экспериментов с животными и людьми эффект антибиотиков (которые, конечно, различались) был обратным [16].
У человеческих детей с СД 1-го типа и здоровых контролей выявили существенную разницу в составе кишечной микробиоты, причем у диабетиков было повышено соотношение Bacteroidetes/Firmicutes и преобладали бактерии, утилизирующие молочную кислоту. У здоровых детей было больше продуцентов масляной кислоты. В целом полагают, что определенные отклонения в составе микрофлоры, происходящие преимущественно в критические периоды онтогенеза (во время эмбриогенеза, рождения, грудного вскармливания и пубертата) способствуют усилению провоспалительной сигнализации со всеми вытекающими иммунными последствиями [16]. Возможно, что из-за сопутствующего нарушения барьерной функции кишечного эпителия выходящие в кровоток и проникающие в панкреатические лимфоузлы бактериальные антигены взаимодействуют с рецепторами NOD2 и провоцируют Т-клетки на атаку панкреатических β-клеток [17].
Таким образом, полученные к настоящему моменту данные создают основу для дальнейшего изучения роли кишечной микрофлоры в механизмах развития ожирения и сахарного диабета 1-го и 2-го типов, а также указывают на возможность профилактики и лечения этих патологий новыми способами — с помощью коррекции нашего микробиома.
Микрофлора полости рта
Последнее обновление: 11.11.2021
От состояния микрофлоры полости рта зависит не только здоровье зубов и десен, но и работа органов пищеварения, иммунной и других систем и органов. Давайте разберемся, что представляет собой эта часть организма, что влияет на состояния полости рта и как быстро восстановить нормальную работу микрофлоры.
Что представляет собой микрофлора полости рта?
Удивительно, но во рту здорового человека живет примерно 160 видов микроорганизмов. Вам, наверное, приходилось слышать о том, что «рот — это самое грязное место в организме». Отчасти это утверждение верно: ротовая полость — один из наиболее заселенных отделов тела человека.
Микроорганизмы попадают в ротовую полость с пищей и водой, а также из воздуха. Именно во рту наблюдаются самые благоприятные условия для развития бактерий. В этой части тела всегда стоит равномерная влажность и температура (примерно 37 °С). Обилие питательных веществ, достаточное содержание кислорода, наличие складок в полости рта, межзубных промежутков и десневых карманов, слабощелочная pH провоцируют размножение различных бактерий.
Микроорганизмы неравномерно распределяются в полости рта. Максимальное их количество наблюдается на поверхности зубов и на спинке языка. В одном грамме зубного налета содержится примерно 300 миллиардов микробов, а в слюне — примерно 900 миллионов на 1 миллилитр.
Можно очень долго перечислять все виды бактерий, заселяющих микрофлору полости рта. Важно понимать, что каждый человек уникален, и для оценки «нормальности» микрофлоры нужно знать особенности конкретного организма.
Например, в одном случае большое количество лактобактерий в полости рта будет сохранять зубы, а в другом — образование большого количества молочной кислоты в процессе их жизнедеятельности задержит рост других важнейших микроорганизмов. Снижается число стафилококков, дизентерийных и брюшнотифозных палочек, активизируются кариозные процессы, и микрофлору полости рта придется восстанавливать.
Нарушение микрофлоры полости рта: причины
Дисбактериоз ротовой полости могут спровоцировать самые разные заболевания и проблемы. Нарушение условно-патогенной микрофлоры полости рта чаще всего вызывают такие проблемы, как:
Стадии дисбактериоза
В зависимости от степени развития заболевания стоматологи различают четыре стадии дисбактериоза:
Для запущенных форм дисбактериоза характерны такие симптомы, как:
Методы восстановления микрофлоры полости рта
Лечение дисбактериоза зависит, в первую очередь от характера возбудителя, который определяется на основании экспертизы в стоматологии.
К сожалению, зачастую постановка диагноза при дисбактериозе бывает затрудненной, так как на начальном этапе болезнь никак не проявляет себя. При малейших подозрениях на заболевание стоматолог направляет пациента на мазок с поверхности слизистых, анализы крови и мочи.
В зависимости от диагностированной причины дисбактериоза стоматолог может назначить следующие методы лечения заболевания:
В редких случаях назначаются противогрибковые средства и антибиотики.
Как правило, длительность лечения дисбактериоза составляет 2-4 недели и зависит от состояния здоровья пациента, количества очагов воспаления и имеющихся осложнений заболевания.
Надежным помощником в борьбе с дисбактериозом станет пробиотический комплекс АСЕПТА PARODONTAL*, источник лактобактерий для восстановления микрофлоры полости рта. Этот уникальный комплекс с запатентованными штаммами лактобактерий и витамином D обладает способностью эффективно восстанавливать микрофлору полости рта. Комплекс нормализует бактериальную флору в ротовой полости, устраняет неприятный запах изо рта и препятствует образованию биопленок патогенных микроорганизмов.
Для улучшения эффективности назначенной терапии стоматологи рекомендуют отказаться от вредных привычек (хотя бы на время лечения), пересмотреть рацион, уделив внимание растительной пищи и обязательно ухаживать за полостью рта после каждого приема пищи.
Возможные осложнения дисбактериоза
Каждому пациенту важно внимательно следить за состоянием микрофлоры полости рта. Отсутствие лечения дисбактериоза может привести к таким неприятным заболеваниям, как:
Кроме того, научно доказана тесная взаимосвязь состояния микрофлоры полости рта с состоянием сердечнососудистой системы. В 2008 году в США была доказано, что заболевания периодонта как источник хронического воспаления являются независимым фактором риска возникновения ишемической болезни сердца (ИБС).
Итак, теперь вам известна роль нормальной микрофлоры полости рта в организме человека. Относитесь к себе внимательно, и ваш здоровый организм будет радовать вас каждый день.
Клинические исследования
Проведенные в 10-ом отделении Cтоматологии и челюстно-лицевой хирургии Стоматологического факультета Международного университета Каталонии, доказали, что применение лактобактерий помогает снизить болевые ощущения и трудности с приемом пищи после удаления зубов у взрослых пациентов.
Эффективность применения комплексной терапии в лечении заболеваний пародонта. (кафедра пародонтологии СФ ГБОУ ВПО МГМСУИМ.А.И.Евдокимова. Москва.)
Немерюк Д.А.- доцент, к.м.н., Дикинова Б.С.- аспирант кафедры пародонтологии СФ Царгасова М.О.- аспирант кафедры пародонтологии СФ Яшкова В.В.- аспирант кафедры пародонтологии СФ
кафедра пародонтологии СФ ГБОУ ВПО МГМСУИМ.А.И.Евдокимова. Москва
Посев на микрофлору (идентификация агента и чувствительность к а/б)
Описание исследования
Посев отделяемого верхних дыхательных путей
Тестирование позволяет определить возбудителя инфекции и выбрать для лечения наиболее действенный антибиотик.
Достаточно часто причинами болезней верхних дыхательных путей (в частности, ринита или синусита (поражения носа), фарингита (слизистой оболочки горла)), является воздействие микроорганизмов:
Своевременная постановка диагноза с точным определением агента инфекции способствует проведению адекватного лечения, что в свою очередь, не позволяет перейти заболеванию из острой в хроническую форму.
Цель исследования – выявление микроорганизмов:
основных возбудителей инфекции, условно-патогенных бактерий:
представителей нормальной флоры:
Цель тестирования – выделение следующих возбудителей инфекции:
Посев раневого отделяемого и тканей
Результаты данного тестирования используются для назначения эффективного лечения ран с применением антибиотиков.
Часто сложные раны не лечатся должным образом, причиной чему во многих случаях является неправильное назначение антибиотиков.
Достаточно часто гнойно-воспалительные осложнения ран возникают из-за воздействия условно-патогенных бактерий. Однако еще более частыми возбудителями выступают бактерии, которые не нуждаются для нормальной жизнедеятельности в кислороде (частично или полностью). Общее название таких микроорганизмов – анаэробы. Осложнения ран вызывается некоторыми их представительями – грамотрицательными (неокрашиваемыми при проведении характерной реакции окрашивания по Граму) палочками, грамположительными (окрашиваемыми) кокками, не образующими спор палочками. При проявлении одинаковых симптомов осложнения и идентичности обнаруженных бактерий, реакция их на антибиотики у разных людей может иметь существенные различия.
Действенность лечения антибиотиками на данный момент оставляет желать лучшего. Однако точная идентификация микроорганизмов и определение их чувствительности к антибиотикам позволяет сделать процесс намного действеннее.
Цель исследования – выделение следующих возбудителей инфекции:
Важно. При отборе пробы необходимо иметь наготове транспортную среду.
Посев отделяемого (соскоба) из глаза
Исследование проводится с целью выделения следующих возбудителей:
— золотистого стафилококка (Staphylococcus aureus)
— эпидермиального стафилококка (Staphylococcus epidermidis) и некоторых других видов;
— пневмококков (Streptococcus pneumoniae);
— пиогенного стрептококка (Streptococcus pyogenes);
— стрептококка вириданс (Viridans streptococcus);
— кандиды (Candida) (чаще всего);
— кишечной палочки (Escherichia coli)
— нейссерии (Neisseria species);
— протея (Proteus vulgaris);
Посев отделяемого половых органов или соскоба из влагалища, цервикального канала, мочеиспускательного канала
Тест предназначен для идентификации бактерий, вызвавших неспецифическое инфекционно-воспалительное заболевание (т.е. когда агент инфекции, послуживший причиной его возникновения, не известен), и назначения по его результатам действенного лечения с применением антибиотиков.
В нормальном состоянии биоценоз (совокупность микроорганизмов, представляющих микрофлору) мочеполовой системы человека представлен более-менее постоянным, иногда зависящим от возраста, составом. Так, микрофлора влагалища женщин репродуктивного возраста в значительном количестве содержит строгие (облигатные – гибнущие при попадании в кислородную среду) и факультативные (которые могут существовать как с присутствием кислорода, так и без него) анаэробные организмы, большинство из которых – лактобациллы. В значительно меньшей мере его населяют аэробные (нуждающиеся для жизнедеятельности в нормальном содержании кислорода) и микроаэрофильные (которым достаточно сниженной концентрации кислорода) условно-патогенные бактерии. Во внутреннем канале шейки матки и в самой матке бактерии в нормальном состоянии отсутствуют.
Микрофлора девочек, не вступивших в фазу полового созревания, представлена кокками и дифтероидами (грамположительными палочками).
В ближних к наружному выходу отделах уретры (мочеиспускательного канала) здоровых мужчин могут присутствовать небольшие количества грамположительных палочек и кокков. В проксимальных (удаленных от выхода) отделах уретры, простате и семявыводящих канальцах в норме стерильно.
Если нарушается баланс между видами микроорганизмов и/или появляются несвойственные для данного места бактерии, это создает серьезную предпосылку для возникновения инфекционно-воспалительного процесса.
Болезни, характерные для женщин:
Болезни, часто встречающиеся у мужчин:
Результатом исследования является выделение условно-патогенных бактерий (т.е. тех, которые могут являться частью нормальной микрофлоры, но при ослаблении иммунитета становятся возбудителями заболеваний): энтеробактерий, стрептококков, стафилококков, гемофильных палочек, неферментирующих грамотрицательных бактерий, энтерококков, коринеформных бактерий, дрожжеподобных грибов (только констатируется факт их присутствия, виды не определяются).
Внимание! Исследование наличия специфических возбудителей – хламидий (Chlamydia trachomatis), влагалищной трихомонады (Trichomonas vaginalis), бледной спирохеты (Treponema pallidum), гонококка (Neisseria gonorrhoeae) в рамках данного теста не проводятся.
Посев отделяемого из уха
Данный тест предназначен для микробиологической диагностики гнойно-воспалительных заболеваний уха.
Гнойно-воспалительные процессы отличаются локализацией, их могут вызывать различные возбудители. По расположению очага болезни различают поражение:
Причиной заболеваний выступают следующие микроорганизмы:
Для быстрого выздоровления пациента, а также дл предотвращения перехода болезни из острой формы в хроническую, очень важно идентифицировать возбудитель и определить его чувствительность к антибиотикам.
Посев проводится для проверки наличия грамотрицательных бактерий, относящихся к семейству энтеробактерий (Enterobacteriaceae), синегнойной палочки (Pseudomonas aeruginosa), стафилококков, стрептококков (S. pyogenes, S. pneumoniae, S. viridans), коринебактерий, дрожжеподобных грибов, гемофильной палочки (Haemophilus influenzae).
Посев пункционного материала
Целью посева является выделение следующих возбудителей:
Для исследования отбираются пробы:
Посев на анаэробную микрофлору
Цель исследования – обнаружить присутствие микроорганизмов, живущих и растущих без доступа кислорода, при гнойно-воспалительных процессах.
Анаэробные бактерии благополучно живут в организме человека, составляя значительную часть его микрофлоры. Однако определенные условия могут сделать их причиной гнойных воспалений.
Независимо от того, в какой части тела расположен очаг, действие анаэробов не отличаются разнообразием – это гниение и газообразование. Чаще всего мишенью микроорганизмов становятся органы, в которых они обитают, вследствие чего происходит поражение мочеполовой системы, желудочно-кишечного тракта, верхних дыхательных путей. Проведение точной диагностики является жизненно необходимым – только это поможет назначить адекватное лечение и обезвредить инфекцию, представляющую смертельную опасность для организма человека.
Инфекция возбуждается превотеллами, вейлонеллами, клостридиями, пропионобактериями, эубактериями, пептострептококками, актиномицетами, фузобактериями, гемеллами, бифидобактериями, бактероидами, порфиромонадами.
При обследовании проводится тестирование:
Подготовка к исследованию
Отделяемое (соскоб) верхних дыхательных путей
Отбирать материал рекомендуется до приема пищи и питья, полоскания и прочих лечебных манипуляций или через 2 часа (минимум) после еды и питья. Отбор пробы проводится до начала приема антибиотиков, антисептиков, грибковых препаратов. При назначении специфической антибактериальной химиотерапии материал отбирается до ее проведения или не ранее, чем через сутки после введения препарата.
Для хранения и транспортировки отделяемого верхних дыхательных путей используется стерильный медицинский контейнер. До доставки в лабораторию он должен храниться в холодильнике.
Подписывая контейнер, необходимо указать ФИО, дату рождения, дату отбора пробы и откуда она была взята.
Взятие соскоба с задней стенки глотки или полости носа производится специальным тампоном, который помещается затем в транспортную систему со средой Амиеса (перед отбором пробы из носа необходимо удалить сухие корочки).
Тестирование нужно проводить перед применением противомикробных препаратов. Порция желчи, отобранная при операции, наиболее соответствует требованиям, предъявляемым к качеству биоматериала.
Если есть подозрения, что воспаление спровоцировано Клостридией перфрингенс (Clostridium perfringens), бактероидами Фрагилис (Bacteroides fragilis), пептострептококками (Peptostreptococcus sp), то рекомендуется посев на анаэробную микрофлору с определением чувствительности возбудителей к антибиотикам.
Посев раневого отделяемого и тканей
Обследование проводится до начала лечения антибиотиками.
Если у пациента рана от укуса, глубокая угревая сыпь, паронихия (воспаление околоногтевого валика), некротический фасциит (поражение бактериями соединительной оболочки – фасции и подкожной клетчатки), пролежни, газовая гангрена, то перед данным тестированием рекомендуется провести предварительные обследования: посев на анаэробы (бактерии, полностью или частично не нуждающиеся в кислороде) и бактериоскопия мазка на стекле.
При проведении обследования необходимо выполнять следующие требования:
Посев отделяемого (соскоба) из глаза
Отбор отделяемого для исследования производит лечащий врач или сам пациент. Обследование назначается до приема антибиотиков.
Соскоб отбирается с конъюнктивы глаза, с переходной складки при вывернутом верхнем или нижнем веке. Для этого используется специальный тампон, который после отбора пробы помещается в емкость с транспортной средой. При проведении специфической антибактериальной химиотерапии проба отбирается до ее начала или через сутки после введения препарата.
В рамках данного теста не исследуется наличие вирусов и хламидий.
Посев отделяемого половых органов
Проведение обследования на фоне приема антибиотиков не информативно. Материал отбирается до его начала или через полторы-две недели после окончания лечения антибактериальными препаратами или иммуномодуляторами.
Нецелесообразно проводить обследование женщин во время менструации, так как количество микроорганизмов в этот период значительно меньшее, чем обычно. Биоматериал отбирается, начиная с 5-7 дня от начала цикла.
Перед проведением тестирования:
Обследование не проводится после инструментального, мануального, ультразвукового исследований, физиопроцедур, кольпоскопии и прочих манипуляций.
У мужчин исследуется эякулят (сперма). Биоматериал собирается в контейнер с крышкой. Для сбора эякулята не используются:
Это объясняется тем, что вещества, в них присутствующие (используемые при производстве презервативов или оставшиеся в контейнере после дезинфекции) могут повлиять на результат обследования.
До доставки в лабораторию, контейнер с образцом хранится в холодильнике при температуре от +2 до +8⁰С, но не более 10-12 часов. Охлажденный эякулят должен быть доставлен для исследования в день сбора (в качестве «холодильника» при транспортировке может быть использован термос с небольшим количеством льда или пакет с охлаждающими элементами).
Соскоб из мочевого канала (уретры) обирается через 1,5-2 часа после мочеиспускания или перед ним. Отбор пробы рекомендуется проводить до начала специфической антибактериальной химиотерапии или не менее чем через сутки после последнего введения лекарственного средства.
Посев отделяемого из уха; посев пункционного материала
Исследование не целесообразно проводить на фоне лечения антибиотиками, применения антисептиков и противогрибковых средств.
Материал для посева собирается только в стерильные контейнеры.
Транспортные среды перед использованием хранятся в холодильнике. Они подогреваются до комнатной температуры за полчаса до применения. Для каждого вида исследования предназначена особая транспортная среда.
Контейнер (или пробирка) с биоматериалом обязательно подписывается. Необходимо указать фамилию и инициалы пациента, дату рождения, дату, время сбора материала, и откуда взята проба.
Хранение отобранного материала должно производиться согласно требованиям, предъявляемым к режиму и срокам.
Посев на анаэробную микрофлору
Обследование не рекомендуется проводить на фоне антибактериальной терапии.
Посев на аэробные микроорганизмы целесообразно проводить параллельно с посевами на микрофлору в условиях отсутствия кислорода и проведением микроскопического исследования мазка, сделанного отдельным стерильным тампоном на стекле. На бланке направления обязательно делается запись, если исследование предназначено для выявления клостридий (бактерий, живущих и растущих только при отсутствии кислорода) и актиномицетов (микроорганизмов, соединяющих в себе признаки грибов и бактерий).
Показания к исследованию
Посев отделяемого верхних дыхательных путей
Посев раневого отделяемого и тканей
Посев отделяемого (соскоба) из глаза
Тестирование назначается при наличии гнойно-воспалительных заболеваний глаз:
Особую группу риска составляют лица, пользующиеся контактными линзами.
Посев отделяемого половых органов (соскоб)
Посев отделяемого из уха
Показанием к проведению теста является наличие гнойных и негнойных отитов (воспаления уха).
Посев пункционного материала
Тестирование назначается при наличии гнойно-воспалительных заболеваний:
Посев на анаэробную микрофлору
Тестирование рекомендуется проводить:
Интерпретация исследования
Посев отделяемого верхних дыхательных путей
Результат обследования выдается на бланке лаборатории. Пациент получает следующую информацию:
В зависимости от вида обнаруженных возбудителей предлагается перечень противомикробных средств.
Если в результате посева дала рост в незначительном количестве нормальная, условно-патогенная или сопутствующая флора, то исследование на чувствительность к антибиотикам не проводится.
Данные, предоставляемые пациенту после обследования, содержат следующую информацию:
Выбор антимикробных средств производится в зависимости от идентифицированных бактерий.
Данное обследование не предназначено для определения вида грибов и их чувствительности к антигрибковым препаратам. Если возникает подозрение на грибковую инфекцию, проводится отдельное тестирование (посев на дрожжеподобные грибы).
Норма – желчь стерильна.
При отборе пробы методом дуоденального зондирования не исключено попадание в пробу сапрофитной микрофлоры (т.е. питающейся мертвой, разлагающейся органикой) рта и верхних отделов пищеварительного тракта (глотки, пищевода, желудка).
Если после посева в незначительном количестве дала рост нормальная, условно-патогенная или сопутствующая флора, то исследование на чувствительность к антибиотикам не проводится.
Посев раневого отделяемого и тканей
После проведения исследования пациент получает следующую информацию:
Противомикробные препараты подбираются в зависимости от вида обнаруженных возбудителей.
Попадание в посев микроорганизмов с кожи может вызвать незначительный рост сапрофитных бактерий.
При наличии заболевания происходит значительный рост бактерий, являющихся его причиной. Высокий титр позволяет диагностировать инфекцию. Количество колоний в таком случае превышает 10 000 КОЕ/тампон.
Если обнаружен рост сопутствующей, нормальной или условно-патогенной микрофлоры в количестве, не способном вызвать заболевание, то исследование на чувствительность к антибиотикам не проводится.
Посев отделяемого (соскоба) из глаза
После исследования предоставляются следующая информация:
Выбор антимикробных препаратов, рекомендуемых для проведения лечения, осуществляется исходя из вида выделенных бактерий.
Если есть вероятность грибковой инфекции, то проводится отдельный тест – «Посев на дрожжеподобные грибы».
Результаты интерпретируются следующим образом:
Посев отделяемого половых органов (соскоб)
Информация, предоставляемая после исследования:
Определение антимикробных препаратов осуществляется исходя из вида выделенных бактерий.
Результаты интерпретируются следующим образом:
При выявлении стрептококков Streptococcus agalactiae и Streptococcus pyogenes, являющихся патогенными (вызывающими заболевание), обязательно определяется чувствительность к антибиотикам независимо от количества колоний в единице объема.
Если обнаружен рост сопутствующей, нормальной или условно-патогенной микрофлоры в количестве, не способном вызвать заболевание, то исследование на чувствительность к антибиотикам не проводится.
Посев отделяемого из уха
После проведения исследования пациент получает следующую информацию:
Антимикробные препараты назначаются в зависимости от вида обнаруженных возбудителей.
Нормой является отсутствие роста.
Данный тест не предусматривает определение вида грибов и их чувствительности к противогрибковым препаратам.
Если в посев попали микроорганизмы с кожи, то происходит незначительный рост сапрофитных или условно-патогенных бактерий.
Если имеет место заболевание, то происходит рост бактерий, его вызывающих. Количество колоний в таком случае превышает 100 000 кое.
Если в наличие явные признаки заболевания, а рост при посеве отсутствует, целесообразно повторить отбор материала, т.к. он мог быть собран неправильно или на фоне применения антибиотиков.
Если обнаружен рост сопутствующей, нормальной или условно-патогенной микрофлоры в количестве, не способном вызвать заболевание, то исследование на чувствительность к антибиотикам не проводится.
Посев пункционного материала
После проведения исследования пациенту выдается следующая информация:
Выбор антимикробных препаратов осуществляется в зависимости от вида выявленных микроорганизмов.
Норма – рост отсутствует.
Если в посеве обнаружено присутствие представителей другой микрофлоры, попавших туда случайно из воздуха, с поверхности кожи или каким-то другим образом, об этом тоже сообщается в описании результатов.
В рамках теста не определяется вид грибов и их чувствительность к противогрибковым препаратам.
Если обнаружен рост сопутствующей, нормальной или условно-патогенной микрофлоры в количестве, не способном вызвать заболевание, то исследование на чувствительность к антибиотикам не проводится.
Посев на анаэробную микрофлору
Результат исследования включает в себя информацию о наличии или отсутствии роста бактерий. Положительный ответ подразумевает дополнительное определение чувствительности к антибиотикам.
Норма: рост при посеве отсутствует.
Результат теста выдается на бланке лаборатории медицинской компании «Наука». Пример по данному анализу представлен ниже:
Ф.И.О.: Иванов Сидор Петрович Пол: м Дата рождения: хх.хх.хххх
Дата исследования: хх.хх.хххх
Исследование
Результат
Нормы интерпретации
Примечание
[411] Посев на микрофлору (идентификация агента и чувствительность к аб)