Что значит подводится тепло
Маневровые локомотивы
Основные термодинамические процессы и циклы
Параметры состояния рабочего тела. Рабочие тела (теплоносители), используемые в тепловых двигателях, находятся в газообразном состоянии (воздух, смесь воздуха с топливом, продукты сгорания топлива). Величины, характеризующие физическое состояние рабочего тела, называются термодинамическими параметрами состояния. Основные параметры состояния рабочего тела: удельный объем, давление и температура.
Так как всякое число в нулевой степени равно единице, то прн «=±со u = const. Такой процесс нзменеиня состояния рабочего тела, прн котором объем тела сохраняется постоянным, называется нзохорным (1 на рис. 17).
Если тепловой процесс осуществляется прн постоянном давлении рабочего тела, то показатель п-0:
т. е. p = const (так как v°-\). Такой процесс изменения состояния рабочего тела называется изобарным (2 на рис. 17).
т. е. pv = const. Графическое изображение такого процесса в координатах pv представлено кривой 3 на рис. 17.
Все другие процессы изменения состояния рабочего тела, не являющиеся нн изохориы-ми, ни изобарными, ни изотермическими, ни адиабатными, будем называть полнтропны-миКривые, описывающие эти процессы на диаграммах, называются политропами (н соответственно изохорами, изобарами, изотермами, адиабатами). Политропные процессы протекают во всех реальных тепловых машинах, в том числе в тепловозных дизелях. Рассмотрение процессов изменения состояния рабочего тела помогает решить важный вопрос- как и куда расходуется тепло, подведенное к рабочему телу.
По первому закону термодинамики, который является частным случаем открытого М. В. Ломоносовым закона сохранения энергии, тепло, подведенное к рабочему телу в каком-либо процессе, расходуется на изменение внутренней энергии тела Ш (иначе, его температуры) и совершение внешней работы 1.:
Первый закон термодинамики
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: работа в термодинамике, первый закон термодинамики, адиабатный процесс.
Начнём с обсуждения работы газа.
При расширении газа эта работа будет положительной (сила давления газа и перемещение поршня направлены в одну сторону). При сжатии работа газа отрицательна (сила давления газа и перемещение поршня направлены в противоположные стороны).
Работа газа в изобарном процессе
Но — изменение объёма газа. Поэтому для работы газа при изобарном расширении мы получаем формулу:
Рис. 2. Работа газа как площадь
Итак, формула выражает работу газа при постоянном давлении — как в процессе расширения газа, так и в процессе сжатия.
Работа газа в произвольном процессе
Но данный интеграл как раз и является площадью криволинейной трапеции (рис. 3 ):
Рис. 3. Работа газа как площадь
Работа, совершаемая над газом
Следовательно, работа поршня равна по модулю и противоположна по знаку работе газа:
Как мы знаем, существует лишь два способа изменения внутренней энергии тела: теплопередача и совершение работы.
Соотношение (3) называется первым законом термодинамики. Смысл его прост: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа и на совершение газом работы.
Напомним, что величина может быть и отрицательной: в таком случае тепло отводится от газа. Но первый закон термодинамики остаётся справедливым в любом случае. Он является одним из фундаментальных физических законов и находит подтверждение в многочисленных явлениях и экспериментах.
Применение первого закона термодинамики к изопроцессам
Напомним, что в изопроцессе остаётся неизменным значение некоторой величины, характеризующей состояние газа — температуры, объёма или давления. Для каждого вида изопроцессов запись первого закона термодинамики упрощается.
Всё подведённое к газу тепло идёт на совершение газом работы.
Всё тепло, переданное газу, идёт на изменение его внутренней энергии.
Адиабатный процесс
Процесс называется адиабатным, если он идёт без теплообмена с окружающими телами.
Адиабатный процесс совершается газом, находящимся в теплоизолированном сосуде. Такой сосуд препятствует всем видам теплопередачи: теплопроводности, конвекции, излучению. Пример теплоизолированного сосуда — термос.
Приблизительно адиабатным будет всякий процесс, протекающий достаточно быстро: в течение процесса теплообмен просто не успевает произойти.
В процессе адиабатного расширения газ совершает положительную работу, поэтому (работа совершается за счёт убыли внутренней энергии). Следовательно, газ охлаждается. Если заставить газ совершить достаточно большую работу, охладить его можно весьма сильно. Именно на этом основаны методы сжижения газов.
Рис. 5. Сравнительный ход изотермы и адиабаты
В обоих процессах давление убывает с увеличением объёма, но в адиабатном процессе убывание идёт быстрее. Почему?
При изотермическом расширении давление падает потому, что уменьшается концентрация частиц газа, в результате чего удары частиц по стенкам сосуда становятся реже. Однако интенсивность этих ударов остаётся прежней: ведь температура газа не меняется — значит, не меняется и средняя кинетическая энергия его частиц.
А при адиабатном расширении, наряду с уменьшением концентрации частиц, падает также и температура газа. Удары частиц становятся не только более редкими, но и более слабыми. Вот почему адиабата убывает быстрее изотермы.
Теплоёмкость



Известно, что подвод теплоты к рабочему телу в каком-либо процессе сопровождается изменением температуры. Отношение теплоты, подведённой (отведённой) в данном процессе, к изменению температуры называется теплоёмкостью тела.
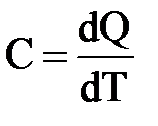
где dQ – элементарное количество теплоты
dT – элементарное изменение температуры.
Теплоёмкость численно равна количеству теплоты, которое необходимо подвести к системе, чтобы при заданных условиях повысить температуру на 1 градус. Измеряется в [Дж/К].
Количество теплоты, подведённое к рабочему телу, всегда пропорционально количеству рабочего тела. Например, количество теплоты, необходимое для нагревания на 1 градус кирпича и кирпичной стены неодинаково, поэтому для сравнения вводят удельные величины теплоёмкости, отнеся подведённую теплоту к единице рабочего тела. В зависимости от количественной единицы тела, к которому подводится теплота в термодинамике, различают массовую, объёмную и мольную теплоёмкости.
Массовая теплоёмкость – это теплоёмкость, отнесённая к единице массы рабочего тела,
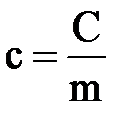
Количество теплоты, необходимое для нагревания 1 кг газа на 1 К называется массовой теплоёмкостью.
Единицей измерения массовой теплоёмкости является Дж/(кг К). Массовую теплоёмкость называют также удельной теплоёмкостью.
Объёмная теплоёмкость – теплоёмкость, отнесённая к единице объёма рабочего тела,
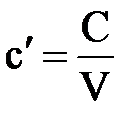
Количество теплоты, необходимое для нагревания 1 м 3 газа на 1 К называется объёмной теплоёмкостью.
Объёмная теплоёмкость измеряется в Дж/(м 3 К).
Мольная теплоёмкость – теплоёмкость, отнесённая к количеству рабочего тела,
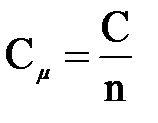
где n – количество газа в моль.
Количество теплоты, необходимое для нагревания 1 моль газа на 1 К называется мольной теплоёмкостью.
Мольную теплоёмкость измеряют в Дж/(моль×К).
Массовая и мольная теплоёмкости связаны следующим соотношением:
Теплоёмкость зависит от условий протекания процесса. Поэтому обычно в выражении для теплоёмкости указывается индекс х, который характеризует вид процесса теплообмена.
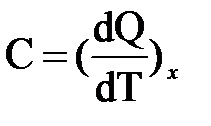
Индекс х означает, что процесс подвода (или отвода) теплоты идёт при постоянном значении какого-либо параметра, например, давления, объёма.
Среди таких процессов наибольший интерес представляют два: один при постоянном объёме газа, другой при постоянном давлении. В соответствии с этим различают теплоёмкости при постоянном объёме Cv и теплоёмкость при постоянном давлении Cp.
1) Теплоёмкость при постоянном объёме равна отношению количества теплоты dQ к изменению температуры dT тела в изохорном процессе (V = const):
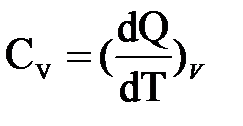
2) Теплоёмкость при постоянном давлении равна отношению количества теплоты dQ к изменению температуры dT тела в изобарном процессе (Р = const):
Для понимания сути этих процессов рассмотрим пример.
Пусть имеется два цилиндра, в которых находится по 1 кг одного и того же газа при одинаковой температуре. Один цилиндр полностью закрыт (V = const), другой цилиндр сверху закрыт поршнем, который оказывает на газ постоянное давление Р (P = const).
Подведём к каждому цилиндру такое количество тепла Q, чтобы температура газа в них повысилась от Т1 до Т2 на 1К. В первом цилиндре газ не совершил работу расширения, т.е. количество подведённого тепла будет равно
здесь индекс v – означает, что теплота подводится к газу в процессе с постоянным объёмом.
Во втором цилиндре, кроме повышения температуры на 1К, произошло ещё передвижение нагруженного поршня (газ изменил объём), т.е. была совершена работа расширения. Количество подведённого тепла в этом случае определится из выражения:
Здесь индекс р – означает, что тепло подводится к газу в процессе с постоянным давлением.
Общее количество тепла Qp будет больше Qv на величину, соответствующую работе преодоления внешних сил:
где R – работа расширения 1 кг газа при повышении температуры на 1К при Т2 – Т1 = 1К.
Если поместить в цилиндр не 1 кг газа, а 1 моль, то выражение примет вид
Это выражение носит название уравнения Майера.
Наряду с разностью Ср – Сv в термодинамических исследованиях и практических расчетах широкое применение имеет отношение теплоемкостей Ср и Сv, которое называется показателем адиабаты.
В молекулярно – кинетической теории для определения k приводится следующая формула k = 1 + 2/n,
где n – число степеней свободы движения молекул (для одноатомных газов n = 3, для двухатомных n = 5, для трёх и более атомных n = 6).
Молекулярная физика. Плавление и кристаллизация.
Переход вещества из твердого кристаллического состояния в жидкое называется плавлением. Чтобы расплавить твердое кристаллическое тело, его нужно нагреть до определенной температуры, т. е. подвести тепло. Температура, при которой вещество плавится, называется температурой плавления вещества.
Обратный процесс — переход из жидкого состояния в твердое — происходит при понижении температуры, т. е. тепло отводится. Переход вещества из жидкого состояния в твердое называется отвердеванием, или кристал лизацией. Температура, при которой вещество кристаллизуется, называется температурой кристалли зации.
Опыт показывает, что любое вещество кристаллизуется и плавится при одной и той же температуре.
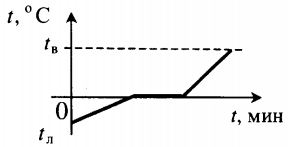
На рисунке представлен график зависимости температуры кристаллического тела (льда) от времени нагревания (от точки А до точки D) и времени охлаждения (от точки D до точки K). На нем по горизонтальной оси отложено время, а по вертикальной — температура.
Вид рассмотренного графика объясняется следующим образом. На участке АВ благодаря подводимому теплу средняя кинетическая энергия молекул льда увеличивается, и температура его повышается. На участке ВС вся энергия, получаемая содержимым колбы, тратится на разрушение кристаллической решетки льда: упорядоченное пространственное расположение его молекул сменяется неупорядоченным, меняется расстояние между молекулами, т.е. происходит перестройка молекул таким образом, что вещество становится жидким. Средняя кинетическая энергия молекул при этом не меняется, поэтому неизменной остается и температура. Дальнейшее увеличение температуры расплавленного льда-воды (на участке CD) означает увеличение кинетической энергии молекул воды вследствие подводимого горелкой тепла.
При охлаждении воды (участок DE) часть энергии у нее отбирается, молекулы воды движутся с меньшими скоростями, их средняя кинетическая энергия падает — температура уменьшается, вода охлаждается. При 0°С (горизонтальный участок EF) молекулы начинают выстраиваться в определенном порядке, образуя кристаллическую решетку. Пока этот процесс не завершится, температура вещества не изменится, несмотря на отводимое тепло, а это означает, что при отвердевании жидкость (вода) выделяет энергию. Это как раз та энергия, которую поглотил лед, превращаясь в жидкость (участок ВС). Внутренняя энергия у жидкости больше, чем у твердого тела. При плавлении (и кристаллизации) внутренняя энергия тела меняется скачком.
Металлы, плавящиеся при температуре выше 1650 ºС, называют тугоплавкими (титан, хром, молибден и др.). Самая высокая температура плавления среди них у вольфрама — около 3400 °С. Тугоплавкие металлы и их соединения используют в качестве жаропрочных материалов в самолетостроении, ракетостроении и космической технике, атомной энергетике.
Подчеркнем еще раз, что при плавлении вещество поглощает энергию. При кристаллизации оно, наоборот, отдает ее в окружающую среду. Получая определенное количество теплоты, выделяющееся при кристаллизации, среда нагревается. Это хорошо известно многим птицам. Недаром их можно заметить зимой в морозную погоду сидящими на льду, который покрывает реки и озера. Из-за выделения энергии при образовании льда воздух над ним оказывается на несколько градусов теплее, чем в лесу на деревьях, и птицы этим пользуются.
Наличие определенной точки плавления — это важный признак кристаллических веществ. Именно по этому признаку их можно легко отличить от аморфных тел, которые также относят к твердым телам. К ним, в частности, относятся стекла, очень вязкие смолы, пластмассы.
Аморфные вещества (в отличие от кристаллических) не имеют определенной температуры плавления — они не плавятся, а размягчаются. При нагревании кусок стекла, например, сначала становится из твердого мягким, его легко можно гнуть или растягивать; при более высокой температуре кусок начинает менять свою форму под действием собственной тяжести. По мере нагревания густая вязкая масса принимает форму того сосуда, в котором лежит. Эта масса сначала густая, как мед, затем — как сметана и, наконец, становится почти такой же маловязкой жидкостью, как вода. Однако указать определенную температуру перехода твердого тела в жидкое здесь невозможно, поскольку ее нет.
Причины этого лежат в коренном отличии строения аморфных тел от строения кристаллических. Атомы в аморфных телах расположены беспорядочно. Аморфные тела по своему строению напоминают жидкости. Уже в твердом стекле атомы расположены беспорядочно. Значит, повышение температуры стекла лишь увеличивает размах колебаний его молекул, дает им постепенно все большую и большую свободу перемещения. Поэтому стекло размягчается постепенно и не обнаруживает резкого перехода «твердое—жидкое», характерного для перехода от расположения молекул в строгом порядке к беспорядочному.
Теплота плавления — это количество теплоты, которое необходимо сообщить веществу при постоянном давлении и постоянной температуре, равной температуре плавления, чтобы полностью перевести его из твердого кристаллического состояния в жидкое. Теплота плавления равна тому количеству теплоты, которое выделяется при кристаллизации вещества из жидкого состояния. При плавлении вся подводимая к веществу теплота идет на увеличение потенциальной энергии его молекул. Кинетическая энергия не меняется, поскольку плавление идет при постоянной температуре.
Изучая на опыте плавление различных веществ одной и той же массы, можно заметить, что для превращения их в жидкость требуется разное количество теплоты. Например, для того чтобы расплавить один килограмм льда, нужно затратить 332 Дж энергии, а для того чтобы расплавить 1 кг свинца — 25 кДж.
Физическая величина, показывающая, какое количество теплоты необходимо сообщить кристаллическому телу массой 1 кг, чтобы при температуре плавления полностью перевести его в жидкое состояние, называется удельной теплотой плавления.
Удельную теплоту плавления измеряют в джоулях на килограмм (Дж/кг) и обозначают греческой буквой λ (лямбда).
Удельная теплота кристаллизации равна удельной теплоте плавления, поскольку при кристаллизации выделяется такое же количество теплоты, какое поглощается при плавлении. Так, например, при замерзании воды массой 1 кг выделяются те же 332 Дж энергии, которые нужны для превращения такой же массы льда в воду.
Чтобы найти количество теплоты, необходимое для плавления кристаллического тела произвольной массы, или теплоту плавления, надо удельную теплоту плавления этого тела умножить на его массу:
Количество теплоты, выделяемое телом, считается отрицательным. Поэтому при расчете количества теплоты, выделяющегося при кристаллизации вещества массой m, следует пользоваться той же формулой, но со знаком «минус»:
Теплота сгорания (или теплотворная способность, калорийность) — это количество теплоты, выделяющейся при полном сгорании топлива.
Для нагревания тел часто используют энергию, выделяющуюся при сгорании топлива. Обычное топливо (уголь, нефть, бензин) содержит углерод. При горении атомы углерода соединяются с атомами кислорода, содержащегося в воздухе, в результате чего образуются молекулы углекислого газа. Кинетическая энергия этих молекул оказывается большей, чем у исходных частиц. Увеличение кинетической энергии молекул в процессе горения называют выделением энергии. Энергия, выделяющаяся при полном сгорании топлива, и есть теплота сгорания этого топлива.
Теплота сгорания топлива зависит от вида топлива и его массы. Чем больше масса топлива, тем больше количество теплоты, выделяющейся при его полном сгорании.
Физическая величина, показывающая, какое количество теплоты выделяется при полном сгорании топлива массой 1 кг, называется удельной теплотой сгорания топлива. Удельную теплоту сгорания обозначают буквой q и измеряют в джоулях на килограмм (Дж/кг).
Количество теплоты Q, выделяющееся при сгорании m кг топлива, определяют по формуле:
Чтобы найти количество теплоты, выделяющееся при полном сгорании топлива произвольной массы, нужно удельную теплоту сгорания этого топлива умножить на его массу.
Фазовые переходы и уравнение теплового баланса
теория по физике 🧲 термодинамика
Фазовые переходы — это термодинамические процессы, приводящие к изменению агрегатного состояния вещества.
Плавление и отвердевание
Для расчета количества теплоты, необходимого для процесса плавления, следует применять формулу:
m — масса вещества, λ (Дж/кг) — удельная теплота плавления.
Плавление каждого вещества происходит при определенной температуре, которую называют температурой плавления. Все проводимое тепло идет на разрушение кристаллической решетки, при этом увеличивается потенциальная энергия молекул. Кинетическая энергия остается без изменения и температура в процессе плавления не изменяется.
Удельная теплота плавления показывает, какое количество теплоты необходимо сообщить 1 кг данного вещества, чтобы перевести его из твердого состояния в жидкое при условии, что оно уже нагрето до температуры плавления. В процессе отвердевания 1 кг данной жидкости, охлажденной до температуры отвердевания, выделится такое же количество теплоты.
Внимание! Удельная теплота плавления — табличная величина.
Определение Отвердевание, или кристаллизация — переход состояния из жидкого состояния в твердое (это процесс, обратный плавлению).
Отвердевание происходит при той же температуре, что и плавление. В процессе отвердевания температура также не изменяется. Количество теплоты, выделяемое в процессе отвердевания:
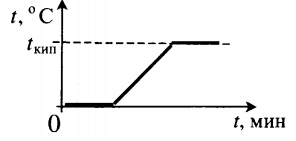
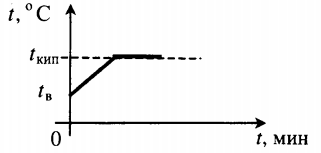
Парообразование и конденсация
Количество теплоты, необходимое для процесса кипения, вычисляют по формуле:
m — масса вещества, r (Дж/кг) — удельная теплота парообразования.
Парообразование происходит при определенной температуре, которую называют температурой кипения. В отличие от испарения, процесс парообразования идет со всего объема жидкости. Несмотря на то, что к кипящему веществу подводят тепло, температура не изменяется. Все затраты энергии идут на увеличение промежутком между молекулами. Температура кипения зависит от рода вещества и внешнего атмосферного давления.
Удельная теплота парообразования показывает, какое количество теплоты необходимо затратить, чтобы перевести в пар 1 кг жидкости, нагретой до температуры кипения. Такое же количество теплоты выделится в процессе конденсации 1 кг пара, охлажденного до температуры конденсации.
Внимание! Удельная теплота парообразования — табличная величина.
Определение Конденсация — процесс, обратный кипению. Это переход вещества из газообразного состояния в жидкое.
Конденсация происходит при температуре кипения, которая также не изменяется во время всего процесса. Количество теплоты, выделяемое в процессе конденсации:
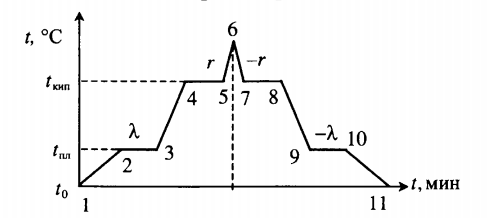
Тепловые процессы при нагревании и охлаждении
Все фазовые переходы, а также процессы нагревания и остывания вещества можно отобразить графически. Посмотрите на график фазовых переходов вещества:
Он показывает зависимость температуры вещества от времени в процессе его нагревания и остывания. Опишем процессы, отображаемые на графике, в таблице.








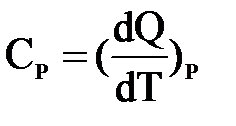


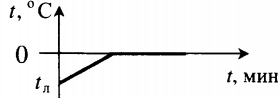
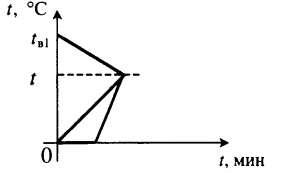 Уравнение теплового баланса:
Уравнение теплового баланса: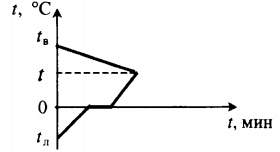 Уравнение теплового баланса:
Уравнение теплового баланса: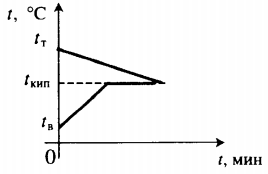 Уравнение теплового баланса:
Уравнение теплового баланса: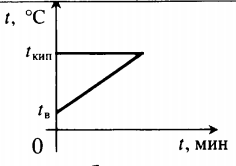 Уравнение теплового баланса:
Уравнение теплового баланса: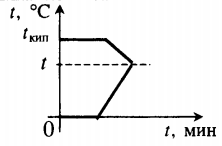 Уравнение теплового баланса:
Уравнение теплового баланса: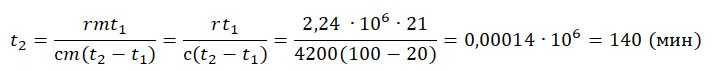
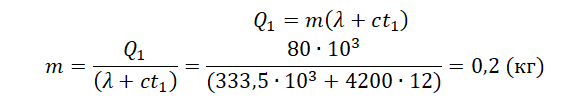
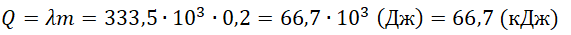
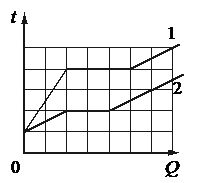 На рисунке представлены графики зависимости температуры t двух тел одинаковой массы от сообщённого им количества теплоты Q. Первоначально тела находились в твёрдом агрегатном состоянии.
На рисунке представлены графики зависимости температуры t двух тел одинаковой массы от сообщённого им количества теплоты Q. Первоначально тела находились в твёрдом агрегатном состоянии.