Что значит осмотические явления
Что значит осмотические явления
Поддержание адекватного объема одной или обеих (внутри- и внеклеточной) жидких сред организма является частой проблемой при лечении тяжелобольных. Распределение внеклеточной жидкости между плазмой и межклеточным пространством в основном зависит от уравновешивания сил гидростатического и коллоидно-осмотического давления, которые действуют на мембрану капилляров.
Распределение жидкости между внутри- и внеклеточной средами в основном определяется осмотическими силами мелких молекул растворенных веществ, преимущественно натрия, хлора и других электролитов, действующих по разные стороны мембраны. Причина этого распределения обусловлена свойствами мембран, проницаемость которых для воды высока, а для ионов даже очень небольшого диаметра, таких как натрий и хлор, практически равна нулю. Следовательно, вода быстро проникает через мембрану, а внутриклеточная жидкость, тем не менее, остается изотоничной по отношению к внеклеточной.
В следующем разделе рассмотрим взаимосвязь между внутри- и внеклеточной жидкостями и причины осмотического характера, способные влиять на перенос жидкости между этими средами.
В статье мы рассмотрим только наиболее важные теоретические положения, касающиеся регуляции объемов жидкости.
Теоретические основы осмоса и осмотического давления
Основы осмоса и осмотического давления изложены в отдельной статье на сайте (просим вас пользоваться формой поиска выше). В этой статье мы рассмотрим только наиболее важные теоретические положения, касающиеся регуляции объемов жидкости.
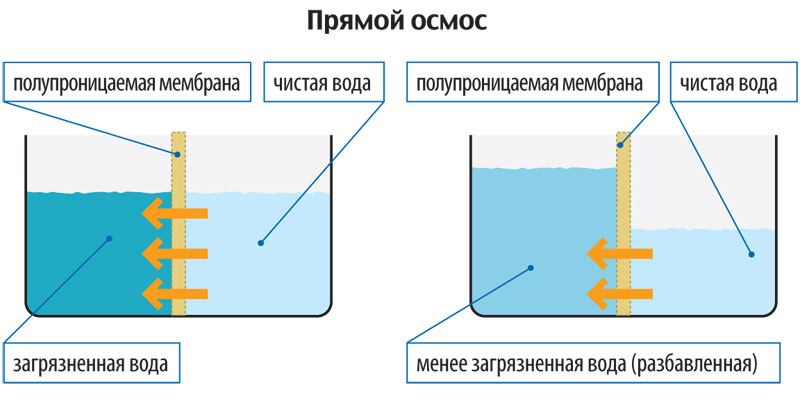
Осмос — процесс диффузии воды через полупроницаемую мембрану. Он происходит из области с высокой концентрацией воды в область с ее низкой концентрацией. Растворение вещества в воде приводит к снижению концентрации воды в данном растворе. Следовательно, чем больше концентрация вещества в растворе, тем ниже в нем содержание воды. Кроме того, вода диффундирует из области с низкой концентрацией вещества (высоким содержанием воды) в область с высокой концентрацией вещества (низким содержанием воды).
Поскольку проницаемость мембраны клеток избирательна (она относительно низка для большинства растворенных веществ, но высока для воды), то при повышении концентрации вещества с одной стороны мембраны вода проникает в эту область путем диффузии. Если растворенное вещество, такое как NaCl, добавить во внеклеточную жидкость, вода будет быстро выходить из клетки до тех пор, пока концентрации молекул воды по обе стороны мембраны не уравняются. Если, напротив, концентрация NaCl во внеклеточной жидкости снизится, вода из внеклеточной жидкости устремится в клетки. Интенсивность, с которой вода диффундирует в клетку, называют осмотической силой.
а) Соотношение молей и осмолей. Поскольку концентрация воды в растворе зависит от количества в нем частиц вещества, под термином «концентрация вещества» (независимо от его химического состава) понимают общее число частиц вещества в растворе. Это число измеряют в осмолях. Один осмоль (осм) соответствует одному молю (1 моль, 6,02×10 23 ) частиц растворенного вещества. Следовательно, каждый литр раствора, содержащий 1 моль глюкозы, соответствует концентрации 1 осм/л. Если молекула диссоциирует на 2 иона, т.е. возникают две частицы (например, NaCl распадается на ионы Na+ и Сl-), то одномолярный раствор (1 моль/л) будет иметь осмолярность 2 осм/л. Аналогично раствор, содержащий 1 моль вещества, которое диссоциирует на 3 иона, например сульфат натрия Na2SО4, будет содержать 3 осм/л. Поэтому термин «осмоль» определяют, ориентируясь не на молярную концентрацию вещества, а на число растворенных частиц.
В целом осмоль — слишком большая величина, чтобы использовать ее в качестве единицы измерения осмотической активности жидких сред организма. Обычно используют 1/1000 осмоли — миллиосмолъ (моем).
б) Осмоляльность и осмолярность. Осмолялъностью называют осмоляльную концентрацию вещества в растворе, которая выражается в количестве осмолей на килограмм растворителя. Когда же речь идет о количестве осмолей в литре раствора, эту концентрацию называют осмолярностью. Для сильно разведенных растворов, которыми являются жидкие среды организма, справедливо использовать оба термина, т.к. разница значений невелика. Во многих случаях сведения о жидких средах организма легче выражать в литрах, чем в килограммах, поэтому в большинстве расчетов, используемых в клинике, а также в следующих главах, за основу принята не осмоляльность, а осмолярность.
в) Осмотическое давление. Осмос молекул воды через избирательно проницаемую мембрану может быть уравновешен силой, приложенной в направлении, обратном осмосу. Величину давления, необходимую для прекращения осмоса, называют осмотическим давлением. Таким образом, осмотическое давление является непрямой характеристикой содержания воды и концентрации веществ в растворе. Чем оно выше, тем меньше в растворе содержание воды и выше концентрация растворенного вещества.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Расскажу простым и понятным языком, что такое осмос, и какая польза нам от использования этого принципа в быту и жизни.
На самом деле – все просто. Родник пробивается сквозь толщи, проходит множество слоёв. А это может быть глина, песок, чернозем, гипс, ракушечник. Благодаря подобной структуре почвы и отсеиваются примеси. Очищается она до кристальной чистоты. Вот поэтому родниковая вода – это синоним идеала.
Но почему мы так озабочены поисками этого самого идеала? Почему мы так радуемся, когда находим чистый родник? Почему так жадно пьем из него? Почему в 21 веке – веке технологий – мы так ценим природную чистоту?
Техническое развитие сделало воду общедоступной. Но…
Но несмотря на прогресс качество водопроводной воды ой, как далеко от идеала.
Что же так влияет на качество воды?
Во-первых, застой в трубах. Жир, пробки из песка, излишние изгибы – вот несколько причин застоя воды.
Во-вторых, химия в воде – это тот самый хлор, с помощью которого обеззараживают воду, а также вещества, используемые для умягчения воды.
Так что – занавес? «Все пропало?»
Нет. Есть лучик света. Это слово из 5 букв – ОСМОС.
Вот что говорит Википедия: «О́смос (от греч. ὄσμος — толчок, давление) — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворенного вещества из объема с меньшей концентрацией растворенного вещества».
Как осмос борется с примесями в воде? 
Вот поэтому вода, прошедшая через мембрану в осмотических системах, чиста от примесей.
До новых встреч. Дмитрий РОМАНОВ
Действуйте! Выбирайте, консультируйтесь, подбирайте, сравнивайте, покупайте, радуйтесь!
Закажите установку в компании ФильтроМир! Круглосуточно отвечаем на ваши вопросы:
фЕНБ: пУНПФЙЮЕУЛЙЕ СЧМЕОЙС Ч ЛМЕФЛЕ
нБФЕТЙБМЩ. мЙУФШС ЬМПДЕЙ ЛБОБДУЛПК (Elodea canadensis); 6-8% ТБУФЧПТ УЕМЙФТЩ ( KNO 3 ).
цЙЪОЕДЕСФЕМШОПУФШ ЛМЕФЛЙ ИБТБЛФЕТЙЪХЕФУС ОЕРТЕТЩЧОП РТПФЕЛБАЭЙНЙ Ч ОЕК РТПГЕУУБНЙ ПВНЕОБ ЧЕЭЕУФЧ, РТЙЮЕН ГЙФПРМБЪНБ ЙЪВЙТБФЕМШОП ТЕБЗЙТХЕФ ОБ ЧПЪДЕКУФЧЙЕ ТБЪОЩИ ЖБЛФПТПЧ ЧОЕЫОЕК УТЕДЩ. ч РПЗМПЭЕОЙЙ Й ЧЩДЕМЕОЙЙ ЧЕЭЕУФЧ ВПМШЫХА ТПМШ ЙЗТБАФ РТПГЕУУЩ ДЙЖЖХЪЙЙ Й ПУНПУБ. пУНПФЙЮЕУЛЙНЙ ОБЪЩЧБАФ СЧМЕОЙС, РТПЙУИПДСЭЙЕ Ч УЙУФЕНЕ, УПУФПСЭЕК ЙЪ ДЧХИ ТБУФЧПТПЧ, ТБЪДЕМЕООЩИ РПМХРТПОЙГБЕНПК НЕНВТБОПК. ч ТБУФЙФЕМШОПК ЛМЕФЛЕ ТПМШ РПМХРТПОЙГБЕНЩИ РМЕОПЛ ЧЩРПМОСАФ РПЗТБОЙЮОЩЕ УМПЙ ГЙФПРМБЪНЩ: РМБЪНБМЕННБ Й ФПОПРМБУФ.
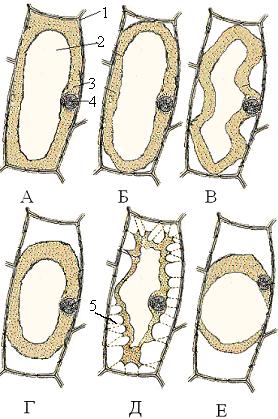
ч ИПДЕ РМБЪНПМЙЪБ ЖПТНБ РМБЪНПМЙЪЙТПЧБООПЗП РТПФПРМБУФБ НЕОСЕФУС. чОБЮБМЕ РТПФПРМБУФ ПФУФБЕФ ПФ ЛМЕФПЮОПК УФЕОЛЙ МЙЫШ Ч ПФДЕМШОЩИ НЕУФБИ, ЮБЭЕ ЧУЕЗП Ч ХЗПМЛБИ. рМБЪНПМЙЪ ФБЛПК ЖПТНЩ ОБЪЩЧБАФ ХЗПМЛПЧЩН (ТЙУ. 10, в).
ъБФЕН РТПФПРМБУФ РТПДПМЦБЕФ ПФУФБЧБФШ ПФ ЛМЕФПЮОЩИ УФЕОПЛ, УПИТБОСС УЧСЪШ У ОЙНЙ Ч ПФДЕМШОЩИ НЕУФБИ, РПЧЕТИОПУФШ РТПФПРМБУФБ НЕЦДХ ЬФЙНЙ ФПЮЛБНЙ ЙНЕЕФ ЧПЗОХФХА ЖПТНХ. оБ ЬФПН ЬФБРЕ РМБЪНПМЙЪ ОБЪЩЧБАФ ЧПЗОХФЩН (ТЙУ. 10, ч).
рПУФЕРЕООП РТПФПРМБУФ ПФТЩЧБЕФУС ПФ ЛМЕФПЮОЩИ УФЕОПЛ РП ЧУЕК РПЧЕТИОПУФЙ Й РТЙОЙНБЕФ ПЛТХЗМХА ЖПТНХ. фБЛПК РМБЪНПМЙЪ ОПУЙФ ОБЪЧБОЙЕ ЧЩРХЛМПЗП (ТЙУ. 10, з ).
еУМЙ Х РТПФПРМБУФБ УЧСЪШ У ЛМЕФПЮОПК УФЕОЛПК Ч ПФДЕМШОЩИ НЕУФБИ УПИТБОСЕФУС, ФП РТЙ ДБМШОЕКЫЕН ХНЕОШЫЕОЙЙ ПВЯЕНБ Ч ИПДЕ РМБЪНПМЙЪБ РТПФПРМБУФ РТЙПВТЕФБЕФ ОЕРТБЧЙМШОХА ЖПТНХ. рТПФПРМБУФ ПУФБЕФУС УЧСЪБООЩН У ПВПМПЮЛПК НОПЗПЮЙУМЕООЩНЙ ОЙФСНЙ зЕИФБ. фБЛПК РМБЪНПМЙЪ ОПУЙФ ОБЪЧБОЙЕ УХДПТПЦОПЗП (ТЙУ. 10, д).
рТЙ ДМЙФЕМШОПН ОБИПЦДЕОЙЙ ЛМЕФПЛ Ч ТБУФЧПТЕ ОЙФТБФБ ЛБМЙС (15 НЙО. Й ВПМЕЕ) ГЙФПРМБЪНБ ОБВХИБЕФ Ч ХДМЙОЕООЩИ ЛМЕФЛБИ, ФБН, ЗДЕ РТПФПРМБУФ ОЕ ЛБУБЕФУС ЛМЕФПЮОЩИ УФЕОПЛ, ПВТБЪХАФУС ФБЛ ОБЪЩЧБЕНЩЕ ЛПМРБЮЛЙ ГЙФПРМБЪНЩ. фБЛПК РМБЪНПМЙЪ ОПУЙФ ОБЪЧБОЙЕ ЛПМРБЮЛПЧПЗП (ТЙУ. 10, е).
тЙУ. 10. рМБЪНПМЙЪ ТБУФЙФЕМШОПК ЛМЕФЛЙ:
ъБДБОЙЕ 1. тБУУНПФТЕФШ ЛМЕФЛЙ МЙУФБ ЬМПДЕЙ, ОБИПДСЭЙЕУС Ч УПУФПСОЙЙ ФХТЗПТБ Й ЪБТЙУПЧБФШ.
ъБДБОЙЕ 2. рТПОБВМАДБФШ СЧМЕОЙЕ РМБЪНПМЙЪБ Ч ЛМЕФЛБИ МЙУФБ ЬМПДЕЙ. пРТЕДЕМЙФШ ЖПТНЩ РМБЪНПМЙЪБ. уДЕМБФШ ТЙУХОЛЙ.
ъБДБОЙЕ 3. рТПОБВМАДБФШ СЧМЕОЙЕ ДЕРМБЪНПМЙЪБ Ч ЛМЕФЛБИ ЬМПДЕЙ, Ф.Е. ЧЕТОХФШ Ч РЕТЧПОБЮБМШОПЕ УПУФПСОЙЕ РМБЪНПМЙЪЙТПЧБООХА ЛМЕФЛХ.
рПУМЕДПЧБФЕМШОПУФШ ТБВПФЩ. уМЕДХЕФ ЪБНЕОЙФШ ТБУФЧПТ УЕМЙФТЩ ЧПДПК, ПФФСОХЧ ТБУФЧПТ ЖЙМШФТПЧБМШОПК ВХНБЗПК. пФНЕФЙФШ ЧПЪЧТБЭЕОЙЕ ГЙФПРМБЪНЩ Л ПВПМПЮЛЕ ЛМЕФЛЙ, Ф.Е. Ч ЕЕ ОПТНБМШОПЕ УПУФПСОЙЕ. дЕРМБЪНПМЙЪ РТПЙУИПДЙФ НЕДМЕООЕЕ, ЮЕН РМБЪНПМЙЪ. пВЯСУОЙФШ СЧМЕОЙЕ ДЕРМБЪНПМЙЪБ.
лПОФТПМШОЩЕ ЧПРТПУЩ
1. у ЛБЛЙНЙ УЧПКУФЧБНЙ ГЙФПРМБЪНЩ Й ЧБЛХПМЙ УЧСЪБОЩ ПУНПФЙЮЕУЛЙЕ СЧМЕОЙС ЛМЕФЛЙ?
2. юФП ФБЛПЕ ФХТЗПТ, РМБЪНПМЙЪ, ДЕРМБЪНПМЙЪ?
3. нПЦЕФ МЙ РТПЙУИПДЙФШ РМБЪНПМЙЪ Ч НЕТФЧПК ЛМЕФЛЕ?
4. лБЛ НПЦОП ЧЩЪЧБФШ РМБЪНПМЙЪ Ч ЛМЕФЛБИ МЙУФБ ЬМПДЕЙ?
5. дБФШ ПРТЕДЕМЕОЙС РПОСФЙСН ПУНПУ Й ДЙЖЖХЪЙС.
ЯВЛЕНИЕ ОСМОСА В НАШЕЙ ЖИЗНИ
Почему мы не можем полностью отказаться от соли? Какие силы заставляют влагу проникать в растение и двигаться внутри него? Что удерживает воду в клетках и не даёт ей выходить наружу? Почему надо очищать воду? Сегодня я разберу эти вопросы. Учёные очень давно пытались ответить на них, но определённой ясности удалось добиться только в конце Х1Х века. Прошло ещё некоторое время, и в лабораториях сумели смоделировать (хотя и очень грубо) это таинственное природное явление. И это явление, осмос. Осмос (от греч.ὄσμος — толчок, давление) — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону большей концентрации растворённого вещества (меньшей концентрации растворителя).
Более широкое толкование явления осмоса основано на применении Принципа Ле-Шателье — Брауна: если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
1.ЯВЛЕНИЯ ПРОЦЕССА ОСМОСА
1.1 СУТЬ ПРОЦЕССА ОСМОСА
Рис. 1. Осмос через полупроницаемую мембрану. Частицы растворителя (синие) способны пересекать мембрану, частицы растворённого вещества (красные) — нет.
Явление осмоса наблюдается в тех средах, где подвижность растворителя больше подвижности растворённых веществ.(см.приложение № 1) Важным частным случаем осмоса является осмос через полупроницаемую мембрану. Полупроницаемыми называют мембраны, которые имеют достаточно высокую проницаемость не для всех, а лишь для некоторых веществ, в частности, для растворителя. (Подвижность растворённых веществ в мембране стремится к нулю). Как правило, это связано с размерами и подвижностью молекул, например, молекула воды меньше большинства молекул растворённых веществ. Если такая мембрана разделяет раствор и чистый растворитель, то концентрация растворителя в растворе оказывается менее высокой, поскольку там часть его молекул замещена на молекулы растворённого вещества (см. Рис. 1). Вследствие этого, переходы частиц растворителя из отдела, содержащего чистый растворитель, в раствор будут происходить чаще, чем в противоположном направлении. Соответственно, объём раствора будет увеличиваться (а концентрация вещества уменьшаться), тогда, как объём растворителя будет соответственно уменьшаться.
Например, к яичной скорлупе с внутренней стороны прилегает полупроницаемая мембрана: она пропускает молекулы воды и задерживает молекулы сахара. Если такой мембраной разделить растворы сахара с концентрацией 5 и 10 % соответственно, то через нее в обоих направлениях будут проходить только молекулы воды. В результате в более разбавленном растворе концентрация сахара повысится, а в более концентрированном, наоборот, понизится. Когда концентрация сахара в обоих растворах станет одинаковой, наступит равновесие. Растворы, достигшие равновесия, называются изотоническими. Если принять меры, чтобы концентрации не менялись, осмотическое давление достигнет постоянной величины, когда обратный поток молекул воды сравняется с прямым.
Осмос, направленный внутрь ограниченного объёма жидкости, называется эндосмосом, наружу — экзосмосом. Перенос растворителя через мембрану обусловлен осмотическим давлением. Это осмотическое давление возникает соответственно Принципу Ле-Шателье из-за того, что система пытается выровнять концентрацию раствора в обеих средах, разделенных мембраной, и описывается вторым законом термодинамики. Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить процесс, то есть создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращению осмоса — обратной диффузии растворителя.
В случаях, когда мембрана проницаема не только для растворителя, но и для некоторых растворённых веществ, перенос последних из раствора в растворитель позволяет осуществить диализ, применяемый как способ очистки полимеров и коллоидных систем от низкомолекулярных примесей, например электролитов.
Осмос играет важную роль во многих биологических процессах. Мембрана, окружающая нормальную клетку крови, проницаема лишь для молекул воды, кислорода, некоторых из растворённых в крови питательных веществ и продуктов клеточной жизнедеятельности; для больших белковых молекул, находящихся в растворённом состоянии внутри клетки, она непроницаема. Поэтому белки, столь важные для биологических процессов, остаются внутри клетки. Осмос участвует в переносе питательных веществ в стволах высоких деревьев, где капиллярный перенос не способен выполнить эту функцию. Осмос широко используют в лабораторной технике: при определении молярных характеристик полимеров, концентрировании растворов, исследовании разнообразных биологических структур. Осмотические явления иногда используются в промышленности, например при получении некоторых полимерных материалов, очистке высокоминерализованной воды методом обратного осмоса жидкостей. Клетки растений используют осмос также для увеличения объёма вакуоли, чтобы она распирала стенки клетки (тургорное). Клетки растений делают это путём запасания сахарозы. Увеличивая или уменьшая концентрацию сахарозы в цитоплазме, клетки могут регулировать осмос. За счёт этого повышается упругость растения в целом. С изменениями тургорного давления связаны многие движения растений (например, движения усов гороха и других лазающих растений). Пресноводные простейшие также имеют вакуоль, но задача вакуолей простейших заключается лишь в откачивании лишней воды из цитоплазмы для поддерживания постоянной концентрации растворимых в ней веществ. Осмос также играет большую роль в экологии водоёмов. Если концентрация соли и других веществ в воде поднимется или упадёт, то обитатели этих вод погибнут из-за пагубного воздействия осмоса.
1.3.РОЛЬ ОСМОСА И ОСМОТИЧЕСКОГО ДАВЛЕНИЯ В БИОЛОГИЧЕСКИХ СИСТЕМАХ
Явление осмоса играет важную роль во многих химических и биологических системах. Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. Упругость клеток (тургор), обеспечивающая эластичность тканей и сохранение определенной формы органов, обусловлена осмотическим давлением. Животные и растительные клетки имеют оболочки или поверхностный слой протоплазмы, обладающие свойствами полупроницаемых мембран. При помещении этих клеток в растворы с различной концентрацией наблюдается осмос. Растворы, имеющие одинаковое осмотическое давление, называются изотоническими. Если два раствора имеют различное осмотическое давление, то раствор с большим осмотическим давлением является гипертоническим по отношению ко второму, а второй – гипотоническим по отношению к первому. При помещении клеток в изотонический раствор они сохраняют свой размер и нормально функционируют. При помещении клеток в гипотонический раствор вода из менее концентрированного внешнего раствора переходит внутрь клеток, что приводит к их набуханию, а затем к разрыву оболочек и вытеканию клеточного содержимого. Такое разрушение клеток называется лизисом, в случае эритроцитов этот процесс называется гемолизом. Кровь с клеточным содержимым, выходящим наружу при гемолизе, за свой цвет называется лаковой кровью. При помещении клеток в гипертонический раствор вода из клеток уходит в более концентрированный раствор, и наблюдается сморщивание (высушивание) клеток. Это явление называется плазмолизом. Биологические жидкости человека (кровь, лимфа, тканевые жидкости) представляют собой водные растворы низкомолекулярных соединений – NaCI, KCl, СаС1, высокомолекулярных соединений – белков, поли–сахаридов, нуклеиновых кислот и форменных элементов – эритроцитов, лейкоцитов, тромбоцитов. Их суммарным действием определяется осмотическое давление биологических жидкостей.
Осмотическое давление крови человека при 310°К (37°С) составляет 780 кПа (7,7 атм). Такое же давление создает и 0,9%-ный водный раствор NaCI (0,15 моль/л), который, следовательно, изотоничен с кровью (физиологический раствор). Однако в крови кроме ионов Na и С1 имеются и другие ионы, а также ВМС и форменные элементы. Поэтому в медицинских целях более правильно использовать растворы, содержащие те же компоненты и в том же количестве, что и входящие в состав крови. Эти растворы применяют в качестве кровезаменителей в хирургии.
Человеческий организм, помимо осмотического давления, характеризуется постоянством (гомеостазом) и других физико-химических показателей крови например кислотности. Допустимые колебания осмотического давления крови весьма незначительны и даже при тяжелой патологии не превышают нескольких десятков кПа. При различных процедурах в кровь человека и животных в больших количествах можно вводить только изотонические растворы. При больших потерях крови (например, после тяжелых операций, травм) больным вводят по несколько литров изотонического раствора для возмещения потери жидкости с кровью.
Явление осмоса широко используют в медицинской практике. Так, в хирургии применяют гипертонические повязки (марлю, смоченную в гипертоническом 10%-ном растворе NaCl), которые вводят в гнойные раны. По закону осмоса ток жидкости раны через марлю направляется наружу, в результате чего рана постоянно очищается от гноя, микроорганизмов и продуктов распада.
2 ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ
Как выпитый глоток воды попадает в клетки нашего организма?
Отгадка, как и большинство научных открытий, будет базироваться на теории и научном эксперименте. Эксперимент ставится на кухне и включает в себя три опыта.
Все опыты посвящаются одному явлению природы — осмосу. Теоретические выкладки занимают три предложения.
Теория в трех предложениях.
Если два раствора разной концентрации разделить перегородкой, пропускающей молекулы воды, но задерживающей молекулы растворенного в ней вещества, то молекулы воды будут переходить в более концентрированный раствор, все больше и больше разбавляя его.
Так распорядилась природа. Люди назвали это явление — “осмос”.
Нами была проведена практическая работа, целью которой было определение закономерностей изменения осмотического давления. Я подтверждала свои гипотезы с помощью опытов.
У нас возникло несколько вариантов насчёт того что, от чего зависит осмотическое давление:
от рода растворяемого вещества;
от температуры раствора.
2.1 ОПЫТ ПЕРВЫЙ, ИЛИ ПЛАЧУЩИЙ ЛИМОН.
2.2 ОПЫТ ВТОРОЙ, ИЛИ СВОЕНРАВНАЯ КАРТОШКА
Спустя час-два заметили, что кубики стали различаться: первый из них (тот, что был в слабосоленой воде) остался прежнего размера,
второй (он находился в сильносоленой воде) съежился и стал значительно меньше, а третий, наоборот, разбух.(см. приложение № 3)
Стало понятно, что и тут сработал осмос. Первый кубик находился в слабом соляном растворе — его концентрация была примерно равна концентрации солей в картофельном соке. Второй кубик окружал раствор большей концентрации, чем концентрация солей в его собственном соке, и в результате осмоса кубик начал обезвоживаться и уменьшаться в размерах. Ну, а кубик, оставленный в водопроводной воде? С ним произошла обратная история: концентрация солей в его соке была выше, чем в воде, и вода начала переходить в кубик. Вот он и “вырос”!
2.3 ОПЫТ ТРЕТИЙ, ИЛИ МОРКОВКА НАСОС
Взяли морковку. Самую обыкновенную. Отрезали от нее зеленый хвостик, а вместо него вставили стеклянную трубку. Получилась пика: морковка — наконечник, а трубка — древко. Если налить в трубку соленую морскую воду, а морковку поставить в стакан с водопроводной водой, то спустя некоторое время можно заметить, что уровень воды в трубке начинает ползти вверх. Это тоже осмос. А знаете, с какой силой водопроводная вода будет давить на морковку? Она будет давить с такой силой, что сможет уравновесить столб воды высотой добрых десять метров. Такое давление называется осмотическим.
Когда морковка находится не в стакане с водой, а растет на огороде, то вода попадает в ее ткани точно так же. Ведь в ее соке концентрация солей выше, чем в воде, которой поливают огород.
Когда мы пьем, вода проникает в наш организм через стенки желудка благодаря осмосу – концентрация солей в крови выше, чем в воде, вот вода и просачивается в кровь.
Когда хозяйка варит суп, она солит воду сразу, чтобы из мяса и овощей вышло как можно больше сока. Но если нам надо приготовить отварное мясо, то следует его варить сначала в несоленой воде, чтобы сок не вышел. Посолить-то ведь всегда успеется!
Когда. Впрочем, здесь лучше остановиться, потому что осмос так часто встречается в нашей жизни, что всех примеров все равно не перечислишь.
Вывод: осмотическое давление зависит от концентрации растворённого вещества.
3 ОСМОС В ЖИЗНЕДЕЯТЕЛЬНОСТИ ЧЕЛОВЕКА
3.1 СОЛЬ В ЖИЗНЕДЕЯТЕЛЬНОСТИ ЧЕЛОВЕКА
Древние наши предки соли отводили уникальное место. На царских пирах знатных гостей сажали выше серебряной ладьи-солонки, а менее именитых – ниже. Были даже времена, когда это белое вещество заменяло деньги и служило причиной неслыханных “соляных” бунтов (например, “соляной бунт”1648 г. в Москве), стихийных “походов протеста” (Индия, начало ХХ в.), вызванных большими налогами на соль (Россия), либо монополизацией производства поваренной соли английскими колонизаторами (Индия)
Всем известна истина – организму требуется все нутриенты, но как избыток, так и недостаток необходимых химических веществ приносит вред. Человеческому организму требуется ежедневно 8-10 г соли, превышение этой средней нормы в два раза уже вредит здоровью, а в три раза – может вызвать и гипертоническую болезнь. Суточной нормы 8-10 г вполне хватит подсолить кашу, суп, больше человеку и не требуется. Но полностью отказываться от соли нельзя хотя бы по той причине, что соль – это необходимый строительный материал для каждой клетки человеческого организма. Поэтому ни один организм не может обходиться совсем без соли. Чтобы уяснить биологическое действие соли в организме, необходимо обратиться к осмосу, известному физическому явлению. Обусловлен осмос стремлением системы к термодинамическому равновесию и выравниванию концентраций раствора по обе стороны мембраны.
Характеризуется явление осмотическим давлением: оно равно избыточному внешнему давлению, которое стоит приложить со стороны раствора, чтобы прекратить осмос. Благодаря осмосу в организме происходит осморегуляция, то есть физико-химические и физиологические процессы, обеспечивающие относительное постоянство осмотическое давление внутренней среды (крови, лимфы, внутриклеточной жидкости) организма. Именно благодаря осморегуляции организм избавляется от излишней воды, шлаков и избытка солей (преимущественно хлористого натрия).
Очень интересно посмотреть, как это явление влияет на жизнедеятельность организмов. Мелкие организмы, обитающие в водоемах, вполне можно уподобить мешочкам с солью, плотность которых больше плотности окружающей их водной среды. вода всегда как бы стремится растворить эти “мешочки с солью”, поглотить их. Пресноводные простейшие еще могут пропустить некоторое количество воды внутрь своего организма, но у них есть специальные приспособления для “откачивания” жидкости. Это сократительные вакуоли. Лучше всего приспособлены к осмосу клетки растений – они окружены плотной мембраной, которая не позволяет им лопнуть от внешнего давления. Эволюция привела к тому, что осмотическое давление, существующее благодаря солевым растворам внутри клеток, как бы распирает клетку изнутри и не дает ей сморщиться. Сложнее обстоит дело с клетками крови (эритроцитами) человека, у которых нет плотной мембраны. Поэтому если разбавить кровь дистиллированной водой, эритроциты раздуются и лопнут. Вот почему для поддержания определенного состава крови нам необходима соль. Именно поэтому при больших кровопотерях в кровь вливают физиологический раствор, содержание хлористого натрия в котором составляет 0,87%, это предотвращает набухание или сморщивание клеток крови. Точно так же и различные капли, которые пускают в нос, готовят на изотоническом растворе, чтобы избежать набухания или обезвоживания клеток слизистой оболочки носа. Все знают, как неприятно, когда при купании в нос попадает пресная вода: она вызывает набухание клеток слизистой. Неприятно также, когда в нос попадает морская вода: она представляет собой гипертоническую среду по отношению к протоплазме и поэтому вызывает сморщивание клеток слизистой. Изотонический же раствор не вызывает никаких неприятных ощущений.
Эффективность английской соли как слабительного также обусловлена осмосом. Ионы, входящие в состав английской соли, не могут быстро проникнуть в клетки эпителия, выстилающего кишечник; в результате, концентрация ионов в просвете кишечника становится значительно выше, чем в клетках; вода выходит из клеток и крови и разжижает содержимое кишечника. Из всего количества потребляемой нами соли лишь небольшой процент всасывается в кровь. Вот почему невозможно и гибельно для организма совсем отказаться от соли.
3.2 СИСТЕМА ВОДОПОДГОТОВКИ, ОСНОВАННАЯ НА ОБРАТНОМ ОСМОСЕ
Что может быть важнее для человека, чем собственное здоровье? Любой согласится, что ничего. А ведь здоровье человека в большой степени зависит от того, что он принимает в качестве пищи, в частности, какую воду он пьет. Сегодня практически каждый человек знает, что употреблять воду из городского водопровода без проведения соответствующей водоподготовки, которая использует обратный осмос воды, нельзя ни в коем случае. Водоподготовка обратный осмос осуществляется для того, чтобы улучшить качество потребляемой жидкости и по возможности удалить из нее все вредные посторонние химические элементы. Вода после обратного осмоса становится практически идеально чистой, из нее удаляются все вредные элементы и бактерии. Конечно, на водопроводных станциях и городских водоочистных сооружениях вся жидкость проходит кое-какую водоподготовку, но ее зачастую бывает недостаточно для того, чтобы полностью очистить воду от нежелательных примесей. Поэтому настоятельно рекомендуется перед употреблением ее для питья или для приготовления пищи использовать дополнительную водоподготовку.
Водоподготовка – это процесс очищения воды от присутствующих в ней в растворенном или нерастворенном виде всевозможных посторонних примесей. Осуществлять водоподготовку можно с помощью фильтров. Практически во всей поступающей из городской системы водоснабжения воде наблюдается повышенное содержание вредных химических элементов, железа, солей магния и кальция. На сегодняшний день существует довольно много способов водоподготовки. Это реагентная и безреагентная водоподготовка, химическая, промышленная. Также поводят водоподготовку путем установки различных фильтров для очистки, которые очищают воду от механических и других примесей. Но самой действенной системой очистки на сегодняшний день является водоподготовка обратный осмос. В том случае, если при отстаивании питьевой воды на дне емкости остается ржавый осадок, это значит, что в воде превышена концентрация железа, и необходимо проводить обезжелезивание. Наиболее частым процессом водоподготовки, используя обратный осмос, является обезжелезивание. Данный процесс водоподготовки проводится при помощи фильтров, которые эффективно удаляют железо, поэтому проведение ее так важно. Принцип действия такого фильтра очень прост. В его корпус засыпается специальная загрузка, которая и ускоряет процесс водоподготовки и очистки. Стоит отметить, что такой процесс занимает считанные секунды. Водоподготовка обратный осмос использует самые современные фильтрующие элементы для очистки питьевой воды от примесей. Ведь технология очистки обратный осмос – это особый метод водоподготовки, при котором применяются высококачественные осмотические мембраны. Следует отметить, что во всех системах водоподготовки обратный осмос является довольно популярным. Питьевая вода, которая прошла очистку через обратный осмос, обогащается кислородом, который делает ее свежей и приятной на вкус. Данный способ водоподготовки – обратный осмос – применяют уже достаточно много времени. Впервые его стали использовать еще в начале 60-х годов прошлого столетия. В самом начале фильтры, которые входят в систему очистки обратного осмоса, применялись для того, чтобы опреснить морскую воду. На сегодняшний день обратный осмос используется во многих странах мира, и с его помощью производится сотни тысяч тонн питьевой воды ежесуточно. Ведь водоподготовка обратный осмос – это такая технология, с помощью которой из воды можно стопроцентно удалить любые нежелательные примеси, в том числе вирусы и металлы. Обратный осмос на сегодня является самой передовой системой водоочистки и водоподготовки, принцип работы которой основан на избирательном проникновении молекул. Воду, которая очищается с помощью технологии обратного осмоса, по качеству можно сравнить только с водой, очищаемой по технологии ионного обмена. Водоподготовку можно вывести на более качественный уровень, если начать
использование многоступенчатой очистки мембранными фильтрами. Но такое возможно лишь на промышленных водоочистных сооружениях. Также при водоподготовке можно использовать дозирующие насосы воды.
В основе работы лежал экспериментальный метод исследования, который позволил доказать выдвинутую в начале работы гипотезу.
В ходе исследования осмоса, используя знания теоретического материала, связанные с изучением проблемы, вынесенной в заглавии работы, в результате практических опытов нами было установлено: осмос имеет большое значение для растительных и животных организмов, способствуя достаточному обводнению клеток и межклеточных структур, осмотическое давление зависит от концентрации растворённого вещества. Возникающее после этого осмотическое давление обеспечивает тургор клеток, т.е. их упругость. Наличие воды необходимо для нормального течения различных процессов. Поэтому данная тема актуальна для любого жителя Земли.
Многочисленными примерами мы ещё раз доказываем, что без осмоса невозможна жизнь на Земле.
Целиисследования достигнуты, гипотеза подтверждена.
Данная работа может быть интересна студентам, опыты, проведенные исследователями интересны и показательны, не требуют особой подготовки, безопасны для жизни человека. Данную работу можно предложить для проведения содержательного классного часа, а также использовать при проведении недели естественных наук.
СУЩНОСТЬ ПРОЦЕССА ОСМОСА
2. Л. А. Шиц. Осмос в БСЭ, 1969—1978
3. Дытнерский Ю.И. Обратный осмос и ультрафильтрация. – М.: «Химия», 1978. 168. — 352 стр.
5. Горшков В. И., Кузнецов И. А., Физическая химия, М., 1986 6.Дуров В. А., Агеев Е.П., Термодинамическая теория растворов неэлектролитов, М., 1987
7. Е. П. Агеев. Мембранные процессы разделения.
8. Клячко В. А., Апельцин И. Э., Подготовка воды для промышленного и городского водоснабжения, М., 1962
9.Кастальский А. А., Минц Д. М., Подготовка воды для питьевого и промышленного водоснабжения, М., 1962.