Что значит одинаковая электроотрицательность
Электроотрицательность. Виды химических связей
Начнем с того, почему вообще важна электроотрицательность. Все химические связи образуются за счет нее. В зависимости от того, какие атомы вступают в образование химической связи, она делится на определенные виды. Поэтому для того, чтобы понять суть этого деления, нам нужно разобраться:
Для того чтобы понять это, нам понадобится понятие атомного остова из прошлой статьи.
Электроотрицательность
Электроотрицательность — это способность атома оттягивать на себя электроны с внешнего электронного слоя.
Да-да, ЕГЭ вы сдали хорошо — электроотрицательность увеличивается слева направо и сверху вниз, но почему? Выделим две причины, но для второй нам потребуется немного физики. Ну все, ты закрываешь статью и говоришь: «Какая физика?»
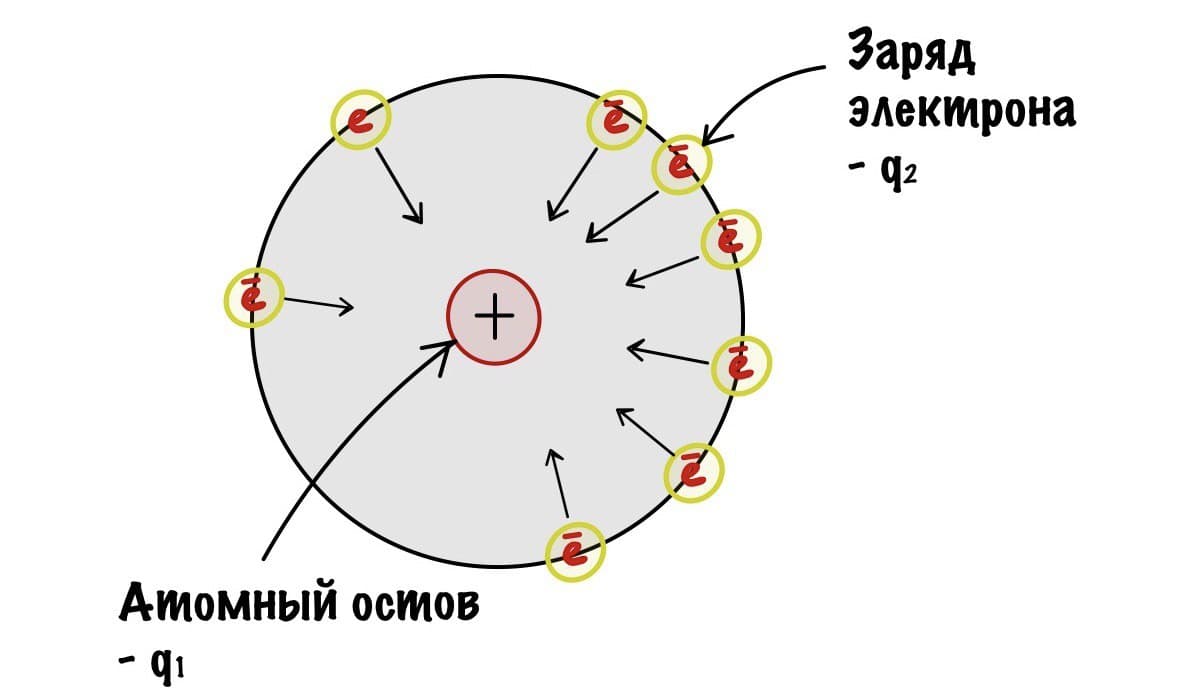
Так, начнем с закона Кулона — он показывает силу взаимодействия между двумя электрическими зарядами. Наши заряды разноименные. Атомный остов — положительный, а электрон — отрицательный. Значит они притягиваются друг к другу.
Сразу скажу, что ничего считать мы не будем. Коэффициент — k нас не интересует. Нам просто нужно понять, что чем больше q1 и q2, тем больше сила притяжения между зарядами. Радиус, как я писал до этого, примерно одинаковый в одном периоде. Теперь мы можем сравнить электроотрицательность атомов второго периода с помощью небольшого рисунка. Для этого мы предположим, что электроны находятся примерно на одном расстоянии атомного остова.
Получается, что q1 — это заряд атомного остова, а q2 — заряд электрона, который всегда одинаковый. Вот мы и нашли легкую зависимость — чем больше заряд атомного остова, тем с большей силой он притягивает электрон, и тем больше электроотрицательность. У кислорода заряд ядерного остова 6, а у азота только 5. Самый большой заряд у фтора — 7. С увеличением периода возрастает радиус атома — электроотрицательность становится меньше. Получается, что максимальная электроотрицательность у элементов второго периода и растет она слева направо, так как увеличивается заряд атомного остова.. Хоть мы это и знали, но прикольно же понять почему такое происходит?
Виды химических связей
Напишу про все, кроме металлической связи, она не особо интересует нас в биохимии. Химическая связь нужна для того, чтобы придать дополнительную стабильность системе. Что за система? Ну это просто атомы, которые вступают в образование связей — при образовании связи энергия системы уменьшается, и она становится стабильнее, а значит стабильнее и состояние атома.
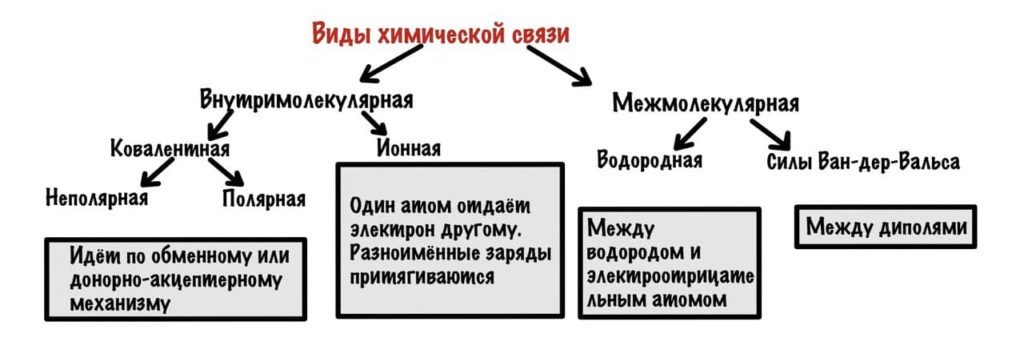
Можно разделить химические связи на две группы: внутримолекулярные и межмолекулярные. Начнем с внутримолекулярных.
Внутримолекулярные химические связи
Всего два варианта: ионная и ковалентная. Правда последняя делится на две, но разберемся с этим в процессе.
Ковалентная химическая связь
Она возникает, если атомы образуют общие электронные пары. Может идти по двум механизмам: обменному и донорно-акцептерному.
Обменный механизм
У атомов на внешнем слое есть неспаренные электроны. Они решают поделиться ими с другими атомами и образовать связь.
Донорно-акцепторный механизм
У одного атома есть неподеленная электронная пара — два электрона на одной орбитали, а у другого есть пустая орбиталь. Если первый атом очень щедрый, то он может отдать свой электрон другому атому и образовать связь. Так образуются ионы аммония и гидроксония — аммиак и вода присоединяют протон водорода (у него нет электрона).
Ну это все понятно, но для чего нужна была электроотрицательность? А вот для чего — ковалентная связь бывает неполярной и полярной.
Ковалентная неполярная химическая связь
Здесь в образовании связи участвуют два атома с одинаковой электроотрицательностью, например — два водорода, два кислорода и так далее.
Нам подойдет один из прошлых рисунков с образованием водорода. Так как электроотрицательность у атомов одинаковая, то общая электронная пара не смещается к какому-либо атому, а лежит посерединке.
Ковалентная полярная химическая связь
После образования связи атом кислорода начинает тянуть электронную пару на себя. Она проводит больше времени с его стороны, так как у электронов отрицательный заряд, то и заряд на кислороде становится частично отрицательным — δ-заряд. Можно нарисовать это попроще.
Мы можем сделать вывод, что чем больше разность электроотрицательности у атомов, тем больше полярность связи. Если возьмем какой-нибудь оксид азота, то кислород будет меньше оттягивать на себя электроны, так как электроотрицательность у них не слишком различается. А это значит, что и дельта заряд на кислороде и азоте будет меньше.
Но если мы возьмем молекулу воды, то разница в электроотрицательности кислорода и водорода большая. Значит дельта заряды и полярность связи будут побольше
Полярность молекулы
Раз уж мы здесь, то давайте сразу определимся от чего зависит полярность молекулы. Это важно для понимания того, какие молекулы свободно пройдут через биологическую мембрану, а какие нет. Полярность молекулы зависит от полярности связей между атомами и геометрии молекулы. Если все связи в молекуле неполярные, то и молекула неполярная, например O2. Такие молекулы легко проходят через мембрану.
Посложнее с полярными связями. Здесь все зависит от геометрии молекулы. Геометрия молекулы может быть симметричной — у нее нет неподеленных электронных пар и неспаренных электронов, например CO2. Значит CO2 тоже легко пройдет через мембрану.
Но если у молекулы есть неподеленные электронные пары или неспаренные электроны, то она асимметрична. Значит она полярна, например H2O и NH3.
Такие молекулы будут хуже проходить через мембрану. Вода транспортируется через специальные белки — поры (аквапорины). Кстати, возможно аквапорины еще нужны потому, что вода в растворе переходит в ион гидроксония. Ион гидроксония — это полярная и заряженная молекула, которая практически не будет проходить через мембрану.
Ионная связь
Она образуется в случае, когда разница в электроотрицательности между двумя атомами просто огромная! Мы знаем, что атомы стараются полностью заполнить свои энергетические слои. Как это можно сделать? Можно отдать лишний электрон или присоединить электрон к себе. Когда два таких атома встречаются, то один из них отдает электроны, а другой принимает — отдает обычно щелочной/щелочно-земельный металл или водород. В итоге один атом становится заряжен отрицательно — анион, а другой положительно — катион. Они удерживаются друг с другом благодаря силам электростатического взаимодействия — разноименные заряды притягиваются. Да, да, я опять пишу эту банальщину.
Или вот ионная связь между молекулами аминокислот.
Сведем все в табличку.
Межмолекулярные химические связи
Здесь взаимодействуют не атомы, а молекулы. Капитан очевидность. В таких связях очень маленькое количество энергии, но их настолько много, что они придают стабильность большим системам — белок, ДНК. Два варианта — водородные связи и и силы Ван-дер-Ваальса.
Водородная связь
Водородная связь — это связь атома водорода одной молекулы с атомом другой молекулы. Звучит просто, но она может образоваться не всегда. Есть условия, о которых мы сейчас поговорим:
С помощью водородных связей образуются вторичная структура белка и вторичная структура ДНК.
Основной вклад в образование таких связей вносит электростатическое взаимодействие. Еще пишут про донорно-акцепторный механизм, но если бы он тут был, то образовывались ионы гидроксония, мы уже разобрали это выше.
Силы Ван-дер-Ваальса
Там три варианта, но я остановлюсь только на двух — ориентационных и индукционных взаимодействиях. Сначала ориентационные, с ними полегче. Проще будет просто показать это.
Такие молекулы называют диполями — у них есть положительно и отрицательно заряженные части. Молекулы ориентируются друг на друга: положительные части располагаются рядом с отрицательными и между ними образуются слабые связи. Ну вы поняли, что такая тема может идти только в соединениях с ковалентной полярной связью.
Теперь индукционные. Смотрите, есть одна молекула — HCl, у нее есть дельта-положительно заряженный водород. Вдруг такая молекула подходит к молекуле, где связь неполярная, например водороду. Что было дальше? А вот что, дельта-положительный водород начинает оттягивать на себя электронную пару из молекулы. Тут то и образуется диполь.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.
1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов.
Электроотрицательность
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
Элементы, проявляющие постоянную СО
Значение постоянной СО этого элемента
IA группы — Li, Na, K, Rb, Cs, Fr
Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
Элемент
Степень окисления практически во всех соединениях
Исключения
Фторид кислорода —
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
Химический элемент
Номер группы
Высшая степень окисления
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Нахождение степеней окисления элементов в различных соединениях
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Решение:
Запишем формулу серной кислоты:
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Обозначим степень окисления серы как x:
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
Т.е. мы получили следующее уравнение:
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:
Т.е. мы получаем два независимых уравнения:
Решая которые, находим x и y:
Как определять степени окисления элементов в органических веществах можно почитать здесь.
Валентность
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
1) неспаренных электронов
2) неподеленных электронных пар на орбиталях валентных уровней
3) пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня. Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Резюмируя информацию по валентным возможностям атома углерода:
1) Для углерода возможны валентности II, III, IV
2) Наиболее распространенная валентность углерода в соединениях IV
3) В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH3), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор( ) предоставляет ее другому атому с вакантной (
) орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии. Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
em>Резюмируя информацию по валентным возможностям атома азота:
1) Для азота возможны валентности I, II, III и IV
2) Валентности V у азота не бывает!
3) В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!).
Валентные возможности фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d-подуровень с 5-ю вакантными орбиталями.
Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т.д.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях. Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа. Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).
Из-за того что атом кислорода не имеет на внешнем уровне d-подуровня, распаривание электронов s и p-орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
Таким образом, кислород практически всегда имеет валентность, равную II, однако в некоторых частицах он трехвалентен, в частности, в молекуле угарного газа C≡O. В случае, когда кислород имеет валентность III, одна из ковалентных связей образована по донорно-акцепторному механизму.
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода H2S.
Как мы видим, у атома серы на внешнем уровне появляется d-подуровень с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p-подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV. Действительно, валентность IV сера имеет в молекулах SO2, SF4, SOCl2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s-подуровне, внешний энергетический уровень приобретает конфигурацию:
В таком состоянии уже становится возможным проявление валентности VI. Примером соединений с VI-валентной серой являются SO3, H2SO4, SO2Cl2 и т.д.
Аналогично можно рассмотреть валентные возможности остальных химических элементов.