Что значит неспаренные электроны в атоме
Атомы и электроны
Атомно-молекулярное учение
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов
Содержание:
Электронная конфигурация атомов
Записать распределение электронов по энергетическим уровням можно несколькими способами.
Запись по электронным оболочкам (схема электронного строения)
Показывает заряд ядра и количество электронов на каждом энергетическом уровне.
Легче всего начинать с неё, потому что она показывает структуру атома «крупным планом».
Запись с обозначением энергетических уровней и подуровней
Каждая орбиталь обозначается квадратной ячейкой. Электрон обозначается стрелкой. Различное направление стрелок указывает на противоположные спины.Под ячейкой подписывают номер энергетического уровня, буквенное обозначение орбитали и количество электронов на ней.
Буквенно-числовое обозначение такого «адреса» электрона – это электронная формула. Электронная конфигурация – это электронная формула, которая показывает распределение электронов по энергетическим уровням.
Электронная конфигурация атомов 1 и 2 периодов
Электронная конфигурация атомов 3 периода
Электронная конфигурация атомов 4 периода
Заполнение орбиталей атомов 4 периода имеет свои особенности.
На движение электрона влияют поле ядра и поле других электронов. Поэтому в атомах с большим количеством электронов энергия электрона определяется главным и орбитальным квантовыми числами.
Здесь уже надо смотреть на сумму обоих квантовых чисел (n+l). Если для двух подуровней эта сумма равна: 3d, 4p, 5s (n+l=5), то сначала заполняются уровни с меньшими значениями n. То есть последовательность заполнения будет следующей: 3d – 4p – 5s.
Поэтому в 4 периоде сначала заполняется подуровень 4s, а потом подуровень 3d.
Есть ещё одна особенность, которая появляется в 4 периоде. Хром и медь имеют на 4s-орбитали по одному электрону. Всё дело в заполнении d-оболочек. Полузаполненные или заполненные d-оболочки устойчивее частично заполненных. В атоме хрома на каждой из 5 3d-орбиталей есть по одному электрону. В атоме меди на каждой на каждой 3d-орбитали есть по два электрона.
Алгоритм записи электронной конфигурации атома
Электронная конфигурация ионов
Электронная конфигурация ионов составляется по тем же принципам. Нужно учитывать изменения количества электронов на внешнем энергетическом уровне.
Атом электронейтрален, то есть сколько протонов ядре, столько же электронов в атоме. Если атом принимает электроны, он становится отрицательно заряженным ионом (анионом), если отдаёт электроны – положительно заряженным ионом (катионом).
Атому легче всего отдать электроны внешнего энергетического уровня, «чужие» электроны он тоже примет на внешний энергетический уровень. На внешнем энергетическом уровне не может находиться более 8 электронов. Теория «октета» была предложена в 1916 году Гилбертом Ньютоном Льюисом и Вальтером Косселем
Атом «стремится» добрать электроны на внешний уровень или избавиться от них, поэтому и становится ионом. Полное заполнение s- и p-подуровней внешнего уровня придаёт атому стабильность. Только атом гелия имеет на единственном внешнем энергетическом уровне 2 электрона, а не 8, потому что первый энергетический уровень состоит только из одной s-орбитали.
Количество электронов на внешнем энергетическом уровне определяется по таблице Менделеева. У элементов главных подгрупп номер группы – это и есть количество электронов на внешнем уровне. У элементов побочных подгрупп количество электронов на внешнем уровне не больше двух.
Основное и возбуждённое состояния атома
На первый взгляд кажется, что атом хлора может образовывать только одну связь и соединения одного типа – например, хлориды. Но откуда берутся хлорная, хлорноватая, хлористая и хлорноватистая кислоты?
Дело в том, что атом можно перевести из основного состояния в возбуждённое.
Основное состояние – это состояние атома с наименьшей энергией. Атом обладает наименьшей энергией в основном состоянии. Но если ему передать дополнительную энергию, он перейдёт в возбуждённое состояние. Электроны перейдут на уровень или подуровень с большей энергией.
Сначала разрываются электронные пары на 3p-подуровне, электроны переходят на 3d-подуровень. Если атом хлора получит ещё больше энергии, спаренный электрон покинет даже 3s-орбиталь и перейдёт на 3d-подуровень.
Благодаря этому атом хлора может образовывать больше химических связей. Затраты энергии, потраченные на распаривание электронов, окупаются при образовании новых химических связей.
Но в возбуждённое состояние могут перейти атомы, у которых есть неспаренные электроны и свободные орбитали. Длится возбуждённое состояние недолго: атом отдаст энергию и вернётся в основное состояние. Хотя если сообщить атому слишком много энергии, электрон покинет его и атом станет ионом.
Что значит неспаренные электроны в атоме
Определите, атомы каких из указанных элементов не имеют в основном состоянии неспаренных электронов. Запишите в поле ответа номера выбранных элементов в порядке возрастания.
Для выполнения заданий 1–3 используйте следующий ряд химических элементов:
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке увеличения электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Из перечня элементов в одном периоде (втором) находятся: бериллий, кислород и фтор. Электроотрицательность усиливается при движении слева направо по периоду. Поэтому последовательность элементов в порядке увеличения электроотрицательности следующая: бериллий — кислород — фтор.
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +2. Запишите в поле ответа номера выбранных элементов в порядке возрастания.
1. Натрий расположен в первой группе ПС — не имеет С.О. +2;
2. Для бериллия характерна С.О. +2;
3. Фтор (самый электроотрицательный элемент ПС) не может проявлять положительные степени окисления;
4. Кислород имеет С.О. +2 во фториде кислорода ();
5. Гелий не проявляет С.О. +2.
Запишем электронные формулы:
1. —
— один неспаренный электрон;
2. —
— нет неспаренных электронов;
3. —
— один неспаренный электрон;
4. —
— два неспаренных электрона;
5. —
— нет неспаренных электронов.
Что значит неспаренные электроны в атоме
Какие из указанных элементов образуют ион с зарядом +1, не имеющий неспаренных электронов в основном состоянии? Запишите в поле ответа номера выбранных элементов в порядке возрастания.
Для выполнения заданий 1–3 используйте следующий ряд химических элементов:
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Из приведённого списка выберите три металла и расположите их в порядке уменьшения основных свойств высшего гидроксида. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
В списке элементов 3 металла: натрий, марганец и медь. Их высшие гидроксиды: гидроксид натрия (сильное основание), гидроксид меди (слабое основание) и марганцевая кислота.
Из приведённого списка выберите два элемента, которые в соединениях могут иметь степень окисления +7. Запишите в поле ответа номера выбранных элементов в порядке возрастания.
Чтобы элемент имел степень окисления +7, у него должно быть 7 валентных электронов. В данном случае это марганец и хлор.
Рассмотрим число валентных электронов в однозарядном ионе каждого из элементов:
1. — 0 электронов;
2. — 4 (2 спаренных и 2 неспаренных);
3. — 6 (6 неспаренных);
4. — 10 (5 пар);
5. — 6 (2 пары и 2 неспаренных).
Задание №1 ЕГЭ по химии
В Задании №1 нам необходимо уметь хорошо пользоваться таблицей Менделеева. Первое задание — это поиск атома или иона с заданной конфигурацией электронов, обычно это количество электронов на внешнем уровне (соответствует номеру группы).
Тематика заданий: электронная конфигурация атомов Бал: 1 Сложность задания: ♦ ◊◊ Примерное время выполнения: 1 мин.
Разбор типовых вариантов заданий №1 ЕГЭ по химии
Вариант 1ЕХ1
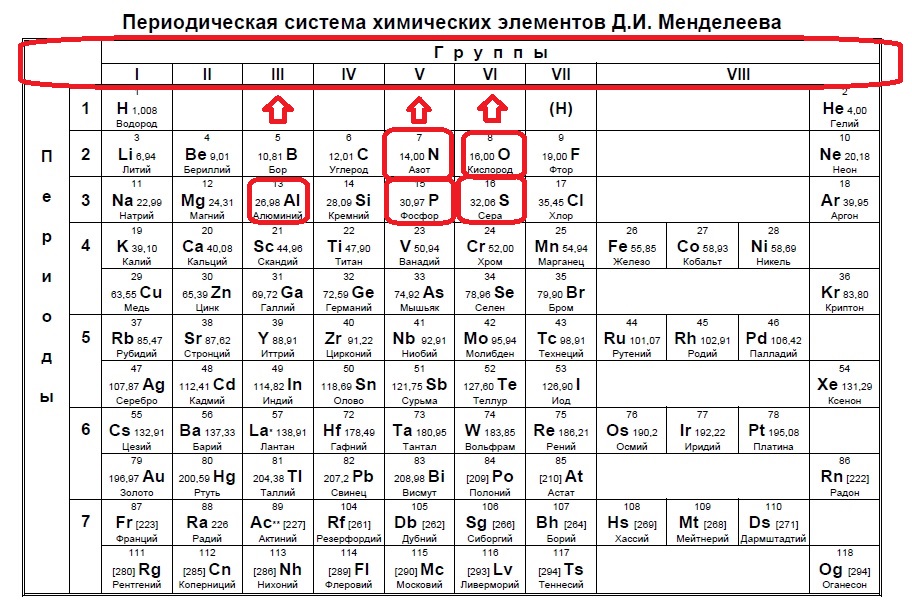
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне пять электронов.
Данный пример — типичный вариант первого задания — необходимо определить количество электронов на внешнем уровне. Вспоминаем, что на количество электронов на внешнем уровне указывает номер ГРУППЫ:
Напомню, что нам важно обращать внимание на то, в главной или побочной группе находится элемент. К сожалению, в таблице, которая дана на ЕГЭ нет деления на главные или побочные группы (какие-то элементы пишут правее, какие-то левее, но это не деление на главные и побочные группы), данная таблица не удобна, однако, по правилам можно пользоваться только ей. Обсуждать недостатки данной таблицы мы не будем, скажем лишь, что в условиях задания представлены всегда элементы главных групп, поэтому данный вопрос отпадает сам собой на экзамене (но нет гарантий, что не могут дать определить количество внешних электронов у кобальта, например, по номеру группы в данной таблице это не определишь).
Итак, находим наши пять элементов из условия:
Определяем номер группы — у алюминия 3 группа, у азота и фосфора — пятая, у кислорода и серы — шестая.
В условии нас спрашивают про пять электронов — значит выбираем элементы из пятой группы — азот и фосфор!
Вариант 1ЕХ2
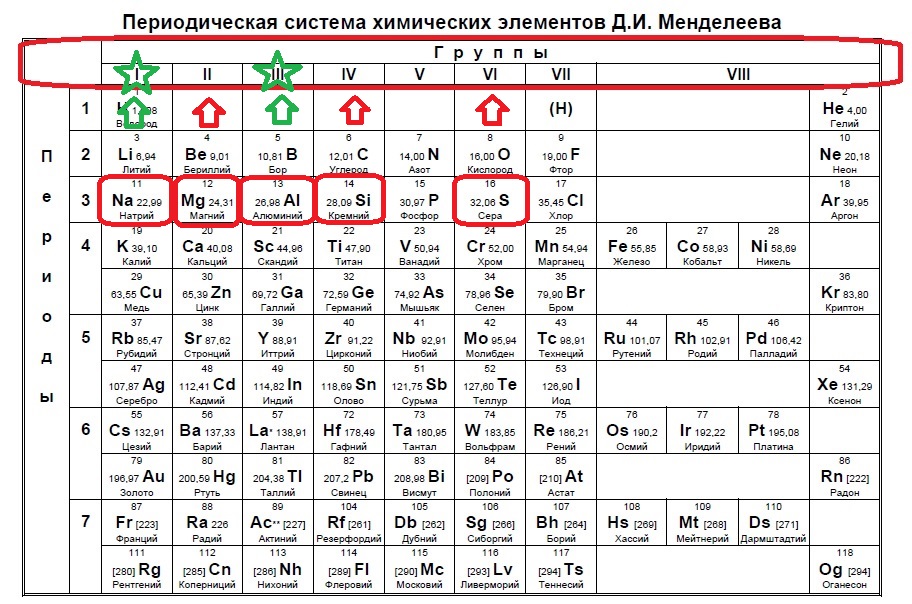
Определите, двум атомам каких из указанных элементов до завершения внешнего уровня не хватает шести электронов.
Данное задание немного другого типа, в нем необходимо определить элементы, которым не хватает какого-то количества электронов до завершения внешнего уровня. В этом случае наш алгоритм прост: мы знаем, что на внешнем уровне должно быть 8 электронов (2 и 3 период, или главные группы 4,5,6.. — в заданиях в основном фигурируют именно эти элементы), а значит вычитаем из 8 заданное число — в нашем случае 6: 8-6=2. Значит, в нашем элементе должно быть два электрона на внешнем уровне и, следовательно, расположен он во второй группе. Определяем группы элементов из условия:
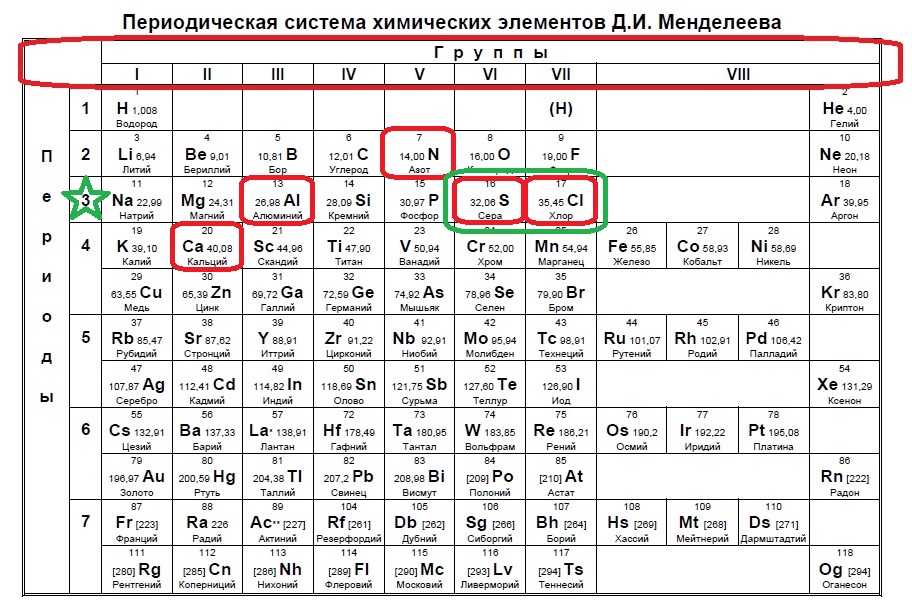
Вариант 1ЕХ3
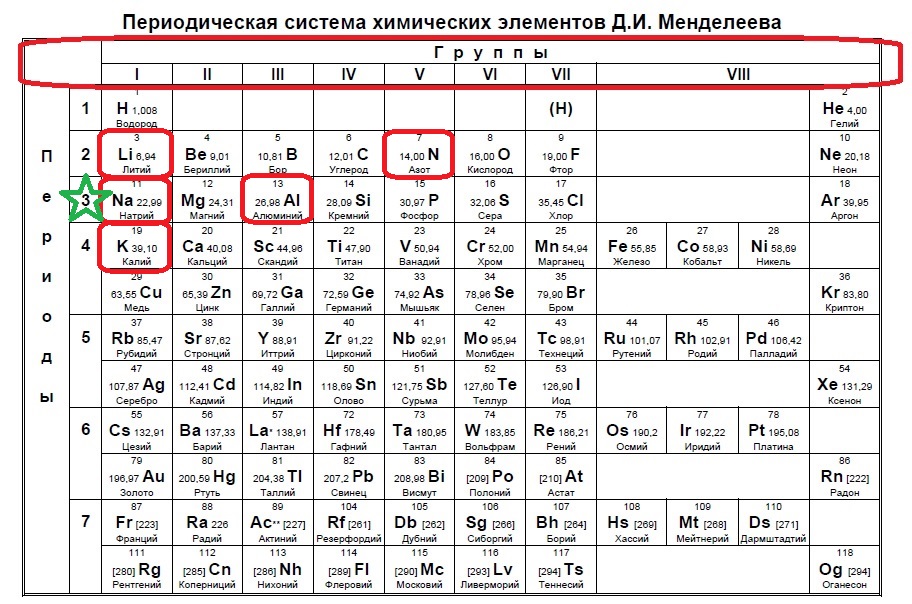
Определите, атомы каких двух из указанных в ряду элементов в основном состоянии содержат один неспаренный электрон.
Следующий вид задания на поиск элементов с неспаренным электроном. Тут все достаточно просто. Так как электроны у нас в орбиталях всегда располагаются по парам (если помните, то есть квадратик, в котором мы рисуем стрелочку вверх и низ), то логично, что неспаренный электрон образуется, когда количество электронов на внешнем уровне нечетно, то есть в элемент должен быть расположен в нечетной группе, а именно 1,3,5,7. Определяем группы указанных нам элементов:
Итак, натрий в первой группе, магний во второй, алюминий в третьей, кремний в четвертой, а сера в шестой.
Выбираем элементы в нечетных группах — это натрий и алюминий!
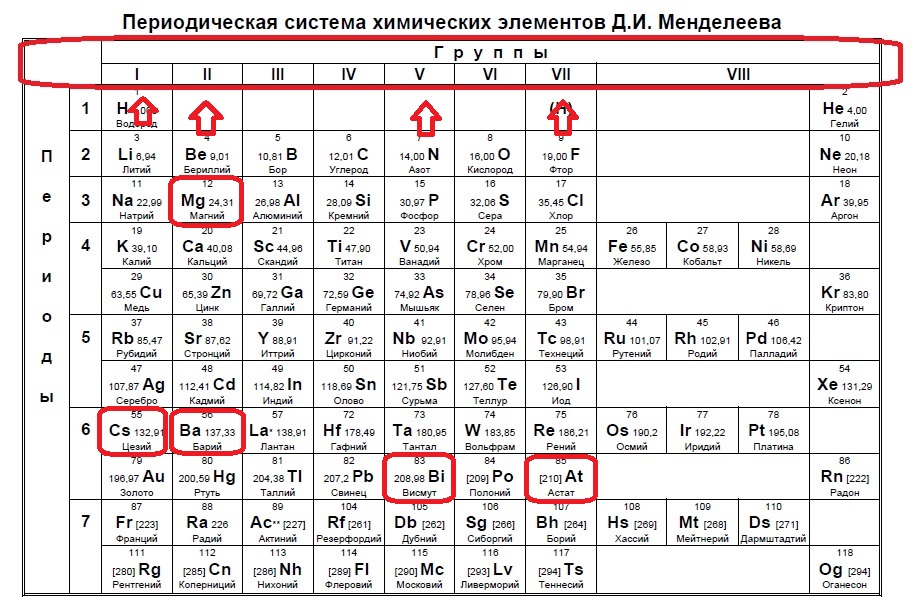
Вариант 1ЕХ4
Определите, атомы каких двух из указанных в ряду элементов в основном состоянии содержат два неспаренных электрона.
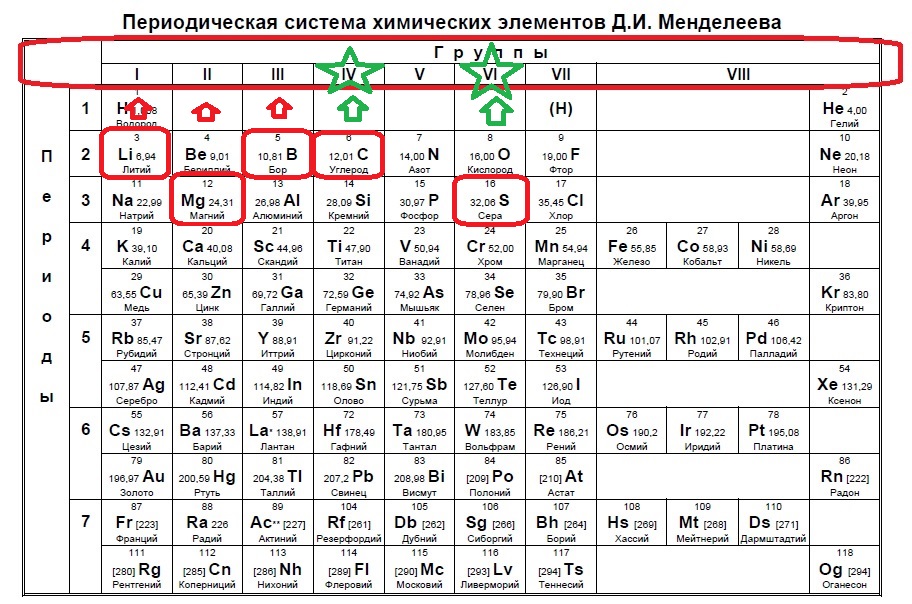
Вариант 1ЕХ5
Определите, какие два из указанных элементов образуют устойчивый положительный ион, содержащий 10 электронов.
В данном варианте задания речь идет уже об ионе, причем положительном, который содержит 10 электронов. В такого вида заданиях необходимо определить, сколько заполнено уровней у иона в зависимости от количества электронов. В нашем случае 10 электронов — это полностью заполненные первый (2) и второй (8) уровни (или периоды в таблице). Так мы говорим о положительном ионе — значит элемент потерял электроны, но у него их было больше чем 10, а значит, он расположен в третьем периоде. Ищем такие элементы:
Нам подходят натрий и алюминий.
Вариант 1ЕХ6
Определите, какие из указанных элементов образуют устойчивый отрицательный ион, содержащий 18 электронов.
Отрицательный ион получается путем добавления электронов к атому. 18 электронов — это полностью заполненный третий уровень или период, значит, наши элементы расположены именно в нем (в отличии от предыдущего задания, где мы искали в следующем периоде, так как ион положительный). Смотрим на предоставленные в условии элементы:
В данном случае в третий период попали алюминий, сера и хлор. Алюминий не может принять электроны до 18, так как является металлом и отдает электроны. Наиболее типичные элементы-любители электронов расположены правее. Это сера и хлор для данного задания.
Вариант 1ЕХ7
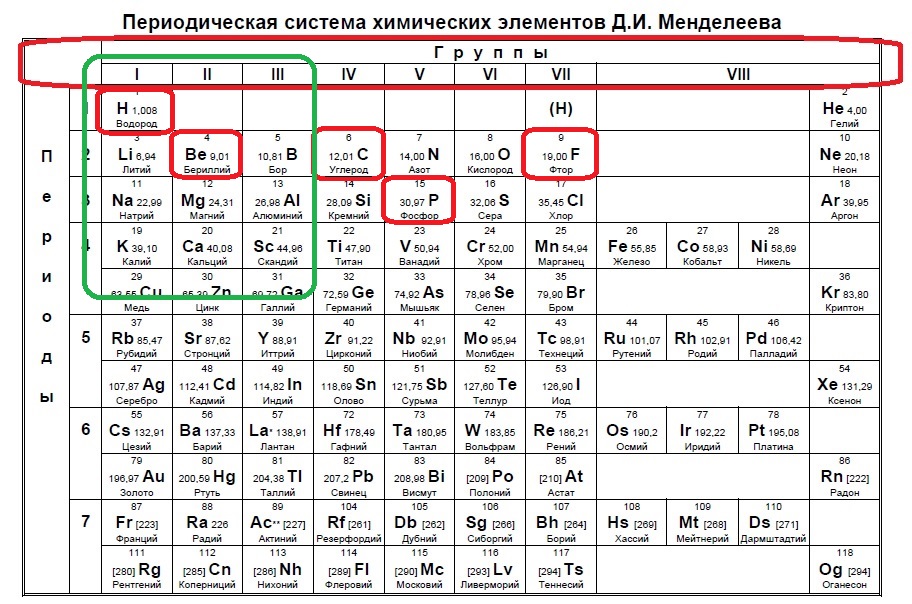
Определите, какие из указанных элементов на внешнем уровне содержат больше s-электронов, чем p-электронов (в основном состоянии).
Такие виды заданий часто встречаются в тренировочных вариантах, нужно либо определить кого меньше, когда равно или кого больше. Разберем для наглядности данный пример. s-электронов всего два, значит p-электронов должно быть 1, чтобы было меньше. В сумме у элемента на внешнем уровне получается максимум 3 электрона (но может быть и ноль p-электронов и один или два s!), а значит он в третьей, второй или первой группе:
Остальные задания очень похожи на разобранные, поэтому вы их точно сможете решить, разобравшись с выше представленными решениями.