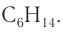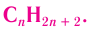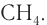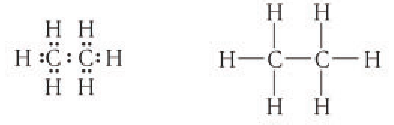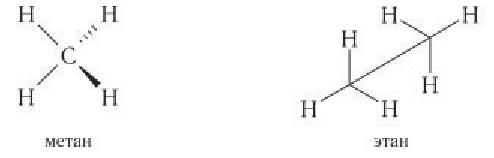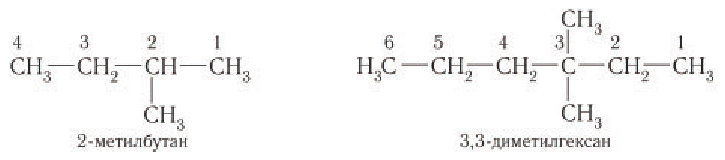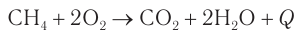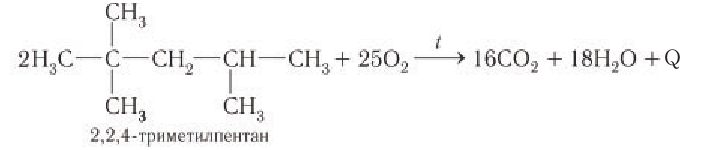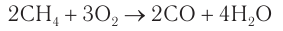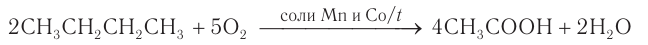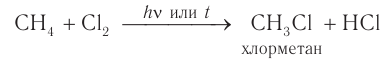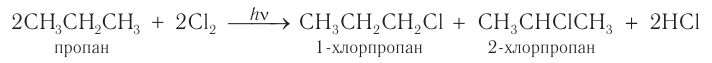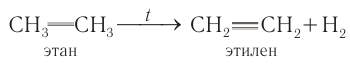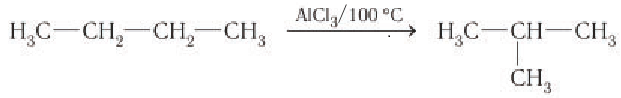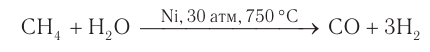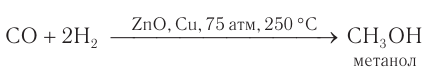Что значит насыщенный углеводород
Насыщенные углеводороды
Полезное
Смотреть что такое «Насыщенные углеводороды» в других словарях:
НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ — в органической химии класс (см.), в молекулах которых атомы (см.) соединены друг с другом и с атомами (см.) одинарными (простыми) связями. Все валентности атомов углерода в них насыщены до предела атомами водорода, поэтому их называют еще… … Большая политехническая энциклопедия
насыщенные углеводороды — 3.1.3 насыщенные углеводороды: Алканы и циклоалканы. Источник: ГОСТ Р 52063 2003: Нефтепродукты жидкие. Определение группового углеводородно … Словарь-справочник терминов нормативно-технической документации
НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ — (предельные углеводороды), орг. соед., углеродные атомы к рых соединены между собой простыми (ординарными) связями. В статье рассмотрены алифатич. насыщ. углеводороды общей ф лы С n Н 2n+2 (алканы, парафины, метановые углеводороды). О циклич. Н.… … Химическая энциклопедия
Насыщенные углеводороды — Эта статья о химических соединениях. Статью о канадской алюминиевой компании Alcan см. ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.… … Википедия
НАСЫЩЕННЫЕ СОЕДИНЕНИЯ — (предельные соединения) органические соединения, в молекулах которых атомы соединены между собой только простыми связями в открытые цепи (алифатические насыщенные соединения) или циклы (алициклические насыщенные соединения). К насыщенным… … Большой Энциклопедический словарь
насыщенные соединения — (предельные соединения), органические соединения, в молекулах которых атомы соединены между собой только простыми связями в «открытые» цепи (алифатические насыщенные соединения) или циклы (алициклические насыщенные соединения). К насыщенным… … Энциклопедический словарь
Углеводороды — класс органических соединений, молекулы которых состоят только из атомов углерода и водорода. В зависимости от строения различают ациклические, или алифатические, У., в молекулах которых атомы углерода связаны друг с другом в линейные или … Большая советская энциклопедия
УГЛЕВОДОРОДЫ — орг. соед., молекулы к рых состоят только из атомов С и H. Различают алифатические, или ациклические, У. (см. Алифатические соединения), в молекулах к рых углеродные атомы образуют линейные или разветвленные открытые цепи (напр., этан, изопрен),… … Химическая энциклопедия
НАСЫЩЕННЫЕ СОЕДИНЕНИЯ — (предельные сосд.), органич. соед., в молекулах к рых атомы соединены между собой только простыми связями в открытые цепи (алифатич. Н. с.) или циклы (алициклич. Н. с.). К Н. с. относятся, напр., алканы, или парафины, общей ф лы СnН2n+2 (метан… … Естествознание. Энциклопедический словарь
УГЛЕВОДОРОДЫ НАСЫЩЕННЫЕ (ПРЕДЕЛЬНЫЕ) — углеводороды, в молекулах которых все атомы углерода связаны между собой простыми связями, в силу чего У. н. лишены способности к реакции присоединения и полимеризации. К У. н. принадлежат метановые (парафиновые) и нафтеновые (полиметиленовые)… … Геологическая энциклопедия
НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ
(предельные углеводороды), орг. соед., углеродные атомы к-рых соединены между собой простыми (ординарными) связями. В статье рассмотрены алифатич. насыщ. углеводороды общей ф-лы С n Н 2n+2 (алканы, парафины, метановые углеводороды). О циклич. Н. у. см. в ст. Алщиклические соединения.
Распространение в природе. Осн. источник Н. у. в природе-нефть; фракции нефти 200-430 °С содержат 30-50% (по массе) Н. у. (из них до 60% углеводородов нормального строения); низшие газообразные Н. у. входят в состав прир. газа (до 98% метана) и растворены в нефти; твердые встречаются в виде залежей озокерита, а также образуют восковые покрытия листьев, цветов и семян растений, входят в состав пчелиного воска.
Свойства. Длины связей СЧС в Н. у.
0,109 нм, угол ССС в газообразном состоянии 109,47°, в кристаллическом-на 2-3° больше.
ФИЗИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ НАСЫЩЕННЫХ УГЛЕВОДОРОДОВ
Нагревание Н. у. без доступа воздуха выше 450 С С приводит к гомолитич. разрыву связей СЧСu образованию олефинов (термич. крекинг). Пром. значение имеет пиролиз легких нефтяных фракций в этилен. В отличие от термического каталитич. крекинг Н. у. протекает по ионному механизму и служит для получения высокооктановых бензинов из более тяжелых фракций нефти. В присут. Н 2 под давлением и катализаторов (Ni, Pt) идет гидрогенолиз (гидрокрекинг) с образованием Н. у. меньшей мол. массы. Каталитич. риформинг на Pt/Al 2 O 3 приводит к дегидроциклиза-ции Н. у. в ароматич. и циклопентановые углеводороды и сопровождается гидрокрекингом и изомеризацией. При дегидрировании Н. у. на разл. катализаторах при 500-600 °С образуются олефиновые и диеновые углеводороды, в присут. АlСl 3 или Pt/Al 2 O 3 Н. у. нормального строения изомеризуются в Н. у. с разветвленной углеродной цепью.
Нитрование Н. у. HNO 3 или N 2 O 4 в газовой фазе приводит к образованию смеси нитропроизводных и протекает по радикальному механизму с разрывом связей СЧС (р-ция Коновалова). По ионному механизму протекает нитрование устойчивыми нитрониевыми солями, напр. NOPFeT в р-рах HF или HSO 3 F. Н. у. вступают в р-ции сульфохлорирования и сульфоокисления; образующиеся соед. используют в синтезе ПАВ. Обработка Н. у. нитрозилхлоридом или смесью NO и Cl 2 приводит к нитрозоалканам-промежут. продуктам в произ-ве полиамидов. При фосфонилировании смесью РСl 3 и О 2 образуются дихлориды фосфоновых к-т, а при карбоксилировании фосгеном или оксалилхлоридом-ацил-хлориды.
Для Н. у. характерно образование клатратных соед. (см. Газовые гидраты). Н. у. нормального строения, начиная с гексана, образуют комплексы с мочевиной, что используется в пром-сти при карбамидной депарафинизации нефтепродуктов. Н. у. изостроения образуют аналогичные соед. с тиомочевиной, циклодекстрином и холевой к-той. Низшие газообразные Н. у., особенно под давлением, склонны к образованию клатратных соед. с водой (6 молекул воды), к-рые могут вымерзать на внутр. стенках газопроводов.
В лаб. условиях Н. у. получают гидрированием олефинов на катализаторах (Pt, Pd, Ni, Rh); восстановлением гало-генопроизводных Н. у. амальгамой Na, гидридами металлов, а также Н 2 на Pd/BaCO 3 ; по р-ции Вюрца [в основном симметрич. Н. у. (1)]; гидролизом реактивов Гриньяра (2); окислит. декарбоксилированием к-т (3) (полученные Н. у. содержат на 1 атом углерода меньше, чем исходная к-та). Н. у. образуются также при фотохим. декарбоксилировании первичных карбоновых к-т Рb(ОСОСН 3 ) 4 в СНСl 3 или электрохим. синтезом Кольбе (4):
Применение. Н. у. применяют гл. обр. в составе моторных и реактивных топлив, как сырье для хим. и нефтехим. пром-сти; жидкие Н. у. и хлорпроизводные метана и этана используют в качестве р-рителей, твердые (парафин, церезин)-в произ-ве пластмасс, каучуков, синтетич. волокон, моющих средств, а также в пищ. пром-сти, электро- и радиотехнике.
Лит.: Петров Ал. А., Химия алканов, М., 1974; его же, Углеводороды нефти, М., 1984; Несмеянов А. Н., Несмеянов Н. А., Начало органической химии, 2 изд., кн. 1, М., 1974; Общая органическая химия, пер. с англ., т. 1, М., 1981. А. А. Братков.
Содержание:
Насыщенные углеводороды:
Углеводородами называют органические соединения, в составе молекул которых находятся атомы углерода и водорода.
В зависимости от тина химической связи углеводороды разделяют на насыщенные, ненасыщенные и ароматические органические соединения.
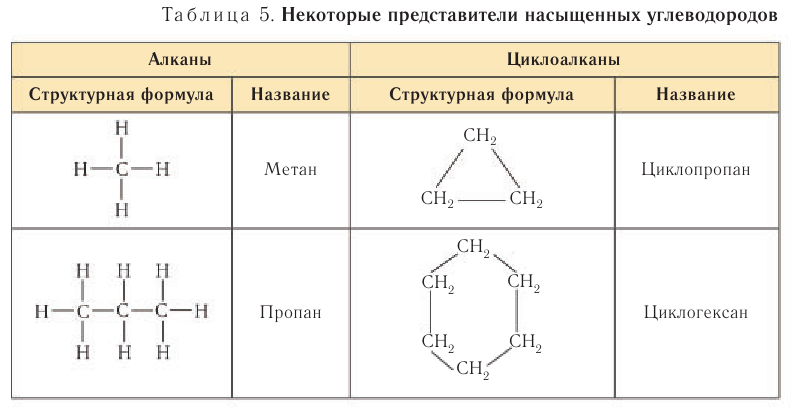
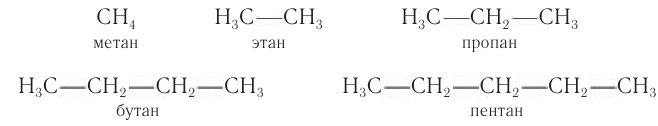
К насыщенным относят углеводороды ациклического (незамкнутые цепи атомов углерода) и циклического (замкнутые цепи) строения (табл. 5).
Алканы
Насыщенными углеводородами называют органические соединения, в составе молекул которых содержатся только одинарные С—С-связи.
Общее название углеводородов алифатического ряда по номенклатуре ИЮПАК (англ. IUPAC) — алканы.
Алканы в природе:
Высшие алканы (более шестнадцати атомов углерода) входят в состав пчелиного воска, восковых покрытий листьев (рис. 15), плодов и семян растений. В больших количествах высокомолекулярные твердые углеводороды встречаются в природе в виде озокерита (содержание его в песках и известняках от 4 до 16 %).
Строение алканов
Насыщенные углеводороды образуют ряд, в котором любой член ряда отличается от другого на одну или несколько групп атомов 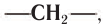
Состав соединений гомологического ряда насыщенных углеводородов можно выразить общей формулой 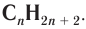
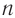
Общая формула алканов
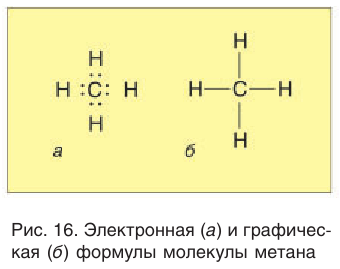
Электронное и пространственное строение насыщенных углеводородов рассмотрим вначале на примере метана. Молекулярная формула метана
Ковалентные связи между атомом углерода и атомами водорода называются 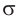
В электронной формуле метана (рис. 16, а) валентные связывающие электроны показаны в виде точек. У атома углерода на внешнем энергетическом уровне находится восемь электронов (октет), а у каждого атома водорода в молекуле метана — два электрона.
Каждая химическая связь, условно изображаемая черточкой при записи структурной формулы, символизирует пару электронов (рис. 16, б).
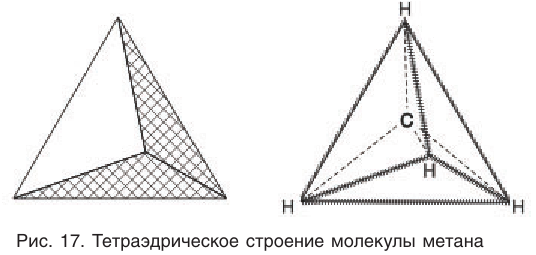
Приведенная структурная формула не отражает пространственное строение молекулы метана. Установлено, что молекула метана имеет тетраэдрическое строение. Если представить атом углерода в центре правильного тетраэдра, тогда атомы водорода будут находиться в вершинах этого тетраэдра (рис. 17). Валентные углы связей в этом случае оказываются равными 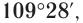
Тетраэдрическое расположение связей обусловлено минимальным взаимным отталкиванием электронных облаков связей С—Н.
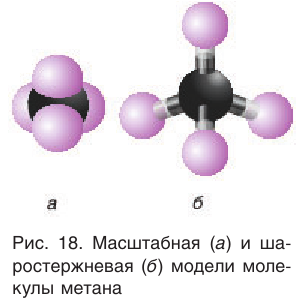
Масштабная и шаростержневая модели молекулы метана показаны на рисунке 18.
Электронное строение других насыщенных углеводородов сходно с электронным строением метана. Например, электронная и структурная формулы этана:
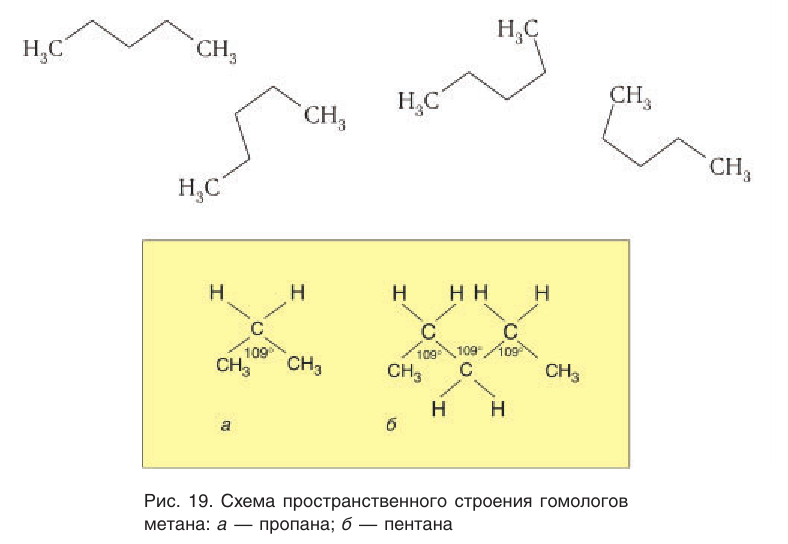
Пространственное строение гомологов метана рассмотрим на примере молекулы пропана. Тетраэдрическое расположение связей вокруг атома углерода характерно и для связей в молекуле пропана и других алканов. Так как углы между химическими связями у насыщенных углеводородов равны приблизительно 109°, то, начиная с молекулы пропана, атомы углерода расположены не по прямой линии, а зигзагообразно (рис. 19).
Особенностью одинарной связи между атомами углерода является возможность свободного вращения атомов или групп атомов вокруг этой связи. Поэтому углеродная цепь алканов может принимать различную форму (изображение в виде скелета связей):
Длина углерод-углеродной С—С-связи в молекулах алканов равна 0,154 нм.
В органической химии пространственное строение молекул органических соединений изображают иногда особым образом, что показано на примере молекул метана и этана:
При пространственном изображении связей в молекуле метана в одной плоскости располагают два атома водорода и атом углерода. Оставшиеся два атома водорода не могут находиться в этой плоскости. Темный клин 
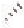
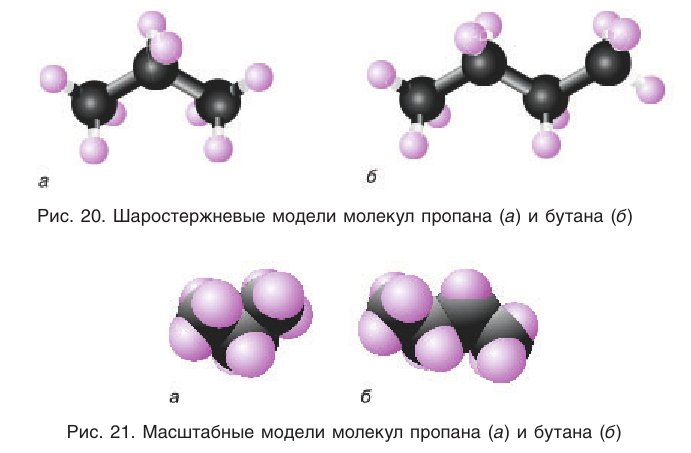
Шаростержневые и масштабные модели молекул некоторых насыщенных углеводородов показаны на рисунках 20 и 21.
Общая формула насыщенных углеводородов 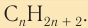
Для метана и его гомологов характерно тетраэдрическое расположение связей у атомов углерода.
Номенклатура алканов
Углеводороды могут иметь неразветвленные цепи атомов углерода:
или разветвленные цепи углеродных атомов:
Систематические названия насыщенных углеводородов с неразветвленной цепью углеродных атомов по номенклатуре ИЮНАК образуют добавлением суффикса -ан к греческим названиям чисел, указывающим число атомов углерода в составе молекул алкана (табл. 6).
Группы атомов, например 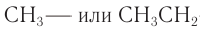
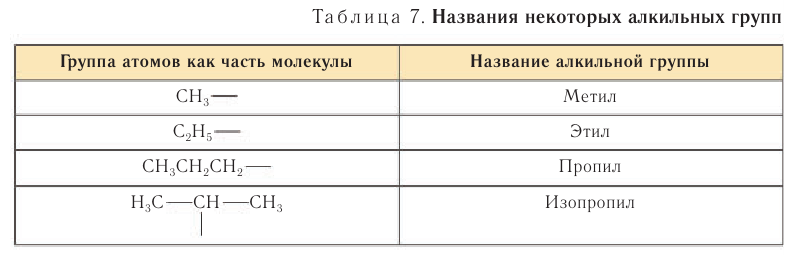
Примеры названий некоторых алкильных групп приведены в таблице 7.
Названия «пропил» 
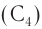
Соединения с разветвленной цепью углеродных атомов рассматривают как производные углеводорода с неразветвленной цепью. В цепи атомов углерода вместо атомов водорода могут находиться алкильные группы, атомы галогенов, нитрогруппа или другие группы. Их называют заместителями.
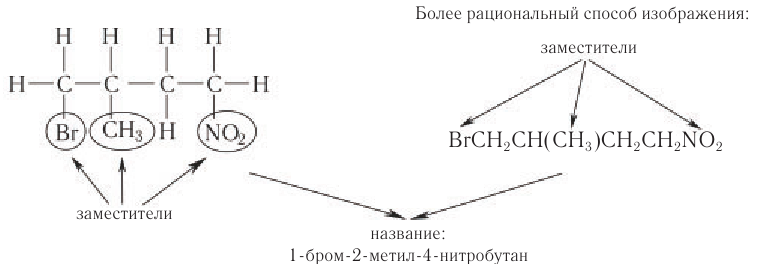
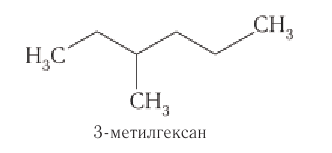
Основу названия таких соединений определяет наиболее длинная цепь атомов углерода, которую в случае одного-двух заместителей нумеруют арабскими цифрами, начиная с того конца, ближе к которому находится заместитель.
При большем числе заместителей для составления правильного названия поступают так: нумеруют самую длинную цепь справа налево и слева направо, обозначая каждый раз цифрами положение заместителей:
Заместители в названии соединений приводятся (через дефис) в алфавитном порядке по первой букве их названий (префиксы «ди», «три», «изо» и др. не учитываются).
Основу названия алканов с разветвленной цепью определяет наиболее длинная цепь атомов углерода, которую нумеруют арабскими цифрами, начиная с того конца, ближе к которому находится заместитель.
Изомерия и физические свойства алканов
Изомерия:
Для органической химии характерно многообразие соединений и разнообразие их свойств. Одной из причин этого является изомерия.
Явление существования разных соединений, имеющих один и тот же качественный и количественный состав, но различный порядок соединения атомов в молекулах (различное химическое строение), называют изомерией.
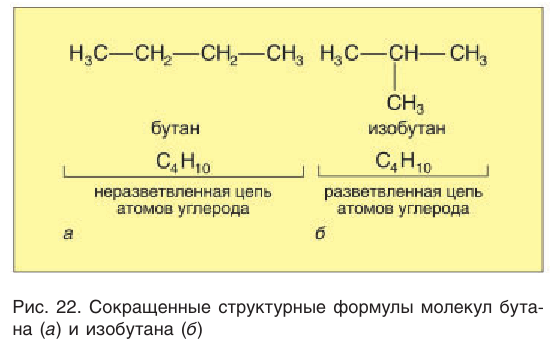
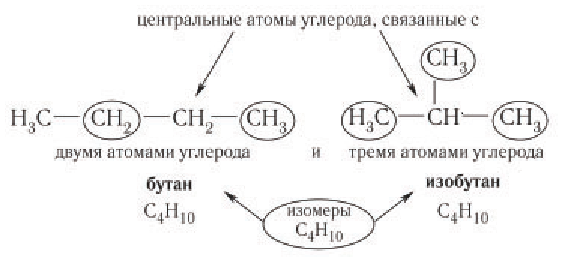
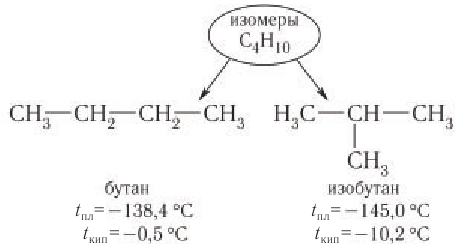
Изомерия возникает при различном порядке связывания атомов или групп атомов с образованием разветвленных углеродных цепей. Изомерия у алканов начинается с бутана (рис. 22).
Приведенные различные структурные формулы веществ, соответствующие одной и той же молекулярной формуле 
Различные структурные формулы принадлежат двум разным веществам — изомерам. Бутан и изобутан являются изомерами.
В Соединения, имеющие один и тот же молекулярный состав (одинаковую молекулярную формулу), но различный порядок соединения атомов в молекулах или различное расположение атомов в пространстве, называют изомерами.
Все существующие изомеры разделяют на структурные и пространственные (стереоизомеры).
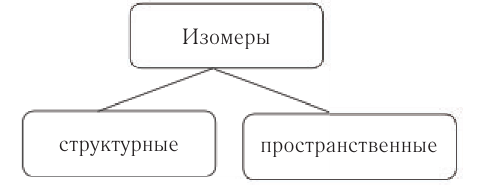
Наиболее простым типом изомерии является структурная, которая возникает в результате различного порядка соединения атомов в молекулах. Одним из видов структурной изомерии является изомерия углеродного скелета (углеродной цепи).
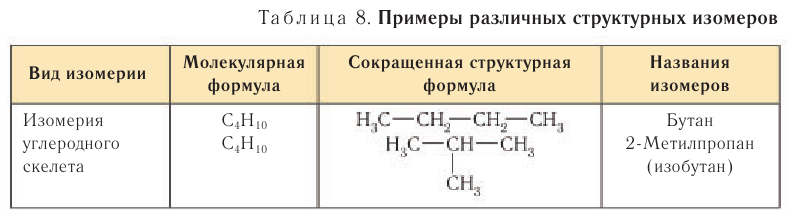
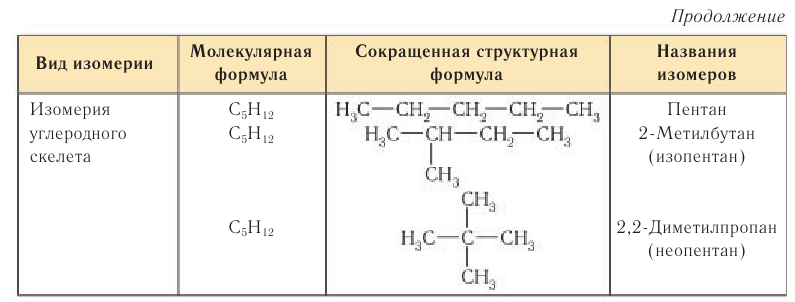
Для алканов характерна изомерия углеродного скелета. Примеры некоторых структурных изомеров приведены в таблице 8.
Изомеры являются различными веществами, несмотря на то что они имеют одинаковый качественный и количественный состав, т. е. одинаковую молекулярную формулу. Например, изомеры с молекулярной формулой
Как видно из приведенных данных, изомеры имеют различные физико-химические характеристики.
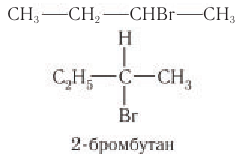
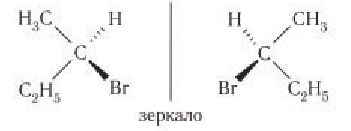
Стереоизомерией (пространственной изомерией) обладают соединения, содержащие атом (ограничимся углеродом) с четырьмя различными заместителями. Такой атом называют стереогенным центром. Соединения с одним стереогенным центром существуют в виде двух стереоизомеров, отличающихся расположением атомов или частей молекул в пространстве и относящихся друг к другу как предмет и несовместимое с ним зеркальное изображение. Изомерия такого типа характерна, например, для 2-бромбутана. Центральный атом углерода связан с четырьмя различными заместителями — водородом, бромом, метильной и этильной группами.
Чтобы убедиться в том, что стереоизомеры 2-бромбутана отличаются друг от друга, лучше всего построить модели этих структур и попытаться совместить их друг с другом. 2-Бромбутан существует в виде двух различных изомеров, поскольку построенные модели при наложении не совмещаются друг с другом.
Стереоизомеры молекулы 2-бромбутана называют энантиомерами.
Нас окружает множество вещей, имеющих такие пространственные различия: перчатки, туфли, ракушки и т.д. Простейшим примером энантиомеров являются ладони: отражение в зеркале левой ладони выглядит как правая ладонь.
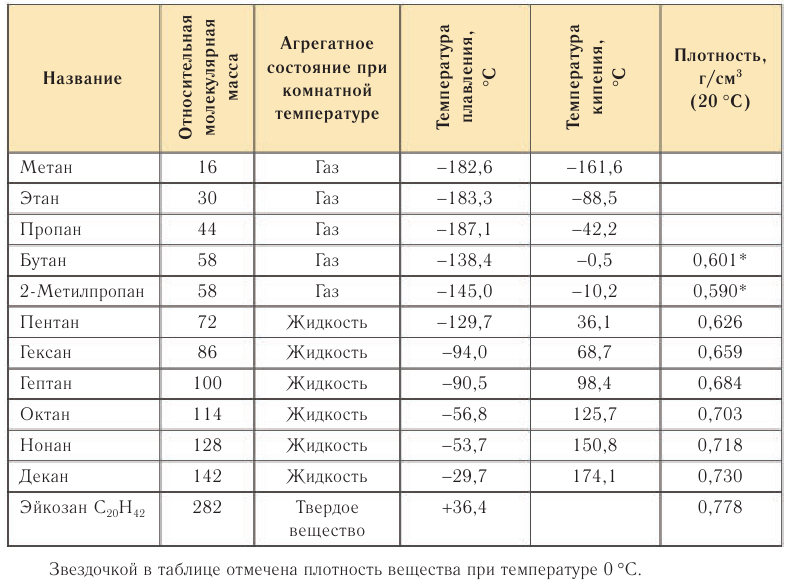
Физические свойства: Физические свойства алканов рассмотрим на примере некоторых представителей гомологического ряда (табл. 9).
Первые члены ряда алканов имеют температуры кипения ниже комнатной (20°С) и являются при этих условиях газами. Алканы 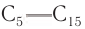
Как видно изданных, приведенных в таблице 9, с увеличением относительной молекулярной массы алканов температуры плавления и кипения их увеличиваются. Например, алкан с относительной молекулярной массой 100 кипит приблизительно при 100°С.
Насыщенные углеводороды практически не растворяются в воде. Причина этого заключается в том, что алканы являются малополярными веществами из-за небольшого различия электроотрицательности атомов углерода и водорода.
Плохая растворимость алканов в воде и их меньшая по сравнению с водой плотность имеют практическое значение. Это позволяет убирать с поверхности воды или почвы разлившуюся нефть или продукты ее переработки.
Соединения, имеющие один и тот же молекулярный состав, но различное строение, называют изомерами.
У алканов с увеличением относительной молекулярной массы температуры плавления и кипения увеличиваются.
Химические свойства алканов. Получение и применение
Алканы при обычной температуре малоактивны по отношению к различным химическим веществам и не вступают в реакции даже с сильными окислителями. Но этой причине их называют еще парафинами (parum affinis — мало сродства).
Однако при облучении светом или при высоких температурах алканы могут вступать в различные реакции, например окисления и замещения.
Реакции окисления
При обычных условиях алканы практически не реагируют с кислородом. Однако реакция происходит при нагревании и в присутствии катализаторов. Продуктами окисления являются смеси кислородсодержащих органических соединений.
1) Полное окисление (горение)
При нагревании до высокой температуры алканы легко горят на воздухе с образованием углекислого газа и воды и с выделением теплоты. Например, горение метана:
Природный газ, состоящий в основном из метана, по этой причине используется в качестве топлива в домах, на электростанциях, горючего для машин и является основой энергетики во многих странах.
Смеси метана с кислородом (1 : 2 по объему) или воздухом (1 : 10) чрезвычайно опасны и приводят к взрывам в помещениях при утечке природного газа.
Метан не имеет запаха, поэтому для обнаружения утечки природного газа к нему добавляют вещества с неприятным запахом (например, этилмеркаптан 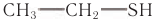
Полное окисление других алканов (бензин и дизельное топливо) в смесях с воздухом используется в бензиновых и дизельных двигателях. Например:
2) Частичное окисление
При недостатке кислорода горение алканов приводит к образованию чрезвычайно токсичного оксида углерода(II). Например, горение метана:
Частичное окисление бутана кислородом в присутствии катализаторов дает уксусную кислоту:
Реакции замещения (галогенирование)
Наиболее энергично и с выделением большого количества теплоты реагирует с алканами фтор, что приводит к разрыву не только 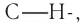

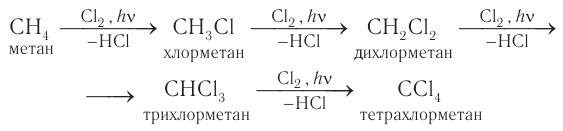
Однако при освещении или сильном нагревании легко проходит реакция замещения атома водорода, например в молекуле метана, на атом хлора с образованием хлорметана:
Процесс превращения связи 

В процессе галогенирования метана, особенно при избытке галогена, происходит последовательное замещение всех атомов водорода и образуется смесь продуктов:
Взаимодействие других алканов с галогенами в большинстве случаев приводит к образованию смеси изомеров. Например:
В органической химии для описания реакций применяют структурные или сокращенные структурные формулы.
Термические превращения алканов
При повышенных температурах (> 600 °С) и без катализатора алканы образуют главным образом алкены и смеси других продуктов. Например, из этана получается этилен и молекулярный водород:
Реакции такого типа называют реакциями дегидрирования.
В молекулах других алканов может происходить разрыв С—С-связей, что приводит к образованию смеси алкенов и алканов. Например, при разложении бутана получается смесь этилена, пропена, бутена-1, бутена-2, а также метана, этана и водорода.
Упрощенная схема расщепления С—С-связей в молекуле бутана и некоторые продукты реакции: 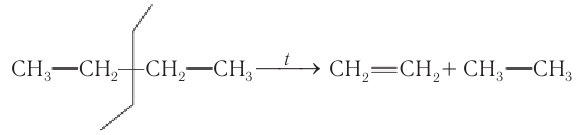
Нагревание алканов в присутствии некоторых катализаторов сопровождается изменением химического строения молекул. Например, при нагревании в присутствии хлорида алюминия происходит изомеризация бутана с образованием изобутана:
Разложение и изомеризация высших алканов при крекинге нефти является современным методом получения высокооктанового бензина.
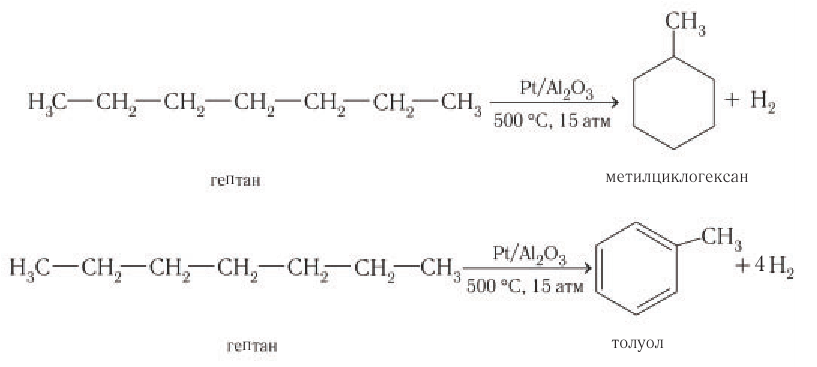
Изменение структуры молекул происходит также при нагревании других алканов, например гептана в присутствии платинового катализатора. В этом случае образуются циклические углеводороды — метилциклогексан или толуол:
Получение и применение алканов:
Разновидностями биомассы являются древесина и органические отходы животных и растений. При получении метана биомассу подвергают ферментации без доступа кислорода. В этих условиях определенные разновидности бактерий разлагают отходы с образованием метана.
В лаборатории алканы можно получить разными способами.
1) Из солей карбоновых кислот. Низкокипящие алканы получают нагреванием солей карбоновых кислот с твердыми щелочами:
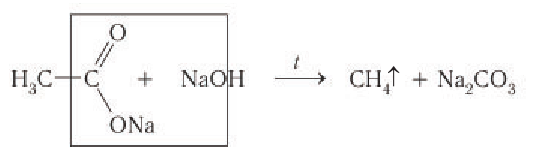
2) Гидрированием ненасыщенных соединений с кратными связями. Алканы любого строения можно получить гидрированием ненасыщенных соединений, содержащих двойные или тройные связи:
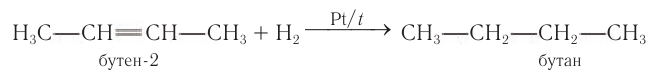
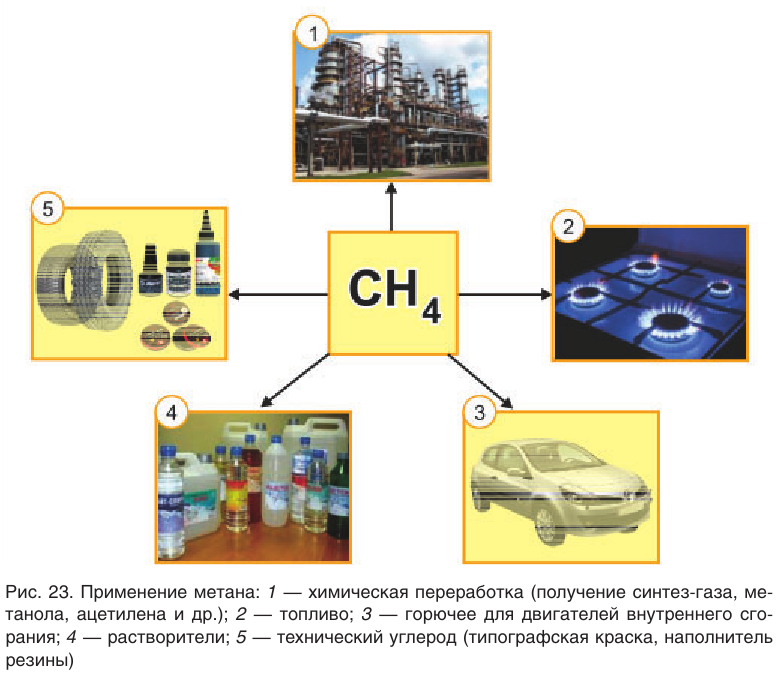
Использование метана в промышленности показано на рисунке 23. Хотя природный газ в настоящее время является основой энергетической промышленности многих стран, химическая переработка его экономически более выгодна и целесообразна. Например, переработка природного газа в смесь оксида углерода(II)и водорода:
Ценное химическое сырье — смесь оксида углерода(II) химическим количеством 1 моль и водорода химическим количеством 2 моль (синтез-газ) — используют для получения метанола и других органических веществ, а водород — для получения аммиака:
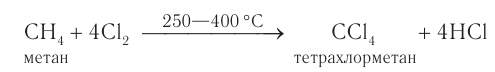
Образующиеся при галогенировании метана трихлорметан и тетрахлорметан применяют в качестве растворителей. Около 15 % производимого в промышленности тетрахлорметана получают полным хлорированием метана:
Реакция разложения метана без доступа воздуха применяется на производстве для получения технического углерода — пигмента для изготовления типографской краски и наполнителя резины для автомобильных шин.
Бутан используют в промышленности для получения бутадиена-1,3, необходимого в производстве синтетических каучуков.
При облучении светом или при высоких температурах алканы вступают в реакции окисления и замещения.
В лаборатории алканы можно получить гидрированием соединений с кратными связями, а также нагреванием солей карбоновых кислот со щелочами.
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.