Что значит насыщенный раствор в химии
Насыщенный раствор
Насыщенный раствор — раствор, в котором растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется. Осадок данного вещества находится в равновесном состоянии с веществом в растворе.
См. также
Смотреть что такое «Насыщенный раствор» в других словарях:
НАСЫЩЕННЫЙ РАСТВОР — раствор, находящийся в равновесии с растворяемой фазой при данных условиях (темп ре, давлении). Концентрация растворённого в H. р. вещества наз. растворимостью последнего в данном растворителе при данных темп ре и давлении. Если концентрация… … Физическая энциклопедия
НАСЫЩЕННЫЙ РАСТВОР — раствор, находящийся в равновесии с избытком растворенного вещества. Пример: раствор соли в воде, в котором присутствуют кристаллы той же соли. Концентрация вещества в насыщенном растворе называется растворимостью этого вещества при данных… … Большой Энциклопедический словарь
НАСЫЩЕННЫЙ РАСТВОР — НАСЫЩЕННЫЙ РАСТВОР, в химии, РАСТВОР, содержащий такое количество растворенного соединения, что большее количество при данной температуре и данном давлении растворятся не будет, кроме как в случае ПЕРЕНАСЫЩЕНИЯ … Научно-технический энциклопедический словарь
насыщенный раствор — – раствор, концентрация которого не увеличивается при добавлении новых порций растворяемого вещества. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
НАСЫЩЕННЫЙ РАСТВОР — раствор, в котором растворяемое вещество при данных температуре и давлении не может более растворяться. Концентрация Н. р. растворимость выражается в г на 100 г (или в кг на 100 кг) растворителя, в г на 100 г раствора (т. е. в % по массе) и др.… … Большая политехническая энциклопедия
насыщенный раствор — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN pregnant solutionsaturated solution … Справочник технического переводчика
насыщенный раствор — раствор, находящийся в равновесии с избытком растворённого вещества. Пример: раствор соли в воде, в котором присутствуют кристаллы той же соли. Концентрация вещества в насыщенном растворе называется растворимостью этого вещества при данных… … Энциклопедический словарь
насыщенный раствор — sotusis tirpalas statusas T sritis Standartizacija ir metrologija apibrėžtis Tirpalas, esantis termodinaminėje pusiausvyroje su tirpiniu. atitikmenys: angl. saturated solution vok. gesättigte Lösung, f rus. насыщенный раствор, m pranc. solution… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
насыщенный раствор — sotusis tirpalas statusas T sritis chemija apibrėžtis Tirpalas, esantis termodinaminėje pusiausvyroje su tirpiniu. atitikmenys: angl. saturated solution rus. насыщенный раствор … Chemijos terminų aiškinamasis žodynas
насыщенный раствор — sotusis tirpalas statusas T sritis fizika atitikmenys: angl. saturated solution vok. gesättigte Lösung, f rus. насыщенный раствор, m pranc. solution saturée, f … Fizikos terminų žodynas
Насыщенный и концентрированный растворы: характеристика, описание
Содержание:
Растворы в химии – это однородные системы, состоящие из двух и более компонентов, состав которых может меняться в широких пределах. Частицы растворов невозможно увидеть даже с помощью микроскопа. Растворы могут быть концентрированными или разбавленными, насыщенными или ненасыщенными.
Что называют раствором в химии
Свойства раствора могут не повторять свойства чистого вещества. Например, сладкая вода – это результат растворения пищевого сахара С12Н22О11 в воде Н2О. Сладкая вода по многим параметрам отличается от чистой воды и сахара.
Вода
Пищевой сахар
Сладкая вода
Классификация растворов
Насыщенные и ненасыщенные растворы
Растворимость, или коэффициент растворимости – это максимально возможное число граммов вещества, которое может раствориться в 100 г растворителя при данной температуре. Например, в справочнике указано, что в 100 г растворителя растворяется 3 г вещества. Для приготовления насыщенного раствора соли в 100 г растворителя необходимо растворить 2 г вещества, а если растворить 3 г вещества, то образуется насыщенная однородная смесь.
Растворимость у всех веществ различна. Растворяемое вещество можно классифицировать на несколько групп в зависимости от растворимости:
Что такое концентрированный и разбавленный раствор
Концентрированные растворы – это однородные смеси, в которых содержание растворенного вещества и растворителя сравнимы. Разбавленные растворы – это однородные смеси, в которых содержание растворенного вещества ниже, чем содержание растворителя. Из малорастворимых и нерастворимых веществ невозможно приготовить концентрированные растворы.
Количественные характеристики
В первом случае массовую долю выражают в процентах %, а во втором единицы измерения не указываются. Также растворы можно выразить с помощью молярной концентрации (молярности):
Приготовление
Чтобы приготовить разбавленный раствор, необходимо добавить отмеренный объем растворителя в концентрированный.
Для приготовления насыщенного раствора, например, хлорида натрия нужно взвесить максимальную массу вещества, которая растворяется в 100 г воды без осадка. Затем вещество растворить в 100 мл воды. Для приготовления ненасыщенного раствора нужно взвесить меньшую массу вещества.
Задачи на растворы
Задача №1. Смешали 5 г хлорида натрия NaCl в 55 г дистиллированной воды Н2О. Найдите массовую долю растворенного вещества.
Дано:
Решение:
mр-ра= m(NaCl) + m(H2O)=5 г + 55 г = 60 г
w(NaCl) = (5 г/60 г) * 100% = 8,33 %
Ответ: w(NaCl) = 8,33 %
Задача №2. Сколько необходимо взять безводного хлорида калия KCl и воды Н2О для приготовления раствора массой 100 г и массовой долей хлорида калия KCl 13 %?
Дано:
Решение:
Ответ: m(Н2О) = 87 г, m(KCl) = 13 г
Найти:
Задача №3. В воде Н2О растворили 8 г хлорида натрия NaCl. Объем раствора довели до 90 мл. Определите молярную концентрацию полученного раствора.
Дано:
Vр-ра = 90 мл = 0,09 л
Решение:
M(NaCl) = 23 + 35,5 = 58,5 г/моль
n(NaCl) = 8 г/58,5 г/моль = 0,137 моль
с(NaCl) = 0,137 моль/0,09 л = 1,52 моль/л
Ответ: с(NaCl ) = 1,52 моль/л
Найти:
Задача №4. Какая масса карбоната кальция CaCO3 необходима для получения раствора этой соли, объем которого равен 150 мл, а концентрация 1,5 моль/л.
Дано:
Vр-ра = 150 мл = 0,15 л
Решение:
Ответ: m(CaCO3)=22,5 г
Ненасыщенные, насыщенные и пересыщенные растворы.
При растворении твердого или газообразного вещества в растворителе при постоянном давлении и температуре (р = const, Т = const) концентрация раствора не стремится к бесконечности.
Ненасыщенный раствор – это раствор, в котором при данной температуре вещество ещё может растворяться.
В некоторый момент растворяемое вещество перестает растворяться, т.к. достигнута определенная его концентрация, которая уже более не меняется и остается величиной постоянной, т.е. раствор достиг фазового равновесия:
растворяемое вещество 
Насыщенный раствор – раствор, в котором растворяемое вещество при данной температуре больше не растворяется, т.е. раствор, находится в равновесии с растворяемым веществом.
При изменении температуры или давления можно продлить процесс растворения. При этом получим раствор, содержащий растворенного вещества больше, чем его должно быть в обычных условиях в насыщенном растворе. Такой раствор называется пересыщенным. Пересыщенные растворы – это неустойчивые, неравновесные системы, которые, например, при лёгком сотрясении сосуда или введении в раствор кристаллов вещества, находящегося в растворе, переходят в равновесное состояние, выделяя избыток растворенного вещества, и раствор становится насыщенным.
Насыщенные растворы в зависимости от значения растворимости веществ разделяются на:
Что такое насыщенный раствор? (с примерами)
насыщенный раствор Это химический раствор, содержащий максимальную концентрацию растворенного вещества, растворенного в растворителе. Это считается состоянием динамического равновесия, где скоростью в растворителе растворяется растворенное вещество и перекристаллизация скорость равна (J., 2014).
Дополнительное растворенное вещество не растворяется в насыщенном растворе и появляется в виде отдельной фазы, либо осадок, если твердое вещества в жидкости или вскипании, если газ в жидкости (Анны-Мари Helmenstine, 2016).
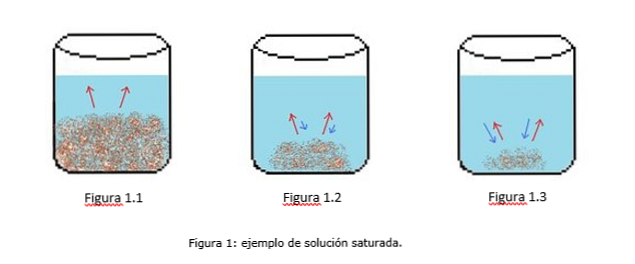
Пример насыщенного раствора показан на рисунке 1. На рисунках 1.1, 1.2 и 1.3 в химическом стакане есть постоянный объем воды. На рисунке 1.1 начинается процесс насыщения, где растворенное вещество начинает растворяться, представленное красными стрелками.
На рисунке 1.2 большая часть твердого вещества растворилась, но не полностью из-за процесса перекристаллизации, обозначенного синими стрелками.
На рисунке 1.3 только небольшое количество растворенного вещества остается нерастворенным. В этом случае скорость рекристаллизации больше, чем скорость растворения. (Типы насыщения, 2014)
Точка максимальной концентрации растворенного вещества в растворителе называется точкой насыщения..
Факторы, влияющие на насыщенность
Количество растворенного вещества, которое можно растворить в растворителе, будет зависеть от различных факторов, среди которых наиболее важными являются:
температура
Растворимость увеличивается с температурой. Например, вы можете растворить больше соли в горячей воде, чем в холодной воде.
Однако могут быть исключения, например, растворимость газов в воде уменьшается с повышением температуры. В этом случае молекулы растворенного вещества при нагревании получают кинетическую энергию, что облегчает их выход.
давление
Увеличение давления может вызвать растворение растворенного вещества. Это обычно используется для растворения газов в жидкостях.
Химический состав
Природа растворенного вещества и растворителя, а также наличие других химических соединений в растворе влияют на растворимость. Например, вы можете растворить большее количество сахара в воде, чем соль в воде. В этом случае говорят, что сахар более растворим.
Этанол в воде полностью растворим друг с другом. В этом конкретном случае растворителем будет соединение, которое находится в большем количестве.
Механические факторы
В отличие от скорости растворения, которая зависит главным образом от температуры, скорость рекристаллизации зависит от концентрации растворенного вещества на поверхности кристаллической решетки, которая благоприятна, когда раствор неподвижен.
поэтому, перемешивание раствора избежать этого накопления, максимизируя растворение (типы насыщения, 2014).
Кривые насыщенности и растворимости
Кривые растворимости представляют собой графическую базу данных, в которой сравнивается количество растворенного вещества, которое растворяется в некотором количестве растворителя, при определенной температуре..
Кривые растворимости обычно строятся для количества растворенного вещества, твердого или газообразного, в 100 граммах воды (Brian, 2014).
Рисунок 2 иллюстрирует кривые насыщения для нескольких растворенных веществ в воде.
В оси ординат она имеет температуру в градусах Цельсия, а по оси абсцисс является концентрация растворенного вещества выражается в граммах растворенного вещества на 100 г воды.
Кривая указывает точку насыщения при определенной температуре. Область под кривой показывает, что у вас есть ненасыщенный раствор, и поэтому вы можете добавить больше растворенного вещества.
Область над кривой имеет перенасыщенный раствор. (Кривые растворимости, с.ф.)
Принимая в качестве примера хлорид натрия (NaCl), при 25 градусах по Цельсию может растворить около 35 г NaCl в 100 г воды, чтобы получить насыщенный раствор. (Cambrige университет, С. Ф.)
Примеры насыщенных растворов
Насыщенные растворы могут быть найдены на ежедневной основе, нет необходимости находиться в химической лаборатории. Растворитель не обязательно должен быть водой. Ниже приведены повседневные примеры насыщенных решений:
-Сода и безалкогольные напитки в целом представляют собой растворы, насыщенные углекислым газом в воде. Вот почему, когда давление сбрасывается, образуются пузырьки углекислого газа..
-Земляные почвы насыщены азотом.
-Вы можете добавить сахар или соль к уксусу, чтобы сформировать насыщенный раствор.
-Добавить шоколадный порошок в молоко до тех пор, пока оно не растворится, образовать насыщенный раствор.
-Молоко может быть насыщено мукой до такой степени, что в молоко больше нельзя добавлять муку.
-Растопленное масло может быть насыщено солью, когда соль больше не растворяется.
Что такое перенасыщенный раствор??
Небольшое изменение раствора или введение «затравочного» или крошечного кристалла растворенного вещества вызовет кристаллизацию избытка растворенного вещества. Если нет точки зарождения для образования кристаллов, избыток растворенного вещества может оставаться в растворе.
Другая форма пересыщения может возникнуть, когда насыщенный раствор тщательно охлаждают. Это изменение условий означает, что концентрация на самом деле превышает точку насыщения, раствор был перенасыщен.
Это может быть использовано в процессе перекристаллизации для очистки химического вещества: растворяют до точки насыщения в горячем растворителе, то в качестве растворителя остывает и уменьшается растворимость, избыток растворенного вещества выпадает в осадок.
Примеси, которые присутствуют в гораздо более низкой концентрации, не насыщают растворитель и, таким образом, остаются растворенными в жидкости.
Растворы
Растворы – это однородные гомогенные системы, состоящие из частиц растворенного вещества, растворителя и продуктов их взаимодействия. Растворенное вещество равномерно распределено в растворителе. Раствор может состоять из двух и более компонентов.
Растворы бывают жидкие, твердые и газообразные.
Растворитель – это то вещество, которое не изменяет агрегатное состояние при растворении. В случае смешения веществ с одинаковым агрегатным состоянием (жидкость-жидкость, газ-газ, твердое-твердое) растворителем считается тот компонент, содержание которого больше.
Образование раствора зависит от характера взаимодействия частиц растворителя и растворенного вещества, и их природы.
В школьном курсе рассматриваются преимущественно растворы электролитов. В курсе ВУЗов рассматриваются также истинные и коллоидные растворы, золи и другие системы.
По способности растворяться вещества условно делят на:
Обратите внимание!
При попадании в воду вещество может:
Коэффициент растворимости – отношение массы растворенного вещества к массе растворителя (например, 10 г соли на 100 г воды).
По концентрации растворенного вещества растворы делят на:
Ненасыщенные растворы – это растворы, в которых концентрация растворенного вещества меньше, чем в соответствующем насыщенном растворе, и в котором при данных условиях можно растворить еще некоторое количества растворенного вещества.
Пересыщенный раствор – это раствор, в котором концентрация растворенного вещества больше, чем в насыщенном. Избыток растворенного вещества легко выпадает в осадок. Приготовить пересыщенный раствор можно, например, с помощью охлаждения насыщенного раствора поваренной соли. При понижении температуры растворимость поваренной соли уменьшается, и раствор становится пересыщенным.
По концентрации растворенного вещества растворы также разделяют на концентрированные и разбавленные:
Концентрированные растворы – это растворы с относительно высоким содержанием растворенного вещества.
Разбавленные растворы – это растворы с относительно низким содержанием растворенного вещества.
Это деление очень условно, и не связано с делением раствора по насыщенности. Разбавленный раствор может быть насыщенным, а концентрированный раствор не всегда может оказаться насыщенным.
Физические величины, характеризующие состав раствора – это массовая доля, массовый процент, молярность (молярная концентрация), мольная доля, мольный процент, мольное соотношение, растворимость (для насыщенных растворов), объемная доля, объемный процент и некоторые другие величины, которые проходятся в курсе ВУЗов (нормальность или нормальная концентрация, моляльность, титр).
Остановимся подробнее на каждой из них:
1. Массовая доля, масс. доли — это отношение массы растворенного вещества mр.в. к массе раствора mр-ра, выраженное в долях от единицы. Долю можно также выразить в процентах, умножив на 100, тогда мы получим массовый процент, масс. %.
Задачи на материальный баланс с использованием массовой доли — обязательный компонент экзаменов по химии (и не только!) разных уровней. Научиться решать задачи на массовую долю и материальный баланс (смешение, разбавление, концентрирование и приготовление растворов) можно здесь!
2. Молярная концентрация (молярность), моль/л, М – это отношение количества растворенного вещества ν, моль к объему всего раствора Vр-ра, л. Концентрация 1 моль растворенного вещества на 1 литр раствора также обозначается так: 1 М. Такой раствор называют «одномолярный». Двухмолярный раствор — 2 М соответствует концентрации 2 моль растворенного вещества на 1 литр раствора и т.д.
Задачи на молярную концентрацию, как правило, встречаются в курсе ВУЗов, в химических олимпиадах и вступительных экзаменах в ВУЗы. Научиться решать задачи на молярную концентрацию можно здесь.
3. Мольная доля, мольн. дол. – это отношение количества растворенного вещества νр.в., моль к общему количеству вещества всех компонентов в растворе νр-ра, моль:
Мольная доля также может быть выражена в мольных процентах (% мольн.), если умножить долю на 100%. Задачи на мольную долю встречаются в курсе ВУЗов, олимпиадах и вступительных экзаменах. Научиться решать задачи на мольную долю можно здесь.
4. Объемная доля, объемн. дол. – это отношение объема растворенного вещества Vр.в., л к общему объему раствора или смеси Vр-ра, л:
Объемная доля также может быть выражена в объемных процентах (% объемн.), если умножить долю на 100%. Задачи на объемную долю, как правило, сводятся к решению задач на мольную долю, т.к. для газовых смесей объемные и мольные доли компонентов в смеси равны.
5. Мольное соотношение – это отношение количества растворенного вещества к количеству вещества растворителя. Также может использоваться массовое соотношение и объемное соотношение.
6. Растворимость – это отношение массы растворенного вещества к массе растворителя (применяется, как правило, для насыщенных растворов).
7. Титр, г/мл – это отношение массы растворенного вещества mр.в., г к объему раствора, выраженному в миллилитрах Vр-ра, мл:
8. Моляльность.
9. Нормальная концентрация (нормальность)
По механизму растворения растворы делят на физические и химические.
Физическое растворение — это растворение, при котором происходит разрыв и образование только межмолекулярных связей (включая водородные). Физически растворяются только некоторые вещества с молекулярной кристаллической решеткой. Например, растворение нафталина в спирте и воде — опыт.
Химическое растворение — это растворение, при котором разрушаются химические связи в веществе. Химическое растворение, как правило, сопровождается электролитической диссоциацией растворяемого вещества. Подробнее про электролитическую диссоциацию и химическое растворение здесь.
Важно! Подобное хорошо растворяется в подобном. Неполярные растворители хорошо растворяют неполярные вещества. Полярные растворители хорошо растворяют полярные вещества. Понимание механизмов растворения, природы растворяемого вещества и растворителя позволяет легко определить растворимость одного вещества в другом.