Что значит мягкий металл
Самый мягкий металл
О том, какой металл самый мягкий, можно рассуждать довольно долго, если учитывать различные параметры. К примеру, многим известно, что золото в чистом виде является очень мягким металлом. Его очень просто поцарапать ногтем или сделать из нескольких грамм данного металла тончайшую проволоку.
Благодаря необычайной мягкости золота можно изготавливать из него любой формы драгоценные изделия, чем и пользуются ювелиры. Однако золото – это не самый мягкий металл. Зато таким с уверенностью можно назвать галлий.
Галлий: характеристики
Данный элемент представляет собой довольно пластичный металл, который отличается серебристым цветом и имеет синеватый оттенок. Расположен самый мягкий металл в мире в таблице Менделеева под номером 31. В природе этот металл не встречается в чистом виде, а извлекают его из цинковой руды или бокситов, которые содержат галлий в огромных количествах.
Однако вряд ли можно считать галлий самым мягким, если он оказывается под воздействием низких температурных режимов. В этом случае он является очень даже твердым. Но стоит лишь температуре воздуха подняться до отметки в плюс 29,8 градусов, как галлий начинает плавиться. Чтобы расплавить такой металл, можно лишь положить его в руку.
А уж если ложка, изготовленная из галлия, окажется в горячем чае, то процесс плавления пойдет еще быстрее. При температуре плюс 500 градусов данный металл и вовсе становится настолько «агрессивным», что способен разъедать множество металлов (исключением будет вольфрам). Например, если разогретая до такой температуры капля галлия окажется на банке из алюминия, то примерно через тридцать минут структура банки слабеет, и она раскрошится, словно тонкий лед от механического воздействия.
Есть возможность даже наблюдать, как галлий напоминает сердце, которое бьется, – выполняется эксперимент, когда представитель наиболее мягких элементов начинает совершать активные движения и даже напоминает при этом совершенно неизведанную форму жизни. А происходит это так – расплавленный галлий в виде одной капли соприкасается с кончиком гвоздя. При этом капля сначала продолжает плавиться, а затем, когда контакт заканчивается, снова собирается. В результате получается довольно эффектное зрелище, за которым хочется наблюдать и наблюдать.
Назначение мягкого металла
Особой роли с биологической точки зрения у данного металла не имеется. Но с того самого момента, когда он впервые был обнаружен (в 1875г.), галлий используется в микроэлектронике. Широко его используют также в фармацевтическом производстве. В наше время для создания микроволновых схем и инфракрасных приложений используют арсенид галлия.
Кроме того, что данный металл признан наиболее мягким, он является еще и дорогостоящим. К примеру, в 2005 году за 1000 килограммов данного металла покупателям приходилось выкладывать чуть больше одного миллиона долларов.
Другие мягкие металлы
Возможно, что некоторым приходит на ум противопоставить галлию ртуть, ведь она изначально является жидким металлом, а значит, тоже имеет право называться самой мягкой. Однако есть и еще несколько элементов из таблицы Менделеева, которые тоже могут считаться одними из самых мягких. Этот цезий, калий и рубидий.
Наиболее мягким элементом при комнатной температуре считается цезий. Он является щелочным металлом, имеющим серебристо-желтый цвет. В переводе с латинского «цезий» означает «небесно-голубой». А все потому, что цезий имеет две ярко-синие линии в эмиссионном спектре.
Встречающийся лишь в соединениях с другими элементами калий является щелочным металлом, обладающим серебристо-белым цветом. Он способен мгновенно окисляться на воздухе и оперативно вступать с водой в химическую реакцию, при которой получается щелочь.
И еще одним из наиболее мягких можно назвать рубидий, который тоже является щелочным металлом. Данный элемент представляет собой простой металл, обладающий серебристо-белым цветом.
14 различных типов металлов
Термин «металл» происходит от греческого слова «metalléuō», что означает выкапываю или добываю из земли. Наша планета содержит много металла. На самом деле из 118 элементов периодической системы порядка 95 являются металлами.
Это число не является точным, потому что граница между металлами и неметаллами довольно расплывчата: нет стандартного определения металлоида, как нет и полного согласия относительно элементов, соответствующим образом классифицированных как таковые.
Сегодня мы используем различные виды металлов, даже не замечая их. Начиная с зажимов в сантехнике и заканчивая устройством, которое вы используете для чтения этой статьи, все они сделаны из определенных металлов. Фактически, некоторые металлические элементы необходимы для биологических функций, таких как приток кислорода и передача нервных импульсов. Некоторые из них также широко используются в медицине в виде антацидов.
Все металлы в периодической таблице можно классифицировать по их химическим или физическим свойствам. Ниже мы перечислили некоторые различные типы металлов вместе с их реальным применением.
Классификация по физическим свойствам
14. Легкие металлы
Сплав титана 6AL-4V
Примеры: Алюминий, титан, магний
Легкие металлы имеют относительно низкую плотность. Формального определения или критериев для идентификации этих металлов нет, но твердые элементы с плотностью ниже 5 г/см³ обычно считаются легкими металлами.
Металлургия легких металлов была впервые развита в середине 19 века. Хотя большинство из них происходит естественным путем, значительная их часть образуется при электротермии и электролизе плавленых солей.
Их сплавы широко используются в авиационной промышленности благодаря их низкой плотности и достаточным механическим свойствам. Например, сплав титана 6AL-4V составляет почти 50 процентов всех сплавов, используемых в авиастроении. Он используется для изготовления роторов, лопастей компрессоров, мотогондол, компонентов гидравлических систем.
13. Тяжелые металлы
Окисленные свинцовые конкреции и кубик размером 1 см3
Примеры: железо, медь, кобальт, галлий, олово, золото, платина.
Эти металлы редки в земной коре, но они присутствуют в различных аспектах современной жизни. Они используются в солнечных батареях, сотовых телефонах, транспортных средствах, антисептиках и ускорителях частиц.
Тяжелые металлы часто смешиваются в окружающей среде из-за промышленной деятельности, ухудшая качество почвы, воды и воздуха, а затем вызывая проблемы со здоровьем у животных и растений. Выбросы транспортных средств, горнодобывающие и промышленные отходы, удобрения, свинцово-кислотные батареи и микропластики, плавающие в океанах, являются одними из наиболее распространенных источников тяжелых металлов в этом контексте.
12. Белый металл
Подшипники из белого металла
Примеры: Обычно изготавливается из олова, свинца, висмута, сурьмы, кадмия, цинка.
Белый металлический сплав изготавливается путем объединения определенных металлов в фиксированных пропорциях в соответствии с требованиями конечного продукта. Основной металл для ювелирных изделий, например, формуется, охлаждается, экстрагируется, а затем полируется, чтобы придать ему точную форму и блестящий вид.
Они также используются для изготовления тяжелых подшипников общего назначения, подшипников внутреннего сгорания среднего размера и электрических машин.
11. Хрупкий металл
Хрупкое разрушение чугуна
Примеры: сплавы углеродистой стали, чугуна и инструментальной стали.
Металл считается хрупким, если он твердый, но не может противостоять ударам или вибрации под нагрузкой. Такие металлы под воздействием напряжения ломаются без заметной пластической деформации. Они имеют низкую прочность на разрыв и часто издают щелкающий звук при поломке.
Многие стальные сплавы становятся хрупкими при низких температурах, в зависимости от их обработки и состава. Чугун, например, твердый, но хрупкий из-за высокого содержания углерода. Напротив, керамика и стекло гораздо более хрупки, чем металлы, из-за их ионных связей.
Галлий, висмут, хром, марганец и бериллий также хрупки. Они часто используются в различных гражданских и военных целях, связанных с высокими деформационными нагрузками. Чугун, устойчивый к повреждениям в результате окисления, используется в машинах, трубах и деталях автомобильной промышленности, таких как корпуса коробок передач и головки цилиндров.
10. Тугоплавкий металл
Микроскопическое изображение вольфрамовой нити в лампе накаливания
Примеры: молибден, вольфрам, тантал, рений, ниобий.
Тугоплавкие металлы имеют чрезвычайно высокие температуры плавления (более 2000 °С) и устойчивы к износу, деформации и коррозии. Они являются хорошими проводниками тепла и электричества и имеют высокую плотность.
Другой ключевой характеристикой является их термостойкость: они не расширяются и не растрескиваются при многократном нагревании и охлаждении. Однако они могут деформироваться при высоких нагрузках и окисляться при высоких температурах.
Благодаря своей прочности и твердости они идеально подходят для сверления и резки. Карбиды и сплавы тугоплавких металлов используются почти во всех отраслях промышленности, включая горнодобывающую, автомобильную, аэрокосмическую, химическую и ядерную.
Металлический вольфрам, например, используется в ламповых нитях. Сплавы рения используются в гироскопах и ядерных реакторах. А ниобиевые сплавы используются для форсунок жидкостных ракетных двигателей.
9. Черные и цветные металлы
Валы-шестерни из (черной) нержавеющей стали
Черные металлы: Сталь, чугун, сплавы железа.
Цветные металлы: Медь, алюминий, свинец, цинк, серебро, золото.
Термин «железо» происходит от латинского слова «Ferrum», что переводится как «железо». Таким образом, термин «черный металл» обычно означает «содержащий железо», тогда как «цветной металл» означает металлы и сплавы, которые не содержат достаточного количества железа.
Поскольку черные металлы могут иметь широкий спектр легирующих элементов, которые значительно изменяют их характеристики, очень трудно поместить свойства всех черных металлов под один зонт. Тем не менее некоторые обобщения могут быть сделаны, например, большинство черных металлов являются твердыми и магнитными.
Черные металлы используются для применения с высокой нагрузкой и низкой скоростью, в то время как цветные металлы предпочтительны для применения с высокой скоростью и нулевой нагрузкой для применения с низкой нагрузкой.
Сталь является наиболее распространенным черным металлом. Она составляет около 80% всего металлического материала благодаря своей доступности, высокой прочности, низкой стоимости, простоте изготовления и широкому спектру свойств. Она широко используется в строительстве и обрабатывающей промышленности. Фактически, рост производства стали показывает общее развитие промышленного мира.
8. Цветные и благородные металлы
Ассортимент благородных металлов
Цветные металлы: медь, алюминий, олово, никель, цинк
Благородные металлы: родий, ртуть, серебро, рутений, осмий, иридий
Благородные металлы, с другой стороны, устойчивы к окислению и коррозии во влажном воздухе. Согласно атомной физике, благородные металлы имеют заполненный электрон d-диапазона. В соответствии с этим строгим определением, медь, серебро и золото являются благородными металлами.
Они находят применение в таких областях, как орнамент, металлургия и высокие технологии. Их точное использование варьируется от одного элемента к другому. Некоторые благородные металлы, такие как родий, используются в качестве катализаторов в химической и автомобильной промышленности.
7. Драгоценные металлы
Родий: 1 грамм порошка, 1 грамм прессованного цилиндра и 1 г аргонодуговой переплавленной гранулы
Примеры: палладий, золото, платина, серебро, родий.
Драгоценные металлы считаются редкими и имеют высокую экономическую ценность. Химически они менее реакционноспособны, чем большинство элементов (включая благородные металлы). Они также пластичны и имеют высокий блеск.
Несколько веков назад эти металлы использовались в качестве валюты. Но сейчас они в основном рассматриваются как промышленные товары и инвестиции. Многие инвесторы покупают драгоценные металлы (в основном золото), чтобы диверсифицировать свои портфели или победить инфляцию.
Классификация по химическим свойствам
6. Щелочные металлы
Твердый металлический натрий
Примеры: натрий, калий, рубидий, литий, цезий и франций.
Щелочь относится к основной природе гидроксидов металлов. Когда эти металлы реагируют с водой, они образуют сильные основания, которые легко нейтрализуют кислоты.
Они настолько реактивны, что обычно встречаются в природе в слиянии с другими веществами. Карналлит (хлорид калия-магния) и сильвин (хлорид калия), например, растворимы в воде и, таким образом, легко извлекаются и очищаются. Нерастворимые в воде щелочи, такие, как фторид лития, также существуют в земной коре.
5. Щелочноземельные металлы
Изумрудный кристалл, основной минерал бериллия.
Примеры: бериллий, кальций, магний, барий, стронций и радий.
Щелочноземельные металлы в стандартных условиях мягкие и серебристо-белые. Они имеют низкую плотность, температуру кипения и температуру плавления. Хотя они не так реакционноспособны, как щелочные металлы, они очень легко образуют связи с элементами. Как правило, они вступают в реакцию с галогенами, образуя галогениды щелочноземельных металлов.
Все они встречаются в земной коре, кроме радия, который является радиоактивным элементом. Радий уже распадался в ранней истории Земли из-за относительно короткого периода полураспада (1600 лет). Современные образцы поступают из цепочки распада урана и тория.
Щелочноземельные металлы имеют широкий спектр применения. Бериллий, например, используется в полупроводниках, теплопроводниках, электрических изоляторах и в военных целях. Магний часто сплавляют с цинком или алюминием для получения материалов со специфическими свойствами. Кальций в основном используется в качестве восстановителя, а барий используется в вакуумных трубках для удаления газов.
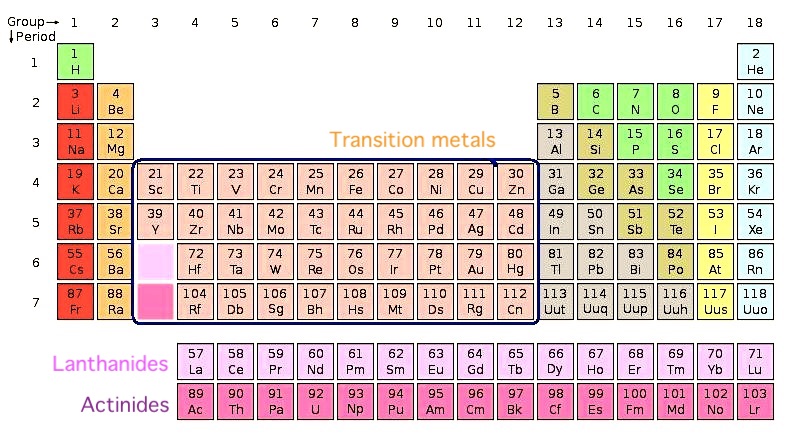
4. Переходные металлы
Примеры: титан, ванадий, хром, никель, серебро, вольфрам, платина, кобальт.
Большинство элементов используют электроны из своей внешней оболочки для связи с другими элементами. Переходные металлы, однако, могут использовать две крайние оболочки для соединения с другими элементами. Это химическая особенность, которая позволяет им связываться со многими различными элементами в различных формах.
Они занимают среднюю часть таблицы Менделеева, служа мостом между (или переходом) между двумя сторонами таблицы. Более конкретно, есть 38 переходных металлов в группах с 3 по 12 периодической таблицы. Все они являются пластичными, податливыми и хорошими проводниками тепла и электричества.
Многие из этих металлов, такие как медь, никель, железо и титан, используются в конструкциях и в электронике. Большинство из них образуют полезные сплавы друг с другом и с другими металлическими веществами. Некоторые из них, включая золото, серебро и платину, называются благородными металлами, потому что они крайне инертны и устойчивы к кислотам.
3. Постпереходные металлы
Висмут в виде синтетических кристаллов
Примеры: алюминий, галлий, олово, свинец, таллий, индий, висмут.
Физически они хрупки (или мягки) и имеют более низкую температуру плавления и механическую прочность, чем переходные металлы. Их кристаллическая структура довольно сложна: они проявляют ковалентные или направленные эффекты связи.
Различные металлы этого семейства имеют различное применение. Алюминий, например, используется для изготовления оконных рам, кухонной посуды, банок, фольги, деталей автомобилей. Оловянные сплавы используются в мягких припоях, оловянных и сверхпроводящих магнитах.
2. Лантаноиды
1-сантиметровый кусок чистого лантана
Примеры: лантан, церий, прометий, гадолиний, тербий, иттербий, лютеций.
Сплавы лантаноидов используются в металлургии из-за их сильных восстановительных способностей. Около 15 000 тонн лантаноидов ежегодно расходуется в качестве катализаторов и при производстве стекол. Они также широко используются в лазерах и оптических усилителях.
Некоторые исследования показывают, что лантаноиды могут быть использованы в качестве противораковых средств. Лантан и церий, в частности, могут подавлять пролиферацию раковых клеток и способствовать цитотоксичности.
1. Актиниды
Металлический уран, высокообогащенный ураном-235
Примеры: актиний, уран, торий, плутоний, фермий, нобелий, лоренций
Подобно лантаноидам, актиниды образуют семейство редкоземельных элементов с аналогичными свойствами. Они представляют собой серию из 15 последовательных химических элементов в периодической системе от атомных номеров 89 до 103.
Все они радиоактивны по своей природе. Синтетически произведенный плутоний, а также природные уран и торий являются наиболее распространенными актинидами на Земле. Первым актинидом, который был открыт в 1789 году, был уран. И большая часть существующих продуктов актинидов была произведена в 20 веке.
Ртуть и цезий: самые мягкие металлы в мире
Согласно таблице твердости немецкого ученого Фридриха Мооса, созданной в 1811 году, самыми мягкими металлами считаются щелочные. В пятерку самых мягких входят: литий – 0,6; натрий – 0,5; калий – 04; рубидий – 0,3 и наконец, рекордсменом по мягкости с показателем твердости всего 0,2 по Моосу считается цезий.
Cамый мягкий металл в мире
Один из интереснейших химических элементов — это ртуть. Этот металл постоянно находится в жидком агрегатном состоянии, поэтому и считается самым мягким в мире металлом. Почему ртуть жидкая и другие интересные факты о ртути читайте здесь.
Ртуть довольно широко применяется в более чем 1000 областей — например в приборах, сельском хозяйстве, горном деле, химической промышленности и проч.
Если же говорить о металлах, для которых характерно постоянно находиться в твердом состоянии, то здесь тройку лидеров удерживают калий, рубидий и цезий.
Цезий
На самом деле этот металл настолько мягкий, что его можно разрезать ножом для масла. Кроме того, цезий плавится при относительно низкой температуре –28,4 градуса по Цельсию (83,12 градуса по Фаренгейту).
Это означает, что он перейдет в жидкое состояние, как только окажется в руке человека, так как температура руки здорового индивидуума 36,6 градусов.
Важно знать, что прикасаться к этому металлу незащищенной кожей нельзя, поскольку он радиоактивный, и может серьезно обжечь кожу, поэтому с ним нужно обращаться с большой осторожностью.
Открытый немецким химиком Робертом Бунзеном в 1860 году, цезий имеет атомный номер 55. Имя элемента происходит от латинского слова «цезий», что означает небесно – голубой. Однако это не отражает цвет металла, который в чистом виде является бледно-золотым.

Золото, серебро и медь, алюминий и другие ковкие металлы, считаются также относительно мягкими, хотя и намного тверже цезия.
Общие характеристики цезия:
Где применяется цезий?
Этот элемент используются в качестве катализатора в химических реакциях. Поскольку он легко ионизируется светом, металлический цезий используется в фотоэлементах и инфракрасных детекторах.
Соединения цезия также используются в специализированных щелочных батареях, предназначенных для работы в условиях минусовой температуры. Карбонат цезия используется в производстве специального стекла и стеклоизделий.
Самые точные часы в мире – «атомные часы», они измеряют время, основываясь на очень точной вибрации электронов во внешней оболочке атома цезия. Эти часы отстают лишь на 5 секунд каждые 300 лет!
Цезий-137 радиоактивен, и может быть использован для лучевой терапии для лечения некоторых видов рака и стерилизации медицинских препаратов.
Инженеры по космическим путешествиям обнаружили, что сжигание цезия в космосе становится очень эффективным видом топлива. Установлено, что он в 140 раз эффективнее любого другого топлива.
Ежегодно используется всего несколько тысяч килограммов цезия. Ряд минералов содержит значительное количество цезия, включая слюду, берилл, полевой шпат, петалит и поллуцит, из которого он обычно добывается.
Самые мягкие металлы в мире
Насколько золото мягкое, и как используется это свойство металла?
Этот металл достаточно сильно распылен в природе. Золото содержится в морской воде, в человеческом организме, его можно обнаружить практически в любом осколке гранита. И это притом, что золота лишь миллионные доли процента в земной коре.
В чистом виде цвет этого металла – желтый с оттенком красного, что отличает его от всех других металлов. Золото является мягким благородным металлом. Под действием окружающей среды оно легко разрушается.
В чистом виде это настолько мягкий металл, что его несложно поцарапать даже ногтем. Известно, что из одного грамма данного металла можно вытянуть трехкилометровую проволоку, так же грамма будет достаточно, чтобы изготовить тончайшую золотую фольгу, которая будет в сотни раз тоньше волоса человека, при этом будет гнуться не ломаясь.
По механической прочности и по своей химической стойкости этот драгметалл уступает почти всем платиноидам, но он незаменим для электрических контактов. Именно поэтому в микроэлектронике повсеместно используются гальванические покрытия и золотые проводники. В ядерных исследованиях не обходится без золота, где его используют как мишень. Применяют его и в нейтронной бомбе в качестве нейтронной оболочки.
Какой из металлов самый твердый и самый мягкий? Самый мягкий металл в мире
О том, какой металл самый мягкий, можно рассуждать довольно долго, если учитывать различные параметры. К примеру, многим известно, что золото в чистом виде является очень мягким металлом. Его очень просто поцарапать ногтем или сделать из нескольких грамм данного металла тончайшую проволоку.
Благодаря необычайной мягкости золота можно изготавливать из него любой формы драгоценные изделия, чем и пользуются ювелиры. Однако золото – это не самый мягкий металл. Зато таким с уверенностью можно назвать галлий.
Свойства металлов
Железо и его сплавы (сталь, чугун), медь, алюминий… Применение этих материалов знаменовало рывки научно-технического прогресса на разных этапах развития цивилизации. У каждого из этих металлов есть характеристики, придающие ему уникальную практическую ценность. Общими признаками для них являются высокая тепло- и электропроводность, пластичность – способность сохранять целостность при деформации, металлический блеск.
Булатный клинок, разрубающий железные доспехи, и самый мягкий металл, на котором остаются следы от малейшего воздействия, имеют сходное внутреннее устройство. В его основе – кристаллическая решетка, в узлах которой – атомы с положительным и нейтральным зарядом, между которыми находится «электронный газ» — частицы, покинувшие внешние оболочки атомов из-за ослабления связи с ядром. Особая металлическая связь между положительными ионами, расположенными в узлах кристаллической решетки, осуществляется за счет сил притяжения, возникающих в «электронном газе». Твердость, плотность, температура плавления металла зависят от кон.
Критерии оценки
Ответ на вопрос о том, какой металл самый мягкий, всегда будет предметом обсуждения, если не согласовать критерии оценки и определить само понятие мягкости. Мнение об этой характеристике материала будет различным у специалистов разных отраслей. Металлург может понимать мягкость как повышенную ковкость, тенденцию воспринимать деформации от абразивных материалов и т. д.
Для материаловедов важно иметь возможность объективно сравнивать разные характеристики веществ. Мягкость также должна иметь общепринятые критерии оценки. Самый мягкий металл в мире должен иметь общепризнанные показатели, доказывающие его «рекордные» характеристики. Существует несколько методик, целью которых является измерение мягкости различных материалов.










Плюсы и минусы
Множество достоинств, но и недостатков не меньше.
| Достоинства | Недостатки |
| Легкая механическая обработка | Высокая плотность; изделия получаются тяжелыми |
| Твердость, упругость, прочность — лучшие свойства сплавов | Коррозия металла в присутствии влаги |
| Возможность получать заданные свойства сплавов при добавлении малого количества примесей | Склонность к электрохимическому корродированию |
Рекомендуем: ЗОЛОТО — дар или проклятие человечеству
Ковкость дает возможность производить декоративные изделия.
Методы измерения
Большинство сертифицированных способов измерения твердости, основаны на измеряемом с помощью точных инструментов контактном воздействии на исследуемый материал со стороны более твердого тела, называемого индентором. В зависимости от вида индентора и от способов измерения различают несколько основных методов:
— Метод Бринелля. Определяется диаметр отпечатка, оставляемого металлическим шариком при вдавливании в поверхность исследуемого вещества.
— Метод Роквелла. Измеряется глубина вдавливания в поверхность шарика или алмазного конуса.
— Метод Виккерса. Определяется площадь отпечатка, оставляемого алмазной четырехгранной пирамидкой.
— Твердость по Шору. Есть свои шкалы для очень твердых и очень мягких материалов – измеряется глубина погружения специальной иглы или высота отскока от поверхности специального бойка.
Технология получения
Железная руда (магнетит и гематит) отправляется в работу: на обогатительный либо металлургический комбинат.

Железная руда
Чугун выплавляют в доменной печи. При 1610°С загружают шихту (агломерат, окатыши) с флюсом, продувают горячим воздухом. Это позволяет убрать примеси, отделить шлак.
Основные способы получения стали:
При необходимости в конце плавки добавляются легирующие присадки.
Закалка стали – нагрев до раскаленности и охлаждение – делают ее пластичной, твердой.
Производство беспримесного металла основано на электролизе расплава солей вещества.
Железный сплав, в составе которого менее 2% углерода, – это сталь. Более 2% углерода – чугун.
Шкала твердости Мооса
Этот шкала для определения относительной твердости минералов и металлов была предложена в начале XIX века немцем Фридрихом Моосом. Она основан на методе царапания, когда более твердый образец оставляет отметку на более мягком, и очень удобна для выяснения — какой металл самый мягкий. По отношению к 10 эталонным минералам, которым присвоен условный показатель твердости, для испытываемого вещества определяется место в шкале и цифровой индекс.
Самый мягкий эталонный минерал – тальк. Он имеет твердость по Моосу — 1, а самый твердый, алмаз – 10.
Оценка твердости по шкале Мооса происходит по принципу «мягче — тверже». Точно определить, во сколько раз, например, алюминий, имеющий индекс по шкале Мооса 2,75, мягче вольфрама (6,0), можно только имея результаты измерений, основанных на других методах. Но чтобы определить самый мягкий металл в таблице Менделеева этой таблицы вполне достаточно.
Самые мягкие – щелочные металлы
Из минералогической шкалы Мооса видно, что самыми мягкими являются вещества, относящиеся к щелочным металлам. Даже ртуть, знакомая многим по жидкости из градусника, имеет показатель твердости 1,5. Мягче её несколько веществ, обладающих сходными физико-механическими и химическими свойствами: литий (0,6 по шкале Мооса), натрий (0,5), калий (0,4), рубидий (0,3).
Самый мягкий металл — это цезий, имеющий по шкале твердости Мооса показатель 0,2.
Физические и химические свойства щелочных металлов определяются их электронной конфигурацией. Она лишь слегка отличается от строения инертных газов. Электрон, расположенный на внешнем энергетическом уровне обладает подвижностью, которая определяет высокую химическую активность. Самым мягким металлам свойственна особая летучесть, их трудно добывать и сохранять в неизменном виде. Им присущи бурные химические взаимодействия с воздухом, водой, кислородом.
Все о металлах — виды металлов и сплавов
и их сплавы — один из главных конструкционных материалов современной цивилизации. Это определяется прежде всего их высокой прочностью, однородностью и непроницаемостью для жидкостей и газов. Кроме того, меняя рецептуру сплавов, можно менять их свойства в очень широких пределах.
Почти все металлы, имеющие промышленное значение, используются в виде сплавов. Все выплавляемое железо почти целиком идет на изготовление обычных и легированных сталей, а также чугунов. Дело в том, что сплавлением с некоторыми компонентами можно существенно улучшить механические, электрические, магнитные, термические свойства многих металлов.
Люди узнали о существовании металлов еще на заре цивилизации.
Они обнаружили, что некоторые камни, которые потом назвали рудой, при нагреве превращаются в блестящее вещество — металл, который при высокой температуре является жидкостью, а при комнатной — твердым телом.
Для практического применения металлов и изготовления металлических изделий (оружия, сельскохозяйственных орудий) люди научились обрабатывать металл. Возникли первые технологии обработки металлов.
Металлургия — область науки и техники и отрасль промышленности, охватывающие процессы получения металлов из руд или других материалов, изменения химического состава, структуры и свойств металлических сплавов, придания металлу определенной формы.
Металлургия является одной из наиболее динамично развивающейся отраслью мировой экономики. Развитие производственных мощностей металлургии заметно опережает динамику роста мировой индустрии. Конкуренция в отрасли велика, поставки импортной продукции нарастают. Так, по данным IISI, мировое производство стали за 2006 г.
составило 1,219 млрд т, что на 7,93% выше уровня предыдущего года.
Раздел содержит справочную информацию об основных промышленных металлах: нахождение в природе, физические и химические свойства, получение и промышленное применение металлов, а также биологическое воздействие металлов и их соединений на человека. Вы можете выбрать интересующий Вас металл, кликнув по ссылке в левом меню страницы.
В настоящее время существует базовая классификация видов металлов, определяющая три основные группы: черные, цветные и благородные металлы.Последние иногда включают в группу цветных металлов. Черные и цветные металлы применяются почти во всех сферах промышленного производства,благородные металлы служат еще и средством сохранения и накопления стоимости.
Черные металлы
Черные металлы — это железо и сплавы на его основе. Сюда входят все виды чугунов и сталей. К черным металлам также относят марганец и ванадий.
Процесс производства черных металлов называется черной металлургией. Литье чугуна и стали традиционно считалось одной из составляющихчастей индустриальной мощи любой крупной страны.
Производство тугоплавких металлов и ферросплавов также относится к области черной металлургии.
Цветные металлы
Другой вид металлов
, цветные металлы, включает в себя большую часть металлических элементов таблицы Менделеева, за исключением черных металлов итяжелых трансурановых элементов. В эту группу относят всем знакомые медь и олово, алюминий и титан, тантал и цирконий, а также редкоземельные элементы.Цветные металлы делятся на две большие группы: тяжелые и легкие цветные металлы.
Благородные металлы
Среди всех видов металлов благородные металлы обладают тем свойством, что практически не подвержены окислению.В группу благородных металлов входят золото, серебро, платина, палладий и другие металлы платиновой группы. Для всех благородных металлов характернаповышенная химическая устойчивость и блеск.
Основные области применения этого вида металлов — это ювелирная промышленность, электроника,медицина, изготовление защитных поверхностей и катализаторов.
Из-за своей высокой стоимости и устойчивости к воздействию внешней среды,металлы этой группы (в основном золото) используются как средство сбережения, государства накапливают золото как консервативную часть своихзолотовалютных резервов.
Элемент № 55 Цезий — самый мягкий металл
Название «цезий» происходит от латинского caesius – “небесно-голубой»: в спектре, излучаемом сильно нагретым веществом, в инфракрасном диапазоне видны две ярко-синие полоски. В чистом виде он хорошо отражает свет, похож на светлое золото и имеет серебристо – желтый цвет. Цезий — самый мягкий металл в мире, показатель твердости по Бринеллю – 0,15 Мн/м2 (0,015 кгс/см2). Температура плавления: +28,5°С, поэтому в обычных условиях, при комнатной температуре цезий находится в полужидком состоянии.
Это редкий, дорогой и чрезвычайно химически активный металл. В электронике, радиотехнике и химической промышленности высоких технологий цезий и сплавы на его основе находят всё большее применение и потребность в нем растет постоянно. Востребованы его химическая активность, способность образовывать соединения с высочайшей электропроводностью. Цезий – важный компонент производства специальных оптических приборов, светильников с уникальными свойствами и других высокотехнологических изделий. При этом мягкость – не самое его востребованное качество.
Распространенность цезия в природе
В литературе нет точных данных о том, сколько цезия имеется на земном шаре. Известно лишь, что он относится к числу редких химических элементов. Полагают, что его содержание в земной коре во всяком случае в несколько сот раз меньше, чем рубидия, и не превышает 7 • 10
Цезий встречается в крайне рассеянном состоянии (порядка тысячных долей процента) во многих горных породах; ничтожные количества этого металла были обнаружены и в морской воде. В большей концентрации (до нескольких десятых процента) он содержится в некоторых калиевых и литиевых минералах, главным образом в лепидолите. Но особенно существенно то, что, в отличие от рубидия и большинства других редких элементов, цезий образует собственные минералы — поллуцит, авогадрит и родицит. Родицит крайне редок, притом некоторые авторы причисляют его к литиевым минералам, так как в его состав (R20 ^АЬОз-ЗВЮз, где R20— сумма окисей щелочных металлов) входит обычно больше лития, чем цезия. Авогадрит (К, Cs)[BF4] тоже редок, да и поллуциты встречаются нечасто; их залежи маломощны, зато цезия они содержат не менее 20, а иногда и до 35%. Наибольшее практическое значение имеют поллуциты CHIA (Южная Дакота и Мэн), Юго-Западной Африки, Швеции и Советского Союза (Казахстан и др.).
Поллуциты — это алюмосиликаты, сложные и весьма прочные соединения. Их состав определяют формулой (Cs, Na) [AlSi206]-гаН20, и хотя цезия в них много, извлечь его не так просто. Чтобы «вскрыть» минерал и перевести в растворимую форму ценные компоненты, его обрабатывают при нагревании концентрированными минеральными кислотами — плавиковой или соляной и серной. Затем освобождают раствор от всех тяжелых и легких металлов и, что особенно трудно, от постоянных спутников цезия — щелочных металлов: калия, натрия и Рубидия.
Современные методы извлечения цезия из поллуцитов основаны на предварительном сплавлении концентратов с избытком извести и небольшим количеством плавиколого шпата. Если вести процесс при 1200° С, то почти весь цезий возгоняется в виде окиси Cs20. Этот возгон, конечно, загрязнен примесью других щелочных металлов, но он растворим в минеральных кислотах, что упрощает дальнейшие операции.
Из лепидолитов цезий извлекается вместе с рубидием попутно, как побочный продукт производства лития. Лепидолиты предварительно сплавляют (или спекадэт) при температуре около 1000° С с гипсом или сульфатом калия и карбонатом бария. В этих условиях все щелочные металлы превращаются в легкорастворимые соединения — их можно выщелачивать горячей водой.
После выделения лития остается переработать полученные фильтраты, и здесь самая трудная операция — отделение цезия от рубидия и громадного избытка калия. В результате ее получают какую-либо соль цезия — хлорид, сульфат или карбонат. Но это еще только часть дела, так как цезиевую соль надо превратить в металлический цезий. Чтобы понять всю сложность последнего этапа, достаточно указать, что первооткрывателю цезия — крупнейшему немецкому химику Бунзену — так и не удалось получить элемент № 55 в свободном состоянии. Все способы, пригодные для восстановления других металлов, не давали желаемых результатов. Металлический цезий был впервые получен только через 20 лет, в 1882 г., шведским химиком Сеттербергом в процессе электролиза расплавленной смеси цианидов цезия и бария, взятых в отношении 4:1. Цианид бария добавляли для снижения температуры плавления. Однако барий загрязнял конечный продукт, а работать с цианидами было трудно ввиду их крайней токсичности, да и выход цезия был весьма мал. Более рациональный способ найден в 1890 г. известным русским химиком Н. Н. Бекетовым, предложившим восстанавливать гидроокись цезия металлическим магнием в токе водорода при повышенной температуре. Водород заполняет прибор и препятствует окислению цезия, который отгоняется в специальный приемник. Однако и в этом случае выход цезия не превышает 50% теоретического.
В литературе описаны еще многие другие способы по-лучения металлического цезия из его соединений, но, как правило, они не сулят особых преимуществ. Так, при замене металлического кальция его карбидом температуру реакции приходится повышать до 800° С, и конечный продукт загрязняется дополнительными примесями. Можно разлагать азид цезия или восстанавливать цирконием его бихромат, но эти реакции взрывоопасны. Впрочем, при замене бихромата хроматом цезия процесс восстановления протекает спокойно, и, хотя выход не превышает 50%, отгоняется очень чистый металлический цезий. Этот способ применим для получения небольших количеств металла в специальном вакуумном приборе.
Мировое производство цезия сравнительно невелико, но в последнее время оно постоянно растет. О масштабах этого роста можно только догадываться — цифры не публикуются.
Самое замечательное свойство цезия — его исключительно высокая активность. По чувствительности к свету он превосходит все другие металлы. Цезиевый катод испускает поток электронов даже под действием инфракрасных лучей с длиной волны 0,80 мкм. Кроме того, максимальная электронная эмиссия, превосходящая нормальный фотоэлектрический эффект в сотни раз, наступает у цезия при освещении зеленым светом, тогда как у других светочувствительных металлов этот максимум проявляется лишь при воздействии фиолетовых или ультрафиолетовых лучей.
Долгое время ученые надеялись найти радиоактивные изотопы цезия в природе, поскольку они есть у рубидия и калия. Но в природном цезии не удалось обнаружить каких-либо иных изотопов, кроме вполне стабильного ir;3Cs. Правда, искусственным путем получено 22 радиоактивных изотопа цезия с атомными массами от 123 до 144. В большинстве случаев они недолговечны: периоды полураспада измеряются секундами и минутами, реже — несколькими часами или днями. Однако три из них распадаготся не столь быстро — это 134Cs, 137Cs и 135Cs, живу-щие 2,07; 26,6 и 3 • 106 лет. Все три изотопа образуются в атомных реакторах при распаде урана, тория и плутония; их удаление из реакторов довольно затруднительно.
Химическая активность цезия необычайна. Он очень быстро реагирует с кислородом и не только моментально воспламеняется на воздухе, по способен поглощать малейшие следы кислорода в условиях глубокого вакуума. Воду он бурно разлагает уже при обычной температуре; при этом выделяется много тепла, и вытесняемый из воды водород тут же воспламеняется. Цезий взаимодействует даже со льдом при—116° С. Его хранение требует большой предосторожности.
Цезий взаимодействует и с углеродом. Только самая совершенная модификация углерода — алмаз — в состоянии противостоять его «натиску». Жидкий расплавленный цезий и его пары разрыхляют сажу, древесный уголь и даже графит, внедряясь между атомами углерода и образуя своеобразные, довольно прочные соединения золотисто-желтого цвета, которые в пределе, по-видимому, отвечают составу C8Cs5. Они воспламеняются на воздухе, вытесняют водород из воды, а при нагревании разлагаются и отдают весь поглощенный цезий.
Даже при обычной температуре реакции цезия с фтором, хлором и другими галогенами сопровождаются воспламенением, а с серой и фосфором — взрывом. При нагревании цезий соединяется с водородом, азотом и другими элементами, а при 300° С разрушает стекло и фарфор. Гидриды и дейтериды цезия легко воспламеняются на воздухе, а также в атмосфере фтора и хлора. Неустойчивы, а иногда огнеопасны и взрывчаты соединения цезия с азотом, бором, кремнием и германием, а также с окисью углерода. Галоидные соединения цезия и цезиевые соли большинства кислот, напротив, очень прочны и устойчивы. Активность исходного цезия проявляется у них разве только в хорошей растворимости подавляющего большинства солей. Кроме того, они легко превращаются в более сложные комплексные соединения.
Сплавы и интерметаллические соединения цезия всегда сравнительно легкоплавки.
У цезия имеется еще одно весьма важное свойство, тесно связанное с его электронной структурой. Дело в том, что он теряет свой единственный валентный электрон легче, чем любой другой металл; для этого необходима очень незначительная энергия — всего 3,89 эв. Поэтому получение плазмы из цезия требует гораздо меньших энергетических затрат, чем при использовании любого другого химического элемента.
Как открыли элемент
История цезия начинается в XIX веке. Ученые (химики Кирхгоф и Бунзен) исследовали минеральные источники Шварцвальда с помощью спектрального анализа и нашли небесно-голубые линии неизвестного элемента. Элемент получил название по цвету линий на спектрограмме (caesius — голубой).
Геохимия и минералогия
Среднее содержание цезия в земной коре — 3,7 г/т. Наблюдается некоторое увеличение содержания цезия от ультраосновных пород (0,1 г/т) к кислым (5 г/т). Основная его масса в природе находится в рассеянной форме и лишь незначительная часть заключена в собственных минералах цезия (поллуците и др.). Постоянно повышенные количества цезия наблюдаются в морганите (1—4 %), родиците (около 5 %), авогадрите и лепидолите (0,85 %). По кристаллохимическим свойствам цезий наиболее близок к рубидию, калию и таллию. В повышенных количествах цезий находится в калиевых минералах. Цезий, как и рубидий, имеет тенденцию накапливаться на поздних стадиях магматических процессов, и в пегматитах его концентрации достигают наивысших значений. Среднее содержание цезия в гранитных пегматитах около 0,01 %, а в отдельных пегматитовых жилах, содержащих поллуцит, даже достигает 0,4 %, что примерно в 40 раз выше, чем в гранитах. Наиболее высокие концентрации цезия наблюдаются в редкометально замещённых микроклин-альбитовых пегматитах со сподуменом. При пневматолито-гидротермальном процессе повышенные количества цезия связаны с массивами грейзенезированных аляскитов и гранитов с кварц-берилл-вольфрамитовыми жилами, где он присутствует главным образом в мусковитах и полевых шпатах. В зоне гипергенеза (в поверхностных условиях) цезий в небольшом количестве накапливается в глинах, глинистых породах и почвах, содержащих глинистые минералы, иногда в гидроокислах марганца. Максимальное содержание цезия составляет лишь 15 г/т. Роль глинистых минералов сводится к сорбции, цезий вовлекается в межпакетное пространство в качестве поглощённого основания. Активная миграция этого элемента в водах очень ограничена. Основное количество цезия мигрирует «пассивно», в глинистых частичках речных вод. В морской воде концентрация цезия составляет около 0,5 мкг/л. Из числа собственно цезиевых минералов наиболее распространены поллуцит (Cs, Na)[AlSi2O6]·nH2O (22—36 % Cs2O), цезиевый берилл (пеццоттаит) Be2CsAl2(Si6O18) и авогадрит (KCs)BF4. Последние два минерала содержат до 7,5 % окиси цезия. Из других цезиевых минералов известны также галхаит (Cs,Tl)(Hg,Cu,Zn)6(As,Sb)4S12 и маргаритасит (Cs,K,H3O)2(UO2)2V2O8·H2O.
Электронная схема цезия
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1 Короткая запись:
Cs:
[Xe]6s1
Одинаковую электронную конфигурацию имеют атом цезия и +2La, +3Ce, +4Pr
Порядок заполнения оболочек атома цезия (Cs) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Цезий имеет 55 электронов, заполним электронные оболочки в описанном выше порядке:
Степень окисления цезия
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы цезия
Валентность Cs
Атомы цезия в соединениях проявляют валентность I.
Валентность цезия характеризует способность атома Cs к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Cs
Квантовые числа определяются последним электроном в конфигурации, для атома Cs эти числа имеют значение N = 6, L = 0, Ml = 0, Ms = ½
Изотопы
Известны изотопы цезия с массовыми числами от 112 до 151 (количество протонов 55, нейтронов от 57 до 96), и 22 ядерных изомеров. Природный цезий — моноизотопный элемент, состоящий из единственного стабильного изотопа 133Cs.
Схема распада Cs-137
Самым долгоживущим искусственным радиоактивным нуклидом цезия является 135Cs с периодом полураспада T1/2 около 2,3 миллиона лет. Другой относительно долгоживущий изотоп 137Cs (T1/2 = 30,17 года).
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Энергия ионизации Cs: Eo = 376 кДж/моль
Кристаллическая решётка цезия:
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая объёмно-центрированная |
| 513 | Параметры решётки | 6,140 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 39,2 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
Добыча
Нахождение в природе затруднено ввиду «распыленности» цезиевых руд.
По добыче цезиевой руды лидирует Канада. Месторождение Берник-Лейк обладает 70% мировых запасов основной руды цезия — поллуцита. В России месторождения цезиевых минералов открыты на Кольском полуострове, в Саянах и Забайкалье.
Добыча цезия из руды
Производство металла затруднено сложностью извлечения металла высокой очистки из руд.

Кристаллы цезия
Способы получения предполагают ректификацию, очистку от мехпримесей, удаление следов газов (O2, H2, N2), ступенчатая кристаллизация.
Интересно: цезий хранят в герметичных сосудах, заполненных инертным газом, жидкостью или в вакууме.
Сплавы
В состав сплавов и соединений обычно входят: барий, сурьма, таллий. Эти сплавы получают методом электролиза.
| Состав лигатуры, формула сплава | Применение |
| Cs3Sb (сурьма) | Фотокатоды |
| CsBi (висмут) | Фотоэлементы |
| CsCl (хлор) | В радиографии, в производстве электропроводящего стекла |
| CsI | В инфракрасной оптике, в детекторах частиц |
| CsBr | Входит в состав люминофоров |
Познавательно: состав поверхности Марса проводили гамма-спектрометром на основе CsI (Tl).
Соединения цезия
Цезий образует бинарные соединения с большинством неметаллов. Гидриды и дейтериды цезия легко воспламеняются на воздухе, а также в атмосфере фтора и хлора. Неустойчивы, а иногда огнеопасны и взрывчаты соединения цезия с азотом, бором, кремнием и германием. Галогениды и соли большинства кислот более стабильны.
Соединения с кислородом. Цезий образует девять соединений с кислородом, имеющих состав от Cs7O до CsO3.
Оксид цезия Cs2O образует коричнево-красные кристаллы, расплывающиеся на воздухе. Его получают медленным окислением недостаточным (2/3 от стехиометрического) количеством кислорода. Остаток непрореагировавшего цезия отгоняют в вакууме при 180–200° С. Оксид цезия в вакууме при 350–450° С возгоняется, а при 500° С разлагается:
Энергично реагирует с водой, давая гидроксид цезия.
Оксид цезия является компонентом сложных фотокатодов, специальных стекол и катализаторов. Установлено, что при получении синтола (синтетической нефти) из водяного газа и стирола из этилбензола, а также при некоторых других синтезах добавление к катализатору незначительного количества оксида цезия (вместо оксида калия) повышает выход конечного продукта и улучшает условия процесса.
Гигроскопичные бледно-желтые кристаллы пероксида цезия Cs2O2 можно получить окислением цезия (или его раствора в жидком аммиаке) дозированным количеством кислорода. Выше 650° С пероксид цезия разлагается с выделением атомарного кислорода и энергично окисляет никель, серебро, платину и золото. Пероксид цезия растворяется в ледяной воде без разложения, а выше 25° С реагирует с ней:
2Cs2O2 + 2H2O = 4CsOH + O2
В кислотах он растворяется с образованием пероксида водорода.
При сжигании цезия на воздухе или в кислороде образуется золотисто-коричневый надпероксид цезия CsO2. Выше 350° С он диссоциирует с выделением кислорода. Надпероксид цезия – очень сильный окислитель.
Пероксид и надпероксид цезия служат источниками кислорода и используются для его регенерации в космических и подводных кораблях.
Полуторный оксид «Cs2О3» образуется в виде темного парамагнитного порошка при осторожном термическом разложении надпероксида цезия. Его можно также получить окислением металла, растворенного в жидком аммиаке, или контролируемым окислением пероксида. Предполагается, что он является динадпероксидом-пероксидом [(Cs+)4(O22–)(O2–)2].
Оранжево-красный озонид CsО3 можно получить при действии озона на безводный порошок гидроксида или пероксида цезия при низкой температуре. При стоянии озонид медленно разлагается на кислород и надпероксид, а при гидролизе он сразу превращается в гидроксид.
Цезий образует также субоксиды, в которых формальная степень окисления элемента существенно ниже +1. Оксид состава Cs7O имеет бронзовую окраску, его температура плавления равна 4,3° С, активно реагирует с кислородом и водой. В последнем случае образуется гидроксид цезия. При медленном нагревании Cs7O разлагается на Cs3O и цезий. Фиолетовые кристаллы Cs11O3 плавятся с разложением при 52,5° С. Красно-фиолетовый Cs4O разлагается выше 10,5° С. Нестехиометрическая фаза Cs2+xO меняет состав вплоть до Cs3O, который разлагается при 166° С.
Гидроксид цезия CsOH образует бесцветные кристаллы, которые плавятся при ° С. Температуры плавления гидратов еще ниже, например моногидрат CsOH·H2O плавится с разложением при 2,5° С, а тригидрат CsOH·3H2O – даже –5,5° С.
Гидроксид цезия служит катализатором синтеза муравьиной кислоты. С этим катализатором реакция идет при 300° С без высокого давления. Выход конечного продукта очень велик – 91,5%.
Галогениды цезия CsF, CsCl, CsBr, CsI (бесцветные кристаллы) плавятся без разложения, выше температуры плавления летучи. Термическая устойчивость понижается при переходе от фторида к иодиду; бромид и иодид в парах частично разлагаются на простые вещества. Галогениды цезия хорошо растворимы в воде. В 100 г воды при 25° С растворяется 530 г фторида цезия, 191,8 г хлорида цезия, 123,5 г бромида цезия, 85,6 г иодида цезия. Из водных растворов кристаллизуются безводные хлорид, бромид и иодид. Фторид цезия выделяется в виде кристаллогидратов состава CsF·nH2O, где n = 1, 1,5, 3.
При взаимодействии с галогенидами многих элементов галогениды цезия легко образуют комплексные соединения. Некоторые из них, например Cs3[Sb2Cl6], используют для выделения и аналитического определения цезия.
Фторид цезия применяют для получения фторорганических соединений, пьезоэлектрической керамики, специальных стекол. Хлорид цезия – электролит в топливных элементах, флюс при сварке молибдена.
Бромид и иодид цезия широко используются в оптике и электротехнике. Кристаллы этих соединений прозрачны для инфракрасных лучей с длиной волны от 15 до 30 мкм (CsBr) и от 24 до 54 мкм (CsI). Обычные призмы из хлорида натрия пропускают лучи с длиной волны 14 мкм, а из хлорида калия – 25 мкм, поэтому применение бромида и иодида цезия вместо хлоридов натрия и калия сделало возможным снятие спектров сложных молекул в отдаленной инфракрасной области.
Если при изготовлении флуоресцирующих экранов для телевизоров и научной аппаратуры ввести между кристалликами сульфида цинка примерно 20% иодида цезия, экраны будут лучше поглощать рентгеновские лучи и ярче светиться при облучении электронным пучком.
Сцинтилляционные приборы для регистрации тяжелых заряженных частиц, содержащие монокристаллы иодида цезия, активированного таллием, обладают наибольшей чувствительностью из всех приборов подобного назначения.
Плюсы и минусы
К достоинствам металла можно отнести его невероятную активность. По чувствительности к свету ему нет равных. Из цезия легче всего получить (энергетически малозатратно) плазму.
Интересно: многие физики считают, что плазму целесообразно создавать, используя энергию атомных реакторов. Это даст возможность непосредственного превращения тепловой энергии в электрическую.
Недостатками можно считать сложность работы с металлом и ограниченный запас цезийсодержащих руд.
Познавательно: изотоп 137Cs — источник высокой радиоактивности в районе Чернобыля.
Использование цезия
Металл используют в двигателях орбитальных спутников, в МГД-генераторах.
Познавательно: японские ученые изобрели ткань, которая может впитывать радиоактивный цезий из воды и почвы.
Галлий: характеристики
Данный элемент представляет собой довольно пластичный металл, который отличается серебристым цветом и имеет синеватый оттенок. Расположен самый мягкий металл в мире в таблице Менделеева под номером 31. В природе этот металл не встречается в чистом виде, а извлекают его из цинковой руды или бокситов, которые содержат галлий в огромных количествах.
Однако вряд ли можно считать галлий самым мягким, если он оказывается под воздействием низких температурных режимов. В этом случае он является очень даже твердым. Но стоит лишь температуре воздуха подняться до отметки в плюс 29,8 градусов, как галлий начинает плавиться. Чтобы расплавить такой металл, можно лишь положить его в руку.
А уж если ложка, изготовленная из галлия, окажется в горячем чае, то процесс плавления пойдет еще быстрее. При температуре плюс 500 градусов данный металл и вовсе становится настолько «агрессивным», что способен разъедать множество металлов (исключением будет вольфрам). Например, если разогретая до такой температуры капля галлия окажется на банке из алюминия, то примерно через тридцать минут структура банки слабеет, и она раскрошится, словно тонкий лед от механического воздействия.
Есть возможность даже наблюдать, как галлий напоминает сердце, которое бьется, – выполняется эксперимент, когда представитель наиболее мягких элементов начинает совершать активные движения и даже напоминает при этом совершенно неизведанную форму жизни. А происходит это так – расплавленный галлий в виде одной капли соприкасается с кончиком гвоздя. При этом капля сначала продолжает плавиться, а затем, когда контакт заканчивается, снова собирается. В результате получается довольно эффектное зрелище, за которым хочется наблюдать и наблюдать.
Назначение мягкого металла
Особой роли с биологической точки зрения у данного металла не имеется. Но с того самого момента, когда он впервые был обнаружен (в 1875г.), галлий используется в микроэлектронике. Широко его используют также в фармацевтическом производстве. В наше время для создания микроволновых схем и инфракрасных приложений используют арсенид галлия.
Кроме того, что данный металл признан наиболее мягким, он является еще и дорогостоящим. К примеру, в 2005 году за 1000 килограммов данного металла покупателям приходилось выкладывать чуть больше одного миллиона долларов.
Другие мягкие металлы
Возможно, что некоторым приходит на ум противопоставить галлию ртуть, ведь она изначально является жидким металлом, а значит, тоже имеет право называться самой мягкой. Однако есть и еще несколько элементов из таблицы Менделеева, которые тоже могут считаться одними из самых мягких. Этот цезий, калий и рубидий.
Наиболее мягким элементом при комнатной температуре считается цезий. Он является щелочным металлом, имеющим серебристо-желтый цвет. В переводе с латинского «цезий» означает «небесно-голубой». А все потому, что цезий имеет две ярко-синие линии в эмиссионном спектре.
Встречающийся лишь в соединениях с другими элементами калий является щелочным металлом, обладающим серебристо-белым цветом. Он способен мгновенно окисляться на воздухе и оперативно вступать с водой в химическую реакцию, при которой получается щелочь.
И еще одним из наиболее мягких можно назвать рубидий, который тоже является щелочным металлом. Данный элемент представляет собой простой металл, обладающий серебристо-белым цветом.
Интересные факты: что ещё дороже золота
Немного интересных фактов: много различных вещей стоят больше золота, например, рог носорога, который можно купить по 110 долларов за грамм. Данная цена обусловлена тем, что добыть его крайне трудно, а животных становится все меньше и меньше. Но ценность рога можно назвать и завышенной, потому что он, в основном, состоит из кератина, который содержится и в человеческих волосах.

Носорог
Антивещество
Антивещество — самая нестабильная субстанция, которую крайне сложно произвести. Является очень мощным веществом, которое позволяет вырабатывать уйму энергии. До конца оно не изучено. Предположительная его стоимость достигает 62 трлн долларов за грамм.

Антивещество
Бриллиант
Бриллиант — это идеально обработанный и доведённый до совершенства алмаз. У него идеальный блеск, идеальные формы, идеальный вид. Стоимость за один грамм доходит до 50 тысяч долларов или более 3 млн рублей.

Бриллиант
Плутоний
Является довольно дорогим веществом из-за слишком сложного процесса создания. Также крайне важен, поскольку используется для изготовления ядерного вооружения и на АЭС.

Плутоний
Насколько золото мягкое, и как используется это свойство металла?
По механической прочности и по своей химической стойкости этот драгметалл уступает почти всем платиноидам, но он незаменим для электрических контактов. Именно поэтому в микроэлектронике повсеместно используются гальванические покрытия и золотые проводники. В ядерных исследованиях не обходится без золота, где его используют как мишень.
Применяют его и в нейтронной бомбе в качестве нейтронной оболочки. Чистое золото настолько мягкое, что его можно поцарапать пальцем Благодаря такому свойству золота, как мягкость, ему можно придать абсолютно любую форму, оно легко поддается обработке. В ювелирном искусстве уже более чем пять тысяч лет используется золото. Ранее из него изготавливали дворцовую утварь, культовые изделия, золотили одежду. Благодаря примесям других металлов, получают золото разных цветов. Так как абсолютно очистить золото от примесей невозможно, нет стопроцентного золота. Даже на банковских слитках написано 99,99%.
Из-за мягкости металла даже в банковских слитках находится сплав золота Долгое время из золота изготавливали только украшения, но со временем оно начало играть роль средства накопления и сбережения. Кстати, золото далеко не самый дорогой металл. По данным uznayvse.ru, гораздо дороже стоит родий. Один грамм этого вещества стоит 255 долларов.
Где используется
Повседневную жизнь трудно представить без металла: железо практично, надежно, дешево. Возможно, когда-нибудь его вытеснит пластик. Сегодня в цене достоинства железного материала.

Сверхчистое железо
Промышленность
Железо нашло применение во всех формах. Сплавы – основа материалов, востребованных промышленностью. Порошок закупается тоннами для сварки, пиротехники, принтеров. Соединения – базис минеральных красок, пигмент при производстве текстиля, чернил.
Без него не обходится ни одна отрасль:
Железо – анод в железо-никелевых, железо-воздушных аккумуляторах. Из стали сделаны бытовые и профессиональные инструменты.
Другие сферы
Металл применяют в науке, медицине, быту:
Искусственные радиоактивные изотопы – маркер при анализе химико-технологических, биологических процессов.