Что значит мутация в гомозиготном состоянии
Что такое MTHFR?
У людей есть две копии гена MTHFR, каждый из которых наследуется от одного из родителей. Мутации в них могут быть гетерозиготными или гомозиготными.
Существует два распространенных типа или варианта мутации MTHFR: C677T и A1298C.
Мутации в генах MTHFR встречаются примерно у 25% людей испаноязычного происхождения и у 10–15% людей европейского происхождения.
Эти мутации часто приводят к высоким уровням гомоцистеина в крови, что может способствовать возникновению многих патологий, таких как:
· врожденные пороки развития;
· расстройства психического здоровья;
· определенные виды рака.
В этой статье мы рассмотрим мутации MTHFR более подробно, включая сопряженные с ними состояния, диагностику и способы лечения. Мы также обсудим, как мутации MTHFR могут повлиять на беременность.
Состояния, связанные с мутацией MTHFR
Мутации в гене MTHFR могут повлиять на метаболизм метионина и гомоцистеина, что может привести к неблагоприятным последствиям для здоровья.
Состояния, которые исследователи связывают с мутациями гена MTHFR, включают:
· сколиоз – аномальное искривление позвоночника;
· анемия, что означает, что у человека низкий уровень эритроцитов;
· сердечно-сосудистые заболевания, такие как тромбозы, инсульты и инфаркт миокарда;
· расстройства психического здоровья и поведения, такие как депрессия и синдром дефицита внимания и гиперактивности (СДВГ).
Возможные признаки и симптомы
Симптомы различаются как у отдельных людей, так и в зависимости от типа мутации. Люди обычно не знают, что они являются носителями мутации MTHFR, если они не испытывают серьезных симптомов или не проходят генетическое тестирование.
Наличие одной или двух мутаций MTHFR может немного увеличить уровни гомоцистеина, присутствующего в крови или моче. Это состояние называется гомоцистинурия.
Симптомы гомоцистинурии вследствие мутаций MTHFR включают в себя:
· патологии свертывания крови;
· онемение или покалывание в руках и ногах.
Врач может заподозрить, есть ли у человека мутации гена MTHFR, просмотрев его историю болезни, учитывая его текущие симптомы и выполнив медицинский осмотр. Врач может порекомендовать провести анализ крови, чтобы проверить уровень гомоцистеина.
Хотя можно идентифицировать мутацию гена MTHFR с помощью генетического тестирования, такие организации, как Американская кардиологическая ассоциация и Американский конгресс акушеров-гинекологов, не рекомендуют проводить скрининг на распространенные варианты генов MTHFR.
Медикаментозное лечение не всегда необходимо при наличии вариантов MTHFR. Изменения в питании и образе жизни зачастую способны компенсировать любые возникающие в результате дефициты питательных веществ.
Однако людям может потребоваться медицинское лечение, если у них высокий уровень гомоцистеина. Врач может предложить людям с повышенным уровнем гомоцистеина принимать следующие добавки:
Ген MTHFR регулирует, как организм обрабатывает фолат, аминокислоту в животных белках, и другие витамины группы В. Употребление пищи, богатой фолатом, может помочь купировать симптомы, вызванные мутациями MTHFR.
Богатые фолатом продукты включают в себя:
· животные и растительные белки, такие как говядина, яйца, бобы, горох и чечевица;
· овощи, в том числе шпинат, спаржа, брюссельская капуста и брокколи;
· фрукты, такие как банан, дыня, папайя и авокадо;
· обогащенные зерна, которые включают в себя рис, муку и зерновые.
Исследователям еще предстоит определить преимущества добавок фолиевой кислоты для лечения людей с мутациями MTHFR.
Влияние на беременность
Женщины с положительным результатом теста на мутацию MTHFR могут иметь повышенный риск преэклампсии, повторных выкидышей или рождения ребенка с врожденными нарушениями.
Мета-анализ 2015 года, основанный на 54 исследованиях с контролем случаев заболевания, выявил убедительные доказательства того, что женщины с генотипом MTHFR C677T имеют более высокий риск преэклампсии.
По словам исследователей, эта мутация присутствовала в 1,371 раза чаще среди женщин с преэклампсией.
В исследовании, проведенном в 2018 году, ученые обнаружили, что преждевременное прерывание беременности чаще встречалось у женщин с мутацией MTHFR C677T, чем у женщин с мутацией MTHFR A1298C.
Исследователи также отметили сильную связь между вариантами MTHFR и следующими исходами беременности:
· рождение детей с расщелиной губы или неба;
· рождение детей с сердечно-сосудистыми нарушениями;
· рождение детей с нарушениями мочевыделительной системы;
· преждевременный разрыв плодных оболочек ( ПРПО);
· преждевременная отслойка нормально расположенной плаценты.
Информационный центр по генетическим и редким заболеваниям заявляет, что исследования показывают: женщины с двумя вариантами гена C677T могут иметь более высокий риск рождения ребенка с дефектом нервной трубки.
Дефекты нервной трубки относятся к нарушениям позвоночника, головного или спинного мозга, которые присутствуют при рождении. Они обычно развиваются в течение первого месяца беременности.
Люди наследуют одну копию гена MTHFR от каждого из своих родителей, что означает, что у каждого есть два гена MTHFR. Мутации могут происходить в одном или обоих генах.
Наличие родителя или близкого родственника с мутацией гена MTHFR может увеличить риск наследования этого варианта человеком.
Люди, чьи оба родителя являются носителями мутации, имеют повышенный риск гомозиготной мутации MTHFR.
Когда обратиться к врачу
Человек должен обратиться к врачу, если он испытывает симптомы дефицита фолата или витамина B-12, которые могут включать:
· потеря аппетита или непреднамеренная потеря веса;
· онемение, покалывание или боль в руках или ногах;
· головокружение или потеря равновесия;
Человек также должен обратиться к врачу, если у него есть симптомы анемии, которые могут включать:
Наличие мутации MTHFR по-разному влияет на разных людей. Люди с одним или несколькими вариантами MTHFR могут иметь более высокие, чем обычно, уровни гомоцистеина в крови или моче.
Хотя текущие исследования выявили связи между вариантами MTHFR и многочисленными заболеваниями, необходимы дополнительные исследования, чтобы определить точное влияние этих генных мутаций на здоровье.
Люди могут поговорить со своим врачом о преимуществах и рисках генетического тестирования. Однако большинство организаций здравоохранения не рекомендуют генетическое тестирование, если человек не испытывает значительных проблем со здоровьем.
Синдром Жильбера
| молекулярно-генетический анализ промоторной области гена UGT1A1 , срок 8 р. дней UAH | Записаться |
Генетическая диагностика синдрома Жильбера
Синдром Жильбера обусловлен мутацией гена UGT1A1, кодирующего фермент глюкуронилтрансферазу. Этот ген находится на хромосоме 2 (2q37). ДНК-диагностика синдрома Жильбера проводится путем анализа числа ТА-повторов в промоторной области гена UGT1A1. В норме повторов 6. При синдроме Жильбера их больше 7 в обеих хромосомах: A(TA)7TAA / A(TA)7TAA.
Данный тест — самый быстрый и эффективный способ дифференциальной диагностики болезни с печеночными поражениями, сопровождающимися гипербилирубинемией, а также профилактики печеночных кризов, изменения образа жизни больного. Генетические анализы на синдром Жильбера рекомендуют сдавать пациентам, которым предстоит прием препаратов с гепатотоксическим эффектом.
Другие мутации этого же гена приводят к синдрому Криглера-Найара, который является более опасной формой гипербилирубинемии (высокого уровня билирубина в крови).
Ген UGT1A1 входит в Панель «Наследственные заболевания желудочно-кишечного тракта»
Как выглядит результат генетического анализа на синдром Жильбера
Высокий риск развития Синдрома Жильбера.
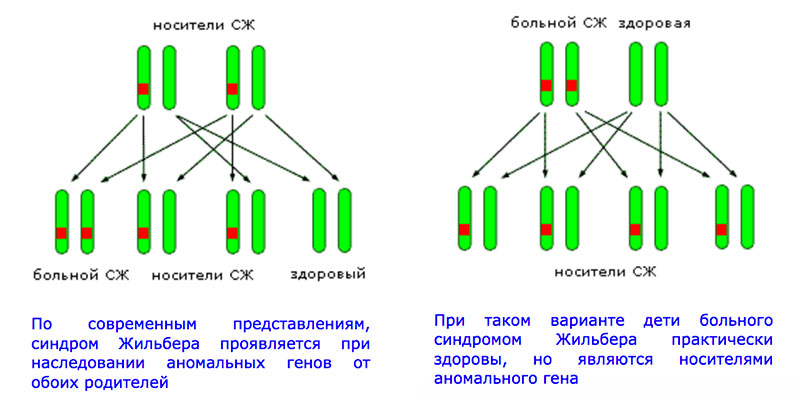
Как наследуется анормальный ген
Многие люди являются носителями анормального гена UGT1A1. Для возникновения синдрома Жильбера у ребенка, у него должны быть 2 копии гена с поломкой в промоторной области, то есть носителями аномального гена должны быть оба родителя. Синдром Жильбера наследуется по аутосомно-рецессивному типу.
Факторы риска синдрома Жильбера
Хотя синдром Жильбера присутствует с детства, он остается обычно незамеченным до подросткового возраста, поскольку выработка билирубина увеличивается во время полового созревания. Болезнь обнаруживается обычно случайно во время анализа крови. Болезнь имеет распространение 3%-10% в зависимости от популяции.
Симптомы синдрома Жильбера
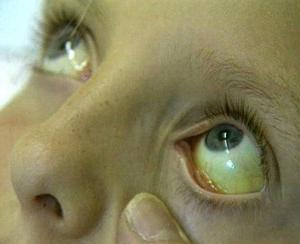
— дискомфортные ощущения в правом подреберье,
— достаточно быстрая утомляемость,
— субиктеричность и иктеричность склер (пожелтение белков глаз) и кожи,
— ксантелазмы (плоские жировые бляшки) век
— в некоторых случаях наблюдается увеличение размеров печени.
Как организм в норме обрабатывает билирубин
Билирубин проходит через печень в кишечник с желчью, а затем выделяется с калом. Небольшое количество билирубина остается в крови.
Осложнения
Низкий уровень фермента, перерабатывающего билирубин, может также увеличивать побочные эффекты некоторых медикаментов, поскольку этот фермент играет роль в выведении этих медикаментов из организма.
При синдроме Жильбера, перед приемом медикаментов следует посоветоваться с врачом. Также, некоторые виды синдрома Жильбера могут увеличивать риск развития желчно-каменной болезни.
Диагностика
При подозрении синдрома Жильбера из-за необъяснимой желтушности или повышенного уровня билирубина, доктор осматривает пациента и опрашивает про симптомы, такие как боль в брюшной полости или темная моча. Врач может рекомендовать биохимический анализ крови и анализ функции печени для исключения других проблем с печенью, которые могут быть причиной повышения билирубина.
Комбинация нормальных анализов крови, нормальных функциональных анализов печени и повышенного уровня билирубина является индикатором синдрома Жильбера. Генетическое тестирование может подтвердить диагноз.
Лечение
Синдром Жильбера обычно не требует лечения. Уровень билирубина в крови может колебаться время от времени, и иногда может возникать желтушность, которая безболезненно проходит сама по себе.
В период обострения синдрома пациенту необходимо строго соблюдать стол №5. Его суть заключается в отказе от жирных, жареных, высококалорийных и других вредных блюд. Также назначается ряд медикаментозных препаратов в виде микросомальных ферментов – Зиксорина и Фенобарбитала. Они назначаются двумя курсами по 1-2 недели с перерывом в месяц. Благодаря этим препаратам удается быстро снизить билирубин.
Образ жизни и профилактика
Синдром Жильбера при беременности
Синдром Жильбера не запрещает женщине выносить и родить ребенка. Если такое генетическое отклонение есть только у одного партнера, то у детей такое заболевание будет отсутствовать. Но такой ребенок становится носителем этого гена: он никогда не столкнется с синдромом, однако его потомство может столкнуться с таким отклонением.
Как пройти исследование
Материал для исследования: Венозная кровь с ЭДТА 4 мл.
Подготовка к анализу: нет
Дни забора (приема) материала: в часы работы медицинского центра.
Генетические нарушения у человека и методы их выявления
Генами называются участки ДНК, в которых закодирована структура всех белков в теле человека или любого другого живого организма. В биологии действует правило: «один ген – один белок», то есть в каждом гене содержится информация только об одном определенном белке.
В 1990 году большая группа ученых из разных стран начала проект под названием «Геном человека». Он завершился в 2003 году и помог установить, что человеческий геном содержит 20–25 тысяч генов. Каждый ген представлен двумя копиями, которые кодируют один и тот же белок, но могут немного различаться. Большинство генов одинаковые у всех людей – различается всего 1%.
ДНК находится в клетке внутри ядра. Она особым образом организована в виде хромосом – эти нитеподобные структуры можно рассмотреть в микроскоп с достаточно большим увеличением. Внутри хромосомы ДНК намотана на белки – гистоны. Когда гены неактивны, они расположены очень компактно, а во время считывания генетического материала молекула ДНК расплетается.
В клетках человека есть структуры, которые называются митохондриями. Они выполняют роль «электростанций» и отвечают за дыхание. Это единственные клеточные органеллы, у которых есть собственная ДНК. И в ней тоже могут возникать нарушения. 
Весь набор хромосом в клетке называется кариотипом. В норме у человека он представлен 23 парами хромосом, всего их 46. Выделяют два вида хромосом:
Методы исследования хромосом
Для исследования кариотипа применяют специальный метод – световую микроскопию дифференциально окрашенных метафазных хромосом культивированных лимфоцитов периферической крови.
Этот анализ применяется для диагностики различных хромосомных заболеваний. Он позволяет выявлять такие нарушения, как:
Однако с помощью исследования кариотипа можно выявить не все генетические нарушения. Оно не способно обнаружить такие изменения, как:

Для получения дополнительной информации, не видимой в световой микроскоп, используют хромосомный микроматричный анализ (ХМА). С его помощью можно изучить все клинически значимые участки генома и выявить изменения в количестве и структуре хромосом, а именно микрополомки (микроделеции и микродупликации).
Во время хромосомного микроматричного анализа применяют технологию полногеномной амплификации и гибридизации фрагментов опытной ДНК с олигонуклеотидами, нанесенными на микроматрицу. Если объяснять простыми словами, то сначала ДНК, которую необходимо изучить, копируют, чтобы увеличить ее количество, а затем смешивают ее со специальными ДНК-микрочипами, которые помогают выявлять различные нарушения.
Эта методика позволяет в одном исследовании выявлять делеции и дупликации участков ДНК по всему геному. Разрешающая способность стандартного ХМА от 100 000 пар нуклеотидов – «букв» генетического кода (в отдельных регионах от 10 000 п. н.).
С помощью ХМА можно выявлять:
Однако, как и предыдущий метод, хромосомный микроматричный анализ имеет некоторые ограничения. Он не позволяет выявлять или ограничен в выявлении таких аномалий, как:
Мутации в генах и заболевания, к которым они способны приводить
Мутации – это изменения, которые происходят в ДНК как случайным образом, так и под действием разных факторов, например химических веществ, ионизирующих излучений. Они могут затрагивать как отдельные «буквы» генетического кода, так и большие участки генома. Мутации происходят постоянно, и это основной двигатель эволюции. Чаще всего они бывают нейтральными, то есть ни на что не влияют, не приносят ни вреда, ни пользы. В редких случаях встречаются полезные мутации – они дают организму некоторые преимущества. Также встречаются вредные мутации – из-за них нарушается работа важных белков, наоборот, происходят достаточно часто. Генетические изменения, которые происходят более чем у 1% людей, называются полиморфизмами – это нормальная, естественная изменчивость ДНК Полиморфизмы ответственны за множество нормальных отличий между людьми, таких как цвет глаз, волос и группа крови.
Все внешние признаки и особенности работы организма, которые человек получает от родителей, передаются с помощью генов. Это важнейшее свойство всех живых организмов называется наследственностью. В зависимости от того, как проявляются гены в тех или иных признаках, их делят на две большие группы.
Например, карий цвет глаз у человека является доминантным. Поэтому у кареглазых родителей с высокой вероятностью родится кареглазый ребенок. Если у одного из родителей глаза карие, а у другого голубые, то вероятность рождения кареглазых детей в такой семье тоже высока. У двух голубоглазых родителей, скорее всего, все дети тоже будут голубоглазыми. А вот у кареглазых родителей может родиться ребенок с голубыми глазами, если у обоих есть рецессивные «гены голубоглазости», и они достанутся ребенку. Конечно, это упрощенная схема, потому что за цвет глаз отвечает не один, а несколько генов, но на практике эти законы наследования зачастую работают. Аналогичным образом потомству могут передаваться и наследственные заболевания.
Как выявляют рецессивные мутации?
Для выявления мутаций, которые передаются рецессивно, используют целый ряд исследований.
Секвенирование по Сэнгеру – метод секвенирования (определения последовательности нуклеотидов, буквально – «прочтение» генетического кода) ДНК, также известен как метод обрыва цепи. Анализ используется для подтверждения выявленных мутаций. Это лучший метод для идентификации коротких тандемных повторов и секвенирования отдельных генов. Метод может обрабатывать только относительно короткие последовательности ДНК (до 300–1000 пар оснований) одновременно. Однако самым большим недостатком этого метода является большое количество времени, которое требуется для его проведения.
Если неизвестно, какую нужно выявить мутацию, то используют специальные панели.
Панель исследования — тестирование на наличие определенных мутаций, входящих в перечень конкретной панели исследования. Анализ позволяет выявить одномоментно разные мутации, которые могут приводить к генетическим заболеваниям. Анализ позволяет компоновать мутации в панели по частоте встречаемости (скрининговые панели, направленные на выявление носительства патологической мутации, часто встречаемой в данном регионе или в определенной замкнутой популяции) и по поражаемому органу или системе органов (панель «Патология соединительной ткани»). Но и у этого анализа есть ограничения. Анализ не позволяет выявить хромосомные аберрации, мозаицизм и мутации, не включенные в панель, митохондриальные заболевания, а также эпигенетические нарушения.
Не в каждой семье можно отследить все возможные рецессивные заболевания. Тогда на помощь приходит секвенирование экзома – тест для определения генетических повреждений (мутаций) в ДНК путем исследования в одном тесте практически всех областей генома, кодирующих белки, изменения которых являются причиной наследственных болезней.
Секвенирование следующего поколения-NGS – определение последовательности нуклеотидов в геномной ДНК или в совокупности информационных РНК (транскриптоме) путем амплификации (копирования) множества коротких участков генов. Это разнообразие генных фрагментов в итоге покрывает всю совокупность целевых генов или, при необходимости, весь геном.
Анализ позволяет выявить точечные мутации, вставки, делеции, инверсии и перестановки в экзоме. Анализ не позволяет выявить большие перестройки; мутации с изменением числа копий (CNV); мутации, вовлеченные в трехаллельное наследование; мутации митохондриального генома; эпигенетические эффекты; большие тринуклеотидные повторы; рецессивные мутации, связанные с Х-хромосомой, у женщин при заболеваниях, связанных с неравномерной Х-деактивацией, фенокопии и однородительские дисомии, и гены, имеющие близкие по структуре псевдогены, могут не распознаваться.
Что делать, если в семье есть наследственное заболевание?
Существуют два способа выявить наследственные генетические мутации у эмбриона:
Предимплантационное генетическое тестирование (ПГТ) в цикле ЭКО. Это диагностика генетических заболеваний у эмбриона человека перед имплантацией в слизистую оболочку матки, то есть до начала беременности. Обычно для анализа проводится биопсия одного бластомера (клетки зародыша) у эмбриона на стадии дробления (4–10 бластомеров). Существует несколько видов ПГТ: на хромосомные отклонения, на моногенные заболевания и на структурные хромосомные перестройки. Данные Simon с соавторами (2018) говорят о том, что в случае проведения ЭКО с ПГТ у пациентки 38–40 лет результативность ЭКО составляет 60%. Но при исследовании эмбриона есть ряд ограничений. Так, из-за ограниченного числа клеток можно не определить мозаицизм.
Если нет возможности провести ЭКО с ПГТ, то используют второй вариант – исследование плодного материала во время беременности.
Для забора плодного материала используют инвазивные методы:
Далее эти клетки исследуют при помощи одного или нескольких генетических тестов (которые имеют свои ограничения). Проведение инвазивных методов может быть связано с риском для беременности порядка 1%.
Таким образом, проведя дополнительные исследования, можно значительно снизить риск рождения ребенка с генетическим заболеванием в конкретной семье. Но привести этот риск к нулю на сегодняшний день, к сожалению, невозможно, так как любой генетический тест имеет ряд ограничений, что делает невозможным исключить абсолютно все генетические болезни.

Автор статьи
Пелина Ангелина Георгиевна
Ведёт генетическое обследование доноров Репробанка, осуществляет подбор доноров для пар, имеющих ранее рождённых детей с установленной генетической патологией.
Генетическая диагностика синдрома Жильбера, UGT 1A1
Генетическая диагностика синдрома Жильбера заключается в анализе количества повторов динуклеотидной последовательности тимидин-аденин (ТА)- гена, кодирующего фермент УДФГТ или уридиндифосфатглюкуронидазу, который отвечает за превращение молекулы билирубина в водорастворимую форму. Место расположения гена – хромосома 2. Мутировавший участок гена приводит не только к формированию синдрома Жильбера, но и провоцирует синдром Криглера-Найяра (описано ниже), преходящую желтуху новорожденных, повышенный сывороточный билирубин.
Описание
Характерен астенический синдром с вегетативными расстройствами – утомляемость, слабость, нарушения засыпания, потливость, дискомфорт в сердце. Если повышенный уровень билирубина держится долго, развивается депрессия.
Уровень билирубина повышается изолированно, чаще до 100 ммоль/л, преобладает прямая (несвязанная) фракция, остальные печеночные пробы не изменяются.?
Механизм развития желтухи следующий. В результате распада эритроцитов образуется прямой билирубин, он циркулирует в крови. В норме в клетках печени прямой билирубин захватывается глюкуроновой кислотой и становится непрямым. «Командует» связыванием прямого билирубина фермент УДФГТ, активность которого при синдроме Жильбера снижена на 25-30%. Билирубин, оставшийся несвязанным, накапливается в тканях, вызывая их повреждение. Лечение симптоматическое – диета №5 (ограничение жирного, жареного, содержащего холестерин, много овощей и фруктов), покой, по назначению врача гепатопротекторы.
Фермент УДФГТ синтезируется по коду, который задает ген UGT 1A1. Синдром Жильбера – это мутация промоторной области (участок нуклеотидов, с которого начинается кодирующая часть), вместо 6 ТА-повторов обнаруживается 7 или реже 8.
Мутация – это изменение генотипа, которое передается потомкам. Генотип – это набор генов, который уникален и неповторим у каждого человека. Мутация гена UGT 1A1 передается по аутосомно-доминантному типу. Это значит, что дефектный ген не содержится в половых хромосомах, мог быть передан как от отца, так и от матери. Дети обоих полов могут болеть с одинаковой частотой.
Имеет значение тип мутации – гомо- или гетерозиготная. Нужно вспомнить, что каждый организм имеет два набора хромосом – от отца и от матери. Гомозиготная мутация (в переводе с греческого «равная, одинаковая яйцеклетка») – такая, при которой пара хромосом имеет одинаковую форму гена. Гетерозиготная мутация отличается тем, что форма генов в паре разная.
При гомозиготной мутации или одинаковой паре генов клиническая картина выражена тяжелее, уровень билирубина максимально высокий. При гетерозиготной форме повышение билирубина обнаруживается случайно, клинических проявлений нет. Бессимптомное течение отмечается в более чем половине случаев синдрома Жильбера.
В группе риска находятся все люди, у которых есть родственники с синдромом Жильбера. Вылечить его невозможно, нужно ограничивать нагрузки на печень, избегать провоцирующих факторов. Продолжительности жизни синдром Жильбера не уменьшает, влияние на качество жизни минимальное. Это особенность организма, с которой нужно считаться, чтобы не навредить себе.
Определять наличие мутантного гена нужно перед началом лечения препаратами, оказывающими токсическое действие. У людей с синдромом Жильбера могут быть тяжелые интоксикационные реакции при приеме многих групп лекарств: глюкокортикоидных и половых гормонов, кофеина, некоторых антибиотиков, аспирина, парацетамола. Особенно это касается приема нового цитостатика Иринотекана, чрезвычайно эффективного при раке толстой кишки.
Специалисты ЦЭЛТ предпочитают полностью обследовать пациента перед сложным лечением во избежание неприятных неожиданностей.