Что значит экзотермическая реакция в химии
Процесс экзотермической реакции, типы и примеры
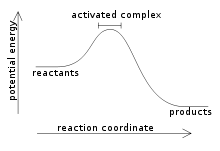
экзотермическая реакция это тип химической реакции, при которой происходит передача энергии, главным образом в форме выделения тепла или света. Название происходит от греческого префикса экзо, что означает «за границей»; и термин «термический», который относится к теплу или температуре.
В этом смысле экзотермические реакции могут передавать другие виды энергии в окружающую среду, где они генерируются, например, при взрывах и способе передачи кинетической и звуковой энергии, когда вещества, находящиеся в газовой фазе при высоких температурах, расширяются. насильственный путь.
Таким же образом, в случае использования батарей, также проводится экзотермическая реакция, только в этом случае транспортируется электрическая энергия..
процесс
Ранее было упомянуто, что когда происходит экзотермическая реакция, происходит выделение энергии, которое можно легче визуализировать в следующем уравнении:
Реагенты (ы) → Продукт (ы) + Энергия
Таким образом, для количественного определения энергии, поглощаемой или выделяемой системой, используется термодинамический параметр, называемый энтальпией (обозначается буквой «H»). Если в системе (в данном случае, химической реакции) происходит выделение энергии в окружающую среду, то изменение энтальпии (выраженное как ΔH) будет иметь отрицательное значение.
В противном случае, если изменение этой меры является положительным, оно отражает поглощение тепла из окружающей среды. Кроме того, величина изменения энтальпии системы является выражением количества энергии, передаваемой в окружающую среду или из нее..
Чем больше величина ΔH, тем больше выделение энергии из системы в окружающую среду.
Это происходит потому, что в этих реакциях чистая энергия, которая выделяется при создании новых связей, больше, чем чистая энергия, используемая при фрагментации связей.
Из вышесказанного можно сделать вывод, что такого рода реакции очень распространены, поскольку продукты реакции имеют количество энергии, запасенное в связях, больше, чем то, что содержится в реагентах..
тип
Существуют различные виды экзотермических реакций в различных областях химии, будь то в лаборатории или в промышленности; некоторые выполняются спонтанно, а другие требуют особых условий или какого-либо типа вещества, такого как катализатор, который будет произведен.
Ниже приведены наиболее важные виды экзотермических реакций:
Реакции горения
Реакции горения представляют собой реакции окислительно-восстановительного типа, которые происходят, когда одно или несколько веществ вступают в реакцию с кислородом, обычно приводя к выделению света и тепловой энергии, то есть света и тепла, когда возникает пламя..
Реакции нейтрализации
Реакции нейтрализации характеризуются взаимодействием между кислотой и щелочным веществом (основанием) с образованием соли и воды, которые проявляют экзотермическую природу..
Реакции окисления
Существует много реакций такого типа, которые демонстрируют экзотермическое поведение, потому что окисление кислорода вызывает выделение большого количества энергии, как это происходит при окислении углеводородов..
Термитная реакция
Эта реакция может давать температуру около 3000 ° C, и из-за высокого сродства алюминиевого порошка с большим количеством оксидов металлов его используют при сварке стали и железа.
Реакция полимеризации
Этот тип реакции возникает тогда, когда реагирует определенное количество химических веществ, называемых мономерами, которые представляют собой единицы, которые при объединении повторяются в цепочках с образованием макромолекулярных структур, называемых полимерами..
Реакция ядерного деления
Этот процесс относится к разделению ядра атома, считающегося тяжелым, то есть с массовым числом (А), превышающим 200, для получения фрагментов или ядер меньшего размера с промежуточной массой..
В этой реакции, где образуются один или несколько нейтронов, выделяется большое количество энергии, потому что ядро с большим весом имеет более низкую стабильность, чем его продукты..
Другие реакции
Существуют также другие экзотермические реакции, имеющие большое значение, такие как обезвоживание некоторых углеводов при взаимодействии с серной кислотой, поглощение воды, в которой гидроксид натрия находится на открытом воздухе, или окисление металлических частиц во многих реакциях коррозии..
примеров
Ниже приведены некоторые примеры экзотермических реакций, которые вызывают изменение энтальпии, которое имеет отрицательное значение из-за того, что они выделяют энергию, как упомянуто выше..
Например, сгорание пропана является спонтанной экзотермической реакцией:
Другой случай экзотермического поведения показан реакцией нейтрализации между карбонатом натрия и соляной кислотой:
Представлено также окисление этанола в уксусную кислоту, используемое в алкотестерах, полная реакция которых показана в следующем уравнении:
Другим классом экзотермической реакции является так называемая термитная реакция, в которой алюминий объединяется с оксидом металла, как показано ниже:
В дополнение к объясненным выше примерам существует множество различных реакций, которые также считаются экзотермическими, такие как разложение определенных органических отходов для компостирования..
Это также подчеркивает окисление люциферинового пигмента под действием фермента люциферазы, чтобы произвести биолюминесценцию, характерную для светлячков, и даже дыхание, среди многих других реакций.
Экзотермические и эндотермические реакции.
Химическая реакция заключается в разрыве одних и образовании других связей,поэтому она сопровождается выделением или поглощением энергии в виде теплоты,света, работы расширения образовавшихся газов.
По признаку выделения или поглощения теплоты реакции делятся на экзотермические и эндотермические.
— химическая реакция, при которой происходит выделение теплоты.
Например, в реакции горения метана
Тот факт, что в этой реакции выделяется теплота, можно отразить в уравненииреакции:
Это так называемое
Здесь символ «+Q» означает,что при сжигании метана выделяется теплота. Эта теплота называется
Термохимическое уравнение реакции
— уравнение реакции, включающее тепловой эффект реакции, рассчитанный на количества вещества, задаваемые коэффициентами этого уравнения.
Тепловой эффект таких реакций отрицательный.
Наряду с тепловым эффектом термохимические процессы очень часто характеризуют разностью энтальпий ∆H продуктов реакции и исходных веществ.
— это определенное свойство вещества, оно является мерой энергии, накапливаемойвеществом при его образовании.
Процессы, протекающие при постоянном давлении,встречаются гораздо чаще, чем те, которые протекают при постоянном объеме, так как большинство из них проводится в открытых сосудах. Доказано, что в химических процессах, протекающих при постоянном давлении, выделившееся (или поглощенное) тепло есть мера уменьшения (или соответственно увеличения) энтальпии реакции ∆ H.
Термохимические уравнения.
На первых этапах изучения химии вы часто пользовались равным по абсолютной величине и противоположным по знаку обозначением,например:
В справочных таблицах обычно приводят не значениявеличины Q, а значения величины ∆H, измеренные приопределенных условиях (чаще всего при 298 К); их обозначают ∆H0.
Теплота образования химических соединений.
Теплотой образования соединения называется количество теплоты, которое выделяется или поглощаетсяпри образовании одного моля химического соединения из простых веществ пристандартных условиях (р = 10 5 Па, T = 298 К).
Тепловые эффекты химической реакции. Основные законы термохимии.
Количество теплоты, которое выделяется или поглощается врезультате реакций между определенными количествами реагентов, называют тепловым эффектом химическойреакции и обычно обозначают символом Q.
вещества называется тепловой эффект сгорания 1 моля этого вещества
Изменение энтальпии ∆Н зависит отдавления и температуры. Поэтому для того, чтобы облегчить сравнениетермохимических данных для различных реакций, были приняты определенныестандартные состояния (условия).
При написании термохимических уравнений твердое вещество, жидкость и газобязательно обозначаются символами (тв), (ж) и (г) соответственно, посколькуизменение энтальпии зависит от агрегатного состояния реагирующих веществ ипродуктов реакции.
Стандартное состояние всегда относится к 298 К.
Так, например,термохимическое уравнение образования воды из водорода и кислорода записываетсяследующим образом:
Значение 286 кДж является теплотой образования воды встандартных условиях и означает, что при образовании 1 моля воды выделяется 286 кДж теплоты: Отметим, что значение теплоты образования газообразнойводы уже будет иным.
Закон Гесса и его следствия.
Важнейшим законом, на котором основано большинство термохимических расчетов, является закон Гесса (его называют также законом суммы тепловых эффектов).
Тепловой эффект химической реакции зависит от состояния исходных веществ и продуктов реакции, но не зависит от промежуточных стадий реакций.
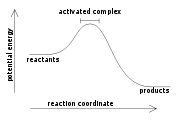
Экзотермические реакции
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты. Противоположна эндотермической реакции.
Полное количество энергии в химической системе чрезвычайно трудно измерить или подсчитать. С другой стороны, изменение энтальпии ΔH в химической реакции гораздо легче измерить или сосчитать. Для этих целей используют калориметры. Измеренное значение ΔH соотносится с энергией связи молекул следующим образом:
ΔH = энергия, потраченная на разрыв связей (Энергия разрыва химической связи)— энергия, выделенная при образовании связей продуктов реакции.
Для экзотермических реакций эта формула даёт отрицательное значение для ΔH, так как большее значение вычитается из меньшего значения. При сгорании водорода, например:
изменение энтальпии равно ΔH = −483.6 кДж на один моль O2.
Примеры
См. также
Полезное
Смотреть что такое «Экзотермические реакции» в других словарях:
Экзотермические реакции — (от экзо. и греч. therme тепло), биохимические реакции, сопровождающиеся потерей энергии (например, диссимиляция углеводов при дыхании, гидролиз жиров). Ср. Эндотермические реакции. Экологический энциклопедический словарь. Кишинев: Главная… … Экологический словарь
экзотермические реакции — – реакции, протекающие с выделением тепловой энергии. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Экзотермические реакции — – химическая реакция, при которой из реагирующей системы в окружающую среду выделяется тепло. [Терминологический словарь по бетону и железобетону. ФГУП «НИЦ «Строительство» НИИЖБ и м. А. А. Гвоздева, Москва, 2007 г. 110 стр.] Рубрика… … Энциклопедия терминов, определений и пояснений строительных материалов
экзотермические реакции — [exothermic reactions] химические реакции с выделением теплоты (ΔH Энциклопедический словарь по металлургии
реакции метанирования — Экзотермические реакции процесса газификации [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN methanation reactions … Справочник технического переводчика
Реакции химические — Химическая реакция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются … Википедия
Реакции — [reactions]: Смотри также: эндотермические реакции химические реакции экзотермические реакции радиационно химические реакции … Энциклопедический словарь по металлургии
экзотермические реакция — – химические реакции, идущие с выделением тепла. Словарь по аналитической химии [3] … Химические термины
Реакции химические — превращения одних веществ в другие, отличные от исходных по химическому составу или строению. Общее число атомов каждого данного элемента, а также сами химические элементы, составляющие вещества, остаются в Р. х. неизмененными; этим Р. х … Большая советская энциклопедия
Химические реакции — Этим термином называется тот процесс, во время которого взятые тела превращаются в новые, ранее не существовавшие. В русском языке мы имеем два слова для выражения этого понятия: X. взаимодействие и X. превращение. Из них нужно отдать… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Экзотермическая реакция
Экзотермическая реакция
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты. Противоположна эндотермической реакции.
Полное количество энергии в химической системе чрезвычайно трудно измерить или подсчитать. С другой стороны, изменение энтальпии ΔH в химической реакции гораздо легче измерить или сосчитать. Для этих целей используют калориметры. Измеренное значение ΔH соотносится с энергией связи молекул следующим образом:
ΔH = энергия, потраченная на разрыв связей — энергия, выделенная при образовании связей продуктов реакции.
Для экзотермических реакций эта формула даёт отрицательное значение для ΔH, так как большее значение вычитается из меньшего значения. При сгорании водорода, например:
изменение энтальпии равно ΔH = −483.6 кДж на один моль O2.
Примеры
См. также
Полезное
Смотреть что такое «Экзотермическая реакция» в других словарях:
ЭКЗОТЕРМИЧЕСКАЯ РЕАКЦИЯ — ЭКЗОТЕРМИЧЕСКАЯ РЕАКЦИЯ, ХИМИЧЕСКАЯ РЕАКЦИЯ, при которой вырабатывается тепло и поднимается температура. Наглядным примером такой реакции является ГОРЕНИЕ. см. также ЭНДОТЕРМИЧЕСКАЯ РЕАКЦИЯ … Научно-технический энциклопедический словарь
ЭКЗОТЕРМИЧЕСКАЯ РЕАКЦИЯ — химическая реакция, сопровождающаяся выделением теплоты (напр., горение). См. также Эндотермическая реакция … Российская энциклопедия по охране труда
ЭКЗОТЕРМИЧЕСКАЯ РЕАКЦИЯ — (от экзо. и греч. therme тепло) химическая реакция (напр., горение), при которой из реагирующей системы в окружающую среду выделяется тепло … Большой Энциклопедический словарь
экзотермическая реакция — Химическая реакция, сопровождающаяся выделением теплоты. [Сборник рекомендуемых терминов. Выпуск 103. Термодинамика. Академия наук СССР. Комитет научно технической терминологии. 1984 г.] Тематики термодинамика Обобщающие термины определения… … Справочник технического переводчика
экзотермическая реакция — (от экзо. и греч. thérmē тепло), химическая реакция (например, горение), при которой в реагирующей системе выделяется теплота. * * * ЭКЗОТЕРМИЧЕСКАЯ РЕАКЦИЯ ЭКЗОТЕРМИЧЕСКАЯ РЕАКЦИЯ, химическая реакция (например, горение), при которой из… … Энциклопедический словарь
Экзотермическая реакция — Exothermic reaction Экзотермическая реакция. Реакция, с выделением тепла, типа горения топлива или в результате химического взаимодействия полимеров на основе смол. (Источник: «Металлы и сплавы. Справочник.» Под редакцией Ю.П. Солнцева; НПО… … Словарь металлургических терминов
экзотермическая реакция — egzoterminė reakcija statusas T sritis chemija apibrėžtis Reakcija, kurios metu išsiskiria šiluma. atitikmenys: angl. exothermic reaction rus. экзотермическая реакция … Chemijos terminų aiškinamasis žodynas
экзотермическая реакция — egzoterminė reakcija statusas T sritis fizika atitikmenys: angl. exothermal reaction; exothermic reaction vok. exotherme Reaktion, f; wärmeabgebende Reaktion, f; wärmegebende Reaktion, f rus. экзотермическая реакция, f pranc. réaction… … Fizikos terminų žodynas
экзотермическая реакция — egzoterminė reakcija statusas T sritis Energetika apibrėžtis Cheminė reakcija, kuriai vykstant į aplinką išsiskiria šiluma. Tai kuro deginimas, cheminių junginių susidarymo reakcijos. atitikmenys: angl. exothermic reaction vok. exotherme Reaktion … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
Экзотермическая реакция — (от Экзо. и греч. thérmó тепло, жар) химическая реакция, сопровождающаяся выделением теплоты. Э. р. являются, например, Горение, Нейтрализация, большинство реакций образования химических соединений из простых веществ (См. Простое… … Большая советская энциклопедия
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.