Что значит число неспаренных электронов
В химия, неспаренный электрон является электрон что занимает орбитальный из атом по отдельности, а не как часть электронная пара. Каждая атомная орбиталь атома (заданная тремя квантовые числа n, l и m) может содержать два электрона (электронная пара) с противоположным спины. Поскольку образование электронных пар часто является энергетически выгодным, либо в виде химическая связь или как одинокая пара, неспаренные электроны относительно редки в химии, потому что объект, несущий неспаренный электрон, обычно довольно реактивен. В органическая химия они обычно возникают ненадолго во время реакции на сущность, называемую радикальный; однако они играют важную роль в объяснении путей реакции.
Радикалы необычны в химии s- и p-блоков, поскольку неспаренный электрон занимает валентность p орбиталь или sp, sp 2 или sp 3 гибридный орбитальный. Эти орбитали сильно направлены и поэтому перекрываются, образуя прочные ковалентные связи, благоприятствуя димеризация радикалов. Радикалы могут быть стабильными, если димеризация приведет к слабой связи или неспаренные электроны стабилизируются с помощью делокализация. Напротив, радикалы в химии d- и f-блоков очень распространены. Менее направленные, более диффузные d- и f-орбитали, в которых находятся неспаренные электроны, перекрываются менее эффективно, образуют более слабые связи, и, таким образом, димеризация обычно нежелательна. Эти d- и f-орбитали также имеют сравнительно меньшую радиальную протяженность, что не способствует перекрытию для образования димеров. [1]
Существуют относительно более стабильные объекты с неспаренными электронами, например то оксид азота у молекулы есть один. В соответствии с Правило Хунда, спины неспаренных электронов выровнены параллельно, и это дает этим молекулам парамагнитный характеристики.
Наиболее стабильные примеры неспаренных электронов находятся на атомах и ионах лантаноиды и актиниды. Неполная f-оболочка этих сущностей не очень сильно взаимодействует с окружающей средой, в которой они находятся, и это препятствует их объединению. Ионы с наибольшим числом неспаренных электронов Б-г 3+ и См 3+ с семью неспаренными электронами.
Непарный электрон имеет магнитный дипольный момент, в то время как электронная пара не имеет дипольного момента, потому что два электрона имеют противоположные спины, поэтому их магнитные дипольные поля находятся в противоположных направлениях и сокращаются. Таким образом, атом с неспаренными электронами действует как магнитный диполь и взаимодействует с магнитное поле. Только элементы с неспаренными электронами обнаруживают парамагнетизм, ферромагнетизм, и антиферромагнетизм.
Атомы и электроны
Атомно-молекулярное учение
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Разница между парными и неспаренными электронами
Парные электроны в атоме встречаются как пары на орбитали, но неспаренные электроны не встречаются как электронные пары или пары. В ключевое отличие между парными и неспаренными электронами заключаетс
Содержание:
Парные электроны в атоме встречаются как пары на орбитали, но неспаренные электроны не встречаются как электронные пары или пары. В ключевое отличие между парными и неспаренными электронами заключается в том, что парные электроны вызывают диамагнетизм атомов, тогда как неспаренные электроны вызывают парамагнетизм или ферромагнетизм в атомах.
Что такое парные электроны?
Более того, если мы рассмотрим магнитные свойства химического элемента, то можно выделить три основных типа магнетизма: диамагнитные, парамагнитные и ферромагнитные элементы. Этот магнетизм в основном зависит от количества неспаренных электронов. Следовательно, спаренные электроны не вносят вклада в магнетизм. Тогда мы можем назвать химические элементы, у которых все электроны спарены, как диамагнитные химические элементы; диамагнетизм означает, что он не притягивается к магнитному полю.
Что такое неспаренные электроны?
Парамагнитные материалы имеют мало неспаренных электронов, в то время как ферромагнитные материалы имеют больше неспаренных электронов; таким образом, ферромагнитные материалы притягиваются к магнитному полю в большей степени, чем парамагнитные материалы. Когда атом или молекула имеет этот тип электронов, мы называем это свободным радикалом. Химические элементы, содержащие эти электроны, обладают высокой реакционной способностью. Это потому, что они стремятся спарить все свои электроны, чтобы стать стабильными; наличие неспаренного электрона нестабильно.
В чем разница между парными и неспаренными электронами?
Электроны находятся на атомных орбиталях. Они свободно перемещаются вокруг ядра атома. Эти электроны могут быть двух типов: спаренные или неспаренные. Разница между парными и неспаренными электронами состоит в том, что спаренные электроны вызывают диамагнетизм атомов, тогда как неспаренные электроны вызывают парамагнетизм или ферромагнетизм в атомах.
Разбор Задания №1 ЕГЭ по ХИМИИ
В Задании №1 нам необходимо уметь хорошо пользоваться таблицей Менделеева. Первое задание — это поиск атома или иона с заданной конфигурацией электронов, обычно это количество электронов на внешнем уровне (соответствует номеру группы).
Тематика заданий: электронная конфигурация атомов
Примерное время выполнения: 1 мин.
Разбор типовых вариантов заданий №1 ЕГЭ по химии
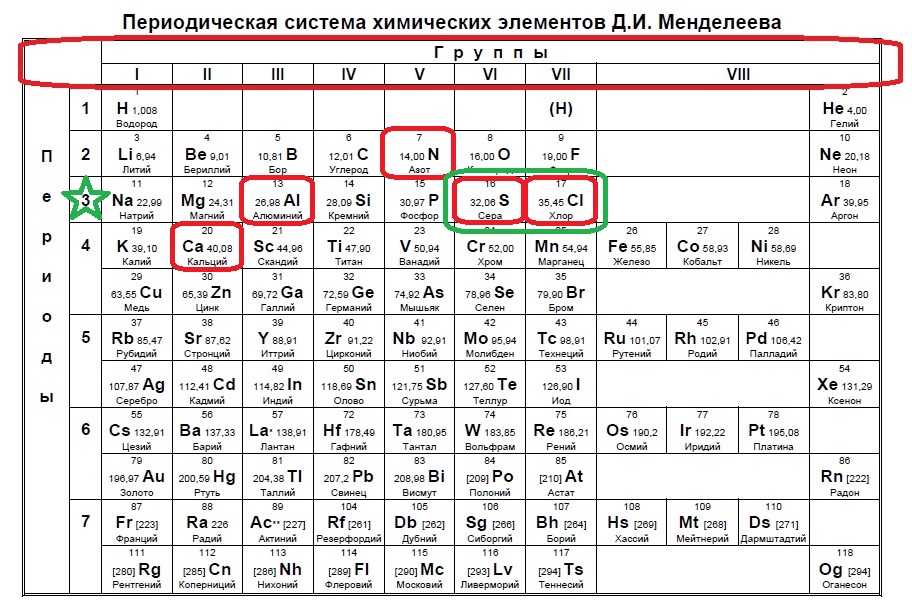
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне пять электронов.
Данный пример — типичный вариант первого задания — необходимо определить количество электронов на внешнем уровне. Вспоминаем, что на количество электронов на внешнем уровне указывает номер ГРУППЫ:
Напомню, что нам важно обращать внимание на то, в главной или побочной группе находится элемент. К сожалению, в таблице, которая дана на ЕГЭ нет деления на главные или побочные группы (какие-то элементы пишут правее, какие-то левее, но это не деление на главные и побочные группы), данная таблица не удобна, однако, по правилам можно пользоваться только ей. Обсуждать недостатки данной таблицы мы не будем, скажем лишь, что в условиях задания представлены всегда элементы главных групп, поэтому данный вопрос отпадает сам собой на экзамене (но нет гарантий, что не могут дать определить количество внешних электронов у кобальта, например, по номеру группы в данной таблице это не определишь).
Итак, находим наши пять элементов из условия:
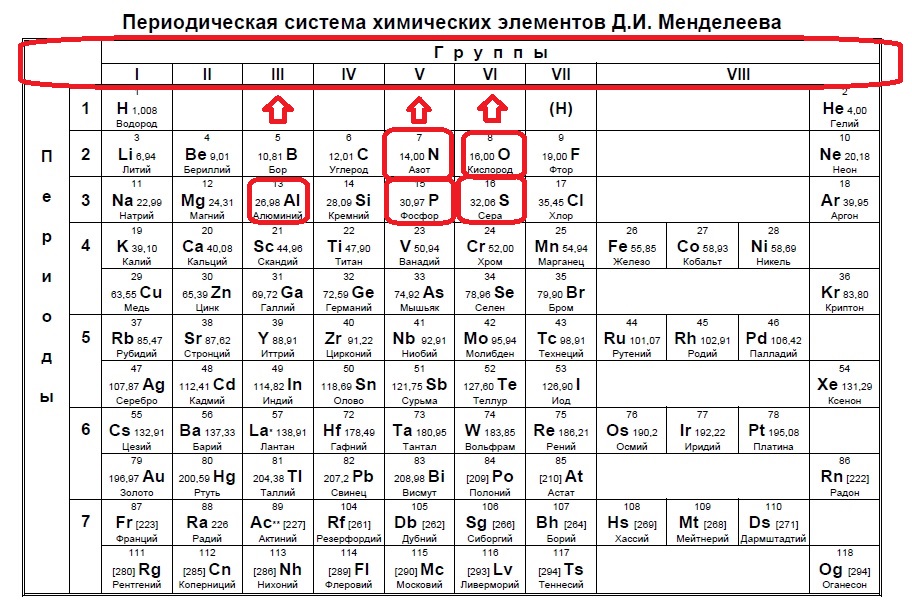
Определяем номер группы — у алюминия 3 группа, у азота и фосфора — пятая, у кислорода и серы — шестая.
В условии нас спрашивают про пять электронов — значит выбираем элементы из пятой группы — азот и фосфор!
Определите, двум атомам каких из указанных элементов до завершения внешнего уровня не хватает шести электронов.
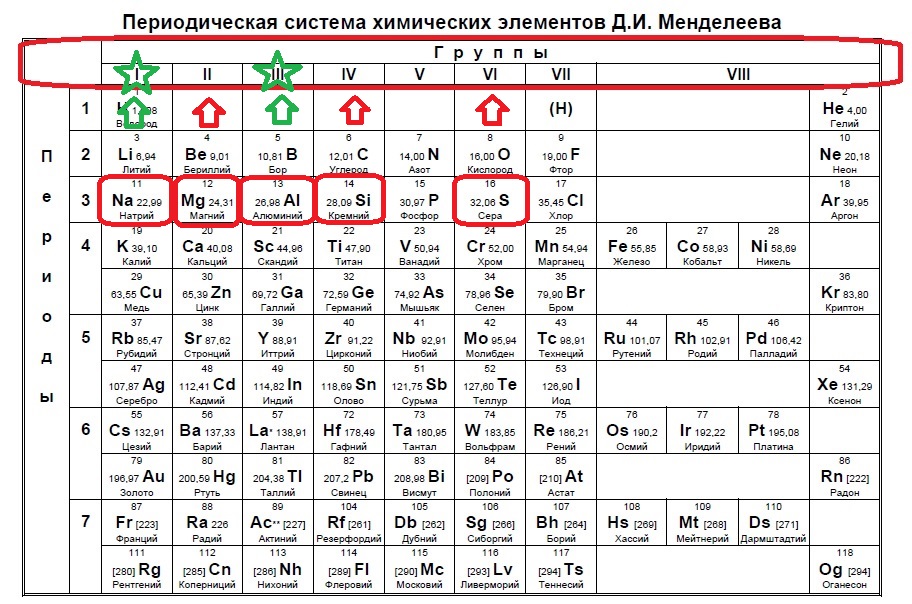
Данное задание немного другого типа, в нем необходимо определить элементы, которым не хватает какого-то количества электронов до завершения внешнего уровня. В этом случае наш алгоритм прост: мы знаем, что на внешнем уровне должно быть 8 электронов (2 и 3 период, или главные группы 4,5,6.. — в заданиях в основном фигурируют именно эти элементы), а значит вычитаем из 8 заданное число — в нашем случае 6: 8-6=2. Значит, в нашем элементе должно быть два электрона на внешнем уровне и, следовательно, расположен он во второй группе. Определяем группы элементов из условия:
В данном случае элементы второй группы — магний и барий.
Определите, атомы каких двух из указанных в ряду элементов в основном состоянии содержат один неспаренный электрон.
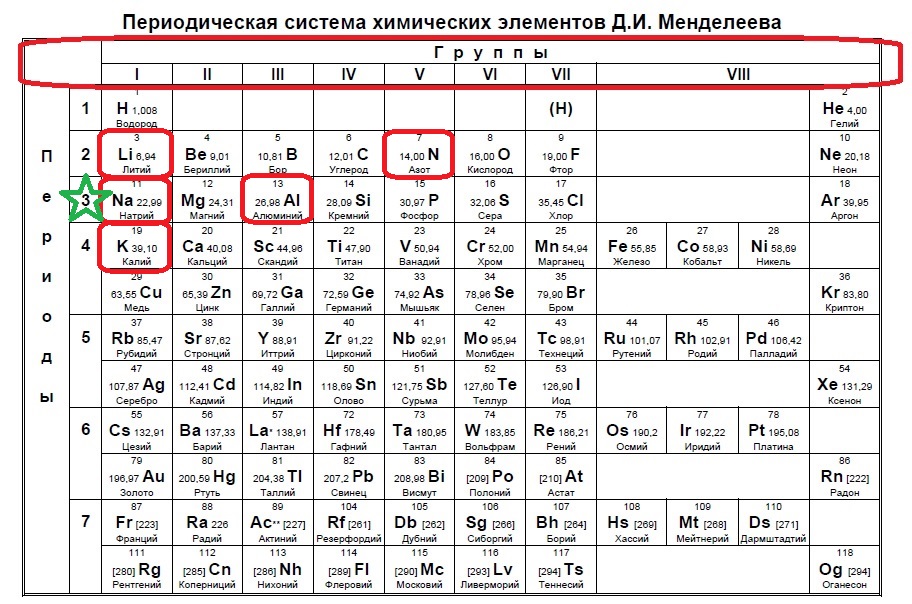
Итак, натрий в первой группе, магний во второй, алюминий в третьей, кремний в четвертой, а сера в шестой.
Выбираем элементы в нечетных группах — это натрий и алюминий!
Определите, атомы каких двух из указанных в ряду элементов в основном состоянии содержат два неспаренных электрона.
В нашем случае это углерод и сера.
Определите, какие два из указанных элементов образуют устойчивый положительный ион, содержащий 10 электронов.
В данном варианте задания речь идет уже об ионе, причем положительном, который содержит 10 электронов. В такого вида заданиях необходимо определить, сколько заполнено уровней у иона в зависимости от количества электронов. В нашем случае 10 электронов — это полностью заполненные первый (2) и второй (8) уровни (или периоды в таблице). Так мы говорим о положительном ионе — значит элемент потерял электроны, но у него их было больше чем 10, а значит, он расположен в третьем периоде. Ищем такие элементы:
Нам подходят натрий и алюминий.
Определите, какие из указанных элементов образуют устойчивый отрицательный ион, содержащий 18 электронов.
Отрицательный ион получается путем добавления электронов к атому. 18 электронов — это полностью заполненный третий уровень или период, значит, наши элементы расположены именно в нем (в отличии от предыдущего задания, где мы искали в следующем периоде, так как ион положительный). Смотрим на предоставленные в условии элементы:
В данном случае в третий период попали алюминий, сера и хлор. Алюминий не может принять электроны до 18, так как является металлом и отдает электроны. Наиболее типичные элементы-любители электронов расположены правее. Это сера и хлор для данного задания.
Определите, какие из указанных элементов на внешнем уровне содержат больше s-электронов, чем p-электронов (в основном состоянии).
Такие виды заданий часто встречаются в тренировочных вариантах, нужно либо определить кого меньше, когда равно или кого больше. Разберем для наглядности данный пример. s-электронов всего два, значит p-электронов должно быть 1, чтобы было меньше. В сумме у элемента на внешнем уровне получается максимум 3 электрона (но может быть и ноль p-электронов и один или два s!), а значит он в третьей, второй или первой группе.
Нам подходит водород и бериллий.
Остальные задания очень похожи на разобранные, поэтому вы их точно сможете решить, разобравшись с выше представленными решениями.
Задание №1 ЕГЭ по химии
В Задании №1 нам необходимо уметь хорошо пользоваться таблицей Менделеева. Первое задание — это поиск атома или иона с заданной конфигурацией электронов, обычно это количество электронов на внешнем уровне (соответствует номеру группы).
Тематика заданий: электронная конфигурация атомов Бал: 1 Сложность задания: ♦ ◊◊ Примерное время выполнения: 1 мин.
Разбор типовых вариантов заданий №1 ЕГЭ по химии
Вариант 1ЕХ1
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне пять электронов.
Данный пример — типичный вариант первого задания — необходимо определить количество электронов на внешнем уровне. Вспоминаем, что на количество электронов на внешнем уровне указывает номер ГРУППЫ:
Напомню, что нам важно обращать внимание на то, в главной или побочной группе находится элемент. К сожалению, в таблице, которая дана на ЕГЭ нет деления на главные или побочные группы (какие-то элементы пишут правее, какие-то левее, но это не деление на главные и побочные группы), данная таблица не удобна, однако, по правилам можно пользоваться только ей. Обсуждать недостатки данной таблицы мы не будем, скажем лишь, что в условиях задания представлены всегда элементы главных групп, поэтому данный вопрос отпадает сам собой на экзамене (но нет гарантий, что не могут дать определить количество внешних электронов у кобальта, например, по номеру группы в данной таблице это не определишь).
Итак, находим наши пять элементов из условия:
Определяем номер группы — у алюминия 3 группа, у азота и фосфора — пятая, у кислорода и серы — шестая.
В условии нас спрашивают про пять электронов — значит выбираем элементы из пятой группы — азот и фосфор!
Вариант 1ЕХ2
Определите, двум атомам каких из указанных элементов до завершения внешнего уровня не хватает шести электронов.
Данное задание немного другого типа, в нем необходимо определить элементы, которым не хватает какого-то количества электронов до завершения внешнего уровня. В этом случае наш алгоритм прост: мы знаем, что на внешнем уровне должно быть 8 электронов (2 и 3 период, или главные группы 4,5,6.. — в заданиях в основном фигурируют именно эти элементы), а значит вычитаем из 8 заданное число — в нашем случае 6: 8-6=2. Значит, в нашем элементе должно быть два электрона на внешнем уровне и, следовательно, расположен он во второй группе. Определяем группы элементов из условия:
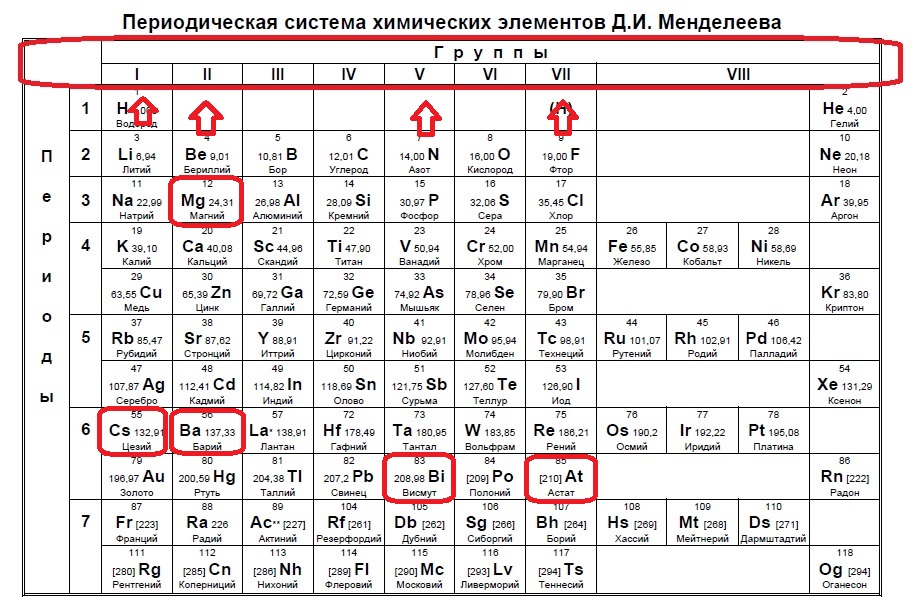
Вариант 1ЕХ3
Определите, атомы каких двух из указанных в ряду элементов в основном состоянии содержат один неспаренный электрон.
Следующий вид задания на поиск элементов с неспаренным электроном. Тут все достаточно просто. Так как электроны у нас в орбиталях всегда располагаются по парам (если помните, то есть квадратик, в котором мы рисуем стрелочку вверх и низ), то логично, что неспаренный электрон образуется, когда количество электронов на внешнем уровне нечетно, то есть в элемент должен быть расположен в нечетной группе, а именно 1,3,5,7. Определяем группы указанных нам элементов:
Итак, натрий в первой группе, магний во второй, алюминий в третьей, кремний в четвертой, а сера в шестой.
Выбираем элементы в нечетных группах — это натрий и алюминий!
Вариант 1ЕХ4
Определите, атомы каких двух из указанных в ряду элементов в основном состоянии содержат два неспаренных электрона.
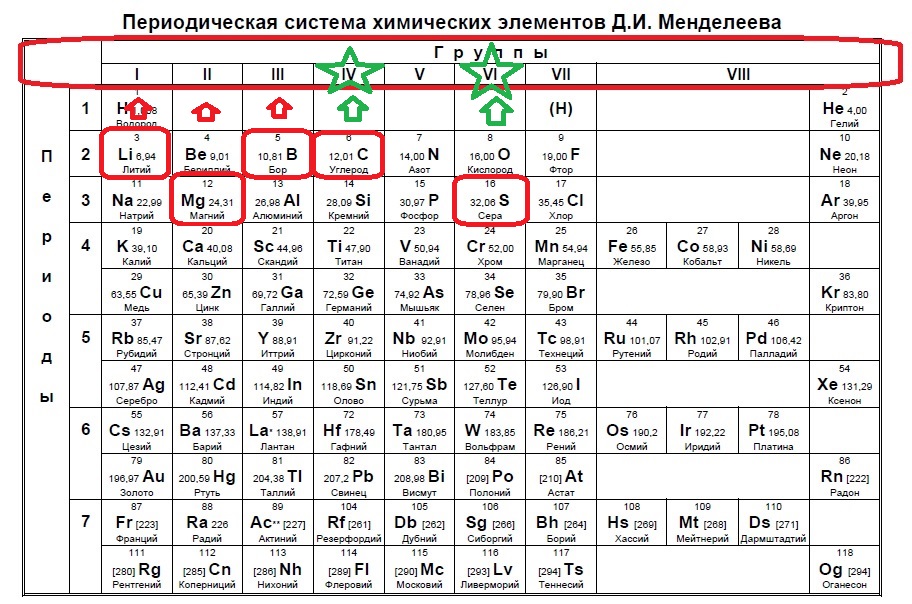
Вариант 1ЕХ5
Определите, какие два из указанных элементов образуют устойчивый положительный ион, содержащий 10 электронов.
В данном варианте задания речь идет уже об ионе, причем положительном, который содержит 10 электронов. В такого вида заданиях необходимо определить, сколько заполнено уровней у иона в зависимости от количества электронов. В нашем случае 10 электронов — это полностью заполненные первый (2) и второй (8) уровни (или периоды в таблице). Так мы говорим о положительном ионе — значит элемент потерял электроны, но у него их было больше чем 10, а значит, он расположен в третьем периоде. Ищем такие элементы:
Нам подходят натрий и алюминий.
Вариант 1ЕХ6
Определите, какие из указанных элементов образуют устойчивый отрицательный ион, содержащий 18 электронов.
Отрицательный ион получается путем добавления электронов к атому. 18 электронов — это полностью заполненный третий уровень или период, значит, наши элементы расположены именно в нем (в отличии от предыдущего задания, где мы искали в следующем периоде, так как ион положительный). Смотрим на предоставленные в условии элементы:
В данном случае в третий период попали алюминий, сера и хлор. Алюминий не может принять электроны до 18, так как является металлом и отдает электроны. Наиболее типичные элементы-любители электронов расположены правее. Это сера и хлор для данного задания.
Вариант 1ЕХ7
Определите, какие из указанных элементов на внешнем уровне содержат больше s-электронов, чем p-электронов (в основном состоянии).
Такие виды заданий часто встречаются в тренировочных вариантах, нужно либо определить кого меньше, когда равно или кого больше. Разберем для наглядности данный пример. s-электронов всего два, значит p-электронов должно быть 1, чтобы было меньше. В сумме у элемента на внешнем уровне получается максимум 3 электрона (но может быть и ноль p-электронов и один или два s!), а значит он в третьей, второй или первой группе:
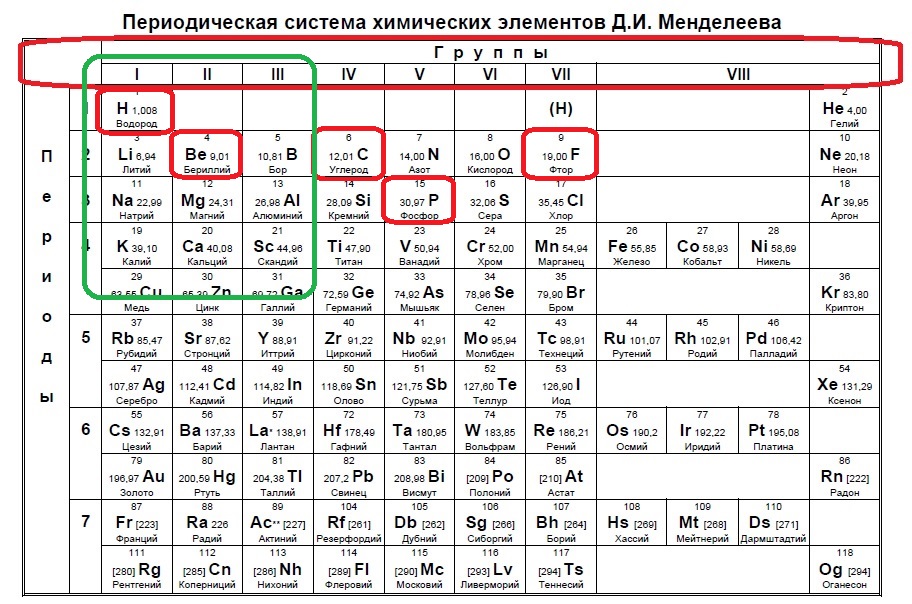
Остальные задания очень похожи на разобранные, поэтому вы их точно сможете решить, разобравшись с выше представленными решениями.