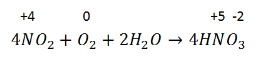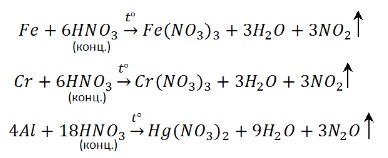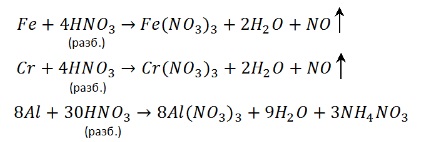Что пассивирует концентрированная серная кислота
Химия, Биология, подготовка к ГИА и ЕГЭ
Давайте рассмотрим свойства
и продукты их реакций
Автор статьи — Саид Лутфуллин
Свойства концентрированной серной кислоты — окислителя
Концентрированная серная кислота – бесцветная тяжелая маслянистая нелетучая жидкость. Не имеет запаха и тянет сказать: «без вкуса», но вкус у нее все же есть, пробовать не советую.
Разбавленная серная кислота ничем особым непримечательна. Свойства как и у других кислот. За исключением того, что она не реагирует со свинцом, так как образующийся сульфат свинца нерастворим. Нерастворимое вещество покрывает кусочек металла и «защищает его от реакции»
А вот концентрированная серная кислота – сильный окислитель (за счет атома серы в высшей степени окисления).
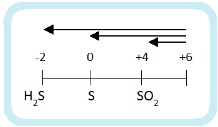
Раз сера – окислитель, то она будет восстанавливаться:
Глубина восстановления серы зависит от активности восстановителя:
На практике образуются несколько продуктов в разных пропорциях. Преобладание того или иного продукта зависит от множества факторов: от вышеупомянутой активности восстановителя, температуры, концентрации кислоты (95%, 90%. 85%, 80%, 75% – это все концентрированная кислота). Но в реалиях школьной программы все схематично и пишем один единственный продукт.
1. Взаимодействие металлов в концентрированной серной кислотой.
Концентрированная серная кислота реагирует с металлами, даже стоящими после водорода. Но кроме платины и золота – эти металлы слишком малоактивны.
Схема этих реакций:
Некоторые металлы (конкретно нужно запомнить — Fe, Al, Cr) при контакте с концентрированной серной кислотой покрываются защитной пленкой – и реакция не идет. Поэтому серную кислоту без всякой опасности перевозят в железных цистернах. Это явление называют пассивацией.
То, что железо, алюминий и хром пассивируются не означает, что реакция невозможна. Просто нужно нагреть – при нагревании от защитной пленки не остаётся и следа:
2. Взаимодействие неметаллов с концентрированной серной кислотой.
Не все неметаллы реагируют с концентрированной серной кислотой: лишь те, что проявляют восстановительные свойства. Поэтому кислород, азот и галогены не вступают в эти реакции.
Мы рассмотрим взаимодействие с фосфором, углеродом, бором, серой. Неметаллы – не такие активные восстановители как типичные металлы – поэтому серная кислота восстанавливается до SO2.
Неметалл окисляется до высшей степени окисления: образуется оксид. Поскольку оксид неметалла – кислотный, то он тут же в момент получения реагирует с водой и образуется кислота:
Угольная кислота не образуется – получается углекислый газ:
Концентрированная серная кислота окисляет серу:
3. Взаимодействие концентрированной серной кислоты с галогенидами.
Галогениды металлов – это соли галогеноводородов (HF, HCl, HBr, HI). Галогеноводороды – летучие кислоты, а HF еще к тому же и слабая.
Поэтому серная кислота их вытесняет из солей:
Соли нужно брать твердые, не раствор. Тогда галогеноводороды будут вытесняться в виде газов.
А к фториду можно и в раствор прилить кислоты, так как фтороводородная кислота – слабая, она вытеснится. Только останется в растворе, вот и вся разница.
С хлоридами и фторидами происходит простая реакция обмена, без изменения степеней окисления.
Галоген окисляется до простого вещества. Сера восстанавливается:
А вот бромиды и иодиды – восстановители. После вытеснения галогеноводорода он тут же окисляется. Поэтому реакции концентрированной серной кислоты с бромидами и иодидами протекают с изменением степеней окисления.
Бромоводород и иодоводород окисляются так же, как и их соли:
Азотная кислота — окислитель.
Производство.
Сырье для производства азотной кислоты – аммиак. Три последовательные реакции окисления:
1. Каталитическое окисление аммиака:
Реакция экзотермическая, необратимая.
2. Окисление NO до NO2:
Реакция экзотермическая, обратимая.
3. Поглощение NO2 водой и одновременно его окисление:
Реакция экзотермическая, обратимая – по этой же схеме азотная кислота разлагается при хранении. Поэтому с течением времени прозрачная изначально азотная кислота буреет. Бурый цвет кислоте придает, образующийся при разложении NO2.
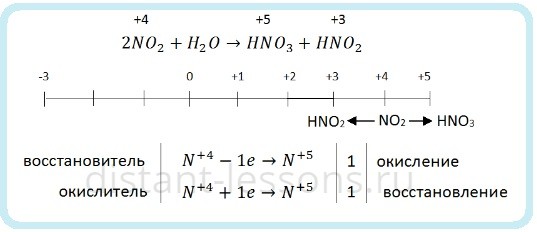
Если растворять NO2 в воде без доступа кислорода, то азот диспропорционирует:
Поэтому оксид азота (IV) NO2 мы относим к кислотным. Хоть у него и нет соответствующей кислоты, при растворении его в воде образуются HNO3 и HNO2.
Азотная кислота – жидкость с резким запахом. Свежая азотная кислота бесцветная. При хранении она разлагается и за счет бурого NO2 приобретает желтоватый цвет.
Важно знать, что азотная кислота летучая, легкокипящая, поэтому и имеет запах. А раз она летучая, то ее можно вытеснить из соли нелетучей кислотой, например, концентрированной серной:
Важно, чтобы нитрат был твердым, а серная кислота концентрированная – меньше воды. Чтобы азотная кислота испарялась, испаряется – значит покидает реакционную смесь, значит реакция идет до конца.
Химические свойства.
Свойства азотной кислоты в целом повторяют свойства концентрированной серной. Но с одной поправкой, в отличие от серной, азотная кислота и концентрированная, и разбавленная проявляет сильные окислительные свойства.
1. Взаимодействие с металлами.
До чего может восстанавливаться азот? Вспомним диаграмму степеней окисления азота:
Получиться может любой из этих продуктов. А на практике – несколько сразу. Мы рассмотрим упрощенный вариант: берем только преобладающий продукт и только два фактора, влияющие на глубину восстановления:
Еще больше упрощая берем только четыре продукта: NH4NO3, N2O, NO, NO2.
Наиболее глубокое восстановление дает разбавленная кислота и активный металл – NH4NO3.
Соответственно при взаимодействии концентрированной кислоты и малоактивного металла образуется NO2. Самое неглубокое восстановление.
Теперь нужно определить в каком случае будет N2O, а в каком NO. Фактор активности металла – решающий. С активным металлом и концентрированной кислотой будет N2O. А с малоактивным металлом и разбавленной кислотой образуется NO.
8Na + 10HNO3 конц → 8NaNO3 + N 2 O ↑ + 5H2O
Концентрированная азотная кислота пассивирует Fe, Cr, Al, как и концентрированная серная.
Чтобы провести реакцию нужно нагреть:
С разбавленной кислотой эти металлы реагируют и без нагревания:
2. Взаимодействие с неметаллами (C, P, B, S).
Неметаллы окисляются до высших кислот. Реагирует и концентрированная, и разбавленная азотная кислота. Неметаллы – не очень хорошие восстановители, поэтому кислота восстанавливается как в реакции с малоактивными металлами (образуются N2O и NO2).
В отличие от серной кислоты, очень концентрированная азотная кислота (безводная) окисляет при нагревании иод до иодноватой кислоты (HIO3):
3. Взаимодействие с галогенидами.
Эти реакции могут запутать, хотя ничего сложного в них нет. Вам нужно просто понять логику каждой из них.
На что следует опираться:
Фториды металлов – это соли слабых кислот, поэтому сильная азотная кислота вытесняет фтороводород. И не важно концентрированная или разбавленная – это простая реакция обмена/p>
Фтороводород не реагирует с азотной кислотой. Реакция обмена невозможна и окислительно-восстановительная тоже: фторид – слабый восстановитель.
Хлориды металлов и хлороводород не реагируют с азотной кислотой. Хлорид ион – слабый восстановитель – не возможна ОВР. Хлориды металлов не реагируют, потому что соляная кислота – сильная (предыдущая плавиковая – слабая, если помните).
Бромиды и иодиды вступают с азотной кислотой в окислительно-восстановительное взаимодействие. Сами окисляются до простых веществ. Азотная кислота восстанавливается до NO2 если концентрированная, разбавленная – до NO, то есть так, как будто взаимодействует с малоактивным металлом.
Серная кислота
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Получение
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом:
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную:
В упрощенном виде нитрозный способ можно записать так:
Химические свойства
В водном растворе диссоциирует ступенчато.
С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)
Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Серная кислота
Природные залежи самородной серы сравнительно невелики. Общее содержание серы в земной коре составляет 0,1%. Сера содержится в нефти, каменном угле, горючих и топочных газах. Чаще сера встречается в природе в виде соединений с цинком, медью и другими металлами. Следует отметить, что доля колчедана и серы в общем балансе сернокислотного сырья постепенно уменьшается, а доля серы, извлекаемой из различных отходов, постепенно возрастает. Возможности получения серной кислоты из отходов весьма значительны. Использование отходящих газов цветной металлургии позволяет получать, без специальных затрат в сернокислотных системах на обжиг серосодержащего сырья.
Физические и химические свойства серной кислоты
Стопроцентная H2SO4 (SO3 х H2O) называется моногидратом. Соединение не дымит, в концентрированном виде не разрушает черные металлы, являясь при этом одной из самых сильных кислот;
Серная кислота смешивается с Н2О и SO3 в любых соотношениях, образуя соединения:
Как сильная кислота H2SO4 вытесняет более слабые кислоты из их солей, например борную кислоту из буры:
Na2B4O7 + H2SO4 + 5 H2O = Na2SO4 + 4 H2BO3,
а при нагревании вытесняет более летучие кислоты, например:
NaNO3 + H2SO4 = NaHSO4 + HNO3.
| Температура замерзания серной кислоты: | |
| концентрация, % | темп.замерз., «С |
| 74,7 | -20 |
| 76,4 | -20 |
| 78,1 | -20 |
| 79,5 | -7,5 |
| 80,1 | -8,5 |
| 81,5 | -0,2 |
| 83,5 | 1,6 |
| 84,3 | 8,5 |
| 85,7 | 4,6 |
| 87,9 | -9 |
| 90,4 | -20 |
| 92,1 | -35 |
| 95,6 | -20 |
Сырьё для получения серной кислоты
Сырьём для получения серной кислоты могут служить: сера, серный колчедан FeS2, отходящие газы печей окислительного обжига сульфидных руд Zn, Сu, РЬ и других металлов, содержащие SO2. В России основное количество серной кислоты получают из серного колчедана. Сжигают FeS2 в печах, где он находится в состоянии кипящего слоя. Это достигается быстрым продуванием воздуха через слой тонко измельченного колчедана. Получаемая газовая смесь содержит SO2, O2, N2, примеси SO3, паров Н2О, As2O3, SiO2 и другие, и несёт много огарковой пыли, от которой газы очищаются в электрофильтрах.
Способы получения серной кислоты
Серную кислоту получают из SO2 двумя способами: нитрозным (башенным) и контактным.
Окисление SO2 окислами азота происходит в растворе после его абсорбции нитрозой. Водою нитроза гидролизуется:
NOOSO3H + H2O = H2SO4 + HNO2.
Сернистый газ, поступивший в башни, с водой образует сернистую кислоту:
Взаимодействие HNO2 и H2SO3 приводит к получению серной кислоты:
2 HNO2 + H2SO3 = H2SO4 + 2 NO + H2O.
Выделяющаяся NO превращается в окислительной башне в N2O3 (точнее в смесь NO + NO2). Оттуда газы поступают в поглотительные башни, где навстречу им сверху подаётся серная кислота. Образуется нитроза, которую перекачивают в продукционные башни. Таким образом осуществляется непрерывность производства и круговорот окислов азота. Неизбежные потери их с выхлопными газами восполняются добавлением HNO3.
Серная кислота, получаемая нитрозным способом, имеет недостаточно высокую концентрацию и содержит вредные примеси (например, As). Её производство сопровождается выбросом в атмосферу окислов азота («лисий хвост», названный так по цвету NO2).
Современные сернокислотные заводы строят для работы по контактному методу. В качестве основы катализатора применяются окислы ванадия с добавками SiO2, Al2O3, K2O, CaO, BaO в различных соотношениях. Все ванадиевые контактные массы проявляют свою активность только при температуре не ниже
420 «С. В контактном аппарате газ проходит обычно 4 или 5 слоев контактной массы. В производстве серной кислоты контактным способом обжиговый газ предварительно очищают от примесей, отравляющих катализатор. As, Se и остатки пыли удаляют в промывных башнях, орошаемых серной кислотой. От тумана серную кислоту (образующейся из присутствующих в газовой смеси SO3 и H2O) освобождают в мокрых электрофильтрах. Пары H2O поглощаются концентрированной серной кислотой в сушильных башнях. Затем смесь SO2 с воздухом проходит через катализатор (контактную массу) и окисляется до SO3:
Серный ангидрид далее поглощается водой, содержащейся в разбавленной H2SO4:
В зависимости от количества воды, поступившей в процесс, получается раствор серной кислоты в воде или олеум.
Посредством данного метода сейчас вырабатывается порядка 80% H2SO4 в мире.
Применение серной кислоты
Серная кислота может служить для очистки нефтепродуктов от сернистых, непредельных органических соединений.
В металлургии серная кислота применяется для удаления окалины с проволоки, а также листов перед лужением и оцинкованием (разбавленная), для травления разичных металлических поверхностей перед покрытием их хромом, медью, никелем и др. Также с помощью серной кислоты разлагают комплексные руды (в частности, урановые).
В органическом синтезе серная кислота концентрированная является необходимым компонентом нитрующих смесей, а также сульфирующим средством при получении многих красителей и лекарственных веществ.
Широко применяется серная кислота для производства удобрений, этилового спирта, искусственного волокна, капролактама, двуокиси титана, анилиновых красителей и целого ряда других химических соединений.
Серная кислота отработанная (отход) применяется в химической, металлургической, деревообрабатывающей и других отраслях промышленности Серная кислота аккумуляторная применяется в производстве свинцово-кислотных источников тока.
Взаимодействие серной кислоты с металлами и неметаллами
Общее описание
Серная кислота является токсичным реагентом, который отличается специфичностью применения и высоким показателем опасности для живого организма. Эта жидкость характеризуется как сильный окислитель. Температура плавления H2SO4 составляет +10 °C. Закипает кислота при +296 °C. В результате выделяется вода и оксид серы SO3. Так как эта жидкость способна поглощать пары воды, её часто используют для осушения газов. Добывают серу промышленным путём, используя для этого диоксид серы SO2, который можно получить только в результате горения серы либо серного колчедана.
Под воздействием низких температур H2SO4 пассивирует некоторые металлы, например алюминий, железо, хром, никель, титан. Благодаря этому транспортировать кислоту можно в герметичных железных цистернах.
Добыть H2SO4 можно двумя способами:
Присутствующий в кислоте раствор SO3 называется олеумом, который также используют для получения H2SO4. Реакция на металлы и неметаллы всегда отличается. При использовании двухосновной маслянистой жидкости образуется 2 вида солей: средние — сульфаты (барий, кальций), кислые — гидросульфаты (натрий, калий).
Этапы производства
Изготовление кислоты является довольно интересным и познавательным процессом. Изначально серный колчедан (измельчённый влажный пирит) засыпают в специальную печь для обжига. В нижней части оборудования пускают воздух, который специально обогащают кислородом. Постепенно из печи начинает выходить газ, в состав которого входят: SO2, O2, микроскопические частицы огарка (оксида железа) и пары воды (использовался влажный пирит). С помощью электрофильтра и циклона газ очищают от примесей твёрдых частиц. Сушильная башня удаляет все пары воды.
Окисление полученного серного газа происходит благодаря катализатору V2O5 в контактном аппарате. Такой подход позволяет ускорить химическую реакцию. Процесс окисления одного оксида в другой на практике является обратным. Специалисты стараются создать оптимальные условия, чтобы добиться протекания прямой реакции — повышенное давление и температура от +500 °C. Всё это позволяет получить необходимую экзотермическую реакцию.
В специальной башне поглощается оксид серы концентрированной кислоты. Приём с водой не используют, так как оксид серы легко растворяется с выделением большого количества теплоты, из-за чего жидкость закипает и превращается в пар. Избежать сернокислотного тумана помогает H2SO4 в концентрации 98%. Оксид серы хорошо растворяется и образует олеум: H2SO4*nSO3.
Использование H2SO4 в разбавленном виде
Серная кислота имеет одну особенность — она может отнимать воду, из-за чего её часто используют как надёжное гигроскопическое средство во многих химических реакциях. С помощью этой жидкости можно получать органические вещества, провести осушку, а также снизить вероятность поглощения воды конкретными элементами. Для решения всех этих задач в лабораторных условиях используются специальные герметические ёмкости, которые называются эксикаторами.
Востребованность H2SO4 никогда не уменьшается, так как она имеет широкую сферу применения. Концентрированная жидкость может обугливать органические вещества (например, древесину), а также вызывать сильные ожоги кожного покрова. Если для проведения химических экспериментов нужно использовать кислоту, тогда должны быть соблюдены все правила безопасности. Если капля разбавленной жидкости H2SO4 попала на кожу либо одежду, то по мере испарения воды она постепенно будет увеличивать свою концентрацию.
Разбавленная кислота может вступать в реакцию замещения, что спровоцировано окислением катионов. По этой причине на все активные металлы, которые находятся до водорода в ряду напряжений, H2SO4 реагирует как обычная кислота. Постепенно происходит вытеснение водорода. Этот эффект подробно объясняют на уроках химии в 8 классе. С разбавленной серной кислотой не взаимодействуют благородные металлы (например, золото, платина) и те элементы, которые стоят после водорода в ряду напряжения. Другими окислительными свойствами разбавленная маслянистая жидкость H2SO4 не обладает.
Лабораторные исследования подтвердили, что кислота реагирует на основные оксиды и основания, из-за чего образуется сразу 2 ряда солей: кислые — гидросульфаты, средние — сульфаты. К качественным реакциям на H2SO4 можно отнести взаимодействие с солями бария, в результате чего образуется белый осадок, который не растворяется в воде и кислой среде. Эту химическую реакцию можно изобразить с помощью формулы: H2SO4 + BaCl 2 = BaSO 4↓ + 2HCl.
Свойства концентрированной кислоты
В концентрированном виде жидкость H2SO4 способна максимально проявить свои окислительные свойства. Это вызвано тем, что в молекулах кислоты находятся атомы серы в высшей степени окисления (+6). В концентрированном виде H2SO4 взаимодействует с металлами, которые находятся в электрохимическом ряду напряжения (правее водорода). Речь касается серебра, ртути и меди. В результате химической реакции образуется вода, сульфаты и продукты восстановления серы. Степень восстановления кислоты зависит от металлов. Например:
В концентрированном виде H2SO4 не вступает в реакцию с платиной и золотом, так как эти металлы обладают небольшой активностью. Если речь касается хрома, алюминия и железа, тогда понадобится нагревание. В противном случае реакция не произойдёт, что связано с пассивированием этих металлов (на поверхности образуется тонкая защитная плёнка).
Продукт восстановления кислоты всецело зависит от концентрации H2SO4 и активности используемого металла. Каждая химическая реакция должна быть рассмотрена индивидуально. Алюминий, хром и железо могут растворяться в концентрированной кислоте, но при условии сильного нагревания. В результате образуется соль металла и продукты восстановления серной кислоты. Формулы выглядят следующим образом:
Совершенно другую реакцию можно наблюдать в том случае, если нужно проверить взаимодействие кислоты с металлами. Происходит выделение SO2 и окисление неметаллов до высшей степени. Например:
В разбавленном виде кислота ничем не отличается от других похожих жидкостей. В категорию исключений входит только то, что H2SO4 не вступает в реакцию со свинцом, так как образовавшийся сульфат свинца невозможно растворить.
Токсичность и сферы применения
Серная кислота и олеум относятся к категории наиболее едких веществ. Они могут обжечь кожу, слизистые оболочки и дыхательные пути. Из-за неаккуратного обращения с агрессивной жидкостью не исключено возникновение химического ожога. Вдыхание паров этих веществ может спровоцировать кашель, затруднённое дыхание, бронхит. В атмосфере может образовываться аэрозоль из-за ядовитого дыма металлургических и химических производств. В такой ситуации могут выпадать кислотные дожди.
При правильном применении H2SO4 может пригодиться в следующих случаях:
Во всём мире в год используется до 160 тонн кислоты. Больше всего эту жидкость применяют в производстве минеральных удобрений. По этой причине сернокислотные заводы стараются возводить вместе с предприятиями, которые будут заниматься изготовлением удобрений.
Не менее востребованными являются соли серной кислоты. Мирабилит (Nа2SO4•10Н2O) был получен немецким химиком И. Глаубером, который экспериментировал с тем, как действует H2SO4 на хлорид натрия. В медицинской практике это средство используется в качестве слабительного.
Спрос также получил железный купорос (FeSO4*7H2O), который ранее применяли для лечения диагностированной чесотки. Но в настоящее время этот химический компонент используется только для борьбы с сельскохозяйственными вредителями. Применение большой концентрации железного купороса чревато гибелью обработанной культуры. Медный купорос (CuSO4*5H2O) получил большой спрос в сельском хозяйстве для борьбы с вредителями растений.