Что означает слово солидное образование
Чем отличается доброкачественная опухоль от злокачественной
В медицине понятие доброкачественности означает лёгкое течение болезни, хорошие результаты лечения и неопасность для жизни. Под злокачественным процессом подразумевают разрушительное течение, сложность терапии, высокий риск смертности.
Для опухолей такое разделение условно. Тем не менее пациентам и врачам крайне важно определить вид опухоли. От этого зависят тактика лечения и прогноз.
Характеристика доброкачественных и злокачественных опухолей
Существуют чёткие критерии:
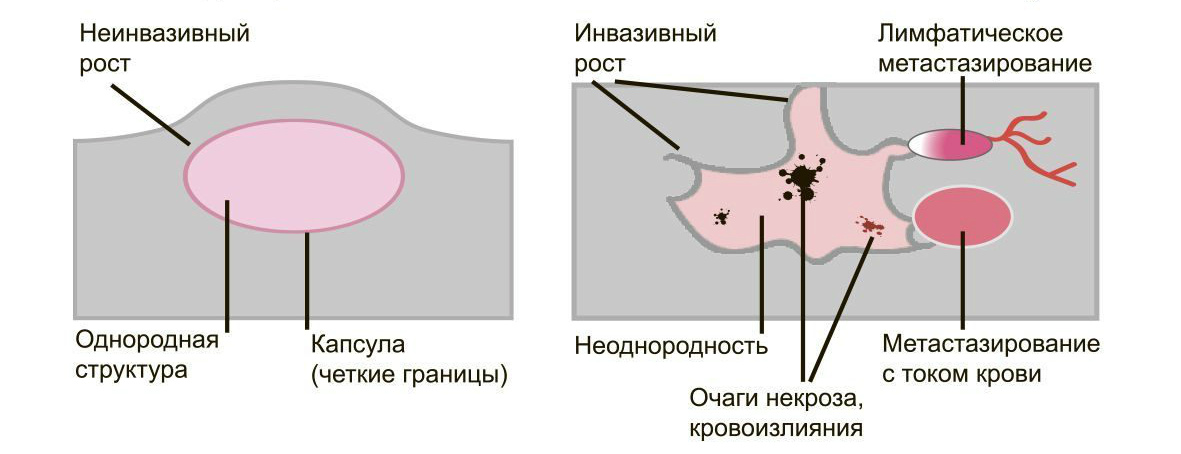
Доброкачественные опухоли чётко отграничены от здоровых тканей, часто имеют капсулу. Рак прорастает окружающие ткани, внедряется в сосуды, его контуры более аморфны.
Большинство доброкачественных опухолей могут расти годами, не проявляя симптомов. Карциномы растут быстро, нарушая функции органов и отравляя организм. Рост сопровождается утомляемостью, слабостью, потерей веса, болью.
Доброкачественные образования “сидят” на одном месте, постепенно растут и раздвигают здоровые ткани, подвижны при прощупывании. Раковые клетки слабо скреплены друг с другом, легко отделяются и разносятся лимфой и кровью по организму. Они оседают в лимфоузлах, костях, внутренних органах, образуя новые опухолевые очаги — метастазы. При пальпации узел спаян с тканями и не сдвигается.
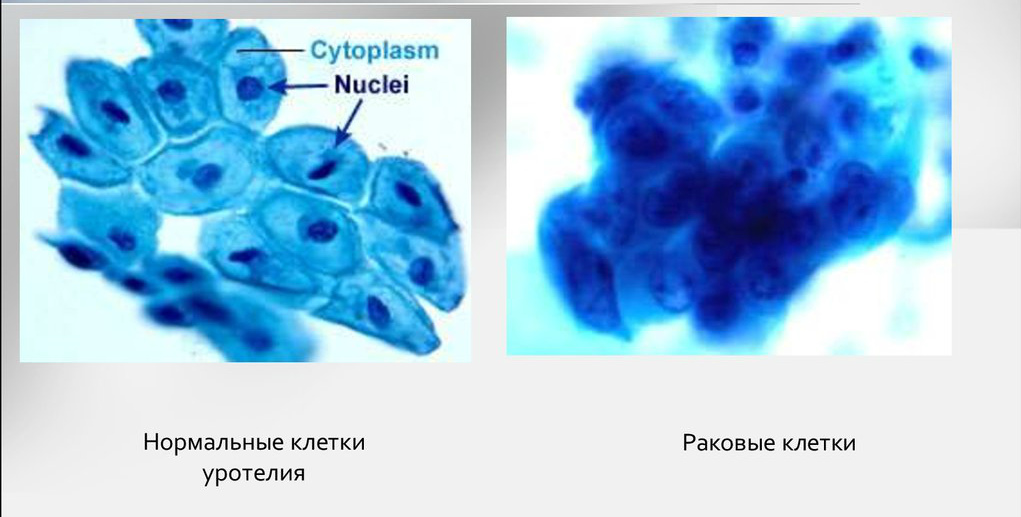
Много информации даёт биопсия. Исследование показывает, что доброкачественные клетки похожи на здоровые, их структура более чёткая. Структура злокачественных клеток сильно изменена из-за выраженных мутаций. Чем меньше клетки напоминают ткань, из которой выросли, тем хуже прогноз для лечения и жизни.
Доброкачественную опухоль, такую как аденома простаты, можно удалить и добиться полного излечения. Если возникнет рецидив, он будет на том же месте, где нашли первичный очаг. Злокачественные образования трудно удалить полностью. Даже одна оставшаяся клетка даст новую опухоль либо на старом месте, либо там, куда она попала по сосудам. Выживаемость больных существенно ниже.
Общие свойства доброкачественных и злокачественных опухолей
Есть моменты, объединяющие оба вида новообразований:
Тяжесть симптомов зависит не только от степени сдавления тканей опухолью, но и от неспособности новообразования выполнять функцию здоровых клеток.
Виды опухолей
Различия не всегда очевидны. Нужна тщательная диагностика для поиска атипичных клеток.
Может ли доброкачественная опухоль стать злокачественной
Любая опухоль способна к малигнизации. Миомы, липомы, фибромы редко переходят в рак. Кисты — крайне редко. Невусы, аденомы, полипы в желудке или кишечнике — очень часто. Многое зависит от условий, в которых находится опухоль, питания, экологии, уровня стресса, гормональных сбоев, наличия предраковых болезней.
В Клинике урологии имени Р. М. Фронштейна доступна современная диагностика опухолей, разработаны эффективные методики лечения. Обращайтесь на консультацию и наши специалисты вам помогут.
Что означает слово солидное образование
а) Дифференциальная диагностика солидного образования брюшной полости:
1. Распространенные заболевания:
• Перитонеальный канцероматоз
• Лимфаденопатия
• Вторичные воспалительные изменения
• Гематома брыжейки
• Образование на ножке, развивающееся из солидного органа брюшной полости или кишечника
2. Менее распространенные заболевания:
• Перитонеальный лимфоматоз
• Перитонеальный саркоматоз
• Перитонеальный туберкулез
• Злокачественная перитонеальная мезотелиома
• Злокачественная фиброзная гистиоцитома
3. Редкие, но важные заболевания:
• Первично злокачественные опухоли брюшины:
о Папиллярная серозная карцинома
о Десмопластическая мелкокруглоклеточная опухоль
• Нейроэндокринная опухоль
• Доброкачественная мезенхимальная опухоль:
о Диссеминированный интраперитонеальный лейомиоматоз
• Опухолеподобные состояния:
о Десмоидная опухоль
о Болезнь Кастлемана
о Воспалительная псевдоопухоль
о Эндометриоз
• Системные заболевания:
о Экстрамедуллярный гемопоэз
о Системный амилоидоз
б) Важная информация:
1. Дифференциальная диагностика:
• Как правило, опухоли брюшины не имеют специфических признаков для точной диагностики
• Вторичные опухоли брюшины встречаются чаще, чем первичные перитонеальные или мезенхимальные опухоли:
о Однако первичные опухоли брюшины, как правило, имеют более агрессивное течение
• Для выявления гистологического типа опухоли необходима биопсия под визуальным контролем
2. Распространенные заболевания:
• Перитонеальный канцероматоз:
о Метастатическая опухолевая диссеминация по поверхности брюшины, связкам брюшины, сальнику и брыжейке
о Подтвержденное злокачественное образование, типичные первичные очаги: яичник, желудок, толстая киста и поджелудочная железа
о Морфологические формы:
— Узловые образования брюшины: множественные гипоэхогенные узлы или пятна на поверхности брюшины; как правило, вовлекается дугласово пространство, карман Моррисона, правое поддиафрагмальное пространство
— Поражение сальника в виде бляшек (патологическое утолщение в виде пирога), диффузное или узловое
— Инфильтрация брюшины и брыжейки
— Асцит
• Лимфаденопатия:
о Солидные узлы по ходу лимфатических протоков о Метастазы, лимфома, лейкемия > саркоидоз, туберкулез, мастоцитоз, болезнь Крона, болезнь Уиппла и целиакия
• Вторичные воспалительные изменения:
о Очаговое воспаление брюшины вследствие прилегающего воспалительного процесса, например, панкреатит или аппендицит
о Эхогенные/гипоэхогенные образования с нечетким контуром, в связи с воспалением брыжейки, с адгезией или инфильтрацией сальника
о Важно определить причину изменений
• Гематома брыжейки:
о Травматическое или спонтанное кровоизлияние у пациентов с нарушениями свертываемости крови
о Эхогенность зависит от срока давности кровоизлияния (от эхогенной до гетерогенной гипоэхогенной)
о Нечеткие границы ± гемоперитонеум или асцит
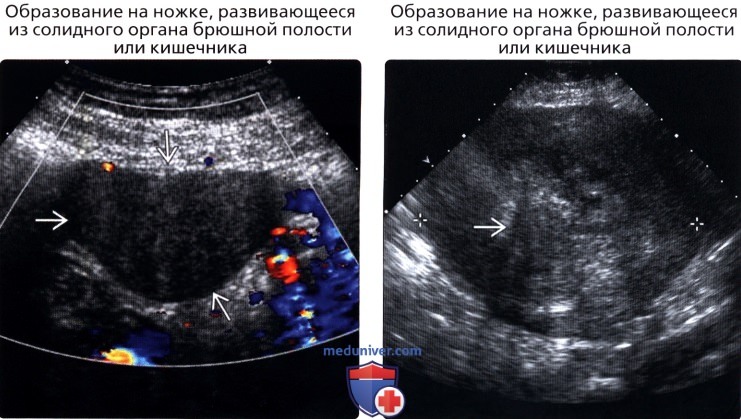
(Правый) УЗИ, продольное сканирование средней трети живота: большое, солидное образование, гетерогенное с эффектом дистального акустического затенения. Визуализировалась инфарктная гастроинтестинальная стромальная опухоль. 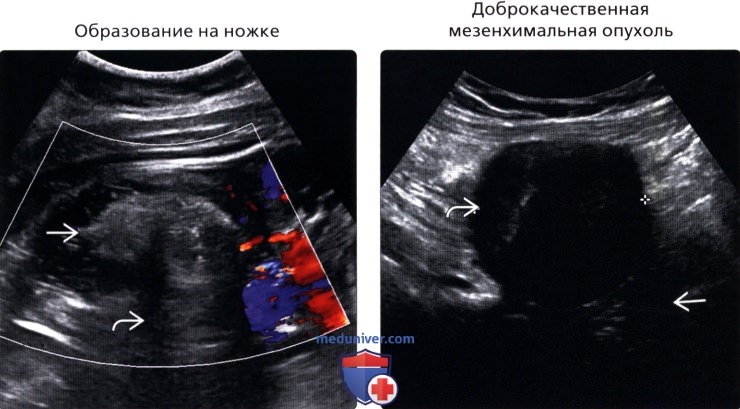
(Правый) УЗИ, поперечное сканирование правого нижнего квадранта живота у пациентки после гистерэктомии: гипоэхогенное солидное образование с дистальным акустическим затенением и кровотоком. При хирургическом вмешательстве была диагностирована лейомиома. Так как образование твердое, биопсия была невозможна.
3. Менее распространенные заболевания:
• Перитонеальный лимфоматоз:
о Редкое проявление агрессивной неходжкинской лимфомы (диффузная крупно-В-клеточная лимфома или лимфома Беркитта)
о На момент постановки диагноза нехарактерно вовлечение брюшины, как единственной зоны поражения
о Выраженная брыжеечная и ретроперитонеальная аденопатия, вовлечение селезенки и кишечника говорит в пользу диагноза лимфомы:
— Важно дифференцировать от перитонеального канцероматоза, так как лечение нехирургическое
• Перитонеальный саркоматоз:
о Первичная саркома конечностей или брюшной полости
о Наиболее часто: гастроинтестинальная стромальная опухоль и лейомиосаркома
о Различные визуализационные находки
о Большое, гетерогенное сосудистое образование с нечетким контуром ± некроз или прилегающая инвазия:
— Менее выраженный асцит, патологическое утолщение большого сальника, утолщение брюшины и лимфаденопатия, чем при канцероматозе
• Злокачественная перитонеальная мезотелиома:
о Фактором риска является контакт с асбестом, но 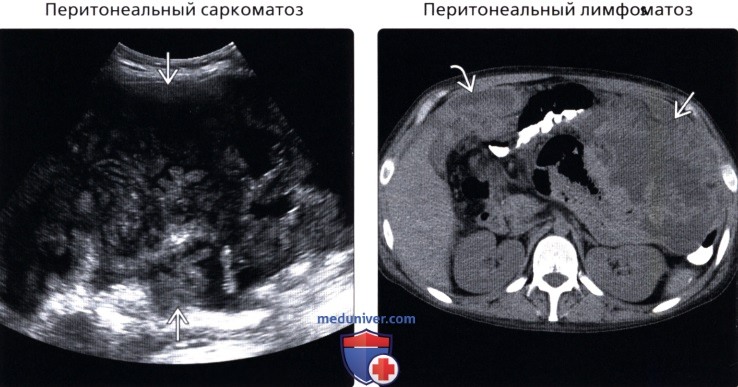
(Правый) Аксиальная КТ без контрастирования у того же пациента: лимфоматозное образование смешанной интенсивности, как и лимфоматозные очаги в брюшной полости справа. На других срезах визуализировался асцит. 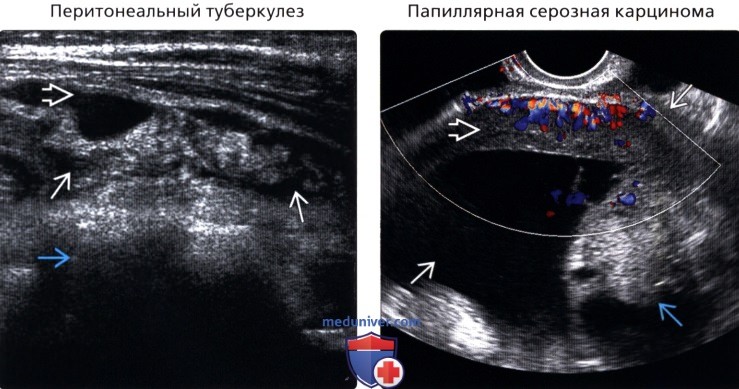
(Правый) Трансвагинальное УЗИ придатков слева, фронтальный срез в режиме цветовой допплерографии: асцит, утолщенная брюшина с кровотоком, злокачественный процесс, и солидное образование брюшины. Была диагностирована серозная карцинома брюшины.
4. Редкие заболевания:
• Первично злокачественные опухоли брюшины:
о Папиллярная серозная карцинома:
— У женщин в постменопаузальном периоде с повышенным маркером СА125
— Визуализационные признаки и гистологическая картина имитируют метастатическую папиллярную серозную карциному яичника, но прогноз более неблагоприятный
— Яичники не измененные, по большей части наблюдается поверхностное вовлечение в опухолевый процесс
— Обширная кальцификация не более чем в 30% случаев
о Десмопластическая мелкокруглоклеточная опухоль:
— Высокозлокачественная опухоль взрослых и подростков
— Множественные гипоэхогенные, округлые большие образования брюшины ± внутренний некроз ± асцит
• Нейроэндокринная опухоль:
о Развивается из стенки кишечника; выраженная фиброзирующая реакция брыжейки приводит к лучистости брыжеечных сосудов в режиме цветовой допплерографии
• Доброкачественная мезенхимальная опухоль:
о Диссеминированный интраперитонеальный лейомиоматоз главным образом поражает женщин репродуктивного возраста:
— Отсутствие асцита и утолщения сальника
о Плексиформная нейрофиброма брыжейки при нейрофиброматозе первого типа является частым проявлением о Одиночная фиброзная опухоль:
— Редко встречается, как правило, доброкачественное веретеноклеточное новообразование
— Мягкотканное гиперваскулярное образование с четким контуром
• Опухолеподобные заболевания:
о Десмоидная опухоль: доброкачественный, место агрессивный пролиферативный процесс с тенденцией к местному рецидивированию; солидное гипоэхогенное образование неправильной формы:
— в 30% случаев инфильтрация брыжейки; в 13% случаев у пациентов синдром Гарднера
о Болезнь Кастлемана: гипертрофическая лимфаденопатия ± гиперваскулярные мягкотканные образования; очаги выраженной кальцификации (5-10%); гепатоспленомегалия
о Воспалительная псевдоопухоль: идиопатический хронический воспалительный процесс у детей и подростков
— Образования или инфильтрация сальника и брыжейки, повышение васкуляризации + слабая кальцификация
о Спленоз: повреждение селезенки или спленэктомия в анамнезе:
— Множественные мелкие солидные узлы, схожие с селезенкой, без асцита, утолщения брюшины или сальника
о Склерозирующий мезентерит:
— Идиопатическое состояние; варианты течения: мезентериальный панникулит и стягивающий мезентерит
— Мягкотканные образования с различным количеством эхогенной жировой клетчатки, вызывающей акустическое затенение ± кальцификация
о Инфаркт сальника/ воспаление сальниковых привесков ободочной кишки:
— Повреждение сосудистой системы сальника или воспаление сальниковых привесков ободочной кишки соответственно
— Гиперэхогенное, содержащее тонкую жировую клетчатку «образование»
о Эндометриоз:
— Женщины детородного возраста
— Фиброзные очаги на серозной оболочке кишечника, спайки, эндометриомы
о Глиоматоз брюшины:
— Очаги глиальной ткани на брюшине вследствие разрыва тератомы, вентрикулоперитонеального шунта или метаплазии
— Образования, утолщение брюшины, утолщение сальника, асцит
• Системные заболевания:
о Экстрамедуллярный гемопоэз:
— Инфильтративные формы (селезенка, печень, брыжейка) > опухолевидные образования (паравертебрально)
— Гипоэхогенные, гиповаскулярные образования
о Системный амилоидоз; редкая многоочаговая или диффузная инфильтрация брыжейки, низкий уровень Са++ является важным симптомом, но присутствует не всегда
Видео УЗИ органов брюшной полости в норме (УЗИ анатомия брюшной полости)
Редактор: Искандер Милевски. Дата обновления публикации: 6.2.2021
Современные классификации солидных опухолей
 Что такое солидные опухоли и в чем их отличие от другой группы — опухолевых заболеваний кроветворной и лимфоидной ткани — лейкозов
Что такое солидные опухоли и в чем их отличие от другой группы — опухолевых заболеваний кроветворной и лимфоидной ткани — лейкозов
Солидные опухоли – собирательное обозначение опухолей, которые имеют определенную локализацию – место расположения, и этим отличаются от другой группы – опухолевых заболеваний кроветворной и лимфоидной ткани – лейкозов.
П.А. Налескина, вед. науч. сотр. лаборатории онкогенетики Института экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины (ИЭПОР), д-р мед. наук.
Успех лечения онкологических больных, особенно со злокачественными новообразованиями, зависит прежде всего от своевременной и правильной постановки диагноза. Это предполагает определение не только нозологической формы и гистологического типа опухоли, но и степени ее распространения в организме. Решающую роль как на первом, так и последующих этапах лечебно-диагностического процесса призвана сыграть классификация опухолей, выступающая в каждом конкретном случае в качестве ключа к раскрытию сущности опухолевого процесса. Классификация опухолей – это своеобразный язык общения врачей различных специальностей, с помощью которого они приходят к взаимопониманию.
Необходимость классифицировать онкологические заболевания диктуется большим многообразием различных форм опухолей, различающихся между собой гистогенезом, цитологическими и гистологическими характеристиками, особенностями возникновения, локализации, метастазирования, клинического течения опухолевого процесса, что является определяющим в прогнозе болезни, а также при выборе лечебных мероприятий, тактики их проведения и последующего динамического наблюдения за больным.
Несмотря на разные подходы, используемые при делении опухолей на группы, основными принципами их классификации остаются морфологический и клинический. На протяжении нескольких десятилетий в ряде стран мира создавались и претерпевали изменения различные классификации, одни из которых носили морфологический, цитологический, другие – клинический или смешанный клинико-морфологический характер. Это свидетельствует о трудностях при систематизации опухолей человека, которые возникают в связи со спорными и не до конца решенными проблемами первоочередной важности. Одной из них является проблема гистогенеза опухолей, тем более что нет ясности относительно происхождения ряда нормальных клеток, тканевых структур, целых органов, которые могут быть источниками опухолей. Например, неясно происхождение структур, способных вырабатывать биологически активные вещества, во многом не решен вопрос с так называемыми стволовыми клетками, обеспечивающими регенерацию органов, и т. д.
В настоящее время в онкологии используются различные классификации для разграничения возникающих у человека опухолей. Одни из них охватывают как доброкачественные, так и злокачественные новообразования, другие касаются только злокачественных опухолей.
Все большее признание в мире приобретают международные классификации опухолей. Это объясняется стремлением врачей-онкологов к единству взглядов на характер и биологическую сущность опухолевого процесса и ко взаимопониманию в вопросах как диагностики, прогноза заболевания, так и лечения больных с использованием современных схем и методов, соответствующих международным стандартам. Для суждения о спектре и природе существующих форм новообразований, их гистогенезе, морфологическом строении, локализации, особенностях структуры в отдельных органах (органоспецифичности), а также доброкачественности или злокачественности используется Международная классификация, согласно которой выделены 7 основных групп опухолей, что в целом составляет около 300 нозологических единиц:
Следует отметить, что данная классификация имеет лишь ориентировочную, в основном морфологическую направленность, и поэтому не удовлетворяет требованиям всех специалистов-онкологов, в частности клиницистов.
Специальными комиссиями Всемирной организации здравоохранения (ВОЗ) была создана Международная гистологическая классификация опухолей. Серия публикаций, состоящая более чем из 20 самостоятельных книг, изданных на протяжении 80-х годов XX столетия, представляет собой результат значительных международных усилий по созданию единых критериев для гистологического определения, номенклатуры и классификации доброкачественных и злокачественных новообразований. Каждая книга охватывает основную локализацию опухоли или систему органов. Несмотря на то, что классификация является базовой для верификации опухолей прежде всего патоморфологами, при ее создании предусматривалось, что изложенные данные будут служить исходными для клиницистов в диагностике, лечении и прогнозировании опухолевого процесса. Это нашло отражение в предисловии к изданию: “Согласованная Международная классификация опухолей, приемлемая в равной мере для врачей, хирургов, рентгенологов, патоморфологов и статистиков, даст возможность онкологам во всех частях мира сравнивать свои результаты и облегчать сотрудничество между ними”.
Тем не менее понятная и удобная для морфологов “Гистологическая классификация опухолей” оказалась недостаточно информативной и поэтому малоприемлемой для применения в клинической практике врачами-онкологами.
В рамках указанной разработки ВОЗ была также издана “Цитологическая классификация опухолей”.
По наблюдениям клиницистов важными факторами прогноза заболевания для большинства солидных злокачественных опухолей являются их размер, степень прорастания в окружающие органы и ткани и распространение в организме в виде регионарных и отдаленных метастазов. Это послужило основанием для градации опухолей в соответствии со стадией их развития. Такое деление базируется на том, что при локальных опухолях процент выживаемости больных выше, чем при поражениях, которые распространяются за пределы органа. Выделяемые стадии часто расцениваются как “ранние” или “поздние” по отношению к последовательности развития опухолевого процесса во времени. Полагают, что стадия процесса в момент установления диагноза может отражать не только распространенность и темп роста опухоли, но также ее тип и взаимоотношение с ней организма.
В Украине, как и в других странах бывшего СССР, принята следующая классификация злокачественных новообразований по стадиям:
Несмотря на простоту и удобство использования, приведенная классификация имеет определенные недостатки: с ее помощью трудно оценить результаты лечения, что усложняет разработку оптимальных схем лечения; она недостаточно отражает прогностические данные (степень местного распространения опухоли и ее дифференцировки, характер поражения лимфатических узлов), что в свою очередь затрудняет анализ отдаленных результатов. Таким образом, классификация по стадиям является недостаточно информативной. Тем не менее она до настоящего времени применяется в клинической практике.
За рубежом используются иные классификации опухолей по стадиям. Нередко они предусматривают выделение опухолей определенных локализаций (например, опухолей женской репродуктивной системы, согласно классификациям AJCC, FIGO). Многие зарубежные хирурги широко применяют классификацию Дюкса (Dukes), предложенную для стадирования рака толстой кишки, в то время как онкологи в нашей стране с ней мало знакомы. Согласно градации Дюкса, в развитии колоректального рака отмечаются следующие стадии:
А – опухоль ограничена стенкой кишки, не прорастает в окружающие ткани, в регионарных лимфатических узлах нет метастазов;
В – опухоль прорастает в окружающие ткани, но отсутствуют метастазы в регионарных лимфатических узлах;
С1 – опухоль прорастает или не прорастает в окружающие ткани, но в околокишечных лимфатических узлах имеются метастазы;
С2 – опухоль пенетрирует все слои кишечной стенки; лимфатические узлы, расположенные в области перевязанных питающих сосудов, поражены метастазами;
D – имеются отдаленные метастазы.
Показатели 5-летней выживаемости четко коррелируют со стадией заболевания.
Несовершенство существующих классификаций, отсутствие должной систематизации качественных и количественных характеристик злокачественного роста влекут за собой разночтение клинических данных, связанное с отсутствием унифицированных критериев.
Для того, чтобы классификация была доступной для понимания всеми специалистами, участвующими в лечебно-диагностическом процессе, в ней должны быть использованы объективная информативная база клинико-морфологических данных об анатомическом распространении поражения и общепринятые, лаконичные, информативные терминология и номенклатура. Этим требованиям отвечает классификация злокачественных опухолей TNM, в появлении которой большая роль принадлежит Международному противораковому союзу. Она основывается на детальном клиническом и, когда это возможно, гистологическом определении анатомического распространения злокачественных опухолей. То, что клиническая классификация впоследствии может быть дополнена сведениями, полученными при патогистологическом исследовании, и/или данными хирургического вмешательства, является наиболее важной ее особенностью, поскольку именно это служит основой прогнозирования болезни.
Система TNM базируется на трех компонентах:
На основании полученных данных в соответствии с системой TNM и pTNM злокачественные опухоли группируют по стадиям. Формирование таких групп ориентировано на прогноз заболевания, который главным образом зависит от распространенности новообразования к моменту установления диагноза.
Хорошим подспорьем в определении прогноза заболевания является накопленный за последние годы спектр данных по молекулярной биологии, иммуногистохимии, цитогенетике, которые широко используются патоморфологами и постепенно приобретают практическую значимость. Поэтому для грамотной интерпретации таких данных большое значение имеет тесное сотрудничество между клиницистами и патоморфологами.
При пользовании классификацией TNM необходимо учитывать следующие правила.
1. Во всех случаях требуется гистологическое подтверждение диагноза; если его нет, случаи описываются отдельно.
2. Для каждой локализации используют две классификации: а) клиническую, основанную на данных клинического, рентгенологического, эндоскопического и других методов исследования, которое проводилось до лечения; б) патогистологическую (pTNM), постхирургическую, базирующуюся на данных хирургического вмешательства, а также гистологического исследования удаленной опухоли.
3. До лечения необходимо установить анатомическое распространение опухолевого процесса согласно всем трем компонентам системы TNM.
4. Нужно помнить, что клиническая классификация особенно важна для выбора и оценки методов лечения, тогда как данные патогистологического исследования позволяют получить наиболее точные сведения для прогноза и анализа отдаленных результатов лечения.
5. Если есть сомнения относительно того, правильно ли определены компоненты категории TNM, следует выбирать низшую категорию – в сторону меньшего распространения опухолевого процесса.
Большим прогрессом является дальнейшее внедрение в классификацию TNM современных маркеров опухолевого роста. Так, если в TNM-5 при стадировании рака яичника стали учитывать такие опухолевые маркеры, как альфафетопротеин, хорионический гонадотропин и лактатдегидрогеназа, то в TNM-6 при классификации рака молочной железы предусматривается учитывать показатель, именуемый “отдельные клетки опухоли”. Это образования, не превышающие 0,2 мм, меньших размеров, чем микрометастазы, которые трудно определить традиционными методами гистологического исследования. Для их идентификации необходимо иммуногистохимическое или молекулярно-биологическое исследование.
В 6-м издании в отличие от 5-го учитываются так называемые сторожевые лимфатические узлы – первые на пути оттока лимфы от опухоли. Результаты их исследования имеют важное значение при установлении категории N у больных раком молочной железы и меланомой кожи.
Относительно опухоли молочной железы кроме перечисленных выше нововведений внесены также следующие изменения:
В новый вариант классификации внесены существенные изменения, касающиеся меланомы кожи:
Наряду с рассмотренными выше клинико-анатомическими классификациями, которые нужно обязательно использовать для правильного, единообразного формулирования диагноза, определения стадии опухолевого процесса, в Украине применяется клинико-статистическая классификация, предусматривающая распределение больных со злокачественными новообразованиями по клиническим группам. По мере развития опухолевого процесса и в зависимости от результатов лечения клиническая группа для конкретного больного изменяется. Выделяют следующие клинические группы:
1а – больные, у которых подозревают рак; диагноз подлежит верификации;
1б – больные с различными предраковыми состояниями, нуждающиеся в наблюдении и соответствующем лечении;
II – больные с установленным диагнозом “рак”, нуждающиеся в применении специальных методов лечения; среди них выделяют группу лиц, подлежащих радикальному лечению (Па);
III – практически здоровые лица, которые прошли радикальное лечение и не имеют признаков, свидетельствующих о наличии у них опухоли;
IV – больные с первично-запущенным процессом и те, для которых лечение оказалось неэффективным.
В процессе повседневной работы при проведении клинических исследований у врачей-онкологов нередко возникает ряд вопросов, на которые требуются конкретные ответы; появляется также необходимость сопоставить свои данные или принять определенные решения в соответствии с объективными результатами наблюдений, накопленных и обобщенных опытными, авторитетными специалистами. Такая возможность существует – благодаря коллективу ведущих специалистов Европейского общества медикаментозной онкологии (ESMO), которые разработали принципы отбора клинических доказательств целесообразности предлагаемых ими стандартов диагностики и эффективного лечения больных с основными типами злокачественных опухолей. Главным стержнем этой ценной разработки является стадирование опухолей с использованием современных международных классификаций рака.
Предложенные рекомендации изданы под названием “Минимальные стандарты” и переведены на украинский язык официальным представителем Украины в ESMO Ярославом Шпариком.
По каждой из вошедших в издание нозологических форм рака рекомендованы наиболее целесообразные подходы к постановке правильного диагноза и проведению стадирования, а также к оценке факторов риска возникновения рака. Предложен стандартизированный план лечения больных и последующего наблюдения за ними.
Онкологи в большей мере, чем специалисты других областей медицины, преуспели не только в унификации базы данных клинико-морфологических исследований, но и в создании унифицированной статистической информации об онкологических болезнях. Единый подход к оценке и документации сведений о степени распространения опухолей необходим как для формирования диагноза, планирования лечения, анализа его результатов, прогноза заболевания, так и для обмена информацией между медицинскими учреждениями, стимулирования дальнейших исследований.
Рабочая группа, утвержденная Международным агентством по изучению рака, при активном содействии Национального института рака США проделала большую работу по формированию и упорядочению Международной классификации болезней (МКБ) класса II (новообразования) и созданию Международной классификации онкологических болезней – МКБ-0 (первое издание опубликовано в 1976 г., второе, на английском языке, – в 1990 г.).
МКБ-0 содержит специальные инструкции по ее использованию не только патоморфологами, специалистами других профилей, но и работниками канцер-регистров.
В целом МКБ-0 базируется на двух важных аспектах медицинской информации об онкологическом больном – о первичной локализации опухоли и сформулированном патоморфологическом диагнозе, отражающем гистологический тип новообразования и степень его злокачественности – и предназначена для кодирования топографии и морфологии опухолей.
Злокачественные новообразования обозначаются буквой “С”.
Первые четыре из 10 знаков составляют топографический код – С00.0 – С80.9. Следующие шесть знаков отражают морфологическую природу опухолевого процесса.
Шифры 8.000-9989 характеризуют морфологическую картину, пятая цифра после косой линии указывает на характер процесса (О – доброкачественный, 1 – пограничный, 3 – злокачественный. 6 – метастатический), шестая – степень зрелости. В основе морфологического раздела МКБ-0 лежит гистологическая терминология, которая использована в серии “Международная гистологическая классификация опухолей” ВОЗ.
Таким образом, современные “рабочие” классификации опухолей – это важный источник клинико-морфологической информации, составляющий основу для своевременной, правильной диагностики новообразований, прогнозирования заболевания, назначения рационального комплекса лечебных мероприятий, адекватных установленному диагнозу, и последующего динамического наблюдения за больными. По мере накопления новых фундаментальных данных о морфолого-гистогенетических особенностях опухолей, их иммунологических, молекулярно-генетических характеристиках в существующие классификации вносятся уточнения, изменения, дополнения, что в конечном итоге направлено на оптимизацию лечебно-диагностической помощи онкологическим больным.
Статья из журнала “DOCTOR” №4 2003 г.
 Что такое солидные опухоли и в чем их отличие от другой группы — опухолевых заболеваний кроветворной и лимфоидной ткани — лейкозов
Что такое солидные опухоли и в чем их отличие от другой группы — опухолевых заболеваний кроветворной и лимфоидной ткани — лейкозов