Что означает число авогадро в химии
Что такое число Авогадро
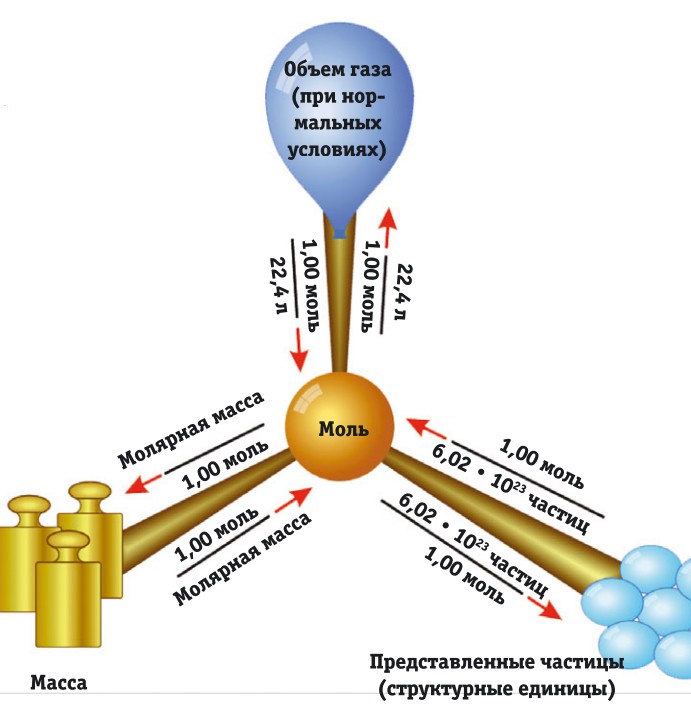
Число Авогадро — это число частиц в одном моле любого вещества (атомов, молекул, ионов и др.), т. е. молекулярная масса в граммах и примерно равно 6,02214076 ⋅ 10²³ моль⁻¹. Ещё число Авога́дро называется постоянная Авогадро или константа Авогадро.
Более кратко это число может обозначаться как 6,02 ⋅ 10²³, например: 1 моль железа (Fe) содержит 6,02 · 10²³ атомов Fe.
Моль — это стандартная единица измерения в химии, которая позволяет взвешивать два вещества, таким образом, что получается равное количество атомов (молекул или др.) в обоих веществах.
Обычно число Авогадро обозначается как 
Чему равен 1 моль?
В одном моле 6,02·10²³ молекул (это число Авогадро).
Что показывает постоянная Авогадро?
Это количество молекул (атомов или др.) вещества на моль. Иногда требуется узнать количество молекул (атомов или др.), которые принимают участие в химической реакции.
Моль — это стандартная единица измерения количества вещества, в котором есть столько же частиц, сколько атомов в 12 г. углерода. Это количество равно постоянной Авогадро, т. е. примерно 6,02 · 10²³ атомов на моль.
Формулы Авогадро
Закон Авогадро
Два газа, взятые в равных объёмах и при одинаковой температуре и давлении, будут иметь одинаковое число молекул (этот закон работает только для газов).
Следствие о молекулярном весе
При равных объёмах любые газы вмещают одинаковое число молекул, следовательно, молекулярный вес (m) газа будет пропорционален его плотности (d):
m = k · d, (где k – коэффициент пропорциональности).
При одинаковых температурах и давлении объем газа (V) прямо пропорционален количеству газа (n):
V / n = k, (где k – коэффициент пропорциональности).
Следствие о молекулярном объёме
При одинаковых температурах и давлении, равное число молекул двух разных газов займут одинаковый объём:
Можно определить количество газообразного вещества (n), поделив объём газа (V) на молярный объём (Vm).
Следствие о молекулярной плотности
ρ = m / V, где ρ — плотность, m — масса, V — объём.
Эта формула, при нормальных условиях и 1 моль газа выглядит таким образом:
Чтобы получить относительную плотность газа (ρ (газа)), нужно поделить молярную массу газа (M) на молярный объём (Vm).
Авогадро и число его имени
Евгений Мейлихов,
доктор физико-математических наук
«Наука и жизнь» №4, 2017
Итальянский учёный Амедео Авогадро — современник А. С. Пушкина — был первым, кто понял, что количество атомов (молекул) в одном грамм-атоме (моле) вещества одинаково для всех веществ. Знание же этого числа открывает путь к оценке размеров атомов (молекул). При жизни Авогадро его гипотеза не получила должного признания. Истории числа Авогадро посвящена новая книга Евгения Залмановича Мейлихова, профессора МФТИ, главного научного сотрудника НИЦ «Курчатовский институт».
Если бы в результате какой-либо мировой катастрофы все накопленные знания оказались бы уничтоженными и к грядущим поколениям живых существ пришла бы только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это — атомная гипотеза: все тела состоят из атомов — маленьких телец, находящихся в беспрерывном движении.
Р. Фейнман, «Фейнмановские лекции по физике»
В конце 2011 года на XXIV Генеральной конференции по мерам и весам единогласно принято предложение определить моль в будущей версии Международной системы единиц (СИ) таким образом, чтобы избежать его привязки к определению грамма. Предполагается, что в 2018 году моль будет определён непосредственно числом Авогадро, которому будет приписано точное (без погрешности) значение, базирующееся на результатах измерений, рекомендованных CODATA. Пока же число Авогадро является не принимаемой по определению, а измеряемой величиной.
Эта константа названа в честь известного итальянского химика Амедео Авогадро (1776–1856), который хотя сам этого числа и не знал, но понимал, что это очень большая величина. На заре развития атомной теории Авогадро выдвинул гипотезу (1811 год), согласно которой при одинаковых температуре и давлении в равных объёмах идеальных газов содержится одинаковое число молекул. Позже было показано, что эта гипотеза есть следствие кинетической теории газов, и сейчас она известна как закон Авогадро. Его можно сформулировать так: один моль любого газа при одинаковых температуре и давлении занимает один и тот же объём, при нормальных условиях равный 22,41383 л (нормальным условиям соответствуют давление P0 = 1 атм и температура T0 = 273,15 К). Эта величина известна как молярный объём газа.
Число Авогадро — одна из важных физических постоянных, сыгравших большую роль в развитии естественных наук. Но является ли она «универсальной (фундаментальной) физической постоянной»? Сам этот термин не определён и обычно ассоциируется с более или менее подробной таблицей числовых значений физических констант, которые следует использовать при решении задач. В связи с этим фундаментальными физическими постоянными зачастую считаются те величины, которые не являются константами природы и обязаны своим существованием всего лишь выбранной системе единиц (таковы, например, магнитная и электрическая постоянные вакуума) или условным международным соглашениям (такова, например, атомная единица массы). В число фундаментальных констант часто включают многие производные величины (например, газовую постоянную R, классический радиус электрона re = e 2 / mec 2 и т. п.) или, как в случае с молярным объёмом, значение некоторого физического параметра, относящегося к специфическим экспериментальным условиям, которые выбраны лишь из соображений удобства (давление 1 атм и температура 273,15 К). С этой точки зрения число Авогадро есть истинно фундаментальная константа.
Истории и развитию методов определения этого числа и посвящена настоящая книга. Эпопея длилась около 200 лет и на разных этапах была связана с многообразными физическими моделями и теориями, многие из которых не потеряли актуальности и по сей день. К этой истории приложили руку самые светлые научные умы — достаточно назвать А. Авогадро, Й. Лошмидта, Дж. Максвелла, Ж. Перрена, А. Эйнштейна, М. Смолуховского. Список можно было бы и продолжить.
Автор должен признаться, что идея книги принадлежит не ему, а Льву Фёдоровичу Соловейчику — его однокашнику по Московскому физико-техническому институту, человеку, который занимался прикладными исследованиями и разработками, но в душе остался физиком-романтиком. Это человек, который (один из немногих) продолжает «и в наш жестокий век» бороться за настоящее «высшее» физическое образование в России, ценит и в меру сил пропагандирует красоту и изящество физических идей. Известно, что из сюжета, который А. С. Пушкин подарил Н. В. Гоголю, возникла гениальная комедия. Конечно, здесь не тот случай, но, может быть, и эта книга покажется кому-то полезной.
Эта книга — не «научно-популярный» труд, хотя и может показаться таковым с первого взгляда. В ней на некотором историческом фоне обсуждается серьёзная физика, используется серьёзная математика и обсуждаются довольно сложные научные модели. Фактически книга состоит из двух (не всегда резко разграниченных) частей, рассчитанных на разных читателей — одним она может показаться интересной с историко-химической точки зрения, а другие, возможно, сосредоточатся на физико-математической стороне проблемы. Автор же имел в виду любознательного читателя — студента физического или химического факультета, не чуждого математики и увлечённого историей науки. Есть ли такие студенты? Точного ответа на этот вопрос автор не знает, но, исходя из собственного опыта, надеется, что есть.
Введение (в сокращении) к книге: Мейлихов Е. З. Число Авогадро. Как увидеть атом. — Долгопрудный: ИД «Интеллект», 2017.
Молекулярная физика. Моль. Постоянная Авогадро. Количество вещества.
Моль — количество вещества, масса которого, выраженная в граммах, численно равна относительной атомной (молекулярной) массе.
Моль — единица количества вещества в СИ (одна из основных единиц СИ).
В 1 моле содержится столько молекул (атомов или других частиц вещества), сколько атомов содержится в 0,012 кг нуклида углерода 12 С с атомной массой 12.
Из этого определения следует, что в одном моле любого вещества содержится одно и то же число атомов или молекул.
Число это называется постоянной Авогадро и обозначается NA:
Постоянная Авогадро (число Авогадро) — это число атомов (молекул, или других структурных элементов вещества), содержащихся в 1 моле.
Постоянная Авогадро — одна из фундаментальных физических констант. Она входит в некоторые другие постоянные, например, в постоянную Больцмана.
Количество вещества.
Количество вещества — это число частиц вещества (атомов, молекул), выраженное в молях. Учитывая определение моля и числа Авогадро, можно сказать, что количество вещества v равно отношению числа молекул N в данном теле к постоянной Авогадро NA, т.е. к числу молекул в 1 моле вещества:

Число Авогадро
Закон Авогадро гласит, что в одинаковых объемах идеальных газов при одинаковом давлении и одинаковой температуре содержится равное число молекул. Другими словами, моль любого газа при одинаковых давлении и температуре занимает один и тот же объем. Моль — количество вещества, которое содержит столько же структурных единиц, сколько содержится в 12 г изотопа углерода 12 С. Структурные единицы — это любые частицы (атомы, молекулы, электроны, ионы и т.д.). Их количество в 1 моле вещества называется числом Авогадро. Оно позволяет определить такие величины, как заряд электрона, масса атома или молекулы и др.
Как же все это понимать? Возьмем химическую реакцию, которая происходит при горении дерева. При соединении углерода древесины с кислородом воздуха образуется двуокись углерода СО2. У одного атома углерода такая же масса, как у 12 атомов водорода, а у двух атомов кислорода — как у 32 атомов водорода. Следовательно, соотношение масс участвующих в реакции углерода и кислорода всегда будет составлять 12 : 32. Соотношение остается неизменным при любых единицах измерения: 12 г углерода всегда реагируют с 32 г кислорода, 12 ц углерода — с 32 ц кислорода и т.д. В химических реакциях главное — относительное количество атомов каждого элемента, который участвует в реакции.
Следовательно, в 12 г углерода столько же атомов, сколько в 16 г кислорода. Именно это количество атомов химики и называют молем. Если принять относительную атомную массу вещества за n (иными словами, его атом в n раз тяжелее атома водорода), то масса одного моля этого вещества будет равна n г. Моль — мера количества вещества, как пара, десяток или сотня. Сапог в паре всегда два, яиц в десятке всегда десять, и в моле вещества всегда одно и то же количество атомов, ионов или молекул.
Но как ученые к этому пришли? Ведь сосчитать атомы очень сложно. Все началось с исследований итальянского химика Амедео Авогадро. Он знал, что, когда между газами протекает химическая реакция, соотношение между объемами газов равно соотношению между количествами их молекул. Так, когда три молекулы водорода Н2 вступают в реакцию с одной молекулой азота N., то образуется две молекулы аммиака NH3, а объем участвующего в реакции водорода оказывается в три раза больше объема азота. Авогадро пришел к выводу, что количество молекул в обоих объемах находится в соотношении 3:1, т. е. в равных объемах газа содержится равное количество атомов или молекул. Это и есть известный сегодня закон Авогадро.
Чему равно число Авогадро?
Постоянная Авогадро
Число́ Авога́дро, константа Авогадро — физическая константа, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле вещества. Определяется как количество атомов в 12 граммах (точно) чистого изотопа углерода-12. Обозначается обычно как NA, реже как L [1].
Значение числа Авогадро, рекомендованное 2006 году [2]:
Моль — количество вещества, которое содержит NA структурных элементов (т.е. столько же, сколько атомов содержится в 12 г 12 С), причем структурными элементами обычно являются атомы, молекулы, ионы и др. Масса 1 моля вещества, выраженная в граммах, численно равна его молекулярной массе. Так, 1 моль натрия имеет массу 22,9898 г и содержит примерно 6,02·10 23 атомов; 1 моль фторида кальция CaF2 имеет массу (40,08 + 2×18,998) = 78,076 г и содержит 6,02·10 23 молекул, как и 1 моль тетрахлорида углерода CCl4, масса которого равна (12,011 + 4×35,453) = 153,823 г и т. п.
Закон Авогадро
На заре развития атомной теории (1811) А. Авогадро выдвинул гипотезу, согласно которой при одинаковых температуре и давлении в равных объёмах идеальных газов содержится одинаковое число молекул. Позже было показано, что эта гипотеза есть необходимое следствие кинетической теории, и сейчас она известна как закон Авогадро. Его можно сформулировать так: один моль любого газа при одинаковых температуре и давлении занимает один и тот же объем, при нормальных условиях равный 22,41383 л. Эта величина известна как молярный объем газа.
Сам Авогадро не делал оценок числа молекул в заданном объеме, но понимал, что это очень большая величина. Первую попытку найти число молекул, занимающих данный объем, предпринял в 1865 Й. Лошмидт; было установлено, что в 1 см³ идеального газа при нормальных условиях содержится 2,68675·10 19 молекул. По имени этого ученого указанная величина была названа числом (или постоянной) Лошмидта. С тех пор было разработано большое число независимых методов определения числа Авогадро. Превосходное совпадение полученных значений является убедительным свидетельством реального существования молекул.
Связь между константами
См. также
Полезное
Смотреть что такое «Постоянная Авогадро» в других словарях:
постоянная Авогадро — Avogadro konstanta statusas T sritis Standartizacija ir metrologija apibrėžtis Apibrėžtį žr. priede. priedas( ai) Grafinis formatas atitikmenys: angl. Avogadro constant vok. Avogadro Konstante, f; Avogadrosche Konstante, f rus. константа Авогадро … Penkiakalbis aiškinamasis metrologijos terminų žodynas
постоянная Авогадро — Avogadro konstanta statusas T sritis fizika atitikmenys: angl. Avogadro’s constant; Avogadro’s number vok. Avogadro Konstante, f; Avogadrosche Konstante, f rus. постоянная Авогадро, f; число Авогадро, n pranc. constante d’Avogadro, f; nombre… … Fizikos terminų žodynas
постоянная Авогадро — Avogadro konstanta statusas T sritis Energetika apibrėžtis Apibrėžtį žr. priede. priedas( ai) MS Word formatas atitikmenys: angl. Avogadro’s constant vok. Avogadro Konstante, f; Avogadrosche Konstante, f rus. константа Авогадро, f; постоянная… … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
АВОГАДРО ПОСТОЯННАЯ — (Авогадро число) (NA), число молекул или атомов в 1 моле вещества; NA=6,022?1023 моль 1. Названа по имени А. Авогадро … Современная энциклопедия
Авогадро постоянная — (Авогадро число) (NA), число молекул или атомов в 1 моле вещества; NA=6,022´1023 моль 1. Названа по имени А. Авогадро. … Иллюстрированный энциклопедический словарь
Авогадро Амедео — Авогадро (Avogadro) Амедео (9.8.1776, Турин, ‒ 9.7.1856, там же), итальянский физик и химик. Получил юридическое образование, затем изучал физику и математику. Член корреспондент (1804), ординарный академик (1819), а затем директор отделения… … Большая советская энциклопедия
Авогадро — (Avogadro) Амедео (9.8.1776, Турин, 9.7.1856, там же), итальянский физик и химик. Получил юридическое образование, затем изучал физику и математику. Член корреспондент (1804), ординарный академик (1819), а затем директор отделения физико… … Большая советская энциклопедия
АВОГАДРО ПОСТОЯННАЯ — (число Авогадро), число структурных элементов (атомов, молекул, ионов или др. ч ц) в ед. кол ва в ва (в одном моле). Названа в честь А. Авогадро, обозна чается NA. А. п. одна из фундаментальных физических констант, существенная для определения мн … Физическая энциклопедия
ПОСТОЯННАЯ — величина, имеющая неизменное значение в области её использования; (1) П. Авогадро то же, что Авогадро (см.); (2) П. Больцмана универсальная термодинамическая величина, связывающая энергию элементарной частицы с её температурой; обозначается k,… … Большая политехническая энциклопедия