Что отвечает за синтез белка
Что отвечает за синтез белка
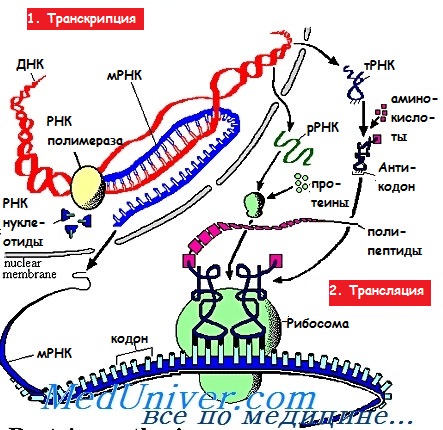
Белки, образуемые из полипептидов, — основные структурные компоненты тела человека, они катализируют большинство процессов метаболизма. Полипептидом называют цепь, состоящую из аминокислот, последовательность которых зависит от последовательности оснований в иРНК в соответствии с «генетическим кодом».
Каждая аминокислота представлена в иРНК одной или несколькими группа ми, называемыми триплетами кодонов, а их интерпретация в качестве полипептида носит имя трансляции. Трансляция иРНК происходит в рибосомах цитоплазмы в направлении от 5′- к З’-концу. Образуемые в результате полипептиды затем превращаются в белки.
Функциональные свойства белков обусловлены в основном их активными центрами, формирующимися при образовании третичной и четвертичной структур.
Генетический код для синтеза белка
Для трансляции необходимы молекулы тРНК, которые кодируют аминокислоты, соответствующие последовательности антикодона. Большинство аминокислот кодированы несколькими кодонами, исключение составляют триптофан и метионин (кодированы одним кодоном). Три из 64 возможных триплетных комбинаций А, Ц, Г и У в иРНК кодируют СТОП-сигналы: УГА, УАГ и УАА.
АУГ кодирует метионин и служит СТАРТ-сигналом, а также одновременно определяет амино-(N-)терминальный конец полипептида и формирует одну из трёх возможных рамок считывания. Генетический код митохондриальной ДНК немного отличается.
Трансляция при синтезе белка
Инициация. Малая субъединица рибосомы, содержащая несколько факторов инициации и кодирующая метионин метионил-тРНК, связывается с 5′-кэпом иРНК, а затем начинает скольжение вдоль молекулы иРНК и, достигнув первой АУГ-последовательности, сцепляется с ней. При этом происходит высвобождение факторов инициации, а большая субъединица рибосомы прикрепляется к малой, после чего запускается процесс трансляции.
Большая субъединица рибосомы имеет в своём составе два специализированных участка, известных как А-сайт (аминоацил-тРНК-связывающий участок) и Р-сайт (пептидил-тРНК-связывающий участок). В конце инициации к Р-сайту прикреплена заряженная мет-тРНК, антикодон которой сцеплен с АУГ-кодоном, в то время как А-сайт свободен.
Элонгация. В соответствии с расположенным рядом кодоном иРНК к А-сайту при помощи растворимого фактора элонгации 1 (EF1) прикрепляется аминоацил-тРНК. Под воздействием пептидилтрансферазы возникает пептидная связь между аминогруппой (-NH2) аминокислоты на А-сайте и карбоксильной группой (-СООН) на Р-сайте, при этом первая тРНК отделяется.
Фермент транслоказа обеспечивает отделение свободной тРНК, движение рибосомы вдоль молекулы иРНК, а также перенос растущей пептидной цепочки от А-сайта к Р-сайту. Для осуществления данного процесса необходим фактор EF2.
Митохондриальные иРНК транслируются при помощи митохондриоспецифических тРНК.
Терминация. Элонгация продолжается до тех пор, пока на пути рибосомы не встретится один из терминирующих (СТОП) кодонов, которые распознают благодаря мультивалентным факторам освобождения (терминации, RF). При этом специфичность пептидилтрансферазы изменяется таким образом, что к | белку прикрепляется молекула воды. Затем рибосома отделяется и распадается на составляющие её субъединицы, освобождая готовый полипептид.
Для синтеза полипептида, длина которого составляет примерно 400 аминокислот, в среднем необходимо до 20 с.
Как только одна рибосома освобождает кэп иРНК, к нему присоединяется следующая, формируя полирибосому или полисому. Время жизни иРНК составляет несколько часов.
Строение белка
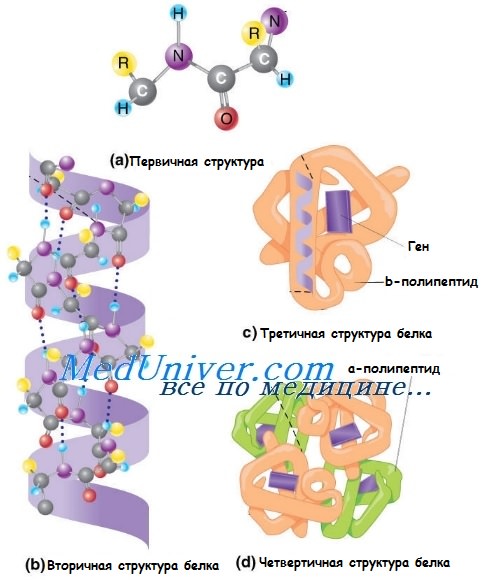
Аминокислотная последовательность полипептида обусловливает его первичную структуру.
Вторичная структура белка представляет собой трёхмерное расположение частей полипептида: а-спираль, коллагеновая про-а-спираль или бета-складочная конформация.
Третичная структура белка образуется при самоукладке всех вторичных структур полипептида.
Четвертичная структура белка — окончательная конформация мультимерного белка, такого, как, например, гемоглобин, который состоит из двух а-глобулиновых и двух бета-глобулиновых мономеров, а также молекулы гема и атома двухвалентного железа. Коллагеновые волокна состоят из трёхспиральных нитей, которые образованы тремя про-а-спиралями.
Чаще всего структуру белка поддерживают дисульфидные мосты, которые возникают между серосодержащими остатками цистеина расположенных рядом цепей, в то время как ферментативные свойства зависят прежде всего от распределения заряженных групп.
Посттрансляционные изменения белка
К посттрансляционным изменениям относят удаление N-терминального метионина и дробление. Объединение происходит между одинаковыми и разными полипептидами, а также между простетическими группами, к которым относят гем.
Полипептиды, предназначенные для внеклеточной (экстрацеллюлярной) секреции, вначале подвергаются гликозилированию в эндоплазматическом ретикулуме и аппарате Гольджи. Для их отбора имеет значение сигнальный пептид, расположенный около N-конца, который связывается с сигналраспознающей частицей, состоящей из цитоплазматической 7SL-PHK и шести специфических белков.
При помощи сигнального пептида происходит связывание с мембранным рецептором эндоплазматического ретикулума. Сразу после синтеза полипептид переносится через мембрану; как только появляется его С-конец (карбоксильная часть), сигнальный пептид отделяется. Затем полипептиды в составе везикул, которые отпочковываются от эндоплазматического ретикулума, попадают к аппарату Гольджи.
Гликозилированию обычно подвержен N-конец пептида. При этом происходит присоединение олигосахарида к NH2-rpynne боковой цепи аспарагина (например, при производстве антител и лизоцима). Иногда олигосахарид присоединяется к ОН-группе боковой цепи серина, треонина или гидроксилизина (например, секретируемые антигены групп крови системы АВО).
Среди других модификаций различают гидроксилирование лизина и пролина, играющее важную роль в образовании про-а-спиралей коллагена, сульфатацию тирозина, служащую сигналом к компартментализации (пространственному разделению), а также липидизацию остатков цистеина и глицина, необходимую для их прикрепления к фосфолипидной мембране.
Ацетилирование лизина в гистоне Н4 влияет на его связывание с ДНК. Протеинкиназы фосфорилируют остатки серина и тирозина и могут регулировать ферментативную способность энзимов, как в случае с каскадной сигнальной трансдукцией протоонкогенов.
Медицинское значение понимания синтеза белка
В основе механизма возникновения болезни клеточных включений лежит недостаточность гликозилирования лизоцима. Рицин, входящий в состав бобов клещевины обыкновенной (Ricinus communis), блокирует EF2, а дифтерийный токсин — транслоказу.
Мишенью для большого количества антибиотиков служат процессы трансляции, характерные для прокариот. Например, эритромицин разрушает транслоказу, хлорамфеникол взаимодействует с пептидилтрансферазой, тетрациклин препятствует связыванию аминоацил-тРНК, пуромицин по своей структуре сходен с аминоацил-тРНК, а стрептомицин связывается с малой субъединицей бактериальных рибосом. При этом митохондрии человека имеют эволюционное родство с бактериями, поэтому некоторые антибиотики оказывают влияние и на митохондриальные функции.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Общая информация о биосинтезе белка: значение, код ДНК, процесс считывания и передачи информации
Общая информация о биосинтезе белка
Значение биосинтеза белка в клетке
Процесс биосинтез белка — наиболее значимая реакция пластического обмена. Способность синтезировать белок есть у всех клеток живых организмов: сложных и простых, грибов, растений и животных. Клетка содержит несколько тысяч различных белков. При этом, для каждого вида клеток характерны специфические белки.
Способность к синтезу собственных уникальных белков является наследственной и сохраняется на протяжении всей жизни организма. Биосинтез белков происходит наиболее интенсивно, когда клетки активно растут и развиваются.
Что такое биосинтез белка?
Процессом синтеза белка называется — процесс, состоящий из множества стадий, на которых происходит синтез белковой макромолекулы и последующее созревание (формирование) белка, и происходящий в живых организмах.
Фотосинтез связан с большими энергетическими затратами. Благодаря ему происходит обеспечение клеток так называемым строительным материалом, биологическими катализаторами (ферментами), регуляторами и средствами защиты организма.
Каково значение белков в клетке? Значение белков неоценимо. Для этого рассмотрим, что такое биосинтез подробнее.
Код ДНК
Определение места синтеза белковых макромолекул — наивысшее достижение молекулярной биологии. ДНК играет ключевую роль в определении структуры синтезируемого белка. Молекула ДНК содержит информацию о первичной структуре молекулы белка.
Геном — часть молекулы ДНК, содержащая информацию о первичной структуре одного белка.
Генетический код — единая для всех живых организмов система сохранения полной наследственной информации.
Если говорить о структуре, то она представляет собой определенную последовательность нуклеотидов в молекулах нуклеиновых кислот. Эта последовательность задает последовательность введения аминокислотных остатков в полипептидную цепь в ходе ее синтеза.
Согласно исследованиям ученых, каждая аминокислота в полипептидной цепи кодируется последовательностью, которая состоит из 3 нуклеотидов (это триплет нуклеотидов).
Всего выделяют 20 основных аминокислот. Каждая аминокислота имеет способность кодироваться несколькими разными триплетами.
Матрица — молекула ДНК, которая содержит информацию.
Процесс считывания и передачи информации
Расположение молекул ДНК — ядро клетки. Также они могут находиться в пластидах и митохондриях. В определенный момент происходит деспирализация молекулы ДНК и расхождение ее параллельных цепей.
В соответствии с принципом комплементарности, на этих цепях происходит синтез небольших молекул и-РНК (информационной РНК). Это транскрипция или считывание.
Молекула и-РНК, синтезированная таким образом, направляется к месту синтеза белка.
Трансляция — процесс переноса и-РНК из ядра к месту синтеза белка.
Механизм биосинтеза белка
Синтез белковых молекул осуществляется на мембранах ЭПС (эндоплазматическая сеть). Рибосома является органеллой, которая отвечает за синтез белка. Рибосомы, нанизываясь на молекулу и-РНК, формируют полисому. Молекула т-РНК (транспортная РНК), которая несет кислотный остаток, подходит к каждой рибосоме.
т-РНК отличается формой трилистика: верхушка — это триплет нуклеотидов или антикодон. Он формирует комплементарную пару с соответствующим триплетом и-РНК (кодоном).
Рибосома в процессе синтеза белка надвигается на нитевидную молекулу и-РНК, которая оказывается двумя ее субъединицами. Присоединение т-РНК к и-РНК происходит в определенном месте — в месте совпадения кодона и антикодона. Присоединение аминокислотных остатков к синтезируемой цепи происходит при помощи полипептидных связей. Происходит отсоединение т-РНК, после чего она покидает рибосому.
Это продолжается до завершения синтеза нити аминокислотных остатков (белковой молекулы).
Заключительный этап — приобретение синтезированным белком пространственной структуры. Благодаря соответствующим ферментам от него отщепляются лишние аминокислотные остатки, происходит введение небелковых фосфатных, карбоксильных и других групп, присоединение углеводов, липидов и т. д. Белок «созревает». Как только все эти процессы заканчиваются, молекула белка становится полностью функционально активной.
Биосинтез белка и генетический код: транскрипция и трансляция белка
Биосинтез белка и генетический код
Биосинтез белка — это ферментативный процесс синтеза белков в клетке, в котором принимают участие три структурных элемента клетки: ядро, цитоплазма и рибосомы.
Молекулы ДНК в ядре клетки сохраняют информацию обо всех белках, синтезирующихся в этой клетке. Эта информация находится в зашифрованном виде — шифруется 4-буквенным кодом.
Генетический код представляет собой последовательность расположения нуклеотидов в молекуле ДНК, определяющей последовательность аминокислот в молекуле белка.
Генетический код обладает следующими свойствами:
К примеру, такая кислота как цистеин кодируется при помощи триплета А-Ц-А. В отношении валина — это Ц-А-А.
Если взять аминокислоту тирозин, то она кодируется при помощи двух триплетов.
УАГ, УАА, УГА — три несодержательных кодона, не кодирующие аминокислоты. Предполагается, что они выступают в качестве стоп-сигналов, благодаря которым происходит разделение генов в молекуле ДНК.
Ген — участок молекулы ДНК, для которого свойственна определенная последовательность нуклеотидов. Ген определяет синтез одной полипептидной цепи.
Этапы биосинтеза белка: транскрипция и трансляция
Транскрипция белка
Этапы биосинтеза белка основаны на двух процессах: транскрипции и трансляции.
Самый популярный вопрос в рамках этой темы — где происходит синтез белка. И только потом разбираются с этапами синтеза белка (и схемой биосинтеза белка).
Любая белковая молекула имеет структуру, закодированную в ДНК. В ее синтезе эта ДНК не принимает непосредственного участия. Роль белковой молекулы — роль матрицы для синтеза РНК.
Далее охарактеризуем функции различных видов РНК в биосинтезе белка.
Где и как происходит биосинтез белка? Синтез белка происходит в, а точнее, синтез белка происходит на рибосомах — в основном они размещаются в цитоплазме. Поэтому, чтобы генетическая информация из ДНК передалась к месту, где белок синтезируется, необходим посредник.
Роль такого посредника играет иРНК.
Первый этап биосинтеза белка — транскрипция.
Транскрипция (переписывание) — процесс синтеза молекулы иРНК на одной цепи молекулы ДНК, в основе которого лежит принцип комплементарности.
Биосинтез белка происходит в рибосомах — с этим мы разобрались.
Где происходит транскрипция? Этот процесс осуществляется в ядре клетки.
Транскрипция происходит в одно и то же время не на всей молекуле ДНК — для этого достаточно одного небольшого участка, отвечающего за определенный ген. Часть двойной спирали ДНК раскручивается, и короткий участок одной из цепей оголяется. Роль матрицы в синтезе молекул иРНК выполняет этот же участок.
Далее в дело вступает фермент РНК-полимераза, который движется вдоль этой цепи. Он соединяет нуклеотиды в цепь иРНК, тем самым удлиняя ее.
Процесс транскрипции осуществляется одновременно на нескольких генах одной хромосомы и на генах разных хромосом.
иРНК, образованная в результате, имеет последовательность нуклеотидов — точную копию последовательности нуклеотидов на матрице.
Если молекула ДНК содержит азотистое основание цитозин, то иРНК — гуанин и наоборот. Комплементарная пара ДНК — аденин-тимин, РНК — аденин-урацил.
тРНК и рРНК (другие типы РНК) синтезируются на специальных генах.
Специальные триплеты строго фиксируют начало и конец синтеза всех типов РНК на матрице ДНК. Они же осуществляют контроль запуска и остановку синтеза (инициирующие и терминальные). Между генами они играют роль «разделительных знаков».
Аминокислоты соединяются с тРНК в цитоплазме. По своей форме молекула тРНК — лист клевера. Вверху этого листа находится антикодон: триплет нуклеотидов, отвечающий за кодировку аминокислоты (ее эта тРНК и переносит).
Количество тРНК определяется количеством аминокислот.
Так как много аминокислот кодируется при помощи нескольких триплетов, то количество тРНК превышает 20. Сегодня известно примерно 60 тРНК.
Ферменты — связующее звено между аминокислотами и тРНК. С помощью молекул тРНК осуществляется транспортировка аминокислот к рибосомам.
Кратко о трансляции в биологии
Что такое трансляция в биологии и как связан с трансляцией биосинтез белка?
В биологии трансляция — это процесс реализации информации о структуре белка, представленной в иРНК последовательностью нуклеотидов, как последовательности аминокислот в синтезируемой молекуле белка.
Как и где происходит биосинтез белка в рамках трансляции и какова схема синтеза белка?
Первый этап трансляции белка — присоединение иРНК к рибосоме. Далее трансляция в биологии — это нанизывание первой рибосомы, синтезирующей белок, на иРНК. Далее трансляция синтеза белка основывается на нанизывании новой рибосомы — по мере того, как предыдущая рибосома продвигается на конец иРНК, который освобождается.
Одна иРНК может одновременно вмещать свыше 80 рибосом, синтезирующих один и тот же белок.
Полирибосома или полисома — группа рибосом, соединенных с одной иРНК,
Информация, записанная на иРНК (а не рибосома), определяет вид синтезируемого белка. Разные белки могут синтезироваться одной и той же рибосомой. Рибосома отделяется от иРНК после того, как синтез белка завершается. Заключительный этап трансляции — это синтез белка или его поступление в эндоплазматическую сеть.
Рибосома включает две субъединицы: малую и большую. Присоединение молекулы иРНК происходит к малой субъединице. Место, в котором рибосома и иРНК контактируют, содержит 6 нуклеотидов (2 триплета). Из цитоплазмы к одному из триплетов постоянно подходят тРНК с различными аминокислотами. Своим антикодоном они касаются кодона иРНК. В случае комплементарности кодона и антикодона, возникает пептидная связь: она образуется между аминокислотой уже синтезированной части белка и аминокислотой, доставляемой тРНК.
Фермент синтетазы участвует в соединении аминокислот в молекулу белка. После отдачи аминокислоты молекула тРНК переходит в цитоплазму, в результате чего рибосома перемещается на один триплет нуклеотидов. Таким образом, происходит последовательный синтез полипептидной цепи. Этот процесс длится до момента достижения рибосомой одного из трех терминирующих кодонов: УАА, УАГ или УГА. Как только это происходит, синтез белка останавливается.
Последовательность того, как аминокислоты включаются в цепь белка, определяется последовательностью кодонов иРНК. В каналы эндоплазматического ретикулюма поступают синтезированные белки. Синтез одной молекулы белка в клетке происходит в течение 1-2 минут.
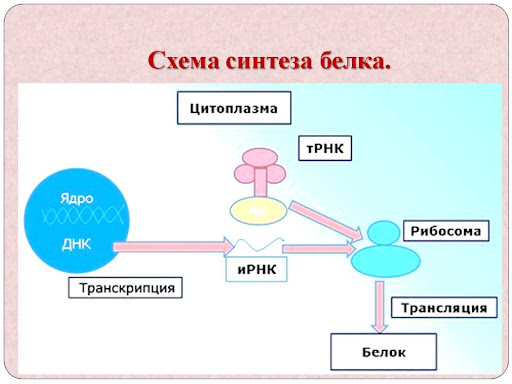
Схема синтеза белка выглядит следующим образом:
Из схемы биосинтеза белка выше вы можете понять, на чем осуществляется синтез белков, как происходит биосинтез белка, и что кроется за трансляцией и транскрипцией.
Также предлагаем изучить таблицу биосинтеза белка. Здесь описано, как осуществляется синтез белков в клетке, описываются кратко транскрипция и трансляция (этапы синтеза белка).
Таблица биосинтеза белка:
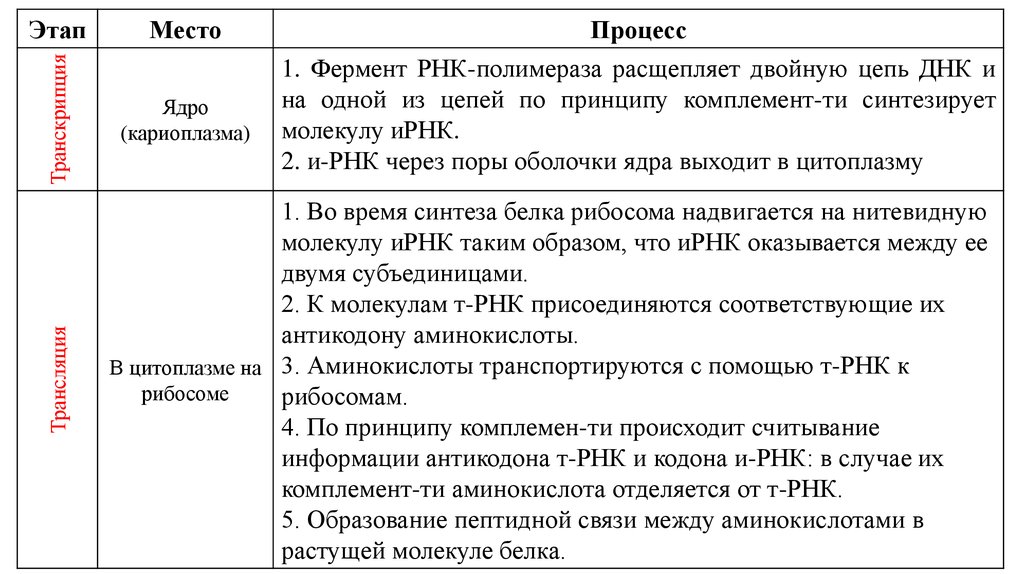
Из таблицы становится ясно, как проходит синтез белка, какие основные этапы синтеза белка, какова роль транскрипции в биосинтезе белка, где происходит синтез белков (место), а также кратко описаны стадии биосинтеза белка.
Таким образом мы охарактеризовали функции различных видов РНК в биосинтезе белков. На примере трансляции и транскрипции мы рассмотрели основные этапы биосинтеза белка.
Это информация о синтезе (биосинтезе) белка кратко.
Как старение влияет на синтез белка
Как старение влияет на синтез белка
Старая (слева) и молодая (справа) мыши существенно различаются по уровню экспрессии генов, связанных с работой иммунной системы, метаболизмом и способностью организма к восстановлению
Автор
Редактор
В последние годы старение как биологический процесс привлекает все большее внимание молекулярных биологов, которые исследуют, что происходит в стареющем организме на молекулярном уровне. Группа исследователей из НИИ ФХБ имени А.Н. Белозерского, Института молекулярной биологии РАН имени В. А. Энгельгардта и Гарвардской медицинской школы изучила, как в ходе старения изменяются транскрипция и трансляция ряда генов, связанных с работой иммунной системы, метаболизмом и защитой от повреждений, а также описала некоторые любопытные возрастные изменения, затрагивающие динамику трансляции.
Старение как биологический феномен привлекает внимание не только биохакеров, стремящихся максимально увеличить продолжительность жизни, но и молекулярных биологов, занимающихся фундаментальной наукой. И их старания не проходят даром.
Например, сейчас известно, что в ходе жизни организма в его тканях накапливаются неправильно уложенные, окисленные или иным образом модифицированные белки, которые не только не выполняют свою функцию должным образом, но и могут образовывать нерастворимые скопления, нарушающие функционирование целых тканей [1].
Несколько исследований продемонстрировали, что с возрастом в организме в целом снижается интенсивность синтеза белка, уменьшается концентрация факторов инициации и элонгации трансляции, замедляется аминоацилирование тРНК. Сообщается, что в ходе старения происходит интенсивное метилирование промоторов генов рРНК, а концентрация самих рРНК уменьшается [1].
Вместе с тем биологические виды, отличающиеся необычно высокой для своей таксономической группы продолжительностью жизни, как правило, характеризуются очень стабильным протеомом и высокой устойчивостью к окислению белков. Примечательно, что виды, у которых в целом интенсивность синтеза белка понижена, характеризуются повышенной продолжительностью жизни, кроме того, видам-долгожителям вроде голого землекопа [2] часто присущи высокоточный аппарат трансляции и низкий кругооборот белков [1].
Подробнее о существующих теориях старения, влиянии питания на старение и различных аспектах этого любопытнейшего биологического явления читайте в нашем спецпроекте «Старение и долголетие» [5], а также в статьях [6], [7].
О рутинной работе рибосом и их неожиданных функциях читайте в статьях «Рибосома за работой» [8] и «Чего вы не знаете о рибосоме. » [9]. — Ред.
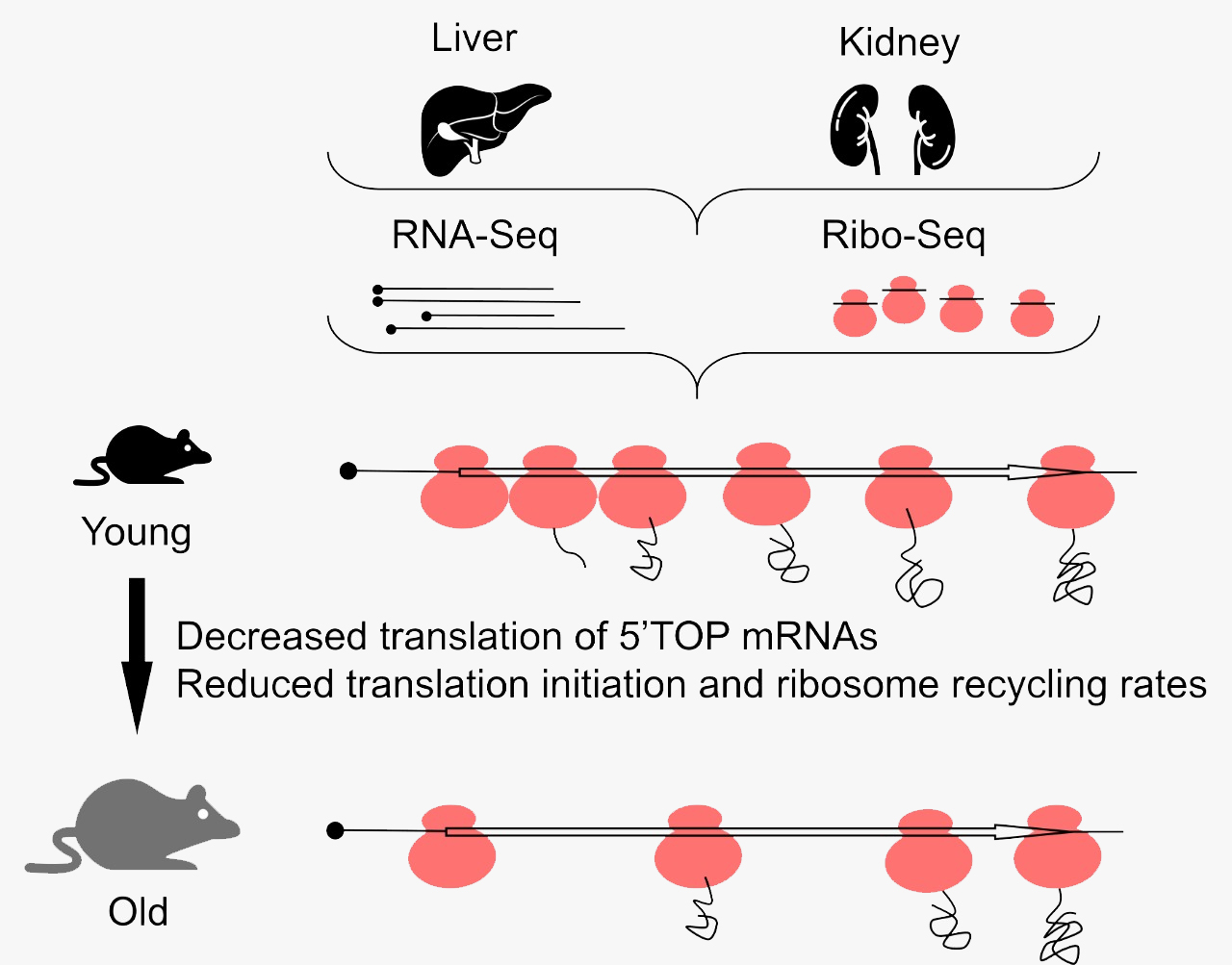
Рисунок 1. Схема исследования, проведенного авторами статьи. Ткани почек и печени, взятые от мышей различных возрастов, были проанализированы с помощью секвенирования РНК и рибосомного профайлинга. Полученные данные позволили оценить, какой вклад вносит трансляция в возрастные изменения экспрессии генов и установить некоторые другие любопытные эффекты, связанные с возрастными изменениями трансляции.
схема выполнена авторами обсуждаемой публикации
Так, по данным экспериментов, в печени и почках мышей с возрастом заметно повышается экспрессия генов, связанных с воспалением и другими иммунными процессами, что соответствует представлениям о развитии хронического воспаления. Сравнив свои данные с результатами более ранних работ на эту тему, авторы смогли выявить четкую и устойчивую возрастную зависимость уровня экспрессии пяти генов, связанных с воспалением и лизосомной деградацией белков (Ctss, C1qa, C1qb, C1qc и Laptm5), так что их можно рассматривать в качестве потенциальных биомаркеров старения.
В отличие от воспалительных процессов, функции митохондрий с возрастом не усиливаются, а угасают. Постепенное возрастное снижение экспрессии некоторых ядерных генов, кодирующих митохондриальные белки, было обнаружено в клетках почек (в клетках печени тоже наблюдалось, но оказалось менее выраженным). Кроме того, синтез компонентов, ответственных за поддержание окислительно-восстановительного баланса, менялся и в печени, и в почках, что хорошо согласуется с широко распространенной теорией о роли окислительного стресса в процессе старения. В то же время в обеих тканях удалось выявить возрастное увеличение экспрессии генов, связанных с регуляцией давления в кровеносных сосудах, а также генов, кодирующих предшественники амилоидов. Также с возрастом в почках снижается синтез белков, связанных с ответом на глюкокортикоидные гормоны, биосинтезом кофакторов и метаболизмом липидов. Примечательно возрастное снижение экспрессии в почках двадцати одного гена компонентов пероксисом, что также согласуется с текущим взглядом на роль возрастных изменений в метаболизме липидов и развитии некоторых заболеваний почек.
О том, как работают митохондрии и какую роль они играют в жизни клетки и целого организма, повествует спецпроект «Биоэнергетика». — Ред.
В общем и целом, большинство возрастных изменений уровня трансляции коррелирует с изменениями уровня транскрипции как в печени, так и в почках, поэтому, вероятнее всего, ключевые изменения экспрессии генов, связанные со старением, происходят именно на уровне транскрипции. Авторы исследования сумели выявить несколько транскрипционных факторов, которые, предположительно, отвечают за возрастные изменения транскрипции. Бóльшая часть генов-мишеней этих факторов задействована в функционировании иммунной системы и воспалении. Многие из транскрипционных факторов, отвечающих за возрастные изменения профилей транскрипции, оказались общими для печени и почек, но среди них есть и тканеспецифичные факторы. В частности, в почках многие транскрипционные факторы, изменяющие профили транскрипции с возрастом, так или иначе связаны с метаболизмом липидов и функционированием пероксисом.
Авторы работы впервые продемонстрировали, что многие гены, экспрессия которых понижается по мере старения организма, связаны с биосинтезом белка, метаболизмом некодирующих РНК и образованием рибосом. В их числе есть гены рибосомных белков, транскрипционных факторов, а также компонентов, задействованных в биогенезе рРНК и рибосом, процессинге некодирующих РНК и других процессах, имеющих ключевое значение для экспрессии генов и ее регуляции. Стоит отметить, что предыдущие исследования, рассматривавшие преимущественно только транскрипционные возрастные изменения, не могли выявить снижение синтеза этих белков, поскольку оно связано с подавлением трансляции, а не транскрипции.
Некодирующие РНК, впрочем, могут кодировать, вопреки своему названию, функциональные пептиды [10]. Примечательно, что длинные некодирующие РНК есть и у бактерий [11], хотя об их функциях известно гораздо меньше, чем о функциях длинных некодирующих РНК эукариот.
Для того чтобы данные по трансляции с определенных мРНК можно было сравнивать не только с аналогичными данными для организма другого возраста, но и с данными по трансляции с других транскриптов, авторы работы использовали специальную нормированную метрику — «занятость» рибосом (RO от англ. ribosome occupancy). Для каждого гена RO вычисляется как количество рибосом, «пойманных» на синтезе его белкового продукта, деленное на общее количество транскриптов гена. Иными словами, RO позволяет понять, насколько интенсивно, по сравнению с другими генами, рибосомы взаимодействуют с мРНК данного гена и синтезируют белок по ее матрице (как правило, чем больше рибосом «сидят» на мРНК гена, тем больше белка с него синтезируется).
Анализ данных рибосомного профайлинга, переведенных в термины RO, показал, что с возрастом и в печени, и в почках увеличивается трансляция с мРНК, связанных с воспалением и дифференцировкой клеток различных типов. В то же время в почках с возрастом заметно снижается экспрессия генов, связанных с образованием и функционированием митохондрий, таких как гены компонентов электрон-транспортной цепи [12]. Примечательно, что трансляция многих ядерных генов, кодирующих белки митохондриального назначения, регулируется сигнальным путем mTOR, причем главную роль в этом процессе играет белок 4E-BP1. Этот же белок отвечает за возрастное снижение экспрессии гена интерферонового регуляторного транскрипционного фактора 7 (Irf7). С возрастом показатель RO для этого гена снижается почти в шесть раз. Стоит отметить, что по мере старения в печени увеличивается синтез субъединиц важнейшего регулятора метаболизма железа — ферритина [13], — трансляция которых зависит от особого железозависимого элемента в 5′-нетранслируемых областях их транскриптов. Вероятно, этот эффект связан с хорошо известными возрастными нарушениями метаболизма и запасания железа, которые зачастую являются последствиями возрастного хронического воспаления. Дело в том, что у грызунов по мере старения в тканях организма накапливается железо, а повышение его концентрации приводит к активации экспрессии гена ферритина и других генов, имеющих железозависимый элемент.
Активная работа mTOR не только поддерживает клеточный цикл и трансляцию белка, но и ухудшает процесс аутофагии [14] — избавления клетки от накопившегося за всю её жизнь «мусора» (дефектных и ненужных молекул). В том числе и поэтому ингибирование mTOR (и, как следствие, интенсификация аутофагии) приводит к увеличению продолжительности жизни модельных животных. — Ред.
Но самый неожиданный и любопытный эффект старения, который выявили авторы работы, состоит в перераспределении рибосом на транскриптах. Оказалось, что с возрастом частота встречаемости рибосом на 5′-концах транскриптов падает и увеличивается на 3′-концах как в печени, так и в почках. Для мышиной печени «точкой невозврата» является возраст 11 месяцев, после которого локализация рибосом становится сильно «перекошенной» в сторону 3′-конца. Особенно выражен эффект смещения рибосом при сравнении образцов тканей от мышей возрастом 11 месяцев и 32 месяца. Наиболее яркий эффект смещения рибосом — вблизи старт- и стоп-кодонов, но его можно пронаблюдать и по всей длине транскрипта.
Один из авторов работы, Сергей Дмитриев, комментирует ее результаты следующим образом: «Наверное, наиболее важным результатом нашей работы с точки зрения понимания механизмов старения является то, что мы показали существенное падение уровня синтеза компонентов трансляционного аппарата в органах стареющих мышей. Интенсивность наработки некоторых рибосомных белков в печени 32-месячных грызунов, например, оказалась в три раза ниже, чем у молодых животных. Причем это снижение происходит именно благодаря регуляции трансляции, поэтому до нас оно не было замечено. То, что белковый синтез у “пожилых” животных идет менее интенсивно, было известно и раньше — но теперь стало понятно, почему это происходит: в клетке просто производится меньше “машин” для биосинтеза белка. Интересный аспект всего этого — что в этой регуляции, по-видимому, замешана протеинкиназа mTOR, которую уже давно “подозревают в связях” со старением. Существуют фармакологические ингибиторы этой киназы (например, рапамицин), которые значимо продлевают жизнь многим модельным организмам. Правда, здесь мы сталкиваемся с парадоксом: с одной стороны, снижение активности белкового синтеза такими лекарствами продлевает жизнь, а с другой — пониженная активность, по нашим данным, характерна как раз для старых животных. Объяснением могло бы быть то, что падение скорости синтеза белка — это не причина старения, а следствие, попытка организма справиться с меняющимися условиями (накоплением в клетке всякого “мусора” и “поломок” — в частности, неправильных белков). Понятно, что когда в квартире не делают уборку, то можно прожить в ней чуточку дольше, если меньше мусорить. Именно это, по-видимому, делает стареющая клетка, и точно так же работают продлевающие жизнь ингибиторы mTOR. К сожалению, эта стратегия лишь отодвигает печальный финал: рано или поздно мусор погребет под собой постояльца. А как провести в клетке “генеральную уборку”, мы пока не придумали».