Что отвечает за образование лизосом
Что отвечает за образование лизосом
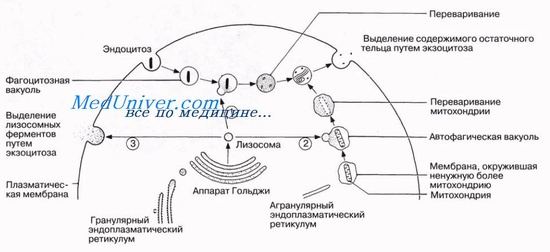
Лизосомы представляют собой пузырьки, отделившиеся от аппарата Гольджи и взвешенные в цитоплазме. Лизосомы формируют внутриклеточную пищеварительную систему у которая позволяет клеткам перерабатывать: (1) поврежденные структуры клетки; (2) частицы питательных веществ, захваченные клеткой; (3) нежелательные элементы, например бактерии. Лизосомы разных клеток существенно отличаются друг от друга, однако их диаметр обычно составляет 250-750 нм.
Лизосома окружена обычным липидным бисло-ем и содержит большое число маленьких гранул от 5 до 8 нм в диаметре. Содержимое гранул представлено белковыми агрегатами, которые содержат около 40 разных гидролаз <расщепляющих ферментов). Гидролитические ферменты способны расщеплять органические вещества на два или более фрагментов путем присоединения к одному из них протона, а к другому — гидроксильного иона.
Так, белки гидролизуются до аминокислот, гликоген — до глюкозы, жиры — до глицерина и жирных кислот.
Мембрана лизосом, как правило, препятствует попаданию ферментов непосредственно в цитоплазму, таким образом не допуская самопереваривания клетки. Однако в некоторых случаях происходит нарушение целостности лизосомальных мембран, что позволяет ферментам выходить в цитозоль. Эти ферменты затем расщепляют органические вещества, которые находятся в непосредственной близости, до небольших, легко диффундирующих мономеров, таких как аминокислоты и глюкоза. Некоторые особые функции лизосом изложены далее.
Пероксисомы напоминают лизосомы, однако имеют два важных отличия. Во-первых, считают, что они образуются не из аппарата Гольджи, а из эндоплазматического ретикулума путем самокопирования или отпочковывания. Во-вторых, они содержат в основном оксидазы, а не гидролазы. Многие оксидазы способны превращать кислород и протоны, образующиеся в клеточных реакциях, в перекись водорода (Н2О2).
Перекись водорода — сильный окислитель, который вместе с каталазой (одна из оксидаз пероксисом) используется клеткой для окисления многих вредных для нее веществ. Так, с помощью этого механизма пероксисомы клеток печени разрушают около половины объема алкоголя, поступающего в организм.
Одной из важных функций многих клеток является секреция тех или иных веществ. Почти все эти вещества вырабатываются с помощью эндоплазматического ретикулума и аппарата Гольджи, затем высвобождаются последним в цитоплазму в виде своеобразных хранилищ — секреторных пузырьков, или секреторных гранул. Эти пузырьки хранят проферменты (ферменты в неактивном состоянии), которые впоследствии выделяются через мембрану клетки наружу и попадают в панкреатический проток, а оттуда — в двенадцатиперстную кишку, где они активируются и используются для переваривания пищи.
Митохондрии клетки
Митохондрии образно называют «энергетическими станциями» клетки, без них клетка была бы неспособна извлекать энергию из питательных веществ и выполнять свои функции.
Митохондрии располагаются во всех отделах цитоплазмы, однако их общее число зависит от потребности данной клетки в энергии и колеблется от нескольких десятков до нескольких тысяч штук. Более того, плотность распределения митохондрий в цитоплазме наиболее высока в области с наивысшей метаболической активностью. Митохондрии могут иметь разную форму и размер. Они бывают округлые (диаметром всего несколько сотен нанометров), вытянутые (около 7 мкм длиной и более 1 мкм в диаметре), а также ветвящиеся и нитевидные.
Основные структуры митохондрий представлены двумя мембранами — наружной и внутренней, каждая из которых состоит из липидного бислоя и белков. Многочисленные складки внутренней мембраны формируют выступы, называемые кристами, с которыми связываются окислительные ферменты.
Кроме того, просвет митохондрии заполнен матриксом, который содержит большое количество растворенных ферментов, необходимых для процессов извлечения энергии из питательных веществ. Эти ферменты вместе с окислительными ферментами, также расположенными в области крист, способствуют окислению питательных веществ до углекислого газа и воды, приводя к высвобождению энергии, которая используется для синтеза макроэргического вещества — аденозинтрифосфата (АТФ). Образовавшийся АТФ перемещается из митохондрии в ту область клетки, где существует потребность в энергии для выполнения какой-либо функции.
Митохондрии относят к самовоспроизводящимся структурам. Это означает, что одна митохондрия при увеличении потребности в энергии АТФ может разделиться на две, три и т.д. Деление происходит благодаря наличию в митохондрии молекул дезоксирибонуклеиновой кислоты — таких же, как и в ядре клетки. В митохондриях ДНК выполняет сходную функцию, регулируя их самовоспроизведение.
Научная электронная библиотека
§ 3.1.4. Строение клетки
Размеры клетки широко варьируют от 0,1 мкм (некоторые бактерии) до 155 мм (яйцо страуса). У всех клеток, независимо от их формы, размеров, функциональной нагрузки обнаруживается сходное строение (рис. 3.13).
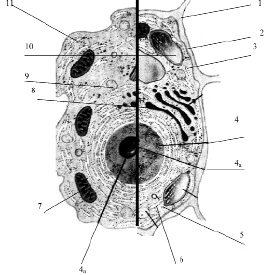
Рис. 3.13. Схема строения живой клетки: 1 – оболочка; 2 – мембрана; 3 – цитоплазма; 4 – ядро; 4а – ядрышко; 5 – рибосомы; 6 – эндоплазматическая сеть (ЭПС); 7 – митохондрии; 8 – комплекс гольджи; 9 – лизосомы; 10 – пластиды; 11 – клеточные включения
Снаружи клетка одета мембраной. Внутренняя часть клетки содержит многочисленные органоиды – структурные образования клетки, выполняющие определенные функции жизнедеятельности клетки.
1. Оболочка. Присутствует только у растительных клеток. Состоит из волокон целлюлозы. Функции оболочки: защита клетки от внешних повреждений, придает стабильную форму клетки, эластичность растительным тканям.
Повреждение наружной оболочки приводит к гибели клетки (цитолиз).
2. Мембрана. Тончайшая структура (75 Ǻ), состоит из двойного слоя молекул липидов и одного слоя белков. Такая структура обеспечивает уникальную эластичность и прочность мембране

Явление фагоцитоза – поглощение клеткой твердых частиц – впервые было описано русским врачом Мечниковым. Фагоцитарная особенность лежит в основе процесса иммунитета. Особенно развита у лейкоцитов, клеток костного мозга, лимфатических узлов, селезенки, надпочечников и гипофиза.
Пиноцитоз – поглощение клеткой растворов – состоит в том, что мельчайшие пузырьки жидкости втягиваются через образующуюся воронку, проникают через мембрану и усваиваются клеткой.
3. Цитоплазма – внутренняя среда клетки. Представляет собой гелеобразную жидкость (коллоидная система), состоит на 80 % из воды, в которой растворены белки, липиды, углеводы, неорганические вещества. Цитоплазма живой клетки находится в постоянном движении (циклоз).




4. Ядро – обязательный органоид эукариотических клеток. Впервые было исследовано и описано Р. Броуном в 1831 г. В молодых клетках расположено в центре клетки, в старых – смещается в сторону. Снаружи ядро окружено мембраной с крупными порами, способными пропускать крупные макромолекулы. Внутри ядро заполнено клеточным соком – кариоплазмой, основная часть ядра заполнена хроматином – ядерным веществом, содержащим ДНК и белок. Перед делением хроматин образует палочковидные хромосомы. Причём, хромосомы одинакового строения (но содержащие разные ДНК!) образуют пары, зрительно воспринимаемые как одно целое (рис. 3.14).
Рис. 3.14. Хромосомный набор человеческой клетки перед началом деления
Структурирование всех хромосом в пары свидетельствует о том, что число хромосом – чётное. Поэтому, его часто обозначают 2n, где n – количество хромосомных пар, а соответствующий набор хромосом называют диплоидным. Например, у голубей n = 40 (80 хромосом), у мухи n = 6 (12 хромосом), у собаки n = 39 (78 хромосом), у аскариды n = 1 (2 хромосомы). У человека n = 23 (46 хромосом). Однако, в половых клетках число хромосом в два раза меньше. Поэтому набор хромосом в половых клетках называется гаплоидным. Клетки, не являющиеся половыми называются соматическими. Иногда клетки с гаплоидным набором хромосом называют гаплоидными клетками, а с диплоидным набором хромосом – диплоидными клетками.
При слиянии двух родительских гаплоидных половых клеток образуется диплоидная клетка, дающая начало новому организму с набором генов отца и матери
Совокупность всех хромосом ядра (а значит и генов) клетки называется генотип. Именно генотип определяет все внешние и внутренние признаки конкретного организма.
В соматических клетках 44 Х-образные хромосомы (22 пары) у женщин и мужчин идентичны (сходны по строению), их называют аутосомами. А 23-я пара имеет конфигурацию ХХ – у женщин и ХY – у мужчин. Эти пары хромосом именуются половыми хромосомами.
В половых клетках 22 хромосомы также одинаковые у яйцеклеток и у сперматозоидов, а 23-я хромосома конфигурации Х – у яйцеклетки и Х или Y – у сперматозоидов. Поэтому при слиянии половых клеток и образовании пар хромосом, 23-я пара будет ( <ХY>или <ХХ>) определять пол будущего ребенка.
Необходимо помнить, что хотя в соматических клетках набор хромосом диплоидный (2n), однако, перед началом деления клеток происходит репликация ДНК, то есть, удвоение их количества, а, значит, и удвоение
количества хромосом. Поэтому перед началом деления соматической клетки в ней насчитывается 4n хромосом (рис. 16). Она становится тетраплоидной.
– хранение генетической информации;
– контроль за всеми процессами, происходящими в клетке: делением, дыханием, питанием и др.
4а. Ядрышко – структура, содержащаяся в ядре. Ядро может содержат 1, 2 или более ядрышек. Функция ядрышка – формирование рибосом.
Следует отметить, что не все клетки имеют оформленное ядро. Клетки, имеющие ядро называются эукариотическими или эукариотами. Клетки, не имеющие ядра, называются прокариотическими или прокариотами. Функции ядра у прокариот несёт одна нить ДНК (именуется хромосома), в которой хранится вся генетическая информация. К прокариотам относятся бактерии и сине-зеленые водоросли. Как правило, у прокариотов отсутствуют и некоторые другие органоиды. Размеры прокариотических клеток меньше, чем размеры эукариот.
5. Рибосомы – самые мелкие органоиды клетки. Были обнаружены в 1954 г. Французским ученым Паладом. Рибосомы были обнаружены в цитоплазме, а также на гранулярной ЭПС и в ядре.
Функция рибосом: обеспечение биосинтеза белка.
6. Эндоплазматическая сеть. Представляет собой каналы и полости, ограниченные мембраной. Различают две разновидности ЭПС: гранулярная ЭПС и агранулярная ЭПС. Гранулярная ЭПС морфологически отличается от агранулярной наличием на ее поверхности многочисленных рибосом (на агранулярной ЭПС рибосомы отсутствуют).
Функции эндоплазматической сети:
– участие в синтезе органических веществ: на гранулярной ЭПС синтезируются белки, на агранулярной – липиды и углеводы;
– транспортировка продуктов синтеза ко всем частям клетки.
Несложно уяснить, что гранулярная ЭПС характерна для клеток, синтезирующих белки (например клетки желез внутренней секреции), агранулярная ЭПС характерна для клеток-производителей углеводов и липидов (например клетки жировой ткани).
7. Митохондрии – крупные органоиды, состоящие из двойного слоя мембран: наружная – гладкая, внутренняя образует многочисленные гребнеобразные складки – кристы. Внутри митохондрии заполнены жидкостью (матрикс).
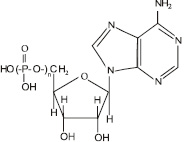
Функции митохондрий: основная функция митохондрий – обеспечение клетки энергией. Этот процесс происходит за счет синтеза аденозинтрифосфорной кислоты (АТФ) (рис. 3.15), в которой фрагмент
Рис. 3.15. Структурная формула аденозинфосфорных кислот. Для аденозинтрифосфорной кислоты n = 3, для аденозиндифосфорной кислоты n = 2, для аденозинмонофосфорной кислоты n = 1
При взаимодействии молекулы аденозинтрифосфорной кислоты с водой отщепляется один остаток фосфорной кислоты, в результате чего образуется аденозиндифосфорная кислота – АДФ и выделяется огромное количество энергии:
АТФ + Н2О = АДФ + Н3РО4 + 10 000 калорий.
Впоследствии от АДФ может отщепляться еще один остаток фосфорной кислоты, образуя АМФ – аденозинмонофосфорную кислоту.
АДФ + Н2О = АМФ + Н3РО4 + 10 000 калорий[37].
Освободившаяся энергия используется для жизнедеятельности клетки (КПД процесса превышает 80 %!).
Наряду с распадом АТФ и выделением энергии в клетке постоянно происходит синтез АТФ и накопление энергии (обратные реакции).
Количество митохондрий в клетке зависит от потребности последней в энергии. Так, в клетках кожи человека находится в среднем 5–6 митохондрий, в клетках мышц – до 1000, в клетках печени – до 2500!
8. Комплекс Гольджи. Итальянский ученый Гольджи обнаружил и описал структуру клетки, напоминающую стопки мембран, цистерны, пузырьки и трубочки. Расположена эта система чаще всего возле ядра.
Функции комплекса Гольджи: в полостях комплекса накапливаются всевозможные продукты обмена клетки, которые по каким-либо причинам не вывелись наружу. В последствии эти продукты могут быть использованы клеткой для процессов жизнедеятельности. Из пузырьков и цистерночек комплекса Гольджи в растительных клетках образуются вакуоли, заполненные клеточным соком.
9. Лизосомы – мелкие органоиды. Представляют собой пузырьки, окруженные мембраной. Внутри лизосомы заполнены пищеварительными ферментами (обнаружено 12 ферментов), которые расщепляют и переваривают крупные макромолекулы (белки, полисахариды, нуклеиновые кислоты).
Функции лизосом: растворение и переваривание макромолекул. Лизосомы участвуют в фагоцитозе. Понятно, что основная функция по перевариванию поступающих в клетку частиц принадлежит лизосомам.
10. Пластиды. Эти органоиды характерны только для растительных клеток. Форма напоминает двояковыпуклую линзу. Структура пластид напоминает таковую у митохондрий: двойной слой мембраны. Наружная – гладкая, внутренняя образует складки, называемые тилакоидами. На тилакоидах происходит основной жизненно важный для всех зеленых растений процесс – фотосинтез:
Пластиды бывают трех типов:
1) Хлоропласты – зеленые пластиды. Их цвет обусловлен наличием хлорофилла. Хлорофилл – основное вещество хлоропластов (имеет зеленый цвет). Только благодаря хлорофиллу возможен процесс фотосинтеза (см. раздел 4.2). Хлоропласты придают зеленый цвет растительным организмам.
2) Хромопласты – пластиды, имеющие различные окраски: от ярко-желтого до пурпурно-багряного. Наличие различных пигментов окрашивают плоды, цветки и осенние листья растений в соответствующие цвета. Этот факт особенно важен для привлечения насекомых к цветкам, как природный индикатор созревания плодов и др.
3) Лейкопласты – бесцветные пластиды, в которых происходит накопление запасных питательных веществ (например, крахмала).
Некоторые виды пластид могут переходить друг в друга: например, переход хлоропластов в хромопласты: созревание томатов, яблок, вишни, и т. д.; изменение окраски листьев в осенний период времени. Лейкопласты могут переходить в хлоропласты: позеленение картофеля на свету. Это доказывает общность происхождения пластид.
11. Клеточные включения. Вакуоли. Это непостоянные и необязательные составляющие клетки. Они могут появляться и исчезать в течение всей жизни клетки. К ним относятся капли жира, зерна крахмала и гликогена, кристаллы щавелево-кислого кальция и др. Жидкие продукты обмена называются клеточным соком и накапливаются они в вакуолях. В клеточном соке растворены сахара, минеральные соли, пигменты и т. д. Чем старше клетка, тем больше клеточного сока накапливает клетка. Молодые клетки практически не содержат вакуолей.
Помимо перечисленного некоторые специализированные клетки обладают специальными органоидами. К ним относятся:
– реснички и жгутики, представляющие собой выросты мембраны клетки, осуществляющие движения клетки. Они имеются у одноклеточных организмов и многоклеточных (кишечный эпителий, сперматозоиды, эпителий дыхательных путей);
– миофибриллы – тонкие нити мышечных клеток, участвующие в сокращении мышц;
– нейрофибриллы – органоиды, характерные для нервных клеток и участвующие в проведении нервных импульсов. Кроме того, в состав клеток входят центриоли – две (иногда более) цилиндрические структуры диаметром около 0,1 мкм и длиной 0,3 мкм. Место расположения центриолей в период между делениями клетки считается серединой клеточного центра. При делении клетки центриоли расходятся в противоположные стороны – к полюсам, определяя ориентацию веретена деления (рис. 16).
Следует иметь в виду, что, хотя животные и растительные клетки имеют много общего, но между ними существуют и серьёзные различия (табл. 3.1).
Более общая классификация клеток представлена на рис. 3.16.
Одно из основных отличий бактерий от архей, состоит в химическом составе мембраны. Бактерии отделены от внешней среды двойным слоем липидов (жиров и жироподобных веществ). Мембраны архей состоят из терпеновых спиртов.
РОЛЬ ЛИЗОСОМ В МЕХАНИЗМЕ ЗАЩИТЫ И ПОВРЕЖДЕНИЯ КЛЕТОК ПРИ ДЕЙСТВИИ ТЯЖЕЛЫХ МЕТАЛЛОВ
Украинский НИИ медицины транспорта, г. Одесса, Украина
Как известно, проблема токсикологии тяжелых металлов (ТМ), отнесенных в последние годы к числу глобальных загрязнителей внешней среды, является традиционной для украинских исследователей. Примечательно, что именно им было предложено осветить эту проблему в фундаментальном издании «Общая токсикология», вышедшем недавно под редакцией Б.А. Курляндского и В.А. Филова в издании «Медицина» [1]. В обстоятельном разделе была освещена роль тяжелых металлов в механизме возникновения токсических эффектов и развитии патологических процессов при их воздействии на организм как тиоловых ядов. Однако в разработке этой сложной проблемы еще имеется ряд пробелов, восполнение которых требует дальнейших исследований с позиции биохимической токсикологии. Так, несмотря на значительный экспериментальный и клинический материал, накопленный в предшествующие годы, продолжают оставаться нераскрытыми отдельные аспекты изучения молекулярных и клеточных механизмов в патогенезе интоксикаций тяжелыми металлами.
Анализ и обобщение накопленной информации позволяют выделить в качестве ведущих механизмов нарушения клеточного метаболизма при экспонировании биообъектов ТМ ферментотоксическое, мембранотропное действие и оксидативный стресс (рис. 1).
При этом первая позиция определяется взаимодействием данной группы ксенобиотиков с SH-группами белковых молекул, характеризующихся прежде всего высокой биологической активностью в плане осуществления биокаталитической, биосинтетической и энергетической функций [4—6]. В основе второй, наряду с изменением свойств и функциональной активности мембраносвязанных белковых молекул, лежат нарушения в работе ионных каналов, а также электродинамических характеристик возбудимых биомембран. К числу относительно недавно раскрытых закономерностей в реализации токсичности ТМ следует отнести оксидативный стресс, в механизмах развития которого ведущую роль играет нарушение баланса активности про- и антиоксидантных систем, генерирование свободных радикалов кислорода, усиление процессов перекисного окисления липидов на фоне угнетения энергопродукции митохондриями и снижения энергетического потенциала клетки. С этими исходными изменениями метаболизма клетки связаны многочисленные морфофункциональные нарушения в органах и тканях, в совокупности составляющими патогенетическую картину развивающихся интоксикаций.
Вместе с тем, далеко не все патологические признаки и симптомокомплексы могут быть удовлетворительно объяснены и взаимосвязаны с рассмотренными выше молекулярно-метаболическими нарушениями. Поэтому не случайно внимание исследователей все больше привлекает к себе вероятная роль в механизмах защиты и повреждения клеток ТМ лизосомальной системы.
Лизосомальная защитная система клетки
На протяжении последних 50 лет лизосомы находятся в фокусе всё возрастающего внимания специалистов в области клеточной биологии и патологи [7—9]. Выявлено много новых, важных для жизнедеятельности организма, свойств этих клеточных органелл. Показано, что лизосомная система является специализированным инструментом клеток, используемым для осуществления таких важных метаболических и физиологических процессов, как катаболизм белков, глико- и липопротеидов, нуклеиновых кислот, накопление, трансформация и выведение из организма чужеродных веществ, в том числе лекарств и токсикантов, везикулярный транспорт и рециклизация рецепторов, ауто-, гетерофагоцитоз и апоптоз, адаптация и реконструкция клеточных структур и др. [10—12]. Это определяется высокой функциональной активностью, мобильностью, индуцибельностью рассматриваемых клеточных органелл, обладающих громадным (до 100 представителей) набором гидролаз и оксидоредуктаз [13]. Их одновременное присутствие, а тем более синхронизированная динамика активности, представляется маловероятной, что подтверждается результатами экспериментальных исследований и этиопатогенезом наследственных лизосомных заболеваний [14, 15]. Более привлекательной является гипотеза о существовании многочисленных клонов первичных лизосом, которые содержат определенные наборы гидролаз. Предполагается не только наличие типового механизма индуктивного образования определенной клоновой популяции лизосом, но и существования в эндоплазматическом ретикулуме рецепторных участков (доменов), действующих как матрицы при формировании органеллы [16].
Лизосомы и тяжелые металлы
Во многочисленных работах раннего периода было показано, что эндотелиальные клетки почек, печени, костного мозга, а также другие виды клеток, особенно макрофаги, способны активно поглощать окислы и соли металлов и изолировать их в виде особых внутриклеточных везикул или гранул [18]. Ультраструктурный и биохимический анализ показал, что многие из наблюдаемых внутриклеточных частиц, обогащенных металлами, являются модифицированными или вторичными лизосомами [19, 20].
На основе способности лизосом накапливать ТМ или металлсодержащие вещества (медь, сорбит железа, коллоидное золото и др.) и изменять при этом свои седиментационные свойства были разработаны эффективные методы их избирательного выделения из гомогенатов различных тканей, что позволило более детально охарактеризовать эти органеллы [21, 22]. Использование для этих целей радиоактивных изотопов ( 110 Ag) дало возможность выявить в лизосомальной мембране наличие специфических переносчиков ТМ, относящихся к классу Р-типа, ответственных, в частности, за внутриклеточный транспорт ионов Cu 2+ и Cd 2+ [23, 24].
Было установлено, что многие металлы при длительном их поступлении в организм или в высоких концентрациях способны не только накапливаться в лизосомных везикулах различных клеток, но и индуцировать усиленное образование новых первичных лизосом и их последующее набухание [25]. Эффект индукции образования лизосом, морфологически выявляемый в виде увеличения их численности и размеров, был отчетливо продемонстрирован в гепатоцитах при циррозе печени у людей [26], в клетках почек и печени овец, отравленных медью [27], в эпителии проксимальных канальцев почек у крыс при многократном введении солей кадмия [28] и уже после однократной инъекции ацетата свинца [29], в различных участках мозга при введении крысам ацетата свинца [30], в первичных культурах астроцитов и нейронов после добавления в среду солей свинца и во множестве других исследований [31—33].
В рамках современных представлений увеличение численности и размеров лизосом, наблюдаемое при воздействии ряда металлов, можно рассматривать как одну из форм структурно-функциональной адаптации клеток, позволяющей им мобилизовать свой защитно-приспособительный потенциал, чтобы противостоять угрозе повреждения клеточных структур и нарушения гомеостаза [34]. По-существу, индукция лизосом, приводящая к повышению «емкости» лизосомного аппарата наряду с адаптивным усилением синтеза металлотионеинов и других транспортных белков, является важным компонентом общего механизма формирования резистентности клеток-мишеней к неблагоприятным воздействиям химических факторов окружающей среды и, в частности, к высоким концентрациям ТМ. Такая резистентность может реализоваться путем аккумуляции и обособления токсичного металла в лизосомных везикулах, а в случае возможного повреждения клеточных органелл токсикантом — посредством быстрой ликвидации дефектных структур с помощью лизосомного аутофагоцитоза и апоптоза [35].
Транспорт тяжелых металлов в лизосомы
Весь процесс поступления металлов в форме металлопротеидов в лизосомы можно разделить на три стадии:
1. Адсорбция металлопротеина на поверхности клетки и образование эндоцитозных вакуолей (эндосом или пиносом),
2. Слияние эндосомы с первичной лизосомой, в результате чего образуется вторичная лизосома, содержащая гидролитические ферменты,
3. Внутрилизосомная трансформация поступивших металлопротеидов.
В настоящее время наиболее детально изучена третья стадия процесса.
Металлопротеины, транспортированные в лизосомы, подвергаются биотрансформации под влиянием катепсинов [36]. Многие металлы (кадмий, цинк, медь, серебро) связываются первоначально с металлотионеином и в такой форме транспортируются в лизосомы [38]. Железо накапливается в лизосомах в виде ферритина [9].
Для изучения особенностей трансформации металлотионеинов обычно используются бесклеточные системы, содержащие изолированные лизосомы, нагруженные различными металлотионеинами [39]. Установлено, что тионеин, не содержащий металла, подвергается очень быстрой деградации, тогда как протеoлиз нагруженных металлом (кадмий, цинк) тионеинов происходит сравнительно медленно. Различные лизосомные протеазы с различной скоростью расщепляют металлотионеины. Так, катепсин В деградирует кадмий-тионеин в 36 раз быстрее, чем катепсин С, и в 45 раз быстрее, чем катепсин Д. Основными продуктами гидролиза металлотионеинов являются аминокислоты. Однако, при деградации кадмий-тионеина было установлено, что в результате его расщепления образуются низкомолекулярные белковые фрагменты, содержащие кадмий, которые в дальнейшем транспортируются в цитозоль и там связываются с высокомолекулярными белками [40].
В последние годы особый интерес вызывают так называемые транспортные белки, отвечающие за перемещение металлов между различными компонентами клетки, в частности, между плазматической мембраной и лизосомами. Процесс переноса металлов, осуществляемый этими белками, является энергозависимым и связан с активностью особой транспортной «Р» АТФазы [41]. Транспортные белки, вероятно, специализированы, каждый из которых отвечает за перемещение и доставку определенной группы металлов. В частности, в эндотелиальных клетках почек, гепатоцитах и других клетках выявлен транспортный белок со специфичностью к кадмию, меди и серебру [27]. В эпителиальных клетках кишечника идентифицирован универсальный белок-транспортер с широкой специфичностью для железа, цинка, меди, кадмия и никеля [14].
Как теперь установлено, внутриклеточному транспорту металлов свойственна цикличность процессов. Многие авторы транспортные белки, связанные с функционированием «Р» АТФазы, рассматривают как «челночные системы», перемещающиеся в двух противоположных направлениях. В первой половине цикла они освобождаются от металлопротеина (или металла) посредством слияния с лизосомами, а затем опять движутся к плазматической мембране или к другим структурам [27].
Детальный механизм внутриклеточного транспорта металлов пока не расшифрован. Известно, что этот процесс зависит от состояния микротрубочек и микрофиламентов цитоскелета. Так, соединения, нарушавшие структуру микротрубочек и микрофиламентов (цитохалазин В и др.), подавляли процесс внутриклеточного перемещения металлов [42].
В свете важности приписываемой транспортной системе функции в накоплении металлов в лизосомах, несомненно, что нарушения в этой системе могут приводить к серьезным патологическим последствиям. Австралийские исследователи, изучая роль лизосом в патогенезе повреждения печени при хроническом отравлении медью, установили эффект неэффективного концентрирования металла. Оказалось, что на начальной стадии отравления (прегемолитический период) концентрация меди в лизосомах возрастает, и параллельно увеличивается количество электронно-плотных лизосом, содержащих этот металл. В то же время на гемолитической стадии процесса индукция лизосом ослаблена и резко снижено количество «плотных» лизосом. При этом наблюдается накопление токсичных количеств меди в цитозоле гепатоцитов, что и обусловливает их некроз. Авторы показали, что накопление меди в цитозоле клеток связано с инактивацией системы транспорта меди в лизосомы [42].
Одна из наиболее известных форм патологии медного обмена — гепатолентикулярная дегенерация (болезнь Вильсона), проявляющаяся накоплением меди в печени, как теперь установлено, также связана с некоторым типом повреждения транспортной системы [41]. При болезни Менкеса, представляющей собой наследственное дегенеративное заболевание, сочетающееся с циррозом печени, наблюдается аккумуляция меди в различных органах. При этом установлено неэффективное концентрирование меди в лизосомах, связанное с дефектом в работе транспортной системы [42].
Важная роль транспортной системы, в том числе и АТФазы Р-типа, в накоплении ряда металлов в лизосомах вполне доказана [43]. Кроме того, необходимо учитывать тот факт, что лизосомные структуры и, особенно, матрикс способствуют концентрированию и удержанию катионов металлов. Наличие в матриксе отрицательно заряженных макромолекул (таких, как гликопротеиды и фосфолипиды) создает благоприятные условия для связывания катионов металлов, высвобождавшихся при расщеплении металлопротеинов катепсинами в лизосомах. Есть основания полагать, что в популяции электронно-плотных лизосом (плотные тельца), которые обычно подвергаются выбросу из клеток путем экзоцитоза, значительная часть металлов находится не в форме металлотионеинов, а связана с макромолекулами матрикса лизосом.
Накопление и распределение тяжелых металлов в клеточных структурах
Значительная часть информации о степени накопления и содержании в лизосомах различных металлов была получена в опытах с применением метода дифференциального центрифугирования гомогенатов тканей. Так, Уэбб [44] приводит данные о внутриклеточном распределении экзогенного кадмия в печени, почках, кишечнике и поджелудочной железе у крыс, получавших перорально хлорид кадмия (10 мг/кг в день, в течение 30 дней). Автор отмечает, что, несмотря на различное содержание кадмия в разных органах, наблюдается сходное распределение метала в субклеточных фракциях ядер (4—5%), митохондрий (7—8,5%), лизосом (6—7,8%), микросом (2,5—3,0%) и цитозоля (75—81%). Другие авторы обнаружили в митохондриально-лизосомной фракции почек 8,5—11% и печени 9,6—11,3% кадмия от общего его содержания в этих органах у крыс [40]. Во многом аналогичные данные были получены в опытах по внутриклеточному распределению меди в почках и печени овец, отравленных медью [45]. Если учесть, что на долю лизосом приходится не более 2—3% общего объема клеток, а выход частиц при центрифугировании составлял не более 50%, то истинная концентрация кадмия и других металлов в лизосомах в несколько раз выше, чем в других субклеточных структурах, что согласуется с данными морфологических исследований.
Важно отметить, что интерпретация биохимических исследований по внутриклеточному распределению металлов и установлению содержания их во фракции лизосом, особенно при хроническим поступлении металлов в организм, требует более осторожного подхода и связана с несовершенством методов фракционирования субклеточных частиц и гетерогенностью лизосом [46]. Как известно, лизосомы (особенно вторичные) представляют собой крайне неоднородную популяцию органелл, которые в процессе функционирования (накопления веществ, переваривания, слияния с другими везикулами) претерпевают различные морфологические трансформации, приобретая при этом различные формы, размеры и плотности. Особым разнообразием отличаются лизосомы при патологических состояниях и воздействии различных токсикантов [3, 15]. Кроме того, в ряде случаев (например, при гормональной индукции, физической нагрузке, в том числе и при избыточном поступлении ряда металлов) лизосомы могут скапливаться вокруг клеточных ядер и прочно ассоциироваться с ядерной оболочкой [15], обогащая таким образом ядерную фракцию лизосомными компонентами.
Поэтому во многих работах по изучению внутриклеточного распределения металлов с помощью метода дифференциального центрифугирования полученная информация, вероятно, не отражает истинный уровень содержания металлов в лизосомной или лизосомно-митоходриальной фракциях, так как при поступлении металлов значительная часть лизосом (иногда даже преобладающая) может трансформироваться и изменить свои седиментационные свойства [16].
Убедительные данные, подтверждающие эту точку зрения, были получены канадскими исследователями [45]. Авторы изучали особенности внутриклеточного распределения меди в почках и печени овец при хроническом отравлении этим металлом. Было установлено, что по мере удлинения срока поступления меди в организм ее количество возрастало в тяжелых субклеточных фракциях (митохондрии, ядра) печени и почек. При этом в тяжелых фракциях пропорционально увеличивалась активность маркерного фермента лизосом — кислой фосфатазы. Ультраструктурный анализ выявил наличие в тяжелых фракциях митохондрий и ядер модифицированных и электронно-плотных лизосом, содержащих медь. Авторы делают заключение, что основной клеточной органеллой (кроме цитозоля), в которой происходит накопление меди, являются лизосомы. Во многом аналогичные результаты были получены при хроническом поступлении ртути в организм [17]. Так, после 6 месяцев введения крысам хлорида ртути наблюдается возрастание содержания металла в ядерной, митохондриальной и лизосомной фракциях почек без увеличения концентрации в цитозоле. В более поздние сроки ртуть продолжала накапливаться только в лизосомах. Существенно не отличались по внутриклеточному распределению ртути такие органы, как печень и головной мозг.
Выявленный повышенный уровень ртути в ядерной и митохондриальной фракциях в значительной мере можно объяснить наличием в этих фракциях электронно-плотных лизосом, обогащенных этим металлом. Можно утверждать, что индуцированные поступлением металлов трансформации лизосом не всегда учитывались во многих работах по изучению внутриклеточного распределения металлов в различных клетках, что приводило к получению заниженных величин содержания металлов в лизосомах и, как следствие, часто к неправильной интерпретации результатов.
Тяжелые металлы и активность лизосомальных ферментов
Во многочисленных биохимических и гистохимических исследованиях показаны изменения активности лизосомных ферментов под влиянием различных металлов [1, 17]. Наиболее часто эти изменения, вероятно, связаны с тем, что металлы, высвобождающиеся при гидролизе металлопротеинов в лизосомах или находящиеся в цитозоле в виде ионов, нередко изменяют свойства лизосомных мембран. При этом наиболее часто наблюдается лабилизация лизосом, сопровождающаяся выходом ферментов в цитозоль. Однако возможна и стабилизация мембран этих органелл.
Еще одна причина изменения активности лизосомных ферментов может быть связана с избирательной инактивацией определенных гидролаз тяжелыми металлами. Так, ингибирующий эффект меди установлен для кислой фосфатазы печени [49] и холинэстеразы лизосом макрофагов [50] у крыс. Кадмий избирательно инактивирует кислую фосфатазу лизосом легких [24] и катепсина Д лизосом почек [51]. Подробные сведения об особенностях модифицирующего действия различных металлов на ферменты лизосом различных органов и тканей приведены в монографии И.М. Транхтенберга и соавт. [17]. Тем не менее, появляются все новые данные, свидетельствующие о сложном характере такого рода взаимодействий и неоднозначности их биологической роли в организме.
Необходимо отметить, что если лизосомная мембрана повреждается и происходит выход гидролитических ферментов, то расположенные рядом с лизосомами структуры подвергаются ферментативной атаке. В результате может развиться выраженное повреждение клеточных структур и макромолекул [10, 46]. С другой стороны, стабилизация лизосомных мембран, наблюдаемая при введении низких доз ацетата свинца [32], как правило, приводит к ослаблению взаимодействия (слияния) лизосом с другими везикулярными структурами (эндосомы, аутофагосомы), что сопровождается нарушением транспортных процессов или аутофаговой функции клеток.
Важное значение в механизме отравления тяжелыми металлами (в частности медью или кадмием) имеет приобретенный в результате их хронического действия дефицит определенных гидролитических ферментов в виде избирательной инактивации катепсинов или эстераз [52, 53]. Развивающийся дефицит ферментов, наряду с другими токсическими эффектами, ведет к ослаблению или глубокому нарушению аутофаговой или других функций лизосом, что в итоге проявляется тяжелой клеточной патологией, нередко приводящей к дегенерации тканей или некрозу.
Тяжелые металлы и аутофагоцитоз
Один из основных механизмов цитотоксического действия многих тяжелых металлов, вероятно, связан с нарушением аутофаговой функции лизосом. В последнее время аутофагоцитоз стал привлекать пристальное внимание в связи с установлением ключевой роли этого процесса в удалении функционально неполноценных клеточных структур и замещении их на аналогичные новые, что, в итоге, имеет жизненно важное значение для адаптации и выживания клеток и организма в целом при различных экстремальных состояниях, в том числе и при воздействии токсических агентов [11, 54].
С помощью аутофагоцитоза клеточные органеллы или участки цитоплазмы (в основном изношенные или поврежденные) изолируются мембраной от остальных частей клетки (секвестрация) в виде так называемых аутофаговых вакуолей или аутофагосом. Затем происходит слияние аутофагосом с первичными лизосомами и образуются аутофаголизосомы, уже содержащие гидролитические ферменты. В функциональном аспекте формируется единая аутофагово-лизосомная система, осуществляющая переваривание секвестрированных клеточных структур, таких как набухшие митохондрии, фрагменты мембран, кластеры рибосом и др. Процесс аутофагоцитоза может быть полным иди частичным. При неполном переваривании в аутофаголизосомах обнаруживаются остатки структур, которые могут быть удалены из клеток путем экзоцитоза. Важно отметить, что при нормальных физиологических условиях аутофаговые вакуоли редко наблюдаются в клетках интактных животных, что связано с коротким (8—10 мин) периодом полужизни этих везикул и часто сравнительно небольшим количеством структур, подлежащих удалению. Кроме того, в норме лизосомы легко сливаются с аутофагосомами, и процесс переваривания секвестрированного материала происходит сравнительно быстро [11, 54]. Выраженный аутофагоцитоз обычно наблюдается при воздействии различных химических и физических факторов. Такой аутофагоцитоз получил название индуцированного. В качестве индукторов аутофагоцитоза наиболее часто используются этионин, диметилнитрозамин, а также хлористый кадмий [11].
Ряд авторов [51, 55], изучая ультраструктурные изменения в различных клетках животных после введения относительно высоких доз хлористого кадмия, обнаружили увеличенные лизосомы и аутофаговые вакуоли в эндотелиальных клетках почки. При этом увеличенные аутофаговые вакуоли содержали поврежденные митохондрии и различные фрагменты цитоплазматических структур. Вероятно, часть поврежденных митохондрий распадается в аутофаговых вакуолях, в которых обнаружена кислая фосфатаза. Авторы полагают, что при определенных условиях может происходить перераспределение кадмия из типичных «плотных» лизосом в аутофаговые вакуоли, которые далее трансформируются в «останочные» тельца, подвергающиеся экзоцитозу.
При изучении влияния сульфита двухвалентного железа на гепатоциты и культуру клеток Heia помимо увеличения лизосом было обнаружено образование множества аутофагических вакуолей [9], а при перегрузке железом (введенным либо с пищей, либо парэнтерально) в клетках печени у крыс отмечено образование аутофагических вакуолей, заключающих часть цитоплазмы, содержащей частички железа в виде ферритина [9, 10]. Повышенное количество аутофагосом в эритробластах отмечено при остром отравлении животных свинцом [17].
Несмотря на то, что феномен аутофагоцитоза, индуцированного ТМ, как и многими другими токсикантами, описан сравнительно давно, ряд аспектов механизма развития и особенности его проявления, имеющие принципиальное значение для понимания цитотоксического действия металлов, остаются еще не ясными и настоятельно требуют дальнейших исследований.
Лизосомы являются специализированными клеточными структурами, активно участвующими в процессах клеточного связывания, накопления и элиминации ТМ из организма. Лизосомальная система реагирует путем индукции процесса образования лизосом, адаптивного синтеза ферментов, усиления аутофагоцитоза, направленного апоптоза и экзоцитоза при экспонировании клеток и организма в целом ТМ, организуя тем самым механизмы защиты от действия ксенобиотиков на клеточном уровне (рис. 2). В то же время, при массивном поступлении ТМ в организм лизосомальный аппарат клеток становится не только мишенью для данной группы химических веществ и их соединений (прежде всего в виде металлопротеиновых комплексов), но также играет важную роль в патогенетических механизмах интоксикаций. Важной вехой в развитии исследований в этом направлении явились работы де Дюва и его последователей, создавших концепцию о лизосомотропных веществах, способных избирательно накапливаться в лизосомах, к числу которых относятся тяжелые металлы. Однако, под влиянием новых данных некоторые положения концепции (в частности, об избирательном накоплении металлов в лизосомах) были несколько пересмотрены. Оказалось, что из-за постоянно протекающих процессов реорганизации структуры клетки и динамичности клеточного метаболизма нельзя достичь локализации тех или иных веществ исключительно в лизосомах. Поэтому одной из важных задач будущих исследований является изучение взаимосвязей, определяющих соотношение уровней накопления и способы детоксикации ТМ в различных компартментах клетки, выяснение кооперативных процессов, осуществляемых разными видами клеток, а также участие в них различных регуляторных и управляющих систем.
В заключение следует отметить, что исследование роли лизосом в метаболизме и выведении ТМ является важной основой для общего понимания механизма защиты и повреждения клеток при нагрузках химическими веществами экзогенного и эндогенного происхождения. Анализ литературных источников показывает, что, несмотря на актуальность проблемы, известно еще сравнительно немного о конкретных системах (клеточных и метаболических), обеспечивающих доставку металлов в лизосомы, о внутрилизосомной трансформации металлопротеинов и процессах, осуществляющих внутриклеточное перемещение и удаление металлов из лизосом в цитозоль и внеклеточную среду. В этой области существует много нерешенных задач, имеющих большое теоретическое и прикладное значение, что делает ее актуальным и перспективным направлением современной биохимической токсикологии.