Что относят к окислителям
Окислитель
Окисли́тель — вещество, в состав которого входят атомы, присоединяющие во время химической реакции электроны, иными словами, окислитель — это акцептор электронов.
В зависимости от поставленной задачи (окисление в жидкой или в газообразной фазе, окисление на поверхности) в качестве окислителя могут быть использованы самые разные вещества.
Содержание
Распространённые окислители и их продукты
| Окислитель | Полуреакции | Продукт | Стандартный потенциал, В |
|---|---|---|---|
| O2 кислород |  | Разные, включая оксиды, H2O и CO2 | +1,229 (в кислой среде) |
+0,401 (в щелочной среде)


с активными металлами, концентрированная
с тяжёлыми металлами, разбавленная
c тяжёлыми металлами, концентрированная
с активными металлами
SO2; окисляет металлы до сульфатов с выделением сернистого газа или серы



Мнемонические правила
Для запоминания свойств окислителей и восстановителей существует несколько мнемонических правил:
Зависимость степени окисления от концентрации окислителя
Чем активнее металл, реагирующий с кислотой, и чем более разбавлен её раствор, тем полнее протекает восстановление. В качестве примера — реакция азотной кислоты с цинком:
Сильные окислители
Сильными окислительными свойствами обладает «царская водка» — смесь одного объема азотной кислоты и трёх объёмов соляной кислоты.
HNO3 + 3HCl ↔ NOCl + 2Cl + 2H2O
Образующийся в нём хлористый нитрозил распадается на атомарный хлор и монооксид азота:
Царская водка является сильным окислителем благодаря атомарному хлору, который образуется в растворе. Царская водка окисляет даже благородные металлы — золото и платину.
Ещё один сильный окислитель — перманганат калия. Он способен окислять органические вещества и даже разрывать углеродные цепи:
Сила окислителя при реакции в разбавленном водном растворе может быть выражена стандартным электродным потенциалом: чем выше потенциал, тем сильнее окислитель.
Очень сильные окислители
Условно к «очень сильным окислителям» относят вещества превышающие по окислительной активности молекулярный фтор. К ним, например, относятся: гексафторид платины, диоксидифторид, дифторид криптона, гексафтороникелат(IV) калия. Перечисленные вещества, к примеру, способны при комнатной температуре окислять инертный газ ксенон, что неспособен делать фтор (требуется давление и нагрев) и тем более ни один из кислородсодержащих окислителей.
См. также
Полезное
Смотреть что такое «Окислитель» в других словарях:
окислитель — – реагент (атом, молекула, ион), который в окислительно восстановительной реакции присоединяет электроны, т.е. восстанавливается. Общая химия : учебник / А. В. Жолнин [1] Окислитель – реагент в окислительно восстановительной реакции, принимающий… … Химические термины
ОКИСЛИТЕЛЬ — ОКИСЛИТЕЛЬ, вещество, вызывающее реакции ОКИСЛЕНИЯ. Так, при образовании УГАРНОГО ГАЗА путем окисления углерода, 2С+О2=2СО, кислород является окислителем. Среди окислителей можно назвать АЗОТНУЮ КИСЛОТУ, ПЕРЕКИСЬ ВОДОРОДА, озон, бихромат калия,… … Научно-технический энциклопедический словарь
ОКИСЛИТЕЛЬ — ОКИСЛИТЕЛЬ, окислителя, муж. (хим.). Вещество, способное производить окисление. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ОКИСЛИТЕЛЬ — ОКИСЛИТЕЛЬ, я, муж. (спец.). Вещество, способное производить окисление. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Окислитель — компонент топлива, окисляющий горючее при сгорании в камере ракетного двигателя. О. должен реагировать с горючими элементами с выделением максимального количества теплоты. В жидких ракетных топливах в качестве О. используют жидкий кислород,… … Энциклопедия техники
окислитель — сущ., кол во синонимов: 3 • металлург (435) • нитробензол (3) • фотоокислитель (2) … Словарь синонимов
Окислитель — составная часть двухкомпонентного ракетного топлива, применяемого в жидкостных ракетных двигателях. В качестве окислителя часто используют жидкий кислород и четырехокись азота. Некоторые типы топлива при соприкосновении с соответствующим… … Морской словарь
окислитель — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999] Тематики электротехника, основные понятия EN oxygen carrier … Справочник технического переводчика
окислитель — 3.2.8 окислитель (oxidant): вещество (О2/О3), которое после осаждения на поверхность или продукт приводит к образованию оксидов или участвует в реакции окисления. Источник … Словарь-справочник терминов нормативно-технической документации
Окислительно-восстановительные реакции
Что такое ОВР
Окислительно-восстановительная реакция (ОВР) — это реакция, которая протекает с изменением степеней окисления.
В такой реакции всегда участвуют вещество-окислитель и вещество-восстановитель. Другие вещества могут выступать в качестве среды, в которой протекает данная реакция.
Конечно, в каждом правиле есть исключения. Например, реакция диспропорционирования галогенов в горячем растворе щелочи выглядит так: Br2 + KOH = KBrO3 + KBr + H2O. Здесь и окислителем, и восстановителем является простое вещество бром (Br2).
Теперь посмотрим внимательнее на вещества — участники окислительно-восстановительных реакций.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет принимать электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет отдавать электроны, тем самым повышая свою степень окисления.
Из определений понятно, что реакция включает два противоположных по действиям явления: процесс окисления и процесс восстановления. Процесс восстановления — это процесс принятия электронов, а процесс окисления — процесс отдачи электронов. Оба процесса протекают одновременно: окислитель восстанавливается, а восстановитель окисляется.
Вот мы и узнали общие закономерности протекания окислительно-восстановительных реакций. Теперь давайте разберемся, какие вещества могут быть окислителями, а какие — восстановителями, и может ли одно вещество проявлять те и другие свойства.
Примеры веществ-окислителей
Только окислителями могут быть элементы в высшей своей степени окисления. Например, S +6 в серной кислоте (H2SO4), N +5 в азотной кислоте (HNO3) или солях-нитратах, Cr +6 в хроматах (CrO4 2− ) и дихроматах (Cr2O7 2− ) соответственно, а также Mn +7 (MnO 4− ).
В зависимости от среды проведения реакции Mn +7 и Cr +6 ведут себя по-разному. Рассмотрим на схемах:
И марганец, и хром в кислой среде (H + ) образуют соли той кислоты, которая образовывала среду. В нейтральной среде (H2O) марганец превращается в оксид бурого цвета, а хром — в серо-зеленый нерастворимый в воде гидроксид. В щелочной среде (OH − ) марганец превращается в манганат (MnO4 2− ), а хром — в комплексное соединение светло-зеленого цвета.
Только окислителями могут быть простые вещества-неметаллы. Например, представители VIIA группы — галогены. Проявляя окислительные свойства в кислой среде, галогены восстанавливаются до соответствующих им галогеноводородных кислот: HF, HCl, HBr, HI. В щелочной среде образуются соли галогеноводородных кислот.
Кислород превращается в анион с устойчивой степенью окисления −2. А сера ведет себя как окислитель по отношению к водороду и металлам, образуя при этом сероводород и сульфиды.
Только окислителями могут быть и протон водорода (H + ) и катионы металлов в их высших степенях окисления при нескольких возможных. Ион Н + при взаимодействии с восстановителями переходит в газообразный водород (H2), а катионы металлов — в ионы с более низкой степенью окисления: 2CuCl2 + 2KI = CuCl + 2KCl + I2.
Рассмотрим как ведут себя сильные кислоты-окислители — азотная и серная. В зависимости от их концентрации меняются и продукты реакции.
Эти кислоты проявляют окислительные способности и с некоторыми неметаллами, окисляя их до соответствующих кислот в высшей степени окисления неметалла-восстановителя.
Для удобства мы собрали цвета переходов важнейших веществ-окислителей в одном месте.
Примеры веществ-восстановителей
Типичными восстановителями могут быть щелочные (IA) и щелочноземельные (IIA) металлы, цинк и алюминий, а также катионы металлов в своих низших степенях окисления при нескольких возможных. Например:
Типичными восстановителями также могут быть бескислородные кислоты и их соли. Например, H2S + 4Cl2 + 4H2O = 8HCl + H2SO4.
Гидриды активных металлов (щелочных и щелочноземельных) тоже являются типичными восстановителями. Например, NaH + H2O = NaOH + H2.
Для удобства мы собрали цвета переходов важнейших веществ-восстановителей в одном месте.
Окислительно-восстановительная двойственность
Окислительно-восстановительная двойственность — это способность атома проявлять как свойства окислителя, так и свойства восстановителя в зависимости от условия протекания химической реакции.
Разберем вещества, атомы которых обладают окислительно-восстановительной двойственностью.
По отношению к водороду и металлам сера играет роль окислителя: S + H2 = H2S.
При взаимодействии с сильными окислителями повышает свою степень окисления до +4 или +6: S + KMnO4 = K2SO4 + MnO2.
Кислородсодержащие соединения серы в степени окисления +4
Сера в сульфитах и сернистой кислоте при взаимодействии с сильными окислителями повышает степень окисления до +6: SO2 + 2HNO3 (конц) = H2SO4 + 2NO2.
С восстановителями соединения серы проявляют окислительные свойства, восстанавливаясь до степени окисления 0 или −2: SO2 + C = CO2 + S.
Пероксид водорода
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии восстановителей может понижать степень окисления до –2: 4H2O2 + PbS = PbSO4 + 4H2O.
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии окислителей может повышать степень окисления до 0: 3H2O2 + 2KMnO4 = 3O2 + 2MnO2 + 2KOH + 2H2O.
Простое вещество йод
Окислительная способность проявляется у йода в реакции с такими восстановителями, как сероводород, фосфор и металлы: I2 + H2S = S + 2HI.
Йод при взаимодействии с более сильными окислителями играет роль восстановителя: I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl.
Азотистая кислота и нитриты
При взаимодействии с более сильными окислителями азот повышает степень окисления до +5 и превращается либо в азотную кислоту из азотистой, либо в нитрат-анион из нитрит-аниона: 5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O.
При взаимодействии с сильными восстановителями обычно происходит восстановление до NO (иногда до других соединений азота в более низких степенях окисления): 2HNO2 + 2HI = 2NO + I2 + 2H2O.
Для удобства мы собрали представителей типичных окислителей и восстановителей в одну схему.
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции можно поделить на четыре типа:
Рассмотрим каждую по отдельности.
Межмолекулярная ОВР — это реакция, окислитель и восстановитель которой являются различными веществами.
2KI + Br2 = 2KBr + I2, где Br2 — окислитель, а KI — восстановитель (за счёт I −1 ).
Внутримолекулярная ОВР — это реакция, в которой один атом является окислителем, а другой восстановителем в рамках одного соединения.
Пример такой окислительно-восстановительной реакции:
где Cl +5 — окислитель, а O −2 — восстановитель.
Термическое разложение нитратов — это внутримолекулярная ОВР. Вот схема разложения нитратов в зависимости от металла, входящего в состав соли.
Исключение — разложение нитрата железа (II): 4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2. Здесь железо окисляется до +3 вопреки правилам. Иначе разлагается при нагревании и нитрат аммония: NH4NO3 = N2O + 2H2O.
Окислительно-восстановительная реакция контрпропорционирования — это реакция, в которой атомы одного и того же химического элемента в разных степенях окисления входят в состав разных веществ, при этом образуя новые молекулы одного и того же продукта.
Основные правила составления ОВР
Подобрать среди исходных веществ окислитель и восстановитель, а также вещество, которое отвечает за среду — при необходимости. Для этого нужно расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.
Составить уравнение реакции и записать продукты реакции. Следует помнить, что в кислой среде образуются соли одно-, двух- и трехзарядных катионов, а для создания среды чаще всего используют серную кислоту. В кислой среде невозможно образование оснóвных оксидов и гидроксидов, так как они вступят в реакцию с кислотой. В щелочной среде не могут образовываться кислоты и кислотные оксиды, а образуются соли.
Уравнять методом электронного баланса или методом полуреакций.
Составим алгоритм для уравнивания окислительно-восстановительных реакций методом электронного баланса.
Главное условие протекания ОВР — общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем.
Определите атомы, которые меняют свои степени окисления в ходе реакции.
Выпишите, сколько электронов принял окислитель и отдал восстановитель. Если восстановителей несколько, выписываем все.
Найдите НОК для суммарно отданных/принятых электронов.
Расставьте первые полученные коэффициенты перед окислителем и одним или несколькими восстановителями.
Уравняйте все присутствующие металлы в уравнении реакции.
Уравняйте кислотные остатки.
Уравняйте водород — в обеих частях его должно быть одинаковое количество.
Проверьте себя по кислороду — если все посчитано верно, то он сойдется.
Конспект для учителя по теме «Реакции окислительно-восстановительные»
Здравствуйте! Как Вы считаете, что такое pеакции окислительно-восстановительные?
(Рассуждение с учениками, обсуждение вариантов)
Переход к основной теме:
Определение
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
Окислители и восстановители
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
Типичные окислители
К типичным окислителям относят:
Типичные восстановители
Типичные восстановители – это, как правило:
И окислители, и восстановители
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители и восстановители приведены в таблице.
В лабораторной практике наиболее часто используются следующие окислители:
К восстановителям, которые применяются в лабораторной практике относятся:
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования.
Межмолекулярные реакции
Межмолекулярные реакции протекают с изменением степени окисления разных элементов из разных реагентов. При этом образуются разные продукты окисления и восстановления.
Внутримолекулярные реакции
Внутримолекулярные реакции – это такие реакции, в которых разные элементы из одного реагента переходят в разные продукты, например:
Реакции диспропорционирования
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты:
Репропорционирование
Репропорционирование (конпропорционирование, контрдиспропорционирование) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент, который из разных реагентов переходит в один продукт. Реакция, обратная диспропорционированию.
Основные правила составления окислительно-восстановительных реакций
Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления:
Окисление — это процесс отдачи электронов восстановителем.
Восстановление — это процесс присоединения электронов окислителем.
Окислитель восстанавливается, а восстановитель окисляется.
В окислительно-восстановительных реакциях соблюдается электронный баланс: количество электронов, которые отдает восстановитель, равно количеству электронов, которые получает окислитель. Если баланс составлен неверно, составить сложные ОВР у вас не получится.
Используется несколько методов составления окислительно-восстановительных реакций (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие.
Метод электронного баланса
Рассмотрим подробно метод электронного баланса.
«Опознать» ОВР довольно легко — достаточно расставить степени окисления во всех соединениях и определить, что атомы меняют степень окисления:
Выписываем отдельно атомы элементов, меняющих степень окисления, в состоянии ДО реакции и ПОСЛЕ реакции.
Степень окисления меняют атомы марганца и серы:
Марганец поглощает 1 электрон, сера отдает 2 электрона. При этом необходимо, чтобы соблюдался электронный баланс. Следовательно, необходимо удвоить число атомов марганца, а число атомов серы оставить без изменения. Балансовые коэффициенты указываем и перед реагентами, и перед продуктами!
Схема составления уравнений ОВР методом электронного баланса:
Внимание! В реакции может быть несколько окислителей или восстановителей. Баланс необходимо составить так, чтобы ОБЩЕЕ число отданных и полученных электронов было одинаковым.
Общие закономерности протекания окислительно-восстановительных реакций
Продукты окислительно-восстановительных реакций зачастую зависят от условий проведения процесса. Рассмотрим основные факторы, влияющие на протекание окислительно-восстановительных реакций.
Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами!
Обратите внимание! Если среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок.
При увеличении температуры большинство ОВР, как правило, проходят более интенсивно и более глубоко.
В гетерогенных реакциях на состав продуктов зачастую влияет степень измельчения твердого вещества. Например, порошковый цинк с азотной кислотой образует одни продукты, а гранулированный — совершенно другие. Чем больше степень измельчения реагента, тем больше его активность, как правило.
Рассмотрим наиболее типичные лабораторные окислители.
Основные схемы окислительно-восстановительных реакций
Схема восстановления перманганатов
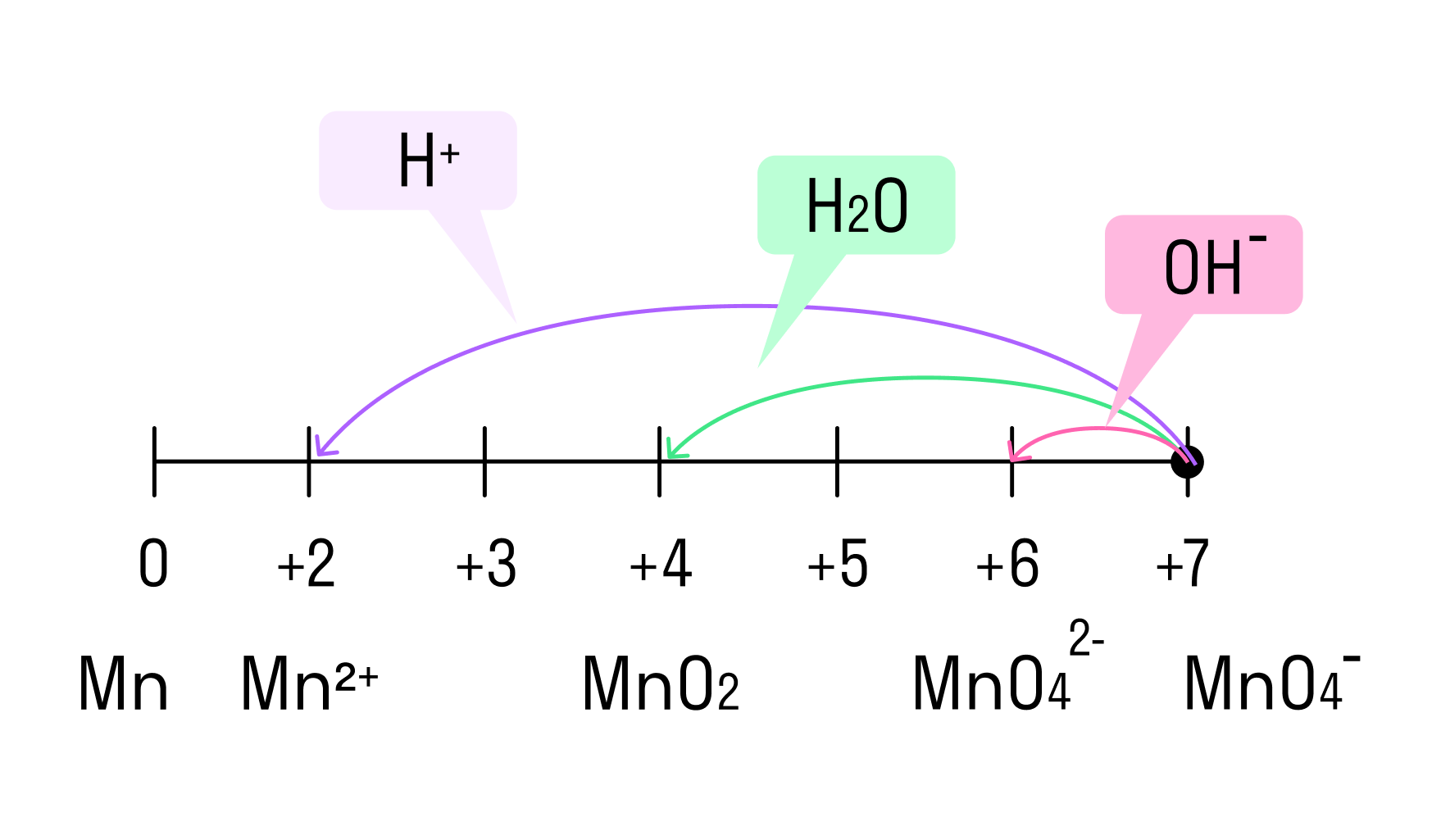
В составе перманганатов есть мощный окислитель — марганец в степени окисления +7. Соли марганца +7 окрашивают раствор в фиолетовый цвет.
Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции. При обычных условиях правильно будет указывать именно молекулярную серу и щелочь отдельно, а не продукты их взаимодействия.
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия. Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно? Если действовать по классической схеме — баланс-балансовые коэффициенты-уравнивание металла, то вы увидите, что металлы уравниваются балансовыми коэффициентами, и наличие щелочи в левой части уравнения реакции будет лишним.
Перманганаты окисляют:
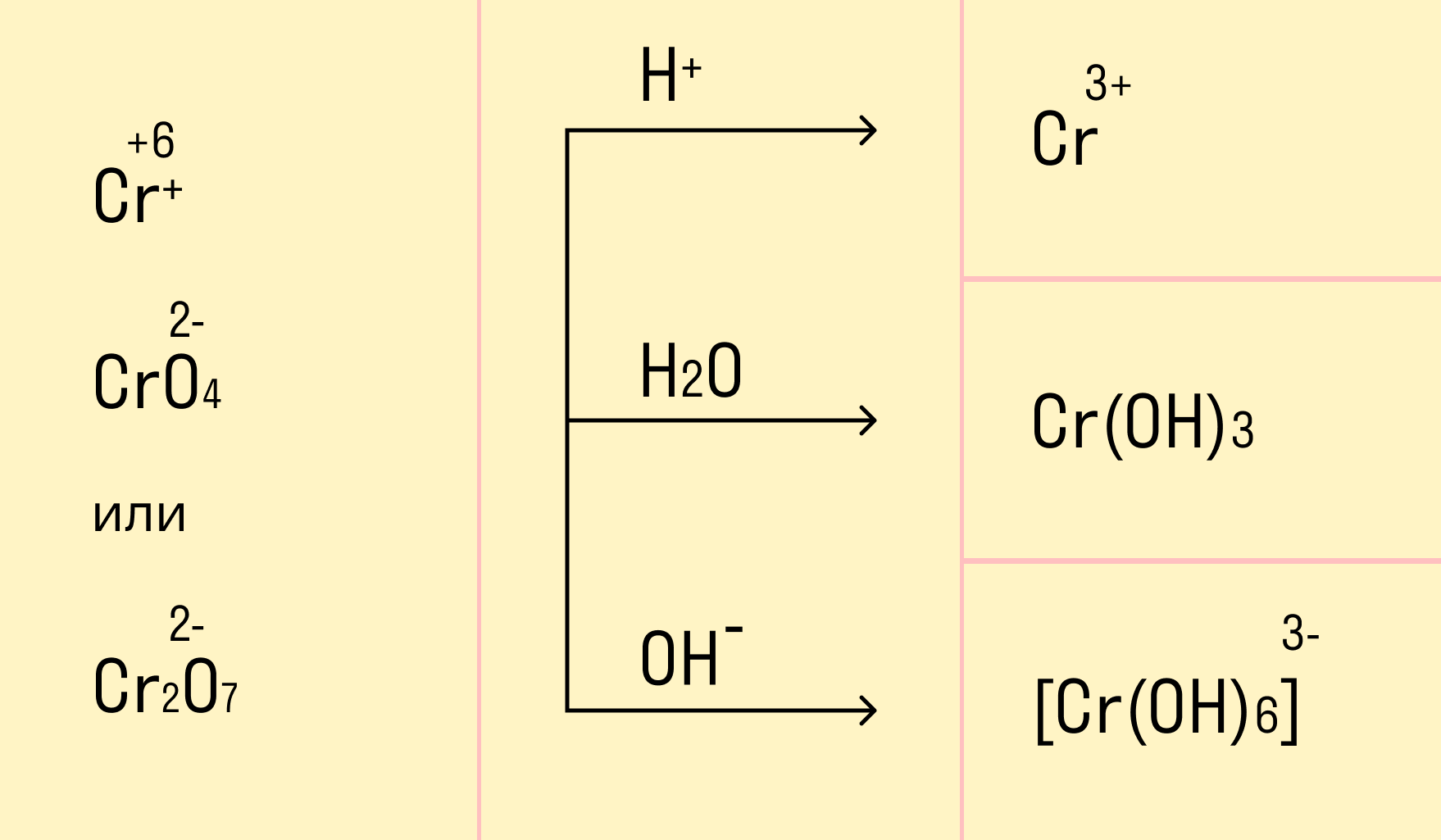
Схема восстановления хроматов/бихроматов
Особенностью хрома с валентностью VI является то, что он образует 2 типа солей в водных растворах: хроматы и бихроматы, в зависимости от среды раствора. Хроматы активных металлов (например, K2CrO4) — это соли, которые устойчивы в щелочной среде. Дихроматы (бихроматы) активных металлов (например, K2Cr2O7) — соли, устойчивые в кислой среде.
Восстанавливаются соединения хрома (VI) до соединений хрома (III). Соединения хрома Cr +3 — амфотерные, и в зависимости от среды раствора они существуют в растворе в различных формах: в кислой среде в виде солей (амфотерные соединения при взаимодействии с кислотами образуют соли), в нейтральной среде — нерастворимый амфотерный гидроксид хрома (III) Cr(OH)3, и в щелочной среде соединения хрома (III) образуют комплексную соль, например:
Соединения хрома VI окисляют:
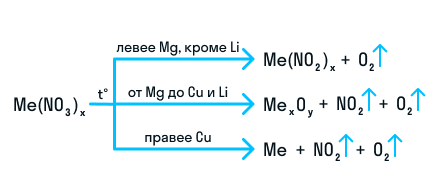
Разложение нитратов
В зависимости от типа металла, образующего соль, при термическом (температурном) разложении нитратов образуются различные продукты: если металл активный (в ряду электрохимической активности находятся до магния), то азот восстанавливается до степени окисления +3, и при разложении образуется соли-нитриты и молекулярный кислород.
Например:
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Если металл в ряду электрохимической активности находится правее магния и левее меди (включая магний и медь), то при разложении образуется оксид металла в устойчивой степени окисления, оксид азота (IV) (бурый газ) и кислород. Оксид металла образует также при разложении нитрат лития.
Например, разложение нитрата цинка:
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe2O3, Al2O3 и др.).
Например, разложение нитрата серебра:
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложение нитрата аммония
При нагревании нитрат аммония разлагается. При температуре до 270 о С образуется оксид азота (I) («веселящий газ») и вода:
Это пример реакции контрдиспропорционирования.
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород:
При разложении нитрита аммония NH4NO2 также происходит контрдиспропорционирование.
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления +3:
Нитрат никеля (II) разлагается до нитрита при нагревании до 150 о С под вакуумом и до оксида никеля при более высоких температурах (разложения нитрата никеля в ЕГЭ по химии не должно быть, но это не точно)).
Окислительные свойства азотной кислоты
Азотная кислота HNO3 при взаимодействии с металлами практически никогда не образует водород, в отличие от большинства минеральных кислот.
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления +5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота + металл = соль металла + продукт восстановления азота + H2O
Азотная кислота при восстановлении может переходить в оксид азота (IV) NO2 (N +4 ); оксид азота (II) NO (N +2 ); оксид азота (I) N2O («веселящий газ»); молекулярный азот N2; нитрат аммония NH4NO3. Как правило, образуется смесь продуктов с преобладанием одного из них. Азот восстанавливается при этом до степеней окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. При этом работает правило: чем меньше концентрация кислоты и выше активность металла, тем больше электронов получает азот, и тем более восстановленные продукты образуются.
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
Например, взаимодействие цинка с очень разбавленной азотной кислотой:
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
Например, окисление меди концентрированной азотной кислотой:
Например, окисление натрия концентрированной азотной кислотой:
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%). Металлы по активности разделим на активные (до алюминия), средней активности (от алюминия до водорода) и неактивные (после водорода). Продукты восстановления азотной кислоты располагаем в порядке убывания степени окисления:
NO2; NO; N2O; N2; NH4NO3
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Например, взаимодействуют концентрированная кислота и неактивный металл медь Cu. Следовательно, смещаемся в крайнее левое положение, образуется оксид азота (IV), нитрат меди и вода.
Взаимодействие металлов с серной кислотой
Например:
Концентрированная серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H2SO4 (конц) + металл = соль металла + продукт восстановления серы (SO2, S, H2S) + вода
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
Например, медь окисляется концентрированной серной кислотой:
Например, взаимодействие концентрированной серной кислоты с цинком:
Пероксид водорода
При взаимодействии с окислителями перекись окисляется до молекулярного кислорода (степень окисления 0): O2. Например:
Скажите, что вы запомнили о окислительно-восстановительных реакциях?
Выучить и повторить материал из конспекта
Реакция алюминия с серой. Записываем схему реакции и указываем изменение степеней окисления.
Окисление фосфора хлором. Записываем схему реакции и указываем изменение степеней окисления.
Восстановление оксида железа (II, III) алюминием. Записываем схему реакции и указываем изменение степеней окисления.
Окисление йодида натрия перманганатом калия в среде серной кислоты. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления.
Окисление сульфида калия манганатом калия в водной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления.
Окисление аммиака хлоратом калия в щелочной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления.
Поступление без ОГЭ и ЕГЭ. Обучаем перспективным профессиям
после 9 или 11 класса.