Что относится к ультрамикроэлементам
Что относится к ультрамикроэлементам
2. Радий.
Радий сильно токсичен. Около 80% поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы и опухоли.
3. Литий.
Литий в незначительных количествах присутствует в живых организмах, но, по-видимому, не выполняет никаких биологических функций. В организме среднего человека (масса 70 кг) содержится около 0,7 мг лития. Токсическая доза 90-200 мг.
4. Бериллий.
В живых организмах бериллий, по-видимому, не несет никакой биологической функции. Его содержание в организме среднего человека (масса тела 70 кг) составляет 0,036 мг, ежедневное поступление с пищей — около 0,01 мг. Летучие и растворимые соединения бериллия, а также пыль, содержащая бериллий и его соединения, очень токсичны. Бериллий замещает в ферментах магний и обладает ярко выраженным аллергическим и канцерогенным действием. Его присутствие в атмосферном воздухе приводит к тяжелому заболеванию органов дыхания — бериллиозу. Следует отметить, что эти заболевания могут возникнуть через 10-15 лет после прекращения контакта с бериллием. Для воздуха ПДК в пересчете на бериллий составляет 0,001 мг/м3.
5. Бор.
Роль бора в животном организме не выяснена. В мышечной ткани человека содержится (0,33-1)•10-4% бора, в костной ткани — (1,1-3,3)•10-4%, в крови — 0,13 мг/л. Ежедневно с пищей человек получает 1-3 мг бора. Токсичная доза — 4 г.
6. Алюминий.
В организм человека алюминий ежедневно поступает с пищей (около 2-3 мг), но его биологическая роль не установлена. В среднем в организме человека (70 кг) в костях, мышцах содержится около 60 мг алюминия.
7. Кремний.
Для некоторых организмов кремний является важным биогенным элементом. Он входит в состав опорных образований. Мышечная ткань человека содержит (1-2)•10-2% кремния, костная ткань — 17•10-4%, кровь — 3,9 мг/л. С пищей в организм человека ежедневно поступает до 1 г кремния.
Соединения кремния не ядовиты. Но очень опасно вдыхание высокодисперсных частиц как силикатов, так и диоксида кремния, образующихся, например, при взрывных работах, при долблении пород в шахтах, при работе пескоструйных аппаратов и т. д. Микрочастицы SiO2, попавшие в легкие, в них кристаллизуются, а возникающие кристаллики разрушают легочную ткань и вызывают тяжелую болезнь — силикоз. Чтобы не допустить попадания в легкие этой опасной пыли, следует использовать для защиты органов дыхания респиратор.
8. Ванадий.
Ванадий постоянно присутствует в тканях всех организмов в ничтожных количествах. В растениях его содержание (0,1-0,2%) значительной выше, чем в животных (1•10–5-1•10–4%). По-видимому, ванадий участвует в некоторых окислительных процессах в тканях. Мышечная ткань человека содержит 2•10–6% ванадия, костная ткань — 0,35•10–6%, в крови — менее 2•10–4% мг/л. Всего в организме среднего человека (масса тела 70 кг) 0,11 мг ванадия. Ванадий и его соединения токсичны. Токсическая доза для человека 0,25 мг, летальная доза — 2-4 мг. Для V2O5 ПДК в воздухе 0,1-0,5 мг/м3.
9.Хром.
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
Металлический хром практически нетоксичен, но металлическая пыль хрома раздражает ткани легких. Соединения хрома(III) вызывают дерматиты. Соединения хрома(VI) приводят к разным заболеваниям человека, в том числе и онкологическим. ПДК хрома(VI) в атмосферном воздухе 0,0015 мг/м3.
10. Никель.
Никель относится к числу микроэлементов, необходимых для нормального развития организмов. Однако о его роли в живых организмах известно немного. Известно, что никель принимает участие в ферментативных реакциях. В организме он накапливается в ороговевших тканях. Повышенное содержание никеля в почвах приводят к эндемическим заболеваниям, у животных — заболевания глаз, связанные с накоплением никеля в роговице. Токсическая доза (для крыс) — 50 мг. Особенно вредны летучие соединения никеля, в частности, его тетракарбонил Ni(CO)4. ПДК соединений никеля в воздухе составляет от 0,0002 до 0,001 мг/м3 (для различных соединений).
11.Мышьяк.
Мышьяк и все его соединения ядовиты. При остром отравлении мышьяком наблюдаются рвота, боли в животе, понос, угнетение центральной нервной системы. Помощь и противоядия при отравлении мышьяком: прием водных растворов Na2S2O3. Промывание желудка, прием молока и творога; специфическое противоядие — унитиол. ПДК в воздухе для мышьяка 0,5мг/м3. Работают с мышьяком в герметичных боксах, используя защитную спецодежду. Из-за высокой токсичности соединения мышьяка использовались Германией как отравляющие вещества в Первую мировую войну.
На территориях, где в почве и воде избыток мышьяка, он накапливается в щитовидной железе у людей и вызывает эндемический зоб.
12. Селен.
Микроэлемент (массовая доля в организме 10–5–10–7%).
В организм человека селен поступает с пищей (55–110 мг в год). Концентрируется в печени и почках. При больших дозах в первую очередь накапливается в ногтях и волосах, основу которых составляют серосодержащие аминокислоты. Атомы селена замещают атомы серы:
R–S–S_–R + 2Se = R–Se–Se_–R + 2S
Селен входит в состав активных центров ферментов: формиатдегидрогеназы, глутатионредуктазы и глутатионпероксидазы, в активном центре которой содержится остаток аминокислоты — селеноцистеина:
Селен способен предохранять организм от отравления ртутью и кадмием, так как связывает их. Существует взаимосвязь между высоким содержанием селена в рационе и низкой смертностью от рака.
Пары селена ядовиты. ПДК аморфного селена в воздухе 2 мг/м3, SeO2, Na2SeO3 — 0,1 мг/м3. ПДК селена в воде 0,01 мг/м3.
13. Бром.
При работе с бромом следует пользоваться защитной спецодеждой, противогазом, перчатками. ПДК паров брома 0,5 мг/м3. Уже при содержании брома в воздухе в концентрации около 0,001% (по объему) наблюдается раздражение слизистых оболочек, головокружение, а при более высоких концентрациях — спазмы дыхательных путей, удушье. При попадании в организм токсическая доза составляет 3 г, летальная — от 35 г. При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух, для восстановления дыхания можно на небольшое время пользоваться тампоном, смоченным нашатырным спиртом, на короткое время периодически поднося его к носу пострадавшего. Дальнейшее лечение должно проводиться под наблюдением врача. Жидкий бром при попадании на кожу вызывает болезненные ожоги.
14. Стронций.
Соединения стронция токсичны. При попадании в организм возможно поражение костной ткани и печени. ПДК стронция в воде 8 мг/л, в воздухе для гидроксида, нитрата и оксида 1 мг/м3, для сульфата и фосфата 6 мг/м3.
15. Рутений.
Летучие и растворимые соединения рутения вызывают аллергию, раздражают слизистые оболочки, вызывают их изъязвление. ПДК для содержания аэрозоля RuO2 в воздухе рабочих помещений 1 мг/м3.
16. Серебро.
Серебро — примесный микроэлемент растительных и животных организмов. В организме человека общее содержание серебра составляет несколько десятых грамма. Физиологическая роль серебра неясна. Соединения серебра токсичны. При попадании в организм больших доз растворимых солей серебра наступает острое отравление, сопровождающееся некрозом слизистой желудочно-кишечного тракта. Первая помощь при отравлении — промывание желудка раствором хлорида натрия NaCl, при этом образуется нерастворимый хлорид серебра AgCl, который и выводится из организма.
Ион Ag+, попадая на тело, вызывает ожог.
Серебро бактерицидно, при 40-200 мкг/л погибают неспоровые бактерии, а при более высоких концентрациях — споровые.
ПДК серебра в воздухе 0,1–0,5 мг/м3.
17. Кадмий.
Пары кадмия и его соединения токсичны, причем кадмий может накапливаться в организме. В питьевой воде ПДК для кадмия 10 мг/м3. Симптомы острого отравления солями кадмия — рвота и судороги. Растворимые соединения кадмия после всасывания в кровь поражают центральную нервную систему, печень и почки, нарушают фосфорно-кальциевый обмен. Хроническое отравление приводит к анемии и разрушению костей.
18. Индий.
Индий токсичен. ПДК в воздухе 0,1 мг/м3. Индиевая пыль вызывает воспалительные и склеротические воспаления легких, поражает печень и другие внутренние органы. Растворимые соединения индия раздражают кожу, глаза, слизистые оболочки.
19. Олово.
О роли олова в организмах практически ничего не известно. В теле человека содержится примерно (1-2)• 10–4% олова, а его ежедневное поступление с пищей составляет 0,2-3,5 мг. Олово представляет опасность для человека в виде паров и различных аэрозольных частиц, пыли. При воздействии паров или пыли олова может развиться станноз — поражение легких. Очень токсичны некоторые оловоорганические соединения. Временно допустимая концентрация соединений олова в атмосферном воздухе 0,05 мг/м3, ПДК олова в пищевых продуктах 200 мг/кг, в молочных продуктах и соках — 100 мг/кг. Токсическая доза олова для человека — 2 г.
20. Сурьма.
Сурьма относится к микроэлементам, содержание в организме человека 10–6% по массе. Постоянно присутствует в живых организмах, физиологическая и биохимическая роль не выяснена.
Накапливается в щитовидной железе, угнетает ее функцию и вызывает эндемический зоб. Однако, попадая в пищеварительный тракт, соединения сурьмы не вызывают отравления, так как соли Sb(III) там гидролизуются с образованием малорастворимых продуктов.
Пыль и пары Sb вызывают носовые кровотечения, сурьмяную «литейную лихорадку», пневмосклероз, поражают кожу, нарушают половые функции. Для аэрозолей сурьмы ПДК в воздухе рабочей зоны 0,5 мг/м3, в атмосферном воздухе 0,01 мг/м3. ПДК в почве 4,5 мг/кг, в воде 0,05 мг/л.
21. Теллур.
Теллур и его летучие соединения токсичны. Попадание в организм вызывает тошноту, бронхиты, пневмонию. ПДК в воздухе 0,01 мг/м3, в воде 0,01 мг/л. При отравлениях теллур выводится из организма в виде отвратительно пахнущих теллуроорганических соединений.
Микроколичества Te всегда содержатся в живых организмах, его биологическая роль не выяснена.
22. Ртуть.
В книге Гарсиласо де ла Вего есть строки: «Короли инков знали о ртути и восхищались ее подвижностью и движением, однако они не знали, что можно из нее и с ее помощью делать. Они не нашли полезного применения ей в своих службах, скорее они почувствовали, что ртуть причиняет вред жизни тех, кто ее добывал и занимался ею, ибо они видели, что она вызывала у них дрожь и потерю сознания. По этой причине. они запретили законом добывать и вспоминать о ней; и индейцы выполнили это столь усердно, что даже имя ее было стерто в их памяти и исчезло из языка».
Ртуть и ее соединения высокотоксичны. Пары и соединения ртути накапливаясь в организме человека, сорбируются легкими, попадают в кровь, нарушают обмен веществ и поражают нервную систему. Признаки ртутного отравления проявляются уже при содержании ртути в концентрации 0.0002–0.0003 мг/л. Пары ртути фитотоксичны, ускоряют старение растений.
Но вот интересный факт: ртуть обнаружена в молекулах ДНК. Возможно, она участвует в передаче наследственной информации.
Сулема HgCl2— важнейший антисептик, применяют при разбавлениях 1:1000. Оксид ртути(II), киноварь HgS применяются для лечения глазных и кожных и венерических заболеваний. Киноварь также используют для приготовления чернил и красок. В древности из киновари готовили румяна. Каломель Hg2Cl2 используется в ветеринарии в качестве слабительного средства.
23. Рений.
Растворимые соединения рения мало токсичны, однако его металлическая пыль может вызывать интоксикации и заболевания дыхательных путей.
24. Осмий.
Соединения осмия, особенно легколетучие, сильно ядовиты. Тетраоксид OsO4 раздражает слизистые, поражает органы дыхания. ПДК в воздухе 0,002 мг/м3.
25. Радий.
Радий сильно токсичен. Около 80% поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы и опухоли. Соли радия используются в медицине для приготовления радоновых ванн.
26. Уран.
В микроколичествах (10-5-10-8 %) обнаруживается в тканях человека. Соединения урана всасываются в желудочно-кишечном тракте (около 1%), в легких — 50%. Основные депо в организме: селезенка, почки, скелет, печень, легкие и бронхолегочные лимфатические узлы. Содержание в органах и тканях человека не превышает 10-7 гг.
Уран и его соединения высокотоксичны. Особенно опасны аэрозоли урана и его соединений. Для аэрозолей растворимых в воде соединений урана ПДК в воздухе 0,015 мг/м3, для нерастворимых форм урана ПДК 0,075 мг/м3. При попадании в организм уран действует на все органы, являясь общеклеточным ядом. Молекулярный механизм действия урана связан с его способностью подавлять активность ферментов. В первую очередь поражаются почки (появляются белок и сахар в моче, олигурия). При хронической интоксикации возможны нарушения кроветворения и нервной системы.
27. Радон.
Радионуклиды радона обусловливают более половины всей дозы радиации, которую в среднем получает организм человека от природных и техногенных радионуклидов окружающей среды. Распад ядер радона в легочной ткани вызывает микроожог. Если концентрация радона в воздухе значительна, то попадание его в легкие может вызвать онкологическое заболевание.
ПДК радона в воздухе помещений 100 Бк/м3. Предельно допустимое поступление Rn через органы дыхания 146 Мбк/год.
28. Свинец.
Свинец и его соединения — токсичны. Попадая в организм, свинец накапливается в костях, вызывая их разрушение. ПДК в атмосферном воздухе соединений свинца 0,003 мг/м3, в воде 0,03 мг/л, почве 20,0 мг/кг. Выброс свинца в Мировой океан 430-650 тысяч т/год.
29. Таллий.
Таллий и его соединения высокотоксичны вследствие того, что катион Tl+ образует прочные соединения с серосодержащими лигандами:
Tl++R–SH=R–S–TI+Н+
Поэтому соединения Tl+ подавляют активность ферментов, содержащих тиогруппы SH.
Вследствие близости радиусов K+ и Tl+ эти ионы обладают сходными свойствами и способны замещать друг друга в ферментах. Попадание в организм даже очень незначительных количеств соединений Tl+ вызывает выпадение волос, поражение нервной системы, почек, желудка.
ПДК в воде 0,0001 мг/л, для соединений таллия в воздухе рабочих помещений 0,01 мг/м3, в атмосферном воздухе 0.004 мг/м3. В качестве противоядия используют серосодержащую аминокислоту цистеин HS–CH2CH(NH2)COOH.
Научные статьи и последние новости о генетике
Особенности химического состава клетки. Макро-, микро — и ультромикроэлементы
Каждая клетка содержит множество химических элементов, участвующих в различных химических реакциях. Химические процессы, протекающие в клетке — одно из основных условий её жизни, развития и функционирования. Одних химических элементов в клетке больше, других — меньше.
Условно все элементы клетки можно разделить на три группы.
К макроэлементам относят кислород (65—75 %), углерод (15—18 %), водород (8—10 %), азот (2,0—3,0 %), калий (0,15—0,4 %), сера (0,15—0,2 %), фосфор (0,2—1,0 %), хлор (0,05—0,1 %), магний (0,02—0,03 %), натрий (0,02—0,03 %), кальций (0,04—2,00 %), железо (0,01—0,015 %. Такие элементы, как C, O, H, N, S, P входят в состав органических соединений.
Углерод — входит в состав всех органических веществ; скелет из атомов углерода составляет их основу. Кроме того, в виде CO2 фиксируется в процессе фотосинтеза и выделяется в ходе дыхания, в виде CO (в низких концентрациях) участвует в регуляции клеточных функций, в виде CaCO3 входит в состав минеральных скелетов.
Кислород — входит в состав практически всех органических веществ клетки. Образуется в ходе фотосинтеза при фотолизе воды. Для аэробных организмов служит окислителем в ходе клеточного дыхания, обеспечивая клетки энергией. В наибольших количествах в живых клетках содержится в составе воды.
Водород — входит в состав всех органических веществ клетки. В наибольших количествах содержится в составе воды. Некоторые бактерии окисляют молекулярный водород для получения энергии.
Азот — входит в состав белков, нуклеиновых кислот и их мономеров — аминокислот и нуклеотидов. Из организма животных выводится в составе аммиака, мочевины, гуанина или мочевой кислоты как конечный продукт азотного обмена. В виде оксида азота NO (в низких концентрациях) участвует в регуляции кровяного давления.
Сера — входит в состав серосодержащих аминокислот, поэтому содержится в большинстве белков. В небольших количествах присутствует в виде сульфат-иона в цитоплазме клеток и межклеточных жидкостях.
Фосфор — входит в состав АТФ, других нуклеотидов и нуклеиновых кислот (в виде остатков фосфорной кислоты), в состав костной ткани и зубной эмали (в виде минеральных солей), а также присутствует в цитоплазме и межклеточных жидкостях (в виде фосфат-ионов).
Магний — кофактор многих ферментов, участвующих в энергетическом обмене и синтезе ДНК; поддерживает целостность рибосом и митохондрий, входит в состав хлорофилла. В животных клетках необходим для функционирования мышечных и костных систем.
Кальций — участвует в свёртывании крови, а также служит одним из универсальных вторичных посредников, регулируя важнейшие внутриклеточные процессы (в том числе участвует в поддержании мембранного потенциала, необходим для мышечного сокращения и экзоцитоза). Нерастворимые соли кальция участвуют в формировании костей и зубов позвоночных и минеральных скелетов беспозвоночных.
Натрий — участвует в поддержании мембранного потенциала, генерации нервного импульса, процессы осморегуляции (в том числе работу почек у человека) и создании буферной системы крови.
Калий — участвует в поддержании мембранного потенциала, генерации нервного импульса, регуляции сокращения сердечной мышцы. Содержится в межклеточных веществах.
Хлор — поддерживает электронейтральность клетки.
К микроэлементам, составляющим от 0,001 % до 0,000001 % массы тела живых существ, относят ванадий, германий, йод (входит в состав тироксина, гормона щитовидной железы), кобальт (витамин В12), марганец, никель, рутений, селен, фтор (зубная эмаль), медь, хром, цинк
Цинк — входит в состав ферментов, участвующих в спиртовом брожении, в состав инсулина
Медь — входит в состав окислительных ферментов, участвующих в синтезе цитохромов.
Селен — участвует в регуляторных процессах организма.
Ультрамикроэлементы составляют менее 0,0000001 % в организмах живых существ, к ним относят золото, серебро оказывают бактерицидное воздействие, ртуть подавляет обратное всасывание воды в почечных канальцах, оказывая воздействие на ферменты. Так же к ультрамикроэлементам относят платину и цезий. Некоторые к этой группе относят и селен, при его недостатке развиваются раковые заболевания. Функции ультрамикроэлементов еще мало понятны.
На атомарном уровне различий между органическим и неорганическим миром живой природы нет: живые организмы состоят из тех же атомов, что и тела неживой природы. Однако соотношение разных химических элементов в живых организмах и в земной коре сильно различается. Кроме того, живые организмы могут отличаться от окружающей их среды по изотопному составу химических элементов. Наиболее резкие различия между живой и неживой природой проявляются на молекулярном уровне.
Биология
Микро- и макроэлементы. Биологическое значение. Ультрамикроэлементы
К макроэлементам относятся те элементы, содержание которых в клетках измеряется десятыми и сотыми долями процента сухого вещества клетки (редко их содержание достигает нескольких процентов): калий, натрий, кальций, магний, железо, сера, хлор, йод. Содержание макроэлементов в клетках выражается в процентах от всей массы сухого вещества клетки.
1. Регулирует углеводный обмен.
2. Регулирует осмотическое давление.
3. Участвует в формировании мембранных потенциалов.
4. Активирует ферменты при фотосинтезе.
5. Радиоактивный изотоп 40 К – основной источник внутренней радиоактивности.
Примечание. Осмотическое давление – это величина, отражающая соотношение воды и сухого вещества в клетке. Чем выше осмотическое давление в клетке, тем легче клетка будет поглощать воду из внеклеточной среды, и, наоборот, чем ниже внутриклеточное осмотическое давление, тем скорее клетка будет терять воду.
Магний (до 3 %). В клетках содержится в виде металлорганических комплексов, реже – в виде ионов. Стабилизирует структуру рибосом, регулирует активность ферментов, входит в состав АТФазы, входит в состав молекулы хлорофилла в клетках растений.
Сероводород и другие восстановленные соединения серы служат донорами электронов при бактериальном фотосинтезе.
Йод (до 0,01 %). Содержится в клетках в виде иодидов J – и металлорганических комплексов. Входит в состав тироксина – гормона щитовидной железы, регулирующего проницаемость мембран.
Микроэлементы – это элементы, суммарное содержание которых в клетке обычно не превышает 0,01 %. Содержатся в клетках в виде гидратированных неорганических ионов и (или) металлорганических комплексов.
Марганец. Участвует в фотосинтезе. Входит в состав дегидрогеназ и фосфатаз, в состав ферментов, участвующих в симбиогенной фиксации азота. Активирует ряд ферментов углеводного и азотного обмена.
Кобальт. Входит в состав нитратредуктаз (катализирует переход нитратов в нитриты). Кобальт в повышенных дозах необходим для азотфиксирующих бактерий.
Медь. Входит в состав оксидаз (переносчиков электронов), оксигеназ (например, в состав цитохромоксидазы – комплекса ферментов, присоединяющих электроны к кислороду), дегидрогеназ (переносчиков водорода). Участвует в синтезе фосфолипидов, гемоглобина.
Цинк. Входит в состав различных ферментов: карбоангидразы (Н2СО3 → Н2О + СО2), пептидаз (катализируют расщепление белков), дегидрогеназ (например, алкогольдегидрогеназы, катализирующей окисление спиртов до альдегидов). Входит в состав гормона поджелудочной железы инсулина, регулирующего углеводный обмен. Регулирует действие гормонов гипофиза.
Молибден. У азотфиксирующих микроорганизмов входит в состав нитрогеназы – фермента, катализирующего восстановление атмосферного азота до аммиака. У большинства других организмов молибден входит в состав нитратредуктазы (фермента, восстанавливающего нитраты) и некоторых дегидрогеназ.
Бор. Бор регулирует деление клеток меристемы у растений. При его недостатке наблюдаются нарушения развития: слабое ветвление корня, засыхание верхушек побегов, некрозы. Кроме того, бор участвует в регуляции азотного и углеводного обмена.
Фтор. Входит в состав зубной эмали в виде фторфосфатов кальция и магния.
Элементы, содержание которых в клетке составляет миллионные доли процента, называются ультрамикроэлементы. К ультрамикроэлементам относятся: селен, цезий, алюминий, кадмий, ртуть, мышьяк, свинец, серебро, золото, радий и многие другие.
Биологические функции ультрамикроэлементов изучены недостаточно. В повышенных концентрациях они являются ферментными ядами. Ядовитые свойства ионов металлов часто обусловлены их необратимым связыванием с белками, при этом происходит денатурация белков.
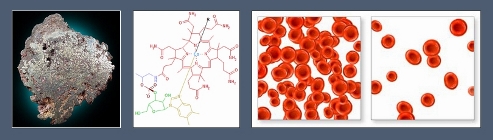
Роль микроэлементов в организме
1 — кобальт в природе; 2 — структурная формула витамина В12; 3 — эритроциты здорового человека и эритроциты больного анемией
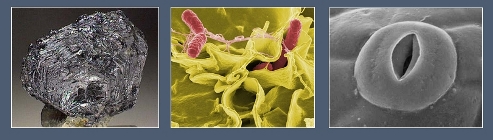
Молибден в составе ферментов участвует в фиксации азота у бактерий и обеспечивает работу устьичного аппарата у растений.
1 — молибденит (минерал, содержащий молибден); 2 — азотфиксирующие бактерии; 3 — устьичный аппарат
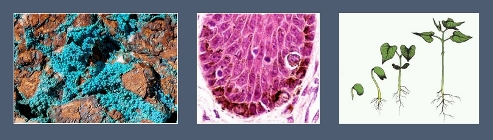
Медь является компонентом фермента, участвующего в синтезе меланина (пигмента кожи), влияет на рост и размножение растений, на процессы кроветворения у животных организмов.
1 — медь; 2 — частицы меланина в клетках кожи; 3 — рост и развитие растения
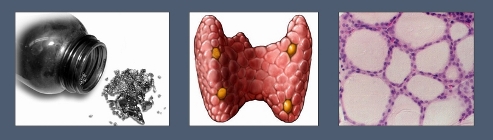
1 — йод; 2 — внешний вид щитовидной железы; 3 — клетки щитовидной железы, синтезирующие тироксин
Бор влияет на ростовые процессы у растений, его недостаток приводит к отмиранию верхушечных почек, цветков и завязей.
1 — бор в природе; 2 — пространственная структура бора; 3 — верхушечная почка
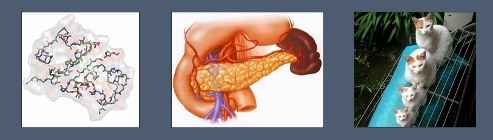
1 — пространственная структура инсулина; 2 — поджелудочная железа; 3 — рост и развитие животных
В организмы растений и микроорганизмов микроэлементы поступают из почвы и воды; в организмы животных и человека — с пищей, в составе природных вод и с воздухом.

Их физиологическая роль в живых организмах пока до конца не установлена.