Что относится к цитостатикам какие препараты
Цитостатическая противоопухолевая терапия
Призвана воздействовать на те клетки в организме, которые делятся наиболее быстро. Прежде всего это относится к опухолевым клеткам. Химиопрепараты могут назначаться по одному (монотерапия) или в комбинации (полихимиотерапия).
Наиболее часто противоопухолевые цитостатики назначаются внутривенно или внутрь, однако в ряде случаев может потребоваться введение лекарств в спинномозговой канал, либо в плевральную или брюшную полости. Иногда эффективность внутривенного введения повышает длительность введения химиопрепарата (до 48 и даже 96 часов).
Как проводится химиотерапия
Практически всегда химиотерапия проводится курсами (циклами), предполагая перерыв для восстановления нормальных тканей и функций организма (помимо опухолевых клеток, в процессе лечения могут повреждаться другие активно делящиеся клетки – в первую очередь клетки крови, волосяных фолликулов, клетки слизистых оболочек.
В последние годы успехи молекулярной биологии позволили для лечения ряда злокачественных новообразований создать препараты так называемой таргетной, или направленной терапии, с конкретной мишенью приложения, отличающей опухолевую клетку от нормальной.
Препараты таргетной терапии
В большинстве случаев препараты таргетной терапии сочетаются с обычными цитостатиками, повышая эффективность лечения, но иногда используются самостоятельно. Наиболее часто мишенью служат рецепторы на поверхности клеток опухоли или питающих ее сосудов (так действуют моноклональные антитела и ингибиторы тирозин-киназ), но мишенью могут быть и последующие этамы передачи пролиферативного сигнала).
Значительное число опухолевых заболеваний лечится не только химиопрепаратами, но и гормонами. Как правило, гормональные препараты принимаются внутрь и лечение осуществляется длительно. Иногда гормональное лечение требует хирургических вмешательств с целью исключить влияние тех или иных гормонов, вырабатывающихся в организме (удаление яичников или яичек).
Реже для лечения злокачественных новообразований используется иммунотерапия (как правило, цитокины интерферон альфа или интерлейкин-2). Обычно эти препараты используются в случаях, когда ограничены возможности химио- и гормонотерапии.
Бисфосфонаты
В арсенале онкологов существует также группа препаратов, избирательно действующих на костную ткань – бисфосфонаты. Предохраняя кость от разрушения опухолью, эти лекарства уменьшают боль и снижают частоту осложнений (прежде всего патологических переломов).
Кроме того, в арсенале онкологов существует целый ряд препаратов поддерживающей терапии для предотвращения либо лечения осложнений, связанных с химиотерапией. Как правило, такое лечение не носит «универсального» характера и присоединяется к противоопухолевой терапии по мере развития осложнений.
Исключение представляет, главным образом, противорвотная (антиэметическая) терапия, назначаемая перед химиотерапией, исходя из данных о возможности тошноты и рвоты при каждой конкретной схеме лечения.
По мере исчерпания возможностей противоопухолевого лечения (а на поздних стадиях болезни это обычно химиотерапия) возрастает значение паллиативной помощи и симптоматического лекарственного лечения как ее компонента.
В настоящее время медицина располагает большим количеством препаратов, позволяющих эффективно бороться с наиболее мучительными симптомами опухолевой болезни, включая болевой.
ВЫ можете нам позвонить:
8 (8452) 98-84-68
и
+7-967-500-8468
или
Базисная терапия системных заболеваний соединительной ткани
Главным средством в лечении аутоимунных заболеваний являются, так называемые базисные препараты. Их название произошло от того, что они воздействуют на основание болезни, ее «базис». Эти препараты вызывают ремиссию и предотвращают или замедляют разрушение суставов, но не являются противовоспалительными препаратами. В настоящее время в качестве базисной терапии используют чаще всего: цитостатики, антималярийные препараты, сульфаниламиды, пеницилламин.
1. Цитостатики.
Цитостатические препараты: метотрексат, арава, азатиоприн (имуран), циклофосфан (эндоксан), циклоспорин (сандимун, экворал), проспидин и др.
Не стоит пугаться от названия «цитостатики», зная спектр их побочных эффектов: дозы этих препаратов при лечении артритов примерно в 5-20 раз меньше используемых при лечении опухолей! Использование цитостатиков помогает, как минимум, 70-80% больных, побочные явления возможны у 15-20% пациентов и редко бывают тяжелыми. Подбор доз под контролем ревматолога сводит возможность побочных эффектов к минимуму
В течение всего периода терапии цитостатиками необходимо, с помощью лабораторных методов исследования, контролировать показатели общего анализа крови,биохимических анализов и мочи у пациента. Если же пациент легко переносит цитостатическую терапию, можно ждать улучшения самочувствия уже через 2-4 недели после начала лечения.
Арава (элафра, лефлайд, лефлюнамид) рекомендуется больным, у которых артрит протекает очень активно, и тем, кто плохо переносит метотрексат. Терапевтический эффект обычно проявляется через 4-6 недель от начала приема аравы и может нарастать в течение 4-6 месяцев.
Ремикейд действует быстрее многих других базисных препаратов.
Однако применять ремикейд надо с очень большой осторожностью. До начала лечения ремикейдом необходимо выявить и пролечить все имеющиеся у пациента инфекции. Если этого не сделать, применение ремикейда может спровоцировать сильнейшее обострение недолеченных инфекционных процессов вплоть до развития сепсиса.
Также, во время лечения ремикейдом рекомендуется применять антиаллергические препараты, чтобы предотвратить возможные аллергические реакции. Стоимость препарата высокая. Лечение проводится только в стационарных условиях
Биологические препараты это одна из новейших групп препаратов для лечения артритов. Они инактивируют специальный белок (фактор некроза опухоли (ФНО)), который играет важную роль в воспалительной процессе. Эти препараты действуют быстро и эффективно уменьшают воспаление. К ним относится ингибитор ФНО этанерцепт (энбрел), анакинра (кинерет), хумира (адалимубаб), актемра (тоцилизумаб), ритуксимаб (ритуксан, мабтера), оренция (абатацепт).
Все эти препараты были разработаны в течение последнего десятилетия, а на мировом фармацевтическом рынке начали появляться не более пяти лет назад. В связи с этим они ещё весьма дороги. Ещё одним их недостатком является то, что они могут вводиться только в инъекционной форме (подкожно или внутривенно), причем в стационарных условиях, так как процедура проводится от получаса до нескольких часов под контролем специалиста. Поэтому данные препараты пока еще не получили широкого применения. Обычно их применяют в комбинации с метотрексатом или с другим базовым препаратом.
Также необходимо знать, что биологические препараты обычно не комбинируют друг с другом из-за высокой вероятности развития побочных эффектов!
Тофацитиниб – первый пероральный ингибитор янус-киназ в лечении ревматоидного артрита. Высокоэффективный и достаточно безопасный препарат. Однако высокая стоимость препарата не дает возможности говорить о его доступности для широкого круга больных.
Другие цитостатические препараты, такие как азатиоприн (имуран), циклофосфан (эндоксан) и циклоспорин (имуспорин, консупрен, сандимун, экворал) применяются только при неэффективности остальных базисных препаратов.
2. Антималярийные препараты
Антималярийные препараты делагил и плаквенил (иммард)
3. Сульфаниламиды.
4. Пеницилламин.
Пеницилламин (купренил ) при артритах обычно назначается в тех случаях, когда терапия цитостатиками не приносит больному облегчения. При системной скеродермии явяется препаратом выбора. Применение купренила при ССД основано в первую очередь на связывании препаратом альдегидных групп коллагена, что приводит к нарушению его биосинтеза и поперечного связывания отдельных молекул
Что относится к цитостатикам какие препараты
Опухоль (новообразование) состоит из клеток, которые пролиферируют независимо от, образно выражаясь, врожденного «строительного плана» организма. При злокачественной опухоли (рак) опухолевая ткань прорастает в здоровые окружающие ткани, разрушая их, или отделившиеся опухолевые клетки образуют вторичные опухоли (метастазы) в других органах. Лечение требует удаления всех злокачественных клеток (радикальная терапия).
Если это невозможно, замедляют рост опухоли, что приводит к увеличению жизни пациента или улучшению качества жизни (паллиативная терапия). Химиотерапия осложнена тем, что злокачественные клетки являются эндогенными и почти не обладают специфическими метаболическими свойствами.
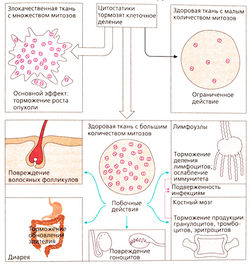
Цитостатики — это цитотоксические вещества, которые поражают в основном пролиферирующие или делящиеся (митотические) клетки. Повреждаются преимущественно быстро делящиеся злокачественные клетки. Нарушение митотических процессов не только замедляет рост опухоли, но и приводит к апоптозу (запрограммированная гибель клетки). Ткани с низкой скоростью митоза практические не поражаются, как и большинство здоровых тканей. Тем не менее это касается и злокачественных опухолей, состоящих из медленно дифференцирующихся клеток.
Цитостатическая терапия, несомненно, оказывает повреждающее действие на ткани с физиологически высокой частотой митозов. Следовательно, развиваются типичные побочные эффекты.
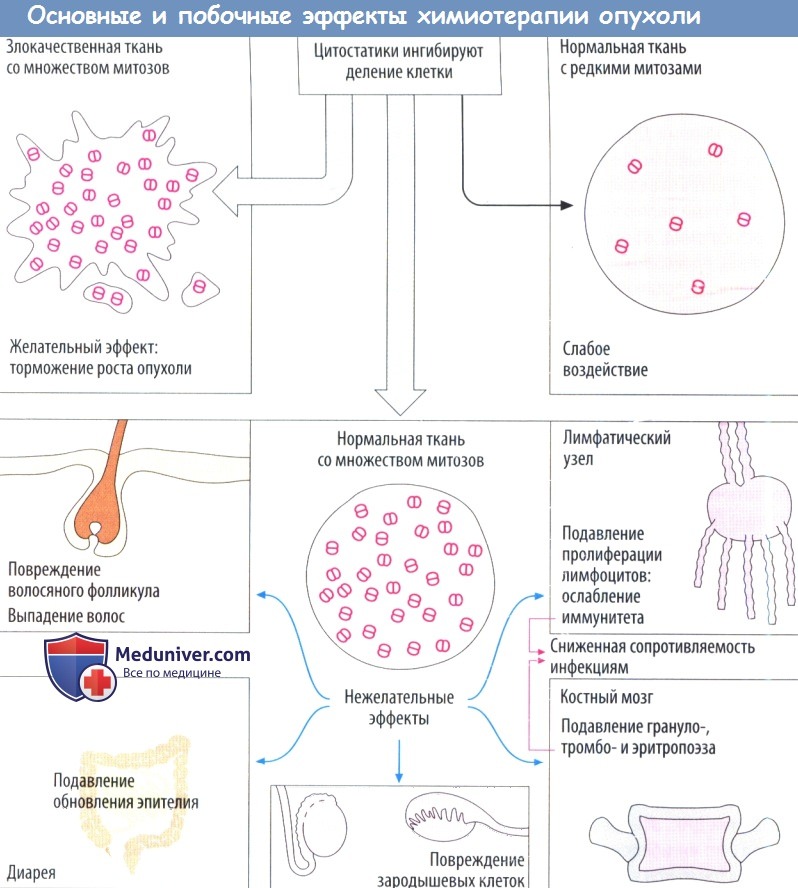
Выпадение волос происходит в результате повреждения волосяных фолликулов; расстройства со стороны ЖКТ, например диарея вследствие недостаточного восполнения энтероцитов, период жизни которыхограничен несколькими днями; тошнотой рвота в результате стимуляции хеморецепторов самого заднего поля ромбовидной ямки рвотного центра; снижение резистентности к инфекции в результате ослабления иммунной системы. Кроме того, цитостатики вызывают миелосупрессию. Восполнение клеток крови зависит от митотической активности стволовых и дочерних клеток костного мозга.
При остановке пролиферации миелоидного ростка в первую очередь поражаются гранулоциты с коротким периодом жизни (нейтропения), затем — тромбоциты крови (тромбопения) и, наконец, эритроциты с большим периодом жизни (анемия). Бесплодие вызвано подавлением сперматогенеза или созревания фолликула. Большинстве цитостатиков нарушает метаболизм ДНК. Это повышает риск повреждения генома здоровых клеток (мутагенный эффект). Возможно, с ним связано развитие лейкоза через несколько лет после цитостатической терапии (корциногенный эффект). Более того, весьма вероятно появление врожденных пороков развития при необходимости использовать цитостатики во время беременности (тератогенный эффект).
Цитостатики имеют разные механизмы действия:
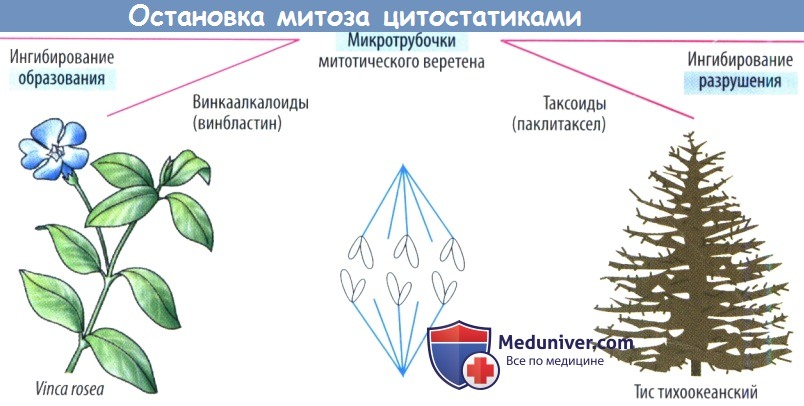
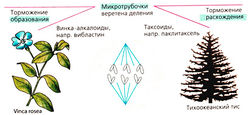
а) Повреждение митотического веретена. Сократительные белки веретенного аппарата разводят реплицированные хромосомы перед делением клетки. Данный процесс нарушают так называемые яды митотического веретена (см. также колхицин), которые останавливают митоз в метафазе за счет нарушения превращения микротрубочек в веретенные нити. Они состоят из белков α- и β-тубулина. Излишние трубочки отрезаются, давая возможность субъединицам тубулина рециркулировать.
Винка алкалоиды винкристин и винбластин (получаемые из барвинка розового, Vinca rosea) ингибируют полимеризацию субъединиц тубулина в микротрубочки. Повреждение нервной системы является ожидаемой нежелательной реакцией в результате нарушения управляемыми микротрубочками аксональных транспортных механизмов.
Паклитаксел, получаемый из коры тиса тихоокеанского (Taxus brevifolia), ингибирует расхождение микротрубочек и индуцирует образование атипичных микротрубочек, что препятствует повторному сбору тубулина в правильно функционирующие микротрубочки. Полусинтетическим производным является доцетаксел.
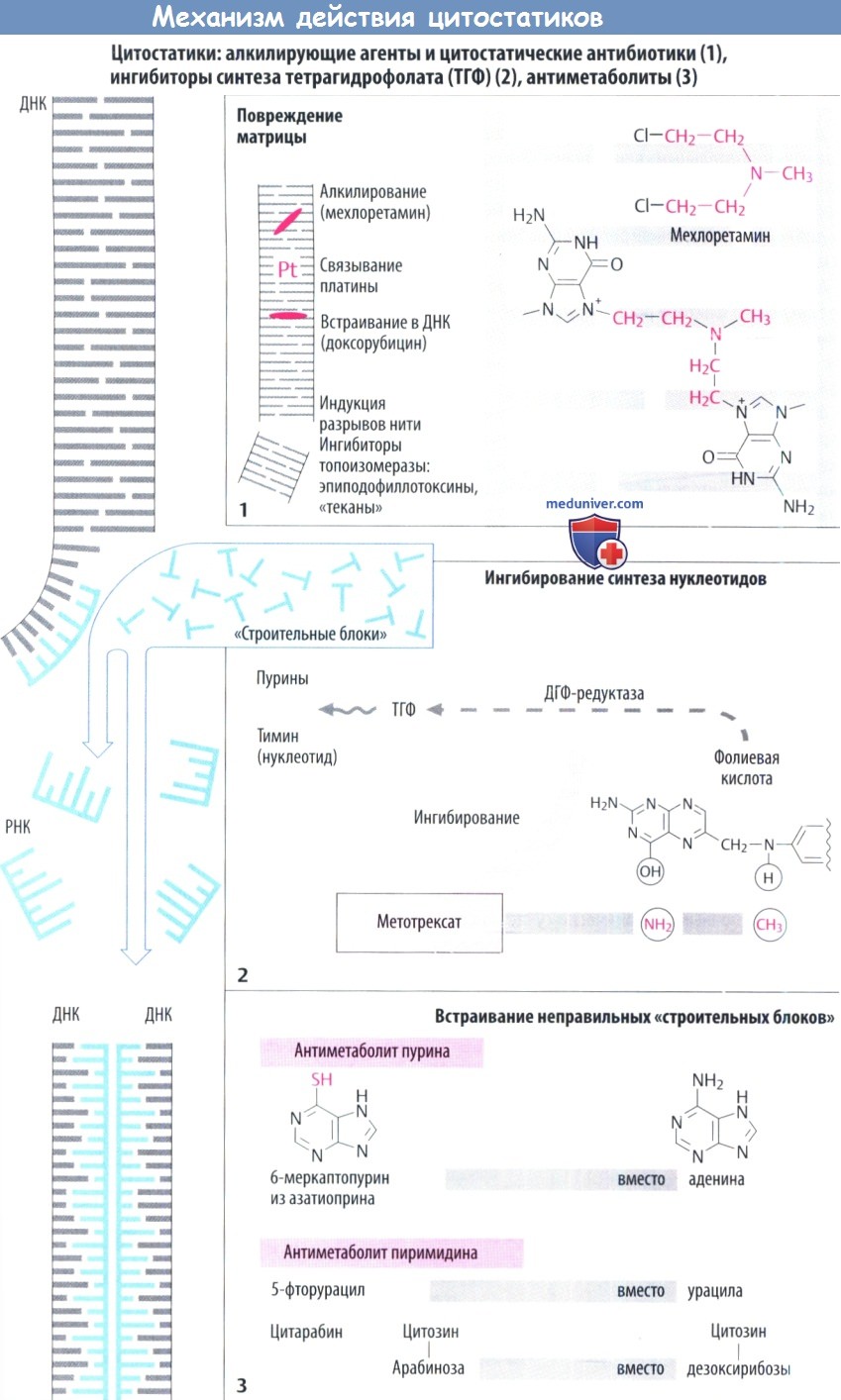
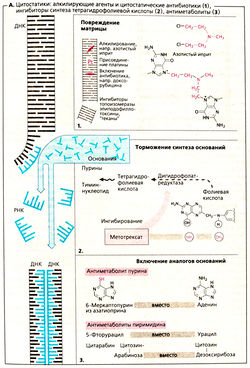
б) Ингибирование синтеза ДНК и РНК. Митозу предшествует репликация хромосом (синтез ДНК) и повышенный синтез белка (синтез РНК). Имеющаяся ДНК (серый цвет) служит в качестве матрицы для синтеза новой ДНК (голубой цвет) или РНК. Синтез новых нуклеиновых кислот ингибируется следующими механизмами.
в) Повреждение матрицы. Алкилирующие цитостатики являются реактивными веществами, которые переводят алкильные остатки на ДНК через ковалентную связь. Например, мехлоретамин (азотистый иприт) способен образовывать перекрестную связь между двумя цепями ДНК, отдавая атомы хлора. Правильное считывание генетической информации поэтому становится невозможным. Другими алкилирующими агентами являются хлорамбуцил, мелфалан, циклофосфамид, ифосфамид. ломустин, тиотепа, митомицин, прокарбазин, дакарбазин и темозоломид.
К специфическим нежелательным реакциям относятся необратимый фиброз легких у бусульфана и геморрагический цистит, вызванный метаболитом циклофосфамида акролеином (предупреждается месной, натрия 2-меркаптоэтансульфонатом). Платиносодержащие противоопухолевые средства (цисплатин, карбоплатин и оксалиплатин) высвобождают платину, которая связывается с ДНК.
г) Цитостатические антибиотики встраиваются в двунитевую ДНК, что приводит к разрыву нити (как у блеомицина). Антрациклиновые антибиотики даунорубицин и адриамицин (доксорубицин) вызывают кардиомиопатию. Кроме того, блеомицин вызывает фиброз легких. Эпирубицин и идарубицин разработаны с целью снижать кардиотоксичность. Трабектин, который тоже встраивается в двунитевую ДНК, не является антибиотиком; его получают из асцидии.
д) Разрыв нити вызывает ингибирование топоизомеразы. Эпиподофиллотоксины этопозид и тенопозид взаимодействуют с топоизомеразой II,в функции которой входят расщепление, перенос и вторичное закрытие нитей ДНК. Эти препараты вызывают разрыв нити за счет ингибирования повторного закрытия. «Теканы» топотекан и иринотекан являются производными камптотецина, получаемыми из фруктов китайского дерева (Camptotheca acuminata). Они ингибируют топоизомеразу I, которая вызывает разрыв однонитевой ДНК.
е) Ингибирование синтеза нуклеотидного основания. Тетрагидрофолиевая кислота (ТГФ) необходима для синтеза как пуриновых оснований, так и тимидина. ОбразованиеТГФ из фолиевой кислоты происходит при участии ДГФ-редуктазы. Аналог фолата метотрексат ингибирует активность фермента. Клеточные запасы ТГФ истощаются. Эффект этих антиметаболитов можно устранить путем введения фолиевой кислоты (5-формил-ТГФ, лейковорин, фолинат кальция).
Гидроксимочевина (гидроксикарбамид) ингибирует рибонуклеотидредуктазу, которая обычно превращает рибонуклеотиды в дезоксирибонуклеотиды, которые затем используются как «строительные блоки» ДНК.
ж) Встраивание ложных «строительных блоков». Неестественные нуклеотидные основания (6-меркаптопурин, 5-фторурацил) и патологические нуклеозиды с измененными сахарами (цитарабин, гемцитабин) измененным основанием (кладрибин) или с обоими измененными компонентами (флударабин, капецитабин) действуют как антиметаболиты. Они ингибируют синтез ДНК/РНК или вызывают синтез ложных нуклеиновых кислот.
6-меркаптопурины образуются в результате биотрансформации неактивного предшественника азатиоприна. Урикостатик аллопуринол ингибирует распад 6-меркаптопурина, поэтому при одновременном введении двух препаратов требуется снижение дозы последнего.
з) Комбинированная терапия. Цитостатики часто применяются по сложным терапевтическим схемам разработанным для улучшения эффективности и переносимости лечения.
и) Поддерживающая терапия. Химиотерапия рака поддерживается адъювантными препаратами. Следующие препараты используются против рвоты, вызванной цитостатиками:
1) дексаметазон в качестве основного препарата;
2) антагонист 5-НТ3 ондонсегрон (при ранней рвоте);
3) антагонист NK1-рецепторов апрепитант, который эффективен против поздней рвоты с началом более чем через 24 ч. При угнетении костного мозга используют гранулоцитарный и гранулоцитарно-макрофагальный колониестимулирующие факторы (филграстим и ленограстим). Поврежденную слизистую оболочку восстанавливают палифермином, рекомбинантным человеческим фактором роста кератиноцитов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Цитостатики
Содержание
Цитостатики [ править | править код ]
Противоопухолевые средства [ править | править код ]
Опухоль (новообразование) состоит из клеток с неуправляемым делением. Злокачественная опухоль (рак) разрушает соседние ткани, и ее клетки распространяются по организму, образуя метастазы. Лечение направлено на уничтожение всех злокачественных клеток в организме. Если это невозможно, то пытаются затормозить рост опухоли и тем самым продлить жизнь больного (паллиативное лечение). Трудности терапии связаны с тем, что опухолевые клетки не имеют специфического обмена и являются частью организма.
Цитостатики повреждают клетки (цитотоксическое действие), находящиеся в стадии митоза. Быстро размножающиеся клетки опухоли подвергаются действию препаратов в первую очередь. Нарушение течения стадий деления препятствует пролиферации, а также приводит к апоптозу (самоуничтожению клетки). Ткани, имеющие меньшую скорость клеточного деления, т. е. большинство здоровых тканей, не подвергаются действию препаратов. Однако это же относится и к низкодифференцированным опухолям с редко делящимися клетками. В то же время клетки некоторых здоровых тканей имеют физиологически обусловленную высокую частоту деления и повреждаются под действием цитостатической терапии, вследствие которой наблюдаются следующие типичные побочные эффекты.
Выпадение волос происходит из-за повреждения волосяных фолликулов. Нарушения функции желудочно-кишечного тракта, например диарея, развиваются вследствие нарушения восстановления эпителиальных клеток кишечника, продолжительность жизни которых составляет около двух суток. Тошнота и рвота возникают из-за возбуждения хеморецепторов рвотного центра. Повышенная частота возникновения инфекционных заболеваний обусловлена ослаблением иммунной системы. Кроме того, цитостатики угнетают костный мозг. В первую очередь это сказывается на короткоживущих гранулоцитах (нейтропения), затем на тромбоцитах (тромбоцитоления) и в конечном итоге на эритроцитах (анемия). Бесплодие обусловлено торможением сперматогенеза или созревания яйцеклетки. Большинство цитостатиков влияют на метаболизм ДНК, поэтому имеется опасность повреждения генетического материала здоровых клеток (мутагенное действие). Возможно, по этой же причине через несколько лет после терапии развивается лейкемия (канцерогенное действие). Если цитостатики назначаются во время беременности, то нарушается развитие плода (тератогенное действие).
Механизмы действия цитостатиков [ править | править код ]
Паклитаксел получают из коры тихоокеанского тиса. Препарат ингибирует разборку микротрубочек и индуцирует образование атипичных микротрубочек, блокируя тем самым преобразование тубулина в микротрубочки с нормальными функциями. Доцетаксел — полусинтетическое производное паклитаксела.
Ингибирование синтеза РНК и ДНК. Митозу предшествует удвоение хромосом (синтез ДНК) и усиление синтеза белков (синтез РНК). ДНК клетки (серый цвет на рисунке) представляет собой матрицу для нового синтеза (синий цвет) ДНК и РНК. Блокада синтеза может осуществляться перечисленными ниже способами.
Повреждения ДНК-матрицы (1). Алкилирующие цитостатики — это реакционноспособные соединения, предоставляющие свой алкильный остаток, который связывается с ДНК ковалентной связью. Например, атомы хлора из молекулы азотистого иприта могут обмениваться на азотистые основания, в результате чего образуются сшивки между нитями ДНК. Нарушается считывание информации. К алкилирующим цитостатикам относятся хлорамбуцил, мефалан, циклофосфамид, ифосфамид, ломустин, бисульфан. Особые побочные эффекты: повреждение легких бисульфаном, повреждение слизистой мочевого пузыря метаболитом циклофос-фамида акролеином (защищают с помощью 2-меркаптоэтансульфоната натрия). Соединения платины цисплатин и карбопла-тин высвобождают платину, которая связывается с ДНК.
Цитостатические антибиотики ковалентно связываются с ДНК, что приводит к обрыву цепи (блеомицин). Антрациклино-вые антибиотики даунорубицин и адриами-цин (доксорубицин) могут оказать побочное действие — повреждение сердечной мышцы. Блеомицин, по-видимому, может привести к развитию фиброза легких.
Ингибиторы топоизомеразы индуцируют обрыв цепи ДНК. Эпиподофиллотоксины этопозид и тенипозид взаимодействуют с топоизомеразой II, которая в норме поддерживает суперспирализацию ДНК путем разрывов и сшивок двунитевой ДНК. Топотекан и иринотекан являются производными камптотецина, получаемого из плодов китайского дерева. Они блокируют топоизомеразу I, которая расщепляет одно-нитевую ДНК.
Ингибирование синтеза оснований (2). Для синтеза пуриновых оснований и тимидина необходима тетрагидрофолиевая кислота (ТГФК). Она образуется из фолиевой кислоты при помощи фермента дищцрофо-латредуктазы. Аналог фолиевой кислоты метотрексат блокирует фермент и таким образом создает дефицит ТГФК в клетках. Восстановить этот дефицит можно путем введения фолиновой кислоты (5-формил-ТГФК; лейковорил или цитроворум-фактор). Гидроксимочевина (гидроксикарбамщ) ингибирует рибонуклеотидредуктазу — фермент, в норме преобразующий рибонуклеотиды в дезоксирибонуклеотиды, из которых построены молекулы ДНК.
Включение аналогов оснований (3). Аналоги оснований (6-меркаптопурин, 5-фторурацил) или нуклеозиды с аномальными сахарами (цитарабин) действуют как антиметаболиты. Они блокируют синтез ДНК/РНК или способствуют синтезу аномальных нуклеиновых кислот.
6-Меркаптопурин образуется в организме из предшественника азатиоприна (см. формулу на рис. 3). Аллопуринол блокирует распад 6-меркаптопурина, и поэтому при их комбинированном назначении нужна меньшая доза азатиоприна.
Для повышения эффективности терапии и улучшения лекарственной переносимости цитостатики часто применяют в комплексной терапии.
Поддерживающая терапия. Химиотерапия может сопровождаться приемом других лекарств. Хороший эффект для профилактики индуцированных цитостатиками и сильными мутагенными препаратами (например, цисплатином) нарушений могут давать антагонисты 5-НТ3-рецептора серотонина, например ондансетрон. Угнетение костного мозга можно предотвратить с помощью колониестимулирующих факторов гранулоцитов или гранулоцитов и макрофагов (рекомбинантные факторы филграстим, ленограстим, мол-грамостим).
Принципы целевой противоопухолевой терапии [ править | править код ]
При злокачественном перерождении стволовых клеток образуется неопластический клон, который подменяет нормальные клетки в процессах обмена. Для борьбы с этим явлением возможно целевое медикаментозное лечение.
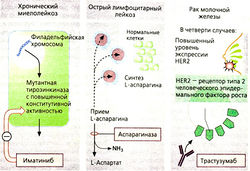
Иматиниб. Хронический миелоидный лейкоз (ХМЛ) обусловлен генетическим дефектом гематопоэтических ретикулоцитов костного мозга. Почти у всех пациентов с ХМЛ обнаруживается филадельфийская хромосома (Ph), представляющая собой хромосому 22, в которой один из фрагментов заменен на фрагмент хромосомы 9, содержащий онкоген. Вследствие этого хромосома 22 содержит рекомбинантный ген (bcr-abl). Этот ген кодирует мутант с нерегулируемой (конститутивной) повышенной тирозинкиназной активностью, что ускоряет клеточное деление. Иматиниб — ингибитор тирозинкиназ, особенно данной киназы, но может тормозить ферментативную активность и других. Больные с ХМЛ, у которых обнаружена филадельфийская хромосома, могут применять препарат перорально.
Аспарагиназа расщепляет аспарагиновую кислоту на аспартат и аммиак. Определенные клетки, например лейкозные клетки при остром лимфолейкозе, нуждаются в аспарагине для белкового синтеза. Они должны брать аспарагин из межклеточного пространства, многие же клетки других видов производят его сами. При приеме фермента, расщепляющего аспарагин, снабжение клеток аминокислотами ухудшается, ингибируется синтез белков и пролиферация неопластических клеток. Аспарагиназа производится из клеток бактерий Е coli или имеет растительное происхождение (из Erwinia chrysanthem’r, этот фермент поэтому также называют хризантаспазой). При пероральном приеме этого фермента могут возникать аллергические реакции.
Трастузумаб — терапевтический препарат на основе моноклональных антител, применяемый при злокачественных неоплазиях. Эти антитела действуют на поверхностный белок, который особенно активно способствует злокачественным перерождениям клеток. Трастузумаб связывается на HER2 — рецепторе эпидермального фактора роста. При раке молочной железы концентрация этих рецепторов намного выше. Вследствие связывания антител клетки иммунной системы становятся отличными от клеток, которые должны быть удалены. Антитела кардиотоксичны; есть сообщения, что блокирование HER2 может привести к нарушению активности сердечной мышцы.
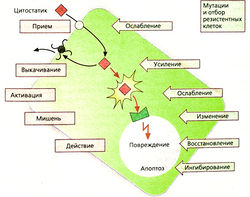
Механизмы устойчивости к цитостатикам [ править | править код ]
После успешного лечения вначале эффект от приема препарата может снизиться, так как в опухоли появляются резистентные клетки. Существует несколько механизмов развития резистентности:
Ослабление захвата препарата клеткой, например вследствие снижения синтеза транспортных белков, необходимых для проникновения метотрексата через клеточную мембрану.
Усиление защитного транспорта из клетки: увеличение продукции Р-гликопротеина, который осуществляет транспорт антрациклинов, винка-алкалоидов, эпиподофиллотоксинов и паклитаксела из клетки (множественная лекарственная устойчивость, ген mdr-1).
Ослабление биоактивации пролекарства, например цитарабина, которому для проявления цитотоксического эффекта необходимо внутриклеточное фосфорилирование.
Изменение места действия, например из-за повышения продукции дигидрофолат-редуктазы для компенсации действия метотрексата.
Восстановление повреждений, например повышение эффективности механизмов восстановления ДНК при ее повреждении цисплатином.