Что относится к цитостатическим препаратам
ВЫ можете нам позвонить:
8 (8452) 98-84-68
и
+7-967-500-8468
или
Базисная терапия системных заболеваний соединительной ткани
Главным средством в лечении аутоимунных заболеваний являются, так называемые базисные препараты. Их название произошло от того, что они воздействуют на основание болезни, ее «базис». Эти препараты вызывают ремиссию и предотвращают или замедляют разрушение суставов, но не являются противовоспалительными препаратами. В настоящее время в качестве базисной терапии используют чаще всего: цитостатики, антималярийные препараты, сульфаниламиды, пеницилламин.
1. Цитостатики.
Цитостатические препараты: метотрексат, арава, азатиоприн (имуран), циклофосфан (эндоксан), циклоспорин (сандимун, экворал), проспидин и др.
Не стоит пугаться от названия «цитостатики», зная спектр их побочных эффектов: дозы этих препаратов при лечении артритов примерно в 5-20 раз меньше используемых при лечении опухолей! Использование цитостатиков помогает, как минимум, 70-80% больных, побочные явления возможны у 15-20% пациентов и редко бывают тяжелыми. Подбор доз под контролем ревматолога сводит возможность побочных эффектов к минимуму
В течение всего периода терапии цитостатиками необходимо, с помощью лабораторных методов исследования, контролировать показатели общего анализа крови,биохимических анализов и мочи у пациента. Если же пациент легко переносит цитостатическую терапию, можно ждать улучшения самочувствия уже через 2-4 недели после начала лечения.
Арава (элафра, лефлайд, лефлюнамид) рекомендуется больным, у которых артрит протекает очень активно, и тем, кто плохо переносит метотрексат. Терапевтический эффект обычно проявляется через 4-6 недель от начала приема аравы и может нарастать в течение 4-6 месяцев.
Ремикейд действует быстрее многих других базисных препаратов.
Однако применять ремикейд надо с очень большой осторожностью. До начала лечения ремикейдом необходимо выявить и пролечить все имеющиеся у пациента инфекции. Если этого не сделать, применение ремикейда может спровоцировать сильнейшее обострение недолеченных инфекционных процессов вплоть до развития сепсиса.
Также, во время лечения ремикейдом рекомендуется применять антиаллергические препараты, чтобы предотвратить возможные аллергические реакции. Стоимость препарата высокая. Лечение проводится только в стационарных условиях
Биологические препараты это одна из новейших групп препаратов для лечения артритов. Они инактивируют специальный белок (фактор некроза опухоли (ФНО)), который играет важную роль в воспалительной процессе. Эти препараты действуют быстро и эффективно уменьшают воспаление. К ним относится ингибитор ФНО этанерцепт (энбрел), анакинра (кинерет), хумира (адалимубаб), актемра (тоцилизумаб), ритуксимаб (ритуксан, мабтера), оренция (абатацепт).
Все эти препараты были разработаны в течение последнего десятилетия, а на мировом фармацевтическом рынке начали появляться не более пяти лет назад. В связи с этим они ещё весьма дороги. Ещё одним их недостатком является то, что они могут вводиться только в инъекционной форме (подкожно или внутривенно), причем в стационарных условиях, так как процедура проводится от получаса до нескольких часов под контролем специалиста. Поэтому данные препараты пока еще не получили широкого применения. Обычно их применяют в комбинации с метотрексатом или с другим базовым препаратом.
Также необходимо знать, что биологические препараты обычно не комбинируют друг с другом из-за высокой вероятности развития побочных эффектов!
Тофацитиниб – первый пероральный ингибитор янус-киназ в лечении ревматоидного артрита. Высокоэффективный и достаточно безопасный препарат. Однако высокая стоимость препарата не дает возможности говорить о его доступности для широкого круга больных.
Другие цитостатические препараты, такие как азатиоприн (имуран), циклофосфан (эндоксан) и циклоспорин (имуспорин, консупрен, сандимун, экворал) применяются только при неэффективности остальных базисных препаратов.
2. Антималярийные препараты
Антималярийные препараты делагил и плаквенил (иммард)
3. Сульфаниламиды.
4. Пеницилламин.
Пеницилламин (купренил ) при артритах обычно назначается в тех случаях, когда терапия цитостатиками не приносит больному облегчения. При системной скеродермии явяется препаратом выбора. Применение купренила при ССД основано в первую очередь на связывании препаратом альдегидных групп коллагена, что приводит к нарушению его биосинтеза и поперечного связывания отдельных молекул
Цитостатическая противоопухолевая терапия
Призвана воздействовать на те клетки в организме, которые делятся наиболее быстро. Прежде всего это относится к опухолевым клеткам. Химиопрепараты могут назначаться по одному (монотерапия) или в комбинации (полихимиотерапия).
Наиболее часто противоопухолевые цитостатики назначаются внутривенно или внутрь, однако в ряде случаев может потребоваться введение лекарств в спинномозговой канал, либо в плевральную или брюшную полости. Иногда эффективность внутривенного введения повышает длительность введения химиопрепарата (до 48 и даже 96 часов).
Как проводится химиотерапия
Практически всегда химиотерапия проводится курсами (циклами), предполагая перерыв для восстановления нормальных тканей и функций организма (помимо опухолевых клеток, в процессе лечения могут повреждаться другие активно делящиеся клетки – в первую очередь клетки крови, волосяных фолликулов, клетки слизистых оболочек.
В последние годы успехи молекулярной биологии позволили для лечения ряда злокачественных новообразований создать препараты так называемой таргетной, или направленной терапии, с конкретной мишенью приложения, отличающей опухолевую клетку от нормальной.
Препараты таргетной терапии
В большинстве случаев препараты таргетной терапии сочетаются с обычными цитостатиками, повышая эффективность лечения, но иногда используются самостоятельно. Наиболее часто мишенью служат рецепторы на поверхности клеток опухоли или питающих ее сосудов (так действуют моноклональные антитела и ингибиторы тирозин-киназ), но мишенью могут быть и последующие этамы передачи пролиферативного сигнала).
Значительное число опухолевых заболеваний лечится не только химиопрепаратами, но и гормонами. Как правило, гормональные препараты принимаются внутрь и лечение осуществляется длительно. Иногда гормональное лечение требует хирургических вмешательств с целью исключить влияние тех или иных гормонов, вырабатывающихся в организме (удаление яичников или яичек).
Реже для лечения злокачественных новообразований используется иммунотерапия (как правило, цитокины интерферон альфа или интерлейкин-2). Обычно эти препараты используются в случаях, когда ограничены возможности химио- и гормонотерапии.
Бисфосфонаты
В арсенале онкологов существует также группа препаратов, избирательно действующих на костную ткань – бисфосфонаты. Предохраняя кость от разрушения опухолью, эти лекарства уменьшают боль и снижают частоту осложнений (прежде всего патологических переломов).
Кроме того, в арсенале онкологов существует целый ряд препаратов поддерживающей терапии для предотвращения либо лечения осложнений, связанных с химиотерапией. Как правило, такое лечение не носит «универсального» характера и присоединяется к противоопухолевой терапии по мере развития осложнений.
Исключение представляет, главным образом, противорвотная (антиэметическая) терапия, назначаемая перед химиотерапией, исходя из данных о возможности тошноты и рвоты при каждой конкретной схеме лечения.
По мере исчерпания возможностей противоопухолевого лечения (а на поздних стадиях болезни это обычно химиотерапия) возрастает значение паллиативной помощи и симптоматического лекарственного лечения как ее компонента.
В настоящее время медицина располагает большим количеством препаратов, позволяющих эффективно бороться с наиболее мучительными симптомами опухолевой болезни, включая болевой.
Что относится к цитостатическим препаратам
Опухоль (новообразование) состоит из клеток, которые пролиферируют независимо от, образно выражаясь, врожденного «строительного плана» организма. При злокачественной опухоли (рак) опухолевая ткань прорастает в здоровые окружающие ткани, разрушая их, или отделившиеся опухолевые клетки образуют вторичные опухоли (метастазы) в других органах. Лечение требует удаления всех злокачественных клеток (радикальная терапия).
Если это невозможно, замедляют рост опухоли, что приводит к увеличению жизни пациента или улучшению качества жизни (паллиативная терапия). Химиотерапия осложнена тем, что злокачественные клетки являются эндогенными и почти не обладают специфическими метаболическими свойствами.
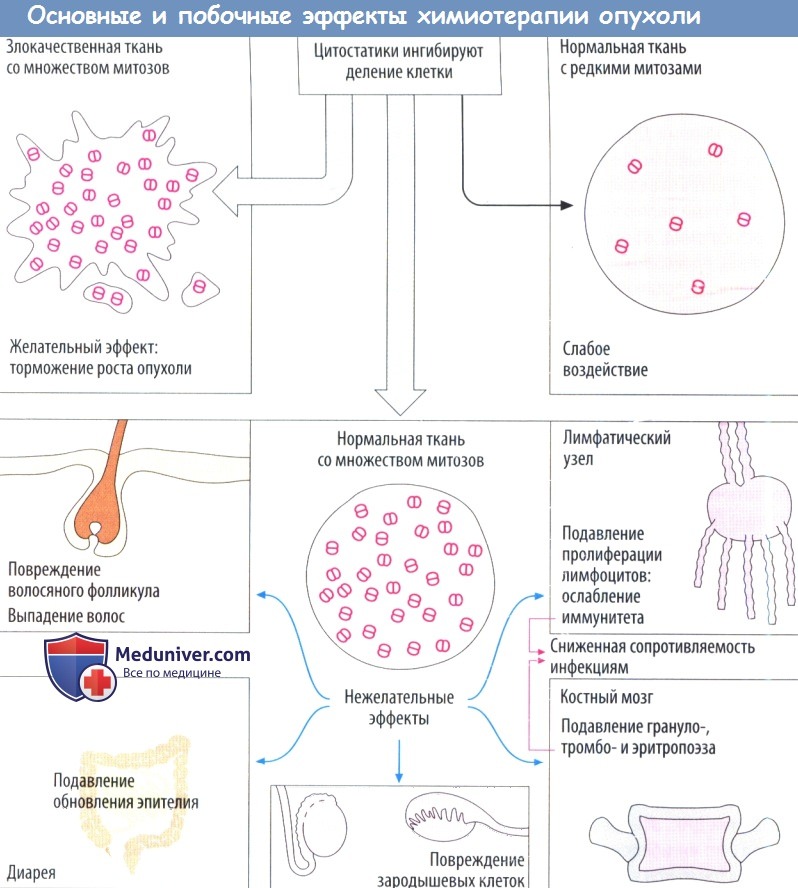
Цитостатики — это цитотоксические вещества, которые поражают в основном пролиферирующие или делящиеся (митотические) клетки. Повреждаются преимущественно быстро делящиеся злокачественные клетки. Нарушение митотических процессов не только замедляет рост опухоли, но и приводит к апоптозу (запрограммированная гибель клетки). Ткани с низкой скоростью митоза практические не поражаются, как и большинство здоровых тканей. Тем не менее это касается и злокачественных опухолей, состоящих из медленно дифференцирующихся клеток.
Цитостатическая терапия, несомненно, оказывает повреждающее действие на ткани с физиологически высокой частотой митозов. Следовательно, развиваются типичные побочные эффекты.
Выпадение волос происходит в результате повреждения волосяных фолликулов; расстройства со стороны ЖКТ, например диарея вследствие недостаточного восполнения энтероцитов, период жизни которыхограничен несколькими днями; тошнотой рвота в результате стимуляции хеморецепторов самого заднего поля ромбовидной ямки рвотного центра; снижение резистентности к инфекции в результате ослабления иммунной системы. Кроме того, цитостатики вызывают миелосупрессию. Восполнение клеток крови зависит от митотической активности стволовых и дочерних клеток костного мозга.
При остановке пролиферации миелоидного ростка в первую очередь поражаются гранулоциты с коротким периодом жизни (нейтропения), затем — тромбоциты крови (тромбопения) и, наконец, эритроциты с большим периодом жизни (анемия). Бесплодие вызвано подавлением сперматогенеза или созревания фолликула. Большинстве цитостатиков нарушает метаболизм ДНК. Это повышает риск повреждения генома здоровых клеток (мутагенный эффект). Возможно, с ним связано развитие лейкоза через несколько лет после цитостатической терапии (корциногенный эффект). Более того, весьма вероятно появление врожденных пороков развития при необходимости использовать цитостатики во время беременности (тератогенный эффект).
Цитостатики имеют разные механизмы действия:
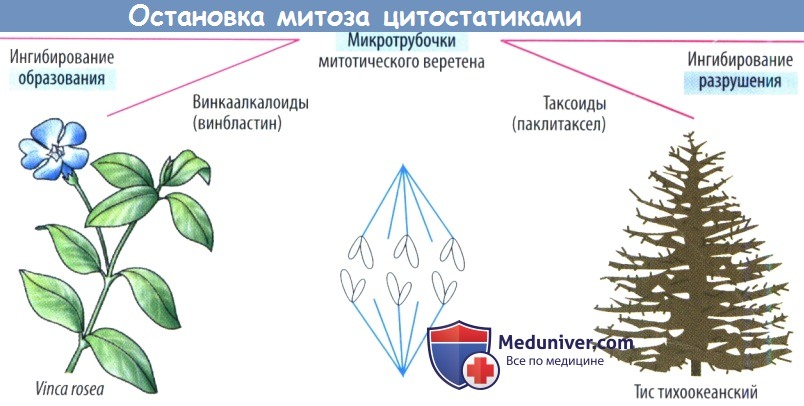
а) Повреждение митотического веретена. Сократительные белки веретенного аппарата разводят реплицированные хромосомы перед делением клетки. Данный процесс нарушают так называемые яды митотического веретена (см. также колхицин), которые останавливают митоз в метафазе за счет нарушения превращения микротрубочек в веретенные нити. Они состоят из белков α- и β-тубулина. Излишние трубочки отрезаются, давая возможность субъединицам тубулина рециркулировать.
Винка алкалоиды винкристин и винбластин (получаемые из барвинка розового, Vinca rosea) ингибируют полимеризацию субъединиц тубулина в микротрубочки. Повреждение нервной системы является ожидаемой нежелательной реакцией в результате нарушения управляемыми микротрубочками аксональных транспортных механизмов.
Паклитаксел, получаемый из коры тиса тихоокеанского (Taxus brevifolia), ингибирует расхождение микротрубочек и индуцирует образование атипичных микротрубочек, что препятствует повторному сбору тубулина в правильно функционирующие микротрубочки. Полусинтетическим производным является доцетаксел.
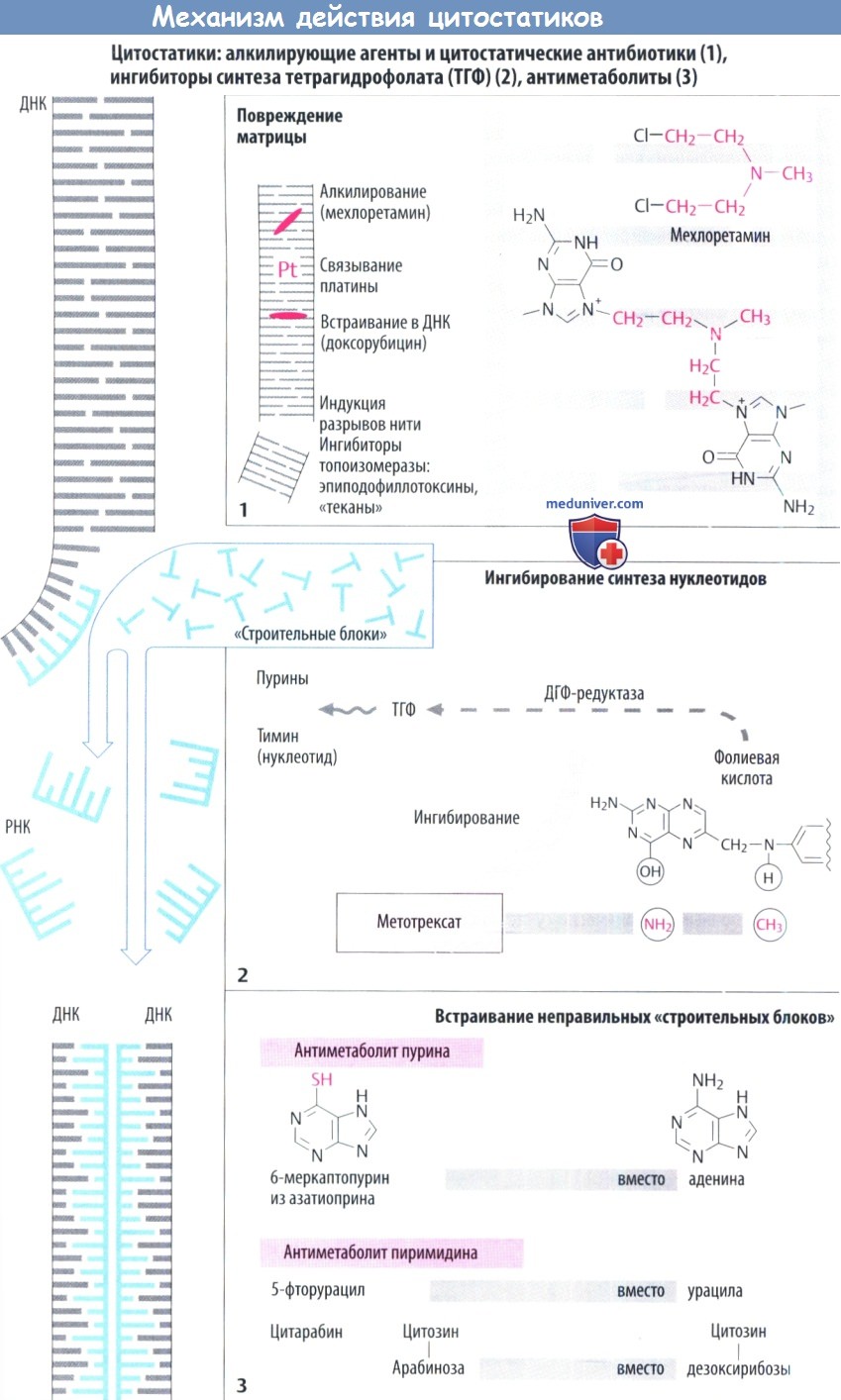
б) Ингибирование синтеза ДНК и РНК. Митозу предшествует репликация хромосом (синтез ДНК) и повышенный синтез белка (синтез РНК). Имеющаяся ДНК (серый цвет) служит в качестве матрицы для синтеза новой ДНК (голубой цвет) или РНК. Синтез новых нуклеиновых кислот ингибируется следующими механизмами.
в) Повреждение матрицы. Алкилирующие цитостатики являются реактивными веществами, которые переводят алкильные остатки на ДНК через ковалентную связь. Например, мехлоретамин (азотистый иприт) способен образовывать перекрестную связь между двумя цепями ДНК, отдавая атомы хлора. Правильное считывание генетической информации поэтому становится невозможным. Другими алкилирующими агентами являются хлорамбуцил, мелфалан, циклофосфамид, ифосфамид. ломустин, тиотепа, митомицин, прокарбазин, дакарбазин и темозоломид.
К специфическим нежелательным реакциям относятся необратимый фиброз легких у бусульфана и геморрагический цистит, вызванный метаболитом циклофосфамида акролеином (предупреждается месной, натрия 2-меркаптоэтансульфонатом). Платиносодержащие противоопухолевые средства (цисплатин, карбоплатин и оксалиплатин) высвобождают платину, которая связывается с ДНК.
г) Цитостатические антибиотики встраиваются в двунитевую ДНК, что приводит к разрыву нити (как у блеомицина). Антрациклиновые антибиотики даунорубицин и адриамицин (доксорубицин) вызывают кардиомиопатию. Кроме того, блеомицин вызывает фиброз легких. Эпирубицин и идарубицин разработаны с целью снижать кардиотоксичность. Трабектин, который тоже встраивается в двунитевую ДНК, не является антибиотиком; его получают из асцидии.
д) Разрыв нити вызывает ингибирование топоизомеразы. Эпиподофиллотоксины этопозид и тенопозид взаимодействуют с топоизомеразой II,в функции которой входят расщепление, перенос и вторичное закрытие нитей ДНК. Эти препараты вызывают разрыв нити за счет ингибирования повторного закрытия. «Теканы» топотекан и иринотекан являются производными камптотецина, получаемыми из фруктов китайского дерева (Camptotheca acuminata). Они ингибируют топоизомеразу I, которая вызывает разрыв однонитевой ДНК.
е) Ингибирование синтеза нуклеотидного основания. Тетрагидрофолиевая кислота (ТГФ) необходима для синтеза как пуриновых оснований, так и тимидина. ОбразованиеТГФ из фолиевой кислоты происходит при участии ДГФ-редуктазы. Аналог фолата метотрексат ингибирует активность фермента. Клеточные запасы ТГФ истощаются. Эффект этих антиметаболитов можно устранить путем введения фолиевой кислоты (5-формил-ТГФ, лейковорин, фолинат кальция).
Гидроксимочевина (гидроксикарбамид) ингибирует рибонуклеотидредуктазу, которая обычно превращает рибонуклеотиды в дезоксирибонуклеотиды, которые затем используются как «строительные блоки» ДНК.
ж) Встраивание ложных «строительных блоков». Неестественные нуклеотидные основания (6-меркаптопурин, 5-фторурацил) и патологические нуклеозиды с измененными сахарами (цитарабин, гемцитабин) измененным основанием (кладрибин) или с обоими измененными компонентами (флударабин, капецитабин) действуют как антиметаболиты. Они ингибируют синтез ДНК/РНК или вызывают синтез ложных нуклеиновых кислот.
6-меркаптопурины образуются в результате биотрансформации неактивного предшественника азатиоприна. Урикостатик аллопуринол ингибирует распад 6-меркаптопурина, поэтому при одновременном введении двух препаратов требуется снижение дозы последнего.
з) Комбинированная терапия. Цитостатики часто применяются по сложным терапевтическим схемам разработанным для улучшения эффективности и переносимости лечения.
и) Поддерживающая терапия. Химиотерапия рака поддерживается адъювантными препаратами. Следующие препараты используются против рвоты, вызванной цитостатиками:
1) дексаметазон в качестве основного препарата;
2) антагонист 5-НТ3 ондонсегрон (при ранней рвоте);
3) антагонист NK1-рецепторов апрепитант, который эффективен против поздней рвоты с началом более чем через 24 ч. При угнетении костного мозга используют гранулоцитарный и гранулоцитарно-макрофагальный колониестимулирующие факторы (филграстим и ленограстим). Поврежденную слизистую оболочку восстанавливают палифермином, рекомбинантным человеческим фактором роста кератиноцитов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Как в фильмах не будет: что должен знать каждый пациент о лекарственной терапии
Химиотерапия — страшно и невыносимо. Об этом говорит нам медиапространство, и неудивительно, что из-за такой гиперболизации многие пациенты боятся ее едва ли не больше, чем самого заболевания. Однако ни один фильм и ни один роман не рассказывает, что это такое, как работает и насколько оправдан страх лекарственного лечения. Вместе с химиотерапевтом клиники «Луч» и научным сотрудником СПбКнПЦСВМП(о) Марией Степановой мы составили инструкцию для пациентов и разобрались, что такое лекарственная терапия и от чего зависит схема лечения.
Что такое лекарственное лечение
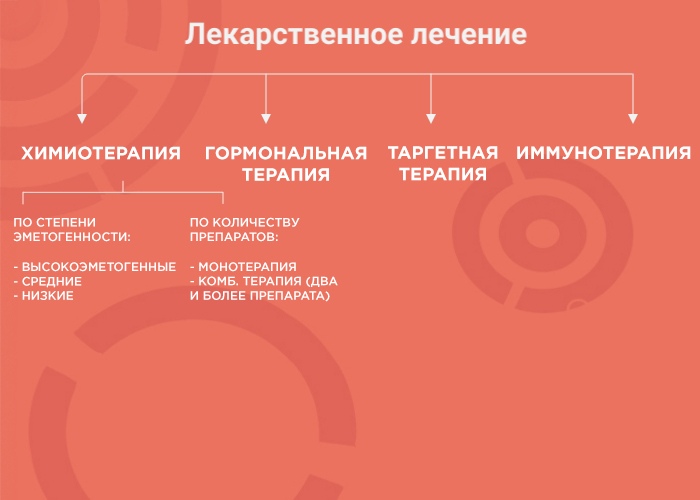
Лекарственная терапия — один из вариантов лечения онкологических заболеваний. Ее возможности и эффективность зависят от типа злокачественного образования. В лекарственной терапии выделяется четыре вида: химиотерапия, наиболее изученный вид терапии; гормонотерапия; таргетная терапия (англ. target «цель, мишень») и иммунотерапия, самый молодой и мало изученный вид лечения. Чтобы понять, почему врач выбирает тот или иной вид терапии, давайте рассмотрим каждый из них более подробно.
 |
Химиотерапия (ХТ)
Некоторые до сих пор ошибочно считают, что лекарственная терапия сводится исключительно к химиотерапии. Действительно, долгое время лекарственное лечение злокачественных опухолей отводилось цитостатикам, противоопухолевым препаратам, принцип действия которых — разрушение быстро делящихся клеток. В том числе — злокачественных.
— Для пациента, который беспокоится о выраженности тошноты важно знать, какие препараты входят в конкретно его схему лечения. Я всегда рассказываю об этом и при необходимости назначаю препараты для снижения побочных эффектов. Чаще всего это сочетание внутривенного и таблетированного вариантов противорвотных препаратов. Однако, плохое самочувствие может нагнать пациента уже дома, и тогда я обсуждаю это и назначаю препараты, которые он может принимать без надзора врача.
— Получается, как в фильмах бывает редко?
— Крайне редко! Конечно, мутить будет, и многие сравнивают это ощущение с токсикозом во время беременности. В таких случаях я рекомендую пить чай с имбирем, использовать жевательные резинки, карамель с кислым вкусом, соленые и кислые продукты.
При химиотерапии используют множество препаратов с разным механизмом действия, ориентированным под разные особенности опухоли. Поэтому врачи используют либо монотерапию (один препарат), либо комбинированное лечение (два и более препарата). Это позволяет усилить противоопухолевый эффект и уменьшить вероятность развития устойчивости опухоли к лечению.
Выделяют также чувствительные к ХТ опухоли (например, герминогенные опухоли, хорионкарциномы, лимфомы) и опухоли, малочувствительные к ХТ (меланома, некоторые виды сарком). Чтобы найти оптимальные варианты лечения для увеличения продолжительности жизни, сейчас активно ведутся клинические исследования о возможности комбинировать этот вид терапии с иммунотерапией.
Гормональная терапия (ГТ)
При гормональной терапии применяются препараты, подавляющие выработку в организме его естественных гормонов или их взаимодействие с рецепторами. Самый частый вариант опухоли, где применяется данный вариант лечения, — рак молочной железы (РМЖ). При выполнении иммуногистохимического (ИГХ) исследования и наличии положительных рецепторов эстрогена и/или прогестерона, оптимальной опцией лечения является гормонотерапия. С ее помощью, можно остановить опухолевый рост и даже добиться полного или частичного исчезновения опухоли.
— Особенность применения этих препаратов, в том что они в подавляющем случае в таблетированной форме и имеют приемлемую токсичность по сравнению с ХТ. Это позволяет пациентам совмещать лечение с работой, хобби и путешествиями.
Таргетная терапия (ТТ)
В отличие от ХТ таргетные (целенаправленные) препараты атакуют только опухолевые клетки. Опухоль для ТТ — своего рода мишень, уничтожение которой означает прекращение репликации (воспроизведения) клеток и метастазирования.
Все началось с того, что врачи отметили недостаточный эффект от цитостатиков и начали внедрять иммуногистохимические параметры. Иммуногистохимическое исследование (ИГХ) выявляет в образце ткани белки, специфичные для того или иного вида клеток. Это позволяет отличать один вид опухоли от другого и выявлять маркеры, которые отвечают за лекарственную чувствительность опухолевой ткани.
— Таргетная терапия начинается с немелкоклеточного рака легкого: в порыве клинических исследований врачи разработали препарат, который начали применять в рамках клинических исследований. Широкое использование Ирессы в клинической практике сопровождалось преимущественно разочарованиями, связанными с редкостью проявления лечебного эффекта*. Загадка разрешилась достаточно быстро: анализ нуклеотидной последовательности гена EGFR, проведенный тремя независимыми исследовательскими коллективами, установил, что опухоли легких, характеризующиеся чувствительностью к Ирессе или Тарцеве, содержат мутированную форму данного рецептора**. Таким образом, с 2009 года Ирессу внедрили в клиническую практику для пациентов имеющих мутацию в гене EGFR. Особенность механизма действия ТТ, заключается в блокировании мутации, в результате чего опухоль не может делиться, — поясняет Мария.
Побочные эффекты при ТТ менее выражены, и пациенту чаще всего не нужно находиться в стационаре. Некоторые таргетные препараты используются в таблетированной форме, во время их приема качество жизни пациента значительно не страдает, и пациенты могут вести привычный образ жизни.
Иммунотерапия (ИТ)
Иммунотерапия — самая молодая отрасль лекарственного лечения. Существует несколько групп иммунопрепаратов с разными механизмами действия. Одни воздействуют на звено образования кровеносных сосудов в опухоли и блокируют их развитие (после чего опухоль перестает получать питание и погибает), а другие активируют и направляют иммунные силы организма на борьбу с опухолью. ИТ занимает много времени, имеет свой спектр побочных эффектов, а также требует внимания врачей и тщательной оценки динамики состояния пациента.
— По идее мы с помощью введения препаратов обучаем иммунную систему распознавать клетки опухоли и разрушать их. Это все равно что установить антивирус, — объясняет Мария
Цели и оценка эффективности лекарственного лечения
Лекарственная терапия бывает трех видов: предоперационная (неоадъювантная), профилактическая (адъювантная) и паллиативная (поддерживающая).
— Как проходит лечение в каждом из случаев?
— Начнем с предоперационной лекарственной терапии. Например, в отделение поступает пациент с диагнозом рак желудка. Результаты КТ показывают, что отдаленных метастатических очагов нет, однако в связи с распространением первичной опухоли операция на первом этапе невозможна. В этом случае лечение выглядит так: четыре курса терапии, затем — операция, а после нее — еще четыре курса адъювантной терапии. Зачем еще? Формально опухоль убрали, но есть риск возврата образования, и адъювантная терапия помогает его отсрочить.
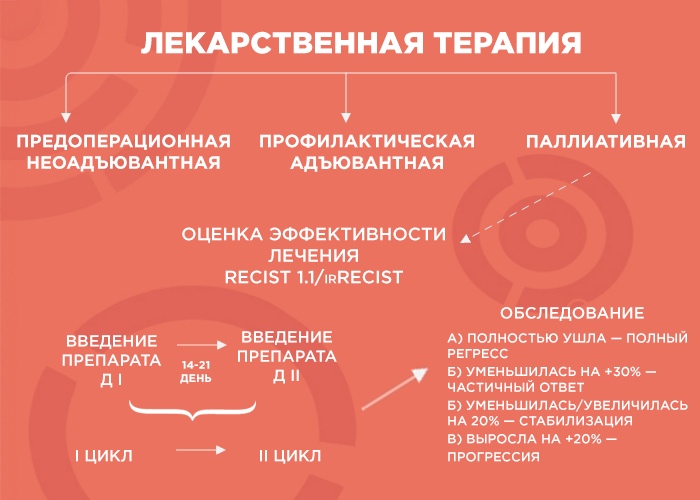 |
— Объясню, как это работает, на примере пациента с опухолью толстой кишки и с множественными метастазами в печени и легких. Чтобы оценить серьезность ситуации, мы проводим обследование, выявляем наиболее измеряемые очаги и проводим два-три цикла химиотерапии. Большая часть курсов ХТ — введение препарата. Между первым введением и вторым — 14-21 дней — и этот временной промежуток называется циклом.
Далее мы смотрим и сравниваем. Если опухоль уменьшилась более чем на 30% — это частичный ответ, и нужно продолжать терапию до шести курсов. Если она ушла — это полный регресс, и тоже добавляем четыре курса, чтобы закрепить результат. Если опухоль увеличилась или уменьшилась на 20% — это стабилизация, мы делаем еще два курса и снова смотрим: если ситуация не изменилась, пациент отправляется на химиотерапевтические каникулы до прогрессирования заболевания, а потом схема повторяется.
Но если опухоль на фоне лечения выросла больше чем на 20% — мы имеем дело с прогрессией, вероятнее всего, это говорит нам об агрессивности опухоли. В этом случае я объясняю пациенту, что с ним происходит и почему мы меняем лечение.
— Как уговорить пациента на лечение?
— К каждому нужен индивидуальный подход. Я всегда говорю: «Химия может ухудшить ваше состояние, но бояться этого не стоит — мы попытаемся подобрать оптимальную симптоматическую терапию, которое уменьшит нежелательные явления». Если после этого во время лечения появятся данные о плохой переносимости, мы подумаем об уменьшении дозы цитостатика. Бывают случаи, когда я буквально уговариваю пациента пойти на терапию и объясняю ему, за что мы боремся. И объясняю это вне зависимости от серьезности случая — если при агрессивной опухоли человек настроен бороться до последнего, моя обязанность ему эту возможность дать.