Что относится к щелочам в быту
Статья по химии на тему «Щелочи в быту»
«Управление общеобразовательной организацией:
новые тенденции и современные технологии»
Свидетельство и скидка на обучение каждому участнику
Щелочи, это кристаллические основания, которые отлично растворяются в воде. Они мылкие на ощупь и являются сильными катализаторами для воздействия на различные материалы, в том числе на фарфор или стекло. Поэтому хранить их в сосудах, которые состоят из этих материалов категорически запрещено. Чаще всего для этого используют пластмассовую тару.
Каустическая сода или едкий натр, научное название – гидроксид натрия. Кристаллообразное вещество светлого желтого или полностью белого цвета, в промышленности изготавливается в виде гранул. Отлично растворяет различные жиры и обладает сильнейшим моющим эффектом. Очищает масляные пятна с разных изделий, очищает канализационные трубы от жировых наростов.
Гашеная известь или по-научному – гидроксид кальция. Чаще применяется в строительной индустрии для побелки и штукатурки стен и потолков.
Нашатырный спирт или раствор аммиака – жидкость с резким раздражающим неприятным запахом, которая негативно воздействует на слизистые глаз и носа. В быту применяется как 25-ти процентный раствор. С его помощью можно стирать шерстяные изделия и удалять пятна, которые имеют органическое происхождение: смолы, жиры, молоко. В последнее время широко используется в составах средств для мытья окон. Так как аммиак имеет отличные моющие свойства, он не оставляет разводов на поверхности стекла. Также слабый раствор нашатырного спирта используют для очистки и придания блеска изделиям из золота и серебра, для этого раствор нужно подогреть, а потом опустить туда украшения на некоторое время. Аммиак способен образовывать соединения с металлами, которые растворяются в воде.
Щёлочи – наши помощники
Сведения о растворимости в воде можно брать из таблицы растворимости. Р – растворимые основания, то есть щёлочи, м – малорастворимые, н – нерастворимые, черта «–» означает, что такого основания не существует.
В обычных условиях являются твёрдыми веществами. Имеют вид белых порошков, легко впитывающих влагу. Требуют хранения в банках из толстого стекла с широким горлышком или полиэтиленовых емкостях.
Получение оснований
Щёлочь образуется в результате реакции металла и воды с большим выделением теплоты.
2Na + 2H2O>2NaOH + H2
CaO + H2O>Ca(OH)2.
Гидроксиды натрия и калия образуются при воздействии на раствор электрического тока:
KCl + 2H2O>2KOH + H2 + Cl2.
Свойства оснований
Щёлочи реагируют
1. С кислотными оксидами:
2КОН+SO3>K2SO4+H2O.
Щёлочи способны растворять оксидную плёнку алюминия (амфотерного оксида):
2. С кислотами:
NaOH+HCl>NaCl+HOH.
Можно определить, осталась ли щёлочь, если добавить 1-2 капли раствора фенолфталеина. Щёлочь прореагировала полностью, если малиновый цвет окрашивания раствора не появился.
Реакция между основанием и кислотой – реакция нейтрализации. Подобные реакции часто применяют с целью очищения сточных вод промышленных предприятий от щелочей и кислот. Продукты таких реакций – соли, которые более безопасны для окружающей среды. Очень эффективной и экономически выгодной является нейтрализация стоков различных производств.
3. С солями. Это реакции обмена. Происходят в растворе, при этом исходная соль должна быть водорастворимой. А получаемое вещество – нерастворимым:
2NaOH+Mn(NO3)2=Mn(OH)2v+2NaNO3
4. С галогенами.
На холоде: Cl2 + 2NaOH = NaClO+NaCl+H2O.
При нагревании: 3Cl2+6NaOH = NaClO3+5NaCl+3H2O.
Расплавить можно только гидроксиды натрия и калия (температуры плавления соединений составляют 322о и 405о соответственно).
Безопасность в работе со щелочами
Химические ожоги, причиняемые щелочами, в том числе едким натром и едким кали, намного опаснее, чем химические ожоги от кислот. Ожог усугубляется, если кусочек кристаллического вещества прилипает к коже.
Щёлочи способны разъедать много материалов, вызывать серьёзные ожоги на коже и слизистых оболочках, поражать глаза. Поэтому гидроксид натрия называют «едким натром», а гидроксид калия – «едким кали». При работе со щелочами и их растворами, нужно соблюдать осторожность. При попадании раствора щелочи на кожу, нужно сразу смыть его большим количеством воды. Затем обработать это место слабым раствором уксусной или борной кислоты. И опять промыть водой.
Что за вещество «нашатырный спирт»?
Во взаимодействие вступает небольшое количество растворённого аммиака и одновременно распадается на исходные вещества, на что указывает знак «-» в уравнении. Гидроксид аммония, подобно щелочам, изменяет окрашивание индикатора, взаимодействует с кислотными оксидами, кислотами и солями.
2NH4OH+СО2>(NH4)2СО3+H2O
NH4OH+HCl>NH4Cl+H2O
NH4OH+Pb(NO3)2>Pb(OH)2v+2NH4NO3.
Применение оснований
Нашатырный спирт используют не только для того, чтобы привести человека в сознание. С его помощью можно отлично вымыть окна, используя 1 столовую ложку препарата на 1 литр воды. Затем нужно вытереть поверхность бумажными полотенцами.
Если смешать 1 часть нашатырного спирта с 1 частью уксуса, а потом протирать полученным раствором поверхность утюга, то он станет чистым. Но не стоит думать, что получится мгновенный эффект. Поверхность нужно аккуратно потереть.
Широко применяют, прежде всего, гидроксиды кальция и натрия. Гашёная известь – это гидроксид кальция Сa(OH)2. Её используют, как вяжущий материал в строительстве. Смешивают с песком и водой. Полученную смесь наносят на кирпич, штукатурят стены. В результате взаимодействия основания с углекислым газом и оксидом силициума (IV), смесь твердеет. Известь способна поглощать кислые газы. Также может впитывать токсичные вещества, поэтому для здоровья жильцов белить комнату предпочтительнее, чем красить.
Также гидроксид кальция используют в сахарной промышленности, сельском хозяйстве, при изготовлении зубных паст, получении многих веществ.
Гидроксид натрия (каустическую соду) используют при производстве мыла в реакции щёлочи с жиром, при изготовлении лекарств, в кожной промышленности, для очищения нефти. Каустическая сода применяется для чистки масляных пятен. Всем известный «Крот» для труб представляет собой раствор гидроксида натрия, способный растворять жиры и даже волосы.
Щёлочи разъедают стекло и фарфор. Растворяют белковые вещества.
Применяются в медицине в качестве антисептиков, раздражающих и прижигающих препаратов. При заболеваниях пищеварительной системы щелочные минеральные воды действуют оздоравливающе. Эффективны в лечении подагры, стоматита, в лечении заболеваний дыхательной системы. Являются мочегонным средством. Нейтрализуют отравление кислотами.
Немаловажно участие щелочей в изготовлении каучука, искусственного волокна, красителей, очищения предметов из металла, обработки деревянных поверхностей. Являются хладагентом холодильных установок. Используются в сельском хозяйстве, лёгкой промышленности и металлургии.
Щелочные продукты питания
Различают кислые, щелочные и нейтральные продукты питания. Среди щелочных продуктов можно перечислить зелень, репу, огурцы, хрен, сельдерей, лимоны, свеклу, морковь, капусту, цитрусовые, смородину, виноград, вишню, сухофрукты, картофель, перец, помидоры, чеснок.
Примечательно, что в составе нейтральных продуктов содержатся и кислоты, и щёлочи. Это растительное, сливочное масло.
Щёлочи активно используются человеком. При этом следует помнить и в обязательном порядке соблюдать правила техники безопасности.
Что такое щелочь, где ее применяют и используют?
Что такое щелочь, где ее применяют и используют?
Щелочи представляют собой растворимые основания. Их кристаллы при растворении становятся едкими и «мыльными». Исходя из этого, для оказания неотложной помощи при ожогах щелочами используют слабые растворы кислот (преимущественно уксусной и борной). Этот прием получил название реакции нейтрализации, в результате которой образуются соль и вода. А при работе с ними используют защитные очки и резиновые перчатки
Щелочи относят к сильным основаниям – они активно реагируют с другими веществами благодаря легкому отщеплению гидрокси-групп. Как и другие основания, они при нагревании распадаются на воду и оксид, а их растворы изменяют цвет индикаторов.
Щелочи хранят в пластиковой посуде, поскольку они разъедают даже фарфор и стекло. Они сильно впитывают влагу.
Применение щелочи. Каустическая сода (она же гидроксид натрия или едкий натр) обладает моющими способностями, используется в составе многих средств бытовой химии. Больше всего подходит для растворения жиров. Едкий натр также применяют для изготовления целлюлозы в бумажной промышленности, производства масел в нефтепереработке, он выступает в роли катализатора или реагента в химической отрасли. Его применяют в производстве экологически чистого биодизельного топлива. И что совершенно удивительно, эта щелочь используется при изготовлении какао, мороженого, шоколада, хлеба, напитков.
Гашеная известь (гидроксид кальция) нашла широкое применение в строительстве для побелки и штукатурки стен.
Нашатырный спирт (раствор аммиака) обладает сильным запахом. Смягчает при стирке шерсть, удаляет пятна от молока, смолы, жира. Хорошо без разводов отмывает стекло, золото, серебро.
Щелочи используют в рыбоводстве для дезинфекции прудов и в качестве удобрения. Они выступают в качестве электролита для щелочных аккумуляторов.
Щелочи широко используют в медицине как антисептики, прижигающие и раздражающие препараты, поскольку они способны растворять белки. Щелочные минеральные воды благотворно влияют на организм при заболеваниях желудочно-кишечного тракта. Эти вещества также применяют при лечении подагры (растворяют мочевую кислоту), стоматита, заболеваний дыхательной системы (муколитическое действие), как мочегонное средство, при отравлении кислотами (в данном случае работает та же реакция нейтрализации).
Щелочи участвуют в процессах изготовления мыла, искусственного волокна, каучука, красителей, витаминов, обработки древесины, очистки металлических предметов, а также участвуют в химической и легкой промышленности, сельском хозяйстве (удобрения), металлургии. Щелочи выступают как хладагент в холодильных установках.
Как видно из статьи, щелочи играют огромную роль в жизни человека. Но следует помнить об опасностях, которые подстерегают при работе с ними. Соблюдая технику безопасности, нам удалось сделать их своими помощниками.
Кислоты и щелочи в быту. Определение рн растворов бытовой химии.
«Управление общеобразовательной организацией:
новые тенденции и современные технологии»
Свидетельство и скидка на обучение каждому участнику
Описание презентации по отдельным слайдам:
Кислоты и щелочи в быту. Определение рН растворов бытовой химии. Выполнила: Чазова Я.С.
Введение Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток. Щёлочи — гидроксиды щелочных, щёлочноземельных металлов. К щелочам относят хорошо растворимые в воде основания. При диссоциации щёлочи образуют анионы OH− и катион металла.
Вопросы: 1. Какие кислоты существуют? 2. Какие кислоты используют в пищу? 3. Какие кислоты применяют в быту? 4. Какие щелочи бывают? 5. Какие щелочи присутствуют в пище? 6. Какие щелочи применяют в быту? Цель работы: Изучить роль кислот и щелочей, используемых человеком в быту. Задачи: 1. Сформулировать представление о кислотах и щелочах; 2. Узнать способы распознания кислот и щелочей; 3. Изучить применение щелочей и кислот в жизнедеятельности людей. Объект исследования: органические и неорганические кислоты и щелочи. Методы исследования: 1. Описательный; 2. Наблюдение; 3. Сравнительный; 4. Опытно-экспериментальный.
Проблема: Кислоты и щелочи – необходимые для жизни человека химические соединения. Вместе с едой мы получаем растительные и животные белки, которые расщепляются на отдельные аминокислоты. Из аминокислот в каждом организме строятся свои белковые структуры, свои живые ткани. Органические кислоты в свободном виде поступают в человеческий организм с молочнокислыми продуктами, ягодами, фруктами, овощами. Некоторые органические кислоты являются витаминами. В наших квартирах можно встретить кислоты и щелочи, и чтобы они не причиняли вред нам, очень важно знать, как с ними обращаться и можно ли их заменить на менее вредные для здоровья средства.
Кислоты в быту • Для дезинфекции сантехники, очистки плит, при пайке металлов; • Для получения лекарств, удобрений, красителей, взрывчатых веществ; • В кулинарии; • В производстве минеральных удобрений, лекарств, моющих средств, красок, искусственного волокна; • Для отбеливания при стирке.
Борная (B(OH)₃) Лимонная ( (HOOCCH₂)₂ ) Муравьиная (HCOOH) Уксусная (C₂H₄O₂) Щавелевая (HOOC−COOH) Серная (H₂SO₄) Соляная (HCl) Азотная (HNO₃)
Щелочи в быту Каустическая сода – одна из самых известных, распространенных и сильных щелочей. — В качестве электролитов. — Для производства удобрений. — В медицине, химических, косметических производствах. — В рыбоводстве для стерилизации прудов
Лакмусовая нейтральная бумага в шампунях принимает красный цвет, фенолфталеиновая не меняет цвет, значит среда кислая. В стиральных порошках соответственно синий и розовый цвета, значит среда щелочная. В мылах соответственно, кроме жидкого мыла, лакмус в синий, фенолфталеин в розовый, причем видно, что в порошках цвет индикаторов насыщеннее, чем в мылах. Но в мылах тоже среда щелочная. Как видим из рисунков для: • Шампуня рН равен интервалу 6-7 • Стиральных порошков – в пределах 11 • Мыла – в пределах 9-10
Щелочь
Производство широкого спектра потребительских товаров зависит от использования щелочей 
Немного исторических моментов из истории получения щелочи.
Лебланский способ производства доминировал в мировом производстве до конца 19-го века, но после первой мировой войны был полностью вытеснен другим методом конверсии соли, который был усовершенствован в 1860-х годах Эрнестом Солве из Бельгии. В конце XIX века появились электролитические методы производства каустической соды, объемы которых быстро росли.
По методу Солве, аммиачно-содовый процесс производства кальцинированной соды протекал следующим образом: поваренная соль в виде сильного рассола химически обрабатывалась для устранения примесей кальция и магния и затем насыщалась рециркулирующим газом аммиака в башнях. После, аммиачный рассол насыщался газом с использованием газообразного диоксида углерода при умеренном давлении в башне другого типа. Эти два процесса дают бикарбонат аммония и хлорид натрия, двойное разложение которого дает желаемый бикарбонат натрия, а также хлорид аммония. Затем бикарбонат натрия нагревают до разложения его до необходимого карбоната натрия. Аммиак, вовлеченный в процесс, почти полностью восстанавливается путем обработки хлоридом аммония с известью, с получением аммиака и хлорида кальция. Восстановленный аммиак затем повторно используют в описанных выше процессах.
В нескольких местах в мире существуют значительные запасы минеральной формы кальцинированной соды, известной как природная щелочь. На таких месторождениях производят большую часть природной щелочи в мире из обширных месторождений в подземных шахтах.
Природный натрий металлический.
Прочитайте статью Щелочи (источник «Энциклопедический словарь химика»)и получите больше представления о том что такое щелочь, или посмотрите видеоролик об этом химическом реактиве Щелочи.
Использование щелочи в окружающей нас среде
Щелочь снискала широкое применение в нашей жизни. Благодаря щелочи можно в той или иной форме добиться смягчения воды и удалить из нее примеси, такие как марганец, фториды и органические танины. В тяжелых отраслях промышленности используют щелочь в виде извести для поглощения и нейтрализации оксидов серы в выбросах в атмосферу, тем самым уменьшая вероятность выпадения кислотных осадков. Диоксид серы, производимый промышленными предприятиями и выпускаемый в атмосферу, возвращается на землю в виде кислотных дождей или серной кислоты. Такие территории, подвергшихся воздействию кислотных дождей, обрабатываются с помощью авиации препаратами, в состав которых входит щелочь. Это позволяет контролировать и нейтрализовывать критический уровень рН воды и почвы на участках, где произошли такие техногенные выбросы. Внесение щелочи в отходы и сточные воды, поддерживая правильный уровень рН в окислительных процессах при их разложении. Стабилизирует образования осадка в сточных водах и уменьшает запах или образования патогенных бактерий. Обработанный негашеной известью ил из сточных водоемов, соответствует экологическим нормам, что делает его пригодным в дальнейшем в использовании в качестве удобрения на сельскохозяйственных землях.
Промышленное применение щелочи
В промышленных и горных работах применение щелочей в сточных водах помогает нейтрализовать вредные соединения и произвести их очистку. Обработка избыточной щелочью, повышает рН воды до 10,5-11 и может дезинфицировать воду и удалять тяжелые металлы. Щелочи, такие как известь, являются ключевыми в химическом производстве карбида кальция, лимонной кислоты, нефтехимии и магнезии. В бумажной промышленности карбонат кальция является каустифицирующим агентом для отбеливания. Сталелитейная промышленность зависит от извести в качестве компонента для удаления примесей, таких как газообразный монооксид углерода, кремния, марганца и фосфора.
Моющие средства образованные щелочью
Щелочные моющие средства помогают при очистке поверхностей с сильными загрязнениями. Эти экономичные, водорастворимые щелочи с рН от 9 до 12,5 могут нейтрализовать кислоты в различных типах грязи и отложениях.
Щелочь в производстве стекла и керамики
Щелочь является основным сырьем в производстве стекла. Известняк, а также песок, кальцинированная сода, известь и другие химикаты, обжигаются при чрезвычайно высоких температурах и превращаются в расплавленную массу. Стеклодувы и гончары используют щелочи для глазурей и флюсов, которые реагируют с кислотами с образованием силикатов (стекла) при нагревании. Концентрированные щелочи создают более насыщенный цвет в глазури.
Литература о щелочи
«Среди многочисленных веществ, которыми химики с давних времен пользовались в своих лабораториях, почетное место всегда занимали едкие щелочи — едкое кали и едкий натр. Сотни различных химических реакций осуществляются в лабораториях, на заводах и в быту при участии щелочей. С помощью едких кали и натра можно, например, сделать растворимыми большинство нерастворимых веществ, а самые сильные кислоты и удушливые пары можно благодаря щелочам лишить всей их жгучести и ядовитости.
Едкие щелочи — очень своеобразные вещества. На вид это беловатые, довольно твердые камни, ничем как будто не примечательные. Но попробуйте взять едкое кали или натр и зажать его в руке. Вы почувствуете легкое жжение, почти как от прикосновения к крапиве. Долго держать в руке едкие щелочи было бы нестерпимо больно: они могут разъесть кожу и мясо до кости. Вот почему их называют «едкими», в отличие от других, менее «злых» щелочей — всем известных соды и поташа. Из соды и поташа, кстати сказать, почти всегда и по лучались едкие натр и кали.
У едких щелочей сильнейшее влечение к воде. Оставьте кусок совершенно сухого едкого кали или натра на воздухе. Через короткое время на его поверхности неизвестно откуда появится жидкость, потом он весь станет мокрым и рыхлым и под конец расползется бесформенной массой, как кисель. Это из воздуха щелочь притягивает к себе пары воды и образует с влагой густой раствор. Кому впервые приходится погрузить пальцы в раствор едкой щелочи, тот с удивлением заявляет: — Как мыло! И это совершенно правильно. Щелочь — скользкая, как мыло. Больше того: мыло потому и «мыльно» на ощупь, что его изготовляют с помощью щелочей. Раствор едкой щелочи и на вкус напоминает мыло.
Но химик узнаёт едкую щелочь не по вкусу, а по тому, как это вещество ведет себя с краской лакмус и с кислотами. Бумажка, про питанная синей краской лакмус, мгновенно краснеет, когда ее опус кают в кислоту; а если этой покрасневшей бумажкой дотронуться до щелочи, то она тотчас же опять становится синей. Едкая щелочь и кислота не могут мирно существовать рядом ни одной секунды. Они тотчас же вступают в бурную реакцию, шипя и разогреваясь, и уничтожают друг друга до тех пор, пока в растворе не останется ни крупинки щелочи или ни капли кислоты. Только тогда наступает успо коение. Щелочь и кислота «нейтрализовали» друг друга, говорят в таких случаях. От соединения их между собой получается «нейтральная» соль — ни кислая, ни едкая. Так, например, от соединения жгучей соляной кислоты с едким натром получается обыкновеннейшая поваренная соль.»
Отличительные признаки щелочи.
Из выше прочитанного мы уже знаем, что противоположностью щелочи является кислота. Вместо горького вкуса 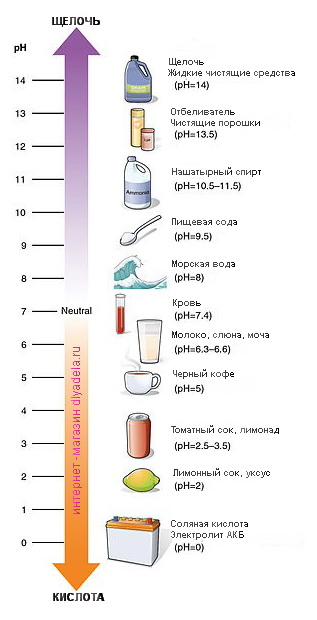
Почему вещество щелочное?
Таким образом, нам уже известно, что рН уровень представляет собой шкалу, значения которой колеблятся от 0-14 и указывают, является ли вещество щелочью или кислотой. Однако мы действительно не знаем, почему. Давайте рассмотрим этот вопрос более детально.
Уровень рH вещества зависит от того, как атомы расположены и объединены в веществе. Чистая вода находится прямо в середине шкалы и имеет pH 7. Это означает, что она содержит равное количество атомов водорода (H +) и гидроксидных атомов (OH-). Когда вещество имеет больше атомов водорода (Н +), это кислота. Когда вещество имеет больше гидроксидных атомов (OH-), оно является щелочным.
Где купить щелочь?
Купить щелочь в Новосибирске со степенью очистки ЧДА (чистая для анализов) в магазине «Для дела» можно на странице заказов: едкий натр NaOH или едкий кали KOH. Для иногородних покупателей товар может быть отправлен Почтой РФ или транспортными компаниями.