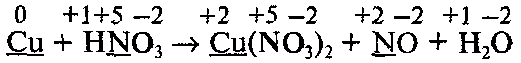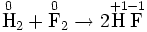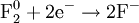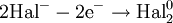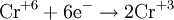Что относится к окислительно восстановительным реакциям
Окислительно-восстановительные реакции (ОВР)
Все химические реакции можно разделить на два типа:
1) Реакции, которые протекают без изменения степеней окисления элементов: степени окисления всех элементов в молекулах исходных веществ равны степеням окисления этих элементов в молекулах продуктов реакции. Например:
2) Реакции, которые протекают с изменением степеней окисления элементов: степени окисления всех или некоторых элементов в молекулах исходных веществ не равны степеням окисления этих элементов в молекулах продуктов реакции. Например:
Реакции второго типа называются окислительно-восстановительными.
Окислительно-восстановительные реакции (ОВР) — это химические реакции, при протекании которых степени окисления элементов изменяются.
Изменение степеней окисления в ходе ОВР обусловлено полным или частичным переходом электронов от атомов одного элемента к атомам элемента.
Так, в реакции 4.1.2 каждый атом магния отдает 2 электрона:
Mg 0 = Mg +2 + 2ē (или: Mg 0 — 2ē = Mg +2 ) (4.1.4)
Эти электроны переходят к молекуле кислорода. Каждый атом кислорода в молекуле О2 присоединяет 2 электрона, поэтому молекула кислорода присоединяет 4 электрона:
Атом марганца, который в исходном веществе (KМnО4) имеет степень окисления +7, присоединяет 5 электронов и превращается в атом марганца со степенью окисления +2 (такую степень окисления он имеет в молекуле продукта реакции MnCl2):
Mn +7 + 5ē = Mn +2 (4.1.7)
Рассмотренный выше механизм ОВР объясняет, почему эти реакции называют реакциями с переносом электронов. Реакции, при протекании которых степени окисления не изменяются, называются реакциями без переноса электронов. Таким образом, любая ОВР представляет собой совокупность процессов отдачи и присоединения электронов.
Процесс отдачи электронов называется окислением. В результате процесса окисления алгебраическая величи на степени окисления элемента повышается.
В рассмотренных примерах процессы 4.1.4 и 4.1.6 являются процессами окисления.
Процесс присоединения электронов называется восстановлением. В результате процесса восстановления алгебраическая величина степени окисления понижается.
Процессы 4.1.5 и 4.1.7 являются примерами процессов восстановления.
Частицы (атомы, молекулы, ионы), которые отдают электроны, называются восстановителями.
В реакциях 4.1.2 и 4.1.3 восстановителями являются соответственно Mg и НCl.
Частицы, которые присоединяют электроны, называются окислителями.
В реакциях 4.1.2 и 4.1.3 окислителями являются соответственно O2 и KМnО4.
Следовательно, в общем виде окислительно-восстановительную реакцию можно представить следующей схемой:
Восстановитель + Окислитель = Продукты реакции
Восстановитель участвует в процессе окисления, т. е. окисляется. А окислитель участвует в процессе восстановления, т. е. восстанавливается.
Важнейшие окислители и восстановители
Какие же вещества могут быть окислителями и какие восстановителями? Это зависит от величины степеней окисления элементов, которые входят в состав данных веществ. Как известно, некоторые элементы имеют постоянные степени окисления во всех или в большинстве сложных веществ. Для таких элементов изменение степеней окисления нехарактерно. Поэтому свойства веществ обычно не зависят от присутствия этих элементов. Элементы с переменной степенью окисления, как правило, легко ее изменяют, т. е. могут участвовать в процессах отдачи или присоединения электронов. Поэтому свойства сложных веществ обусловлены наличием в их составе элементов с переменной степенью окисления.
Если в состав вещества входит элемент с высшей степенью окисления, он может только понижать ее, т. е. участвовать в процессе восстановления. Следовательно, данное вещество может только присоединять электроны и выступать только в роли окислителя.
Например, свойства перманганата калия KМnО4 определяются степенью окисления марганца (калий и кислород — элементы с постоянной степенью окисления). Марганец в KМnО4 имеет высшую степень окисления +7, поэтому KМnО4 может быть только окислителем.
Если в состав вещества входит элемент с низшей степенью окисления, он может только повышать ее, т. е. участвовать в процессе окисления. Следовательно, данное вещество может только отдавать электроны и выступать только в роли восстановителя.
Например, свойства аммиака NH3 определяются степенью окисления азота (для водорода степень окисления +1 является практически постоянной). Азот в NH3 имеет низшую степень окисления —3, поэтому NH3 может быть только восстановителем.
Если в состав вещества входит элемент с промежуточной степенью окисления, он может как повышать, так и понижать ее, т. е. может участвовать и в процессе окисления, и в процессе восстановления. Следовательно, данное вещество может быть и окислителем, и восстановителем. Это зависит от второго участника реакции.
Например, свойства сульфита натрия Na2SО3 определяются степенью окисления серы, которая имеет промежуточную степень окисления +4. Поэтому Na2SО3 проявляет окислительно-восстановительную двойственность. В реакции с перманганатом калия:
сульфит натрия окисляется до сульфата натрия, т. е. выступает в роли восстановителя. Это обусловлено тем, что KМnО4 может быть только окислителем (см. выше). А в реакции с сероводородом:
сульфит натрия восстанавливается до свободной серы, т. е. выступает в роли окислителя, так как H2S может быть только восстановителем (сера в H2S находится в низшей степени окисления).
Важнейшими окислителями являются:
б) сложные вещества, молекулы которых содержат элементы в высшей степени окисления — перманганат калия KМnО4, хроматы и дихроматы (например, дихромат калия K2СrО7), азотная кислота HNO3 и ее соли — нитраты, концентрированная серная кислота H2SO4, оксид свинца (IV) РbО2, хлорная кислота HClO4 и ее соли — перхлорат и др.
Важнейшими восстановителями являются:
Среди веществ, содержащих элементы в промежуточных степенях окисления, есть вещества, для которых более характерными являются или окислительные, или восстановительные свойства. Обычно являются окислителями галогены Сl2 и Br2, хлорноватистая кислота НClО и ее соли — гипохлориты, хлораты (KСlO3 и др.), оксид марганца (IV) МnO2, соли трехвалентного железа (FeCl3 и др.). Как правило, в роли восстановителей выступают водород Н2, углерод С, оксид углерода (II) СО, сульфиты металлов (Na2SO3 и др.), соли двухвалентного железа (FeSO4 и др.).
Типы окислительно-восстановительных реакций
Различают 3 типа окислительно-восстановительных реакций.
1) Межмолекулярные окислительно-восстановительные реакции. В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав молекул различных веществ. Примерами данного типа реакций являются
2) Внутримолекулярные окислительно-восстановительные реакции. В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав одного вещества. Например:
К этому типу ОВР относятся многие реакции термического разложения веществ.
З) Реакции самоокисления-самовосстановления, называемые также реакциями диспропорционирования. Это ОВР, при протекании которых один и тот же элемент, находящийся в промежуточной степени окисления, и окисляется и восстанавливается. Часть атомов данного элемента отдает электроны другой части атомов этого же элемента. Например:
Составление уравнений окислительно-восстановительных реакций
Для составления уравнений окислительно-восстановительных реакций часто используется специальный метод — метод электронного баланса. В основе его лежит следующее правило: общее число электронов, которые отдает восстановитель, должно быть равно общему числу электронов, которые присоединяет окислитель.
Рассмотрим применение метода электронного баланса на примере реакции, которая выражается следующей схемой:
а) Определим степени окисления всех элементов в молекулах исходных веществ и продуктов реакции:
б) Подчеркнем символы элементов, которые изменяют степени окисления в ходе реакции:
в) Составим уравнения процессов окисления и восстановления:
Обратите внимание, что в левой части уравнения процесса окисления взято два атома брома, так как продуктом окисления является двухатомная молекула брома Br2.
г) Находим множители для уравнений процессов окисления и восстановления, при умножении на которые числа отданных и присоединенных электронов будут равны. Так как наименьшим общим кратным чисел «5» и «2» является «10», то уравнение процесса восстановления нужно умножить на «2», а уравнение процесса окисления — на «5»:
д) Найденные множители запишем как коэффициенты перед формулами веществ, которые содержат элементы, участвующие в процессах окисления и восстановления:
е) После этого уравниваем числа атомов элементов, которые не изменяют степени окисления. В данном случае это атомы калия, серы, водорода и кислорода.
Обычно числа атомов водорода и кислорода уравнивают в последнюю очередь. Во многих случаях равенство чисел атомов кислорода в левой и в правой частях уравнения ОВР свидетельствует о том, что это уравнение составлено правильно (в составленном уравнении 40 атомов кислорода и в левой, и в правой частях).
Рассмотрим некоторые более сложные примеры составления уравнений ОВР.
Составим уравнение реакции, которая протекает по следующей схеме:
Определим степени окисления всех элементов и подчеркнем символы элементов, которые изменяют свои степени окисления:
Составим уравнения процессов окисления и восстановления и найдем множители, на которые нужно умножить эти уравнения:
Обратите внимание, что не все атомы азота, которые входят в состав HNО3, изменяют свою степень окисления: часть атомов азота без изменения степени окисления переходит в молекулы Cu(NO3)2 Поэтому найденные методом электронного баланса коэффициенты напишем перед всеми формулами, содержащими Сu и N, кроме формулы HNO3:
Коэффициент перед формулой HNO3 равен общему числу атомов азота в правой части уравнения, т. е. равен 8 (из них 6 атомов, которые не изменяют степень окисления):
В последнюю очередь уравниваем числа атомов водорода и кислорода:
В некоторых ОВР более двух элементов изменяют свои степени окисления. В качестве примера рассмотрим следующую реакцию:
Два элемента — фосфор и сера — в ходе этой реакции окисляются, один элемент — азот — восстанавливается:
Общее число электронов, которые участвуют в процессах окисления, равно 22; в процессе восстановления участвует 1 электрон. Поэтому общий множитель для двух уравнений процессов окисления равен 1, а множитель для уравнения процесса восстановления равен 22. Запишем эти множители в качестве коэффициентов перед формулами соответствующих веществ:
В заключение уравняем числа атомов водорода и кислорода:
Окислительно-восстановительная реакция
Окисли́тельно-восстанови́тельные реа́кции — это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Содержание
Описание
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества, называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части. При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e − ↔ сопряжённый восстановитель.
Восстановление
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
Виды окислительно-восстановительных реакций
Примеры
Окислительно-востановительная реакция между водородом и фтором
Разделяется на две полуреакции:Ы
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
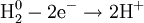

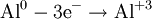
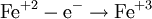
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
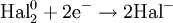
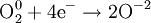

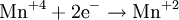
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
Мнемонические правила
Для запоминания процессов окисления-восстановления, а также свойств окислителей и восстановителей существует несколько мнемонических правил:
См. также
Ссылки
Полезное
Смотреть что такое «Окислительно-восстановительная реакция» в других словарях:
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНАЯ РЕАКЦИЯ — хим. реакция, при которой число отданных одними атомами или ионами электронов всегда равно числу приобретённых другими. Отдача электронов называется окислением, их присоединение восстановлением. Сущность О. в. р. состоит в полном или частичном… … Большая политехническая энциклопедия
окислительно-восстановительная реакция — — [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN oxidation reduction reaction … Справочник технического переводчика
окислительно-восстановительная реакция — 3.1 окислительно восстановительная реакция: Реакция, протекающая с изменением степени окисления атомов, входящих в состав реагирующих веществ. Источник … Словарь-справочник терминов нормативно-технической документации
окислительно-восстановительная реакция на поверхности электрода, возбуждающая индукционный ток — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN electron transfer reaction … Справочник технического переводчика
Реакция серебряного зеркала — Реакция серебряного зеркала это реакция восстановления серебра из аммиачного раствора оксида серебра (реактив Толленса). В водном растворе аммиака оксид серебра растворяется с образованием комплексного соединения гидроксид… … Википедия
Окислительно-восстановительные реакции — Окислительно восстановительные реакции, ОВР, редокс (от англ. redox ← reduction oxidation окисление восстановление) это встречно параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав… … Википедия
ГОСТ Р 8.702-2010: Государственная система обеспечения единства измерений. Электроды для определения окислительно-восстановительного потенциала. Методика поверки — Терминология ГОСТ Р 8.702 2010: Государственная система обеспечения единства измерений. Электроды для определения окислительно восстановительного потенциала. Методика поверки оригинал документа: 3.3 измерительный электрод: Электрод, служащий… … Словарь-справочник терминов нормативно-технической документации
Конпропорционирование — Окислительно восстановительная реакция, в которой окислителем и восстановителем является один и тот же химический элемент в разных степенях окисления. В результате образуется продукт с тем же элементом в промежуточной степени окисления. Примеры… … Википедия
окисление — ▲ реакция соединения окисление процесс потери веществом своих электронов во время химической реакции. окислитель. окислить, ся. окислительный. < > восстановление (хим). восстановитель. окислительно восстановительная реакция реакция,… … Идеографический словарь русского языка
ФОТОСИНТЕЗ — окислительно восстановительная реакция синтеза органических веществ из неорганических с помощью световой энергии, улавливаемой хлорофиллом … Словарь ботанических терминов
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.