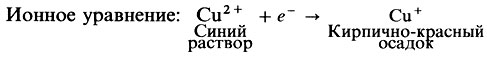Что относится к нередуцирующим сахарам
Что относится к нередуцирующим сахарам
5.2.2. Дисахариды
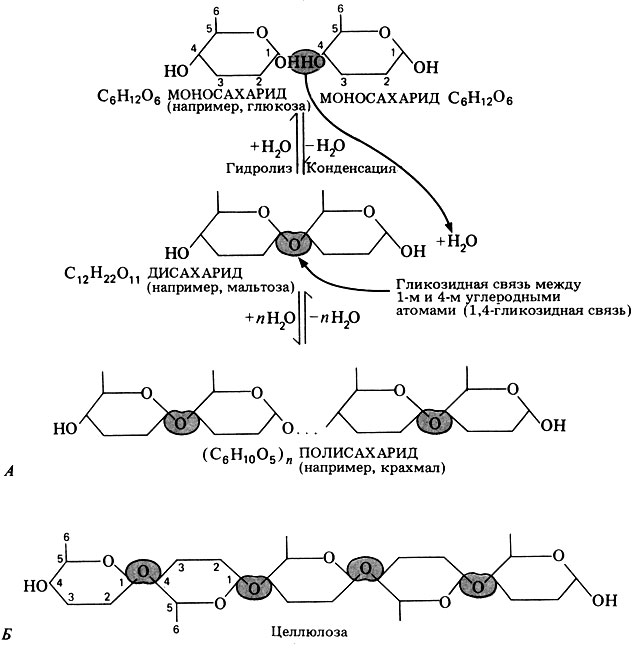
На рис. 5.6 отмечены некоторые свойства дисахаридов. Дисахариды образуются в результате реакции конденсации между двумя моносахаридами, обычно гексозами (рис. 5.14).
Рис. 5.14. А Образование дисахарида и полисахарида. Показаны лишь те части молекул, которые в данном случае представляют для нас интерес. Полностью молекула глюкозы представлена на рис. 5.13. Б. Строение целлюлозы. У некоторых полисахаридов, например у целлюлозы, присоединяемые моносахаридные единицы при каждой очередной конденсации поворачиваются на 180°
Связь между двумя моносахаридами называют гликозидной связью. Обычно она образуется между 1-м и 4-м углеродными атомами соседних моносахаридных единиц (1,4-гликозидная связь). Этот процесс может повторяться бессчетное число раз, в результате чего и возникают гигантские молекулы полисахаридов (рис. 5.14). После того как моносахаридные единицы соединятся друг с другом, их называют остатками. Таким образом, мальтоза состоит из двух остатков глюкозы.
Среди дисахаридов наиболее широко распространены мальтоза, лактоза и сахароза:
Мальтоза образуется из крахмала в процессе его переваривания (например, в организме животных или при прорастании семян) под действием ферментов, называемых амилазами. Расщепление мальтозы до глюкозы происходит под действием фермента, называемого мальтозой. Лактоза, или молочный сахар, содержится только в молоке. Сахароза, или тростниковый сахар, наиболее распространена в растениях. Здесь она в больших количествах транспортируется по флоэме. Иногда она откладывается в качестве запасного питательного вещества, так как метаболически она довольно инертна. Промышленным способом сахарозу получают из сахарного тростника или из сахарной свеклы; именно она и есть тот самый «сахар», который мы обычно покупаем в магазине.
Редуцирующие сахара
Лекция на тему «Углеводы»
Тема: Редуцирующие и нередуцирующие сахара
Моносахариды и большинство дисахаридов обладают редуцирующей способностью, все они обязаны (альдегидной) карбоксильной группе, которую они имеют в своей же молекуле. Свободный конец атома используется путем передачи электонов другой свободной молекуле. Их открытая химическая структура (с двумя кольцами химических веществ) позволяет им разбиваться с удвоенной скоростью дисахаридов.
Этот редуцирующий характер можно продемонстрировать с помощью окислительно-восстановительной реакции, проводимой между ними и сульфатом меди (II). Растворы этой соли имеют синий цвет. После реакции с восстановительным углеводным оксидом меди (I) образуется кирпично-красный цвет. Таким образом, изменение цвета указывает на то, что указанная реакция произошла и что, следовательно, данный углевод редуцирующий. Ученые используют несколько обычных химических составов на определение редуцирующего сахара: самые распространенные реакция Бенедикта и реакция Фелинга.
Сахара, которые дают положительные результаты по тестам известны как редуцирующие сахара. Положительный результат дают сахара с полуацетальную или гемикетальную группой. Но я не буду их рассматривать(это для общего понятия).
Самыми распространенными сахарами в продуктах питания являются глюкоза и фруктоза (моносахариды), а в меньшей степени лактоза и галактоза(дисахариды). Ряд сахаров или сахароза не является редуцирующим сахаром, но если сахарный раствор нагревается или подкисляется, идет гидролиз: сахароза разрушается до глюкозы и фруктозы, а это уже моносахариды. И они редуцируются.
Это углеводы – полисахариды. Самая распространенная – сахароза. Имеет закрытую (замкнутую )химическую структуру. У нее несколько химических колец(три), где открытые атомы используются для связывания структуры в целом и, следовательно, не имеют свободных электронов для отдачи связующей молекуле. Из-за этого окисления нет во время реакции. Чтобы вызвать разложение, понадобится гораздо больше времени.
У нередуцирующего сахара нет реакционной способности, нет альдегидной группы, поэтому тест Бенедикта дает отрицательный результат.

2. Раствор фруктозы + 2 капли реактива Бенедикта
3. Раствор глюкозы + 2 капли реактива Бенедикта
4. Раствор лактозы + 2 капли реактива Бенедикта
Структурная биохимия
Учебное пособие предназначено для студентов направления «Биология» всех профилей подготовки, всех форм обучения для теоретической подготовки к занятиям, зачетам и экзаменам. Пособие охватывает основные разделы структурной биохимии: строение, физико-химические свойства и функции основных классов биологических макромолекул. Большое внимание уделено ряду прикладных аспектов биохимии.
Оглавление
Приведённый ознакомительный фрагмент книги Структурная биохимия предоставлен нашим книжным партнёром — компанией ЛитРес.
Углеводы широко представлены в растениях и животных, где они выполняют как структурные, так и метаболические функции. В растениях в процессе фотосинтеза из углекислого газа и воды синтезируется глюкоза, которая далее запасается в виде крахмала или превращается в целлюлозу — структурную основу растений. Животные способны синтезировать ряд углеводов из жиров и белков, но большая часть углеводов поступает с пищей растительного происхождения.
Углеводы — это альдегидные или кетонные производные полиатомных (содержащих более одной ОН-группы) спиртов или соединения, при гидролизе которых образуются эти производные.
Их можно классифицировать следующим образом:
Моносахариды — углеводы, которые не могут быть гидролизованы до более простых форм. Их можно подразделить на триозы, тетрозы, пентозы, гексозы, гептозы и октозы в зависимости от числа содержащихся в их молекуле атомов углерода; их можно разделить также на альдозы и кетозы в зависимости от присутствия альдегидной или кетонной группы.
Дисахариды при гидролизе дают две молекулы моносахарида (одинаковых или различных).
Олигосахариды при гидролизе дают 3—6 моносахаридов или, что чаще, полисахариды, в состав которых входит несколько десятков моносахаридных остатков.
Полисахариды дают при гидролизе более 6 молекул моносахаридов. Они могут быть линейными или разветвленными. Если полисахарид состоит из одинаковых мономеров, то их их называют гомополисахаридами, если из разных, то гетерополисахаридами. Также следует отметить, что большая часть полисахаридов содержит более тысячи мономерных остатков. Примерами служат крахмал и декстрины.
Моносахариды — углеводы, которые не могут быть гидролизованы до более простых форм. Их можно подразделить на триозы, тетрозы, пентозы, гексозы, гептозы и октозы в зависимости от числа содержащихся в их молекуле атомов углерода; их можно разделить также на альдозы и кетозы в зависимости от присутствия альдегидной или кетонной группы. Отсчет атомов углерода начинают либо от входящего в состав альдегидной группы (первый атом), либо от ближайшего к кетонной группе.
Стереоизомерия или D и L изоформы:
В многих органических молекулах есть атом углерода с которым связаны четыре различные группировки, и такую молекулу можно представить как молекулу метана, в виде тетраэдра, в верхушках которого располагаются группировки. Такой атом называется хиральным, в случае моносахаридов принадлежность к D или L форме определяется расположением гидроксильной (ОН) группировки, относительно хирального атома углерода. Если ОН-группа слева, то это L-форма, если справа, то D-форма. Но полностью этому правилу соответствует только глицероальдегид, имеющий только один хиральный атом (Рисунок 1 А). Во всех других углеводах хиральных атомов несколько, и каждый из них может быть признан для определения принадлежности к одной из форм стереоизомеров. Было принято решение признать атомом, определяющим стереоизомерию, последний хиральный атом молекулы (предпоследний атом углерода в молекуле). Но изменение положения гидроксильной группы только у данного атома углерода не приведет к образованию полностью зеркального отображения, что является основным условием для существования двух форм стереоизомеров. Поэтому появилось понятие ряда углеводов, то есть все углеводы могут быть выведены или синтезированы из минимального углевода (триозы), и, следовательно, эта триоза является предшественником или родительским соединением, так как единственная триоза, обладающая оптическими свойствами — глицероальдегид, то именно эта молекула является родительским соединением для всех остальных. Принадлежность к одному их стреоизомеров родительского соединения, определяет принадлежность к D или L-форме всех остальных моносахаридов, синтезируемых из данного родительского соединения (Рисунок 2). В ходе синтеза углеводов с числом атомов больше чем три (глицероальдегид), присоединение каждого следующего атома углерода
Рисунок 1. Структурные формулы стереоизомеров углеводов, * — отмечены асимметрические (хиральные) атомы. А — глицероальдегид * — отмечен асимметрический атом, определяющий принадлежность к D или L форме, Б — стереоизомеры глюкозы, крупной * отмечены асимметрические атомы углерода, определяющие принадлежность к стереоизомерам
происходит по альдегидной группе, и, следовательно, хиральный атом родительского соединения оказывается все дальше от первого атома углерода, то есть остается последним асимметричным или просто предпоследним атомом углерода (рисунок 2). Присутствие асимметрических атомов углерода является причиной оптической активности соединения. Если пучок плоскополяризованного света проходит через раствор оптического изомера, плоскость поляризации света поворачивается либо вправо (правовращающий изомер, +), либо влево (левовращающий изомер, — ). Соединение обозначают D ( — ), D (+), L ( — ) или L (+); это обозначение показывает наличие структурного родства с D — или L — глицеральдегидом, но не обязательно тот же знак оптического вращения. Например, природной формой фруктозы является D ( — ) — изомер. Если D — и L-изомеры присутствуют в равных количествах, их смесь не проявляет оптической активности — активности изомеров компенсируют одна другую. Такие смеси называют рацемическими (или DL-смесями). Соединения, получаемые синтетическим путем, оказываются рацемическими, поскольку в этом случае вероятности образования каждого из изомеров одинаковы.
Рисунок 2. Структура D-ряда углеводов
2. Пиранозные и фуранозные кольцевые структуры.
Альдегидные или кетонные группировки легко реагируют со спиртовыми, образуя полуацетальные или полукетальные группировки, чаще всего это происходит внутри молекулы, и, следовательно, происходит циклизация моносахарида, в результате образуется модифицированный гетероцикл, содержащий атом кислорода. Наиболее устойчивы пяти и шестичленные циклы. Пятичленные циклы углеводов сходны с молекулой фурана, поэтому это фуранозная форма, шестичленные с молекулой пирана — пиранозная форма (Рисунок 3). Все гидроксильные группы, расположенные справа оказываются под циклом, а те что слева — над циклом. Кольцевую структуру могут принимать и кетозы (например, D-фруктофураноза или D-фруктопираноза). В растворе глюкозы более 99% молекул находится в пиранозной форме и менее 1% — в фуранозной форме.
Рисунок 3. Пиранозные и фуранозные формы углеводов
3. α — и β-аномеры. При циклизации образуется гидроксильная группа при полуацетальной или полукетальной группировке, полуацетальный или полукетальный гидроксил, эта группа может располагаться под циклом, в результате образуется α-аномер, а может располагаться над циклом, тогда образуется β-аномер. Циклическая структура сохраняется и в растворе, но при этом происходит образование изомеров относительно положения альдегидного и кетонного атома углерода, что приводит к образованию смеси α — глюкопиранозы (36%) и β — глюкопиранозы (63%); оставшийся 1% представлен в основном α — и β — аномерами глюкофуранозы. Описанное выше установление равновесия сопровождается так называемой мутаротацией: полуацетальное кольцо раскрывается и вновь замыкается, при этом может изменяться положение групп — Н и — ОН при углероде 1. Предполагают, что в ходе этого процесса образуется промежуточная гидратированная линейная (ациклическая) молекула, хотя по данным полярографии на долю ациклической формы глюкозы приходится всего 0,0025%. В растворе глюкоза является правовращающей; этим объясняется еще одно ее название — декстроза (декстро — правый), часто употребляемое в клинической практике (Рисунок 4).
Рисунок 4. Структурные формулы аномеров глюкозы. α — и β-аномеры
4. Эпимеры. Изомеры, различающиеся по конфигурации положением групп — Н и — ОН при асимметричных атомах углерода, которые не связаны с принадлежностью к стереоизомерам, называются эпимерами. Биологически наиболее важными эпимерами глюкозы являются: манноза и галактоза, образующиеся путем эпимеризации при атомах углерода 2 и 4 соответственно (Рисунок 5).
Рисунок 5. Эпимеризация глюкозы
5. Альдо-кето-изомеризация. Фруктоза имеет ту же химическую формулу, что и глюкоза, но отличается по структурной формуле, поскольку фруктоза содержит потенциальную кетонную группу в положении 2, а глюкоза — потенциальную альдегидную группу в положении 1.
Шестичленные кольца из одинарных связей, в циклогексане и в сахарах, как правило, принимают конформацию «кресла», как это видно на примере глюкозы (Рисунок 6). Помимо этого, шестичленные кольца могут принимать менее устойчивую конформацию «лодки». Свободно переходят одна в другую через промежуточные скошенные конформации.
Пятичленные кольца образуют конформацию «конверта».
Рисунок 6. Конформация шестичленных колец
Физические свойства моносахаридов
Моносахариды гидрофильны, а, следовательно, легко растворимы в воде. Растворимость моносахаридов примерно одинакова, поэтому разделение моносахаридов достаточно сложно. Моносахариды не поглощают свет ни в видимой, ни в ультрафиолетовой части спектра. Из-за этого нельзя определять концентрацию моносахаридов спектрофотометрическими методами. Так как моносахариды находятся в природе либо в растворе, либо в кристаллах, в физиологических диапазонах температуры нет вопроса о температурах плавления и кипения.
Химические свойства моносахаридов
По своей структуре моносахариды содержат два типа функциональных групп: спиртовые и альдегидные (кетонные), соответственно моносахариды вступают в реакции по этим группам. Моносахариды вступают во многие химические реакции, весьма важные для практического использования и исследования углеводов. Реакции, обсуждаемые в данном разделе, демонстрируют либо наиболее важные свойства углеводов, либо типы реакций, часто встречающиеся в их метаболизме.
Образование эфиров. Это реакция спиртовых групп образуются либо эфиры неорганических кислот, либо органические эфиры (простые со спиртами или галогенидами или сложные с ангидридами кислот). Наиболее активной является полуацетальная спиртовая группа, соответственно она чаще вступает в реакции с образованием эфиров. Эфиры фосфорной и уксусной кислот занимают уникальное место в биохимии и встречаются во многих углеводах и их производных.
Алкилирование (Рисунок 7)
Рисунок 7. Алкилирование
При взаимодействии со спиртами в реакцию вступает только полуацетальная гидроксильная группа, так как спирты слабо активны, поэтому образуется эфир с полуацетальной гидроксильной группой. Галогениды более реакционно способны, поэтому образуют эфиры со всеми свободными группами моносахарида.
Ацилирование (Рисунок 8)
Рисунок 8. Ацилирование
В реакцию образования сложных эфиров вступают спиртовые и карбоксильные группы, но карбоновые кислоты мало реакционно способны поэтому не вступают в реакцию моносахаридами. В реакции ацилирования используют ангидриды карбоновых кислот, их высокая реакционная способность позволяет модифицировать все свободные гидроксильные группы.
Образование эфиров неорганических кислот (Рисунок 9)
Рисунок 9. Образование эфиров неорганических кислот
Неорганические кислоты бывают сильными и слабыми, это объясняет различия их взаимодействия с моносахаридами. Сильные кислоты, например серная, вступают в реакцию с полуацетальной гидроксильной группой, образуя эфир, слабые кислоты вступают в реакцию только после реакции ацилирования, но модифицируют только эфир образованный полуацетальной группой.
Дегидратация. В сильных минеральных кислотах высокой концентрации происходит дегидратация пентоз и гексоз (Рисунок 10). Образовавшиеся фурфурол и оксиметилфурфурол легко полимеризуются; при этом получается коричневая смола. Они также конденсируются с различными фенолами, образуя характерно окрашенные продукты; многие цветные реакции на углеводы основаны на этом свойстве.
Рисунок 10. Дегидратация
Перегруппировка в щелочной среде. В холодном разбавленном щелочном растворе глюкоза образует маннозу и фруктозу. Механизм реакции, возможно, включает енолизацию, которая сопровождается диссоциацией водорода от атома углерода, примыкающего к карбонильной группе. Так образуются эпимеры — глюкоза и манноза.
Окисление моносахаридов. Окисление моносахаридов, возможно, многими способами.
Рисунок 11. Мягкое окисление моносахаридов до альдоновых кислот
Более жесткое окисление до альдуроновых кислот, реакция происходит при участии «средних» окислителей, например небольшие концентрации азотной кислоты (Рисунок 12). Данная реакция происходит и в природе, но при других условиях. В результате окисляется гидроксильная группа при последнем атоме углерода.
Рисунок 12. Окисление до альдуроновых кислот
Жесткое окисление до альдаровых кислот, реакция происходит в жестких условиях, например при больших концентрациях сильных кислот, например, азотной. В результате происходит окисление обеих групп — альдегидной и последней спиртовой, в результате образуется дикарбоновая кислота, или альдаровая (Рисунок 13).
Рисунок 13. Окисление до альдаровых кислот
Восстановление моносахаридов. Восстановлению могут подвергаться как альдегидная, так и спиртовые группы
Восстановление альдегидной группы. D-Глюкоза и L-сорбоза восстанавливаются газообразным водородом в присутствии подходящего металлического катализатора, образуя сорбит (Рисунок 14).
Рисунок 14. Восстановление альдегидной группы
Восстановление спиртовой группы. В клетке происходит переход рибозы в дезоксирибозу (Рисунок 15). Эта реакция происходит в природе, но при несколько иных условиях. Это один из основных способов синтеза дезоксисахаров.
Рисунок 15. Восстановление спиртовой групы
Образование аминосахаров. В природе также происходит синтез аминосахаров, но механизм и атакуемые группы отличаются, в искуственной системе в реакцию вступает полуацетальная группировка как наиболее реакционно способная (Рисунок 16).
Рисунок 16. Образование аминосахаров
Укорочение цепи. Этот процесс связан с окислением в средних условиях. Карбоксильная группа в последнем положении нестабильна и легко отщепляется от молекулы, в результате углевод становится на один атом короче (Рисунок 17).
Рисунок 17. Укорочение цепи
Удлинение цепи. Это результат реакции с цианидом, затем происходит реакция с водой, в результате образуется кислота. Восстановление карбоксильной группы приводит к образованию моносахарида, но на один атом углерода длиннее (Рисунок 18).
Рисунок 18. Удлинение цепи
Гидролиз поли — и олигосахаридов. Реакция гидролиза это реакция расщепления полимера с участием молекулы воды. В случае гидролиза поли — и олигосахаридов атаке подвергается гликозидная связь. В результате реакции отщепляются мономерные остатки (моносахариды). Реакции гидролиза поли — и олигосахаридов с последующим анализом продуктов гидролиза используются для качественного и количественного определения состава полисахаридов.
Некоторые качественные реакции, которые используются для идентификации моносахаридов.
Реактив: α-нафтол (реакция Молиша), триптофан аминогуанин.
Более чувствительна для кетоз.
Реактив: резорцин (реакция Селиванова).
Кетогексозы, Кетопентозы, метилпентозы, диоксиацетон
Все углеводы, включая уроновые кислоты и дезоксипентозы
Характерное окрашивание со всеми углеводами.
Многие углеводы, включая полисахариды, чаще используется для гексоз.
Реактив: цистеин/H2SO4, антрон.
Неодинаковое окрашивание с различными углеводами.
Пентозы, гептулозы, уроновые кислоты
Окрашивание, обусловленное присутствием других углеводов, может быть ликвидировано независимыми методами, уроновые кислоты декарбоксилируются до пентоз и вступают в реакцию.
Аминосахара не дают окрашивания без предварительного дезаминирования нитритом.
Моно и дидезоксипентозы
Реактив: триптофан/HClO4, индол/HCl, лейкофуксин (реакция Фольгена).
Реактив: тиобарбитуровая кислота.
Функции моносахаридов очень разнообразны и зависят от того сколько атомов углерода содержит моносахарид.
Триозы — промежуточные продукты обмена углеводов и липидов.
Тетрозы — промежуточные продукты обмена углеводов могут входить в состав полисахаридов.
Пентозы — промежуточные продукты обмена углеводов могут входить в состав полисахаридов, и нуклеотидов.
Гексозы — глюкоза и фруктоза основные сахара энергетического обмена углеводов, входят в состав полисахаридов.
Гептозы — промежуточные продукты обмена углеводов.
Физиологически важные моносахариды
В какие молекулы или вещества входит: нуклеотиды, коферменты, РНК.
Биологическое значение: компонент нуклеиновых кислот коферментов (NAD, NADP, FAD), нуклеотидов, промежуточное соединение пентозофосфатного пути.
В какие молекулы или вещества входит: образуется в ходе метаболизма.
Биологическое значение: промежуточное соединение пентозофосфатного пути.
В какие молекулы или вещества входит: гуммиарабик, сливовая и вишневая мякоть.
Биологическое значение: компонент гликопротеинов.
В какие молекулы или вещества входит: древесная смола, протеогликаны, гликозаминогликаны.
Биологическое значение: компонент гликопротеинов.
В какие молекулы или вещества входит: ликсофлавин.
Биологическое значение: компонент ликсофлавина, выделяемого сердечной мышцей.
В какие молекулы или вещества входит: промежуточный продукт метаболизма уроновых кислот.
Биологическое значение: промежуточный продукт метаболизма уроновых кислот.
В какие молекулы или вещества входит: фруктовые соки, крахмал, сахароза, лактоза, мальтоза
Биологическое значение: сахар организма, участвует в энергетическом обмене, является предшественником других соединений.
В какие молекулы или вещества входит: мед, сахароза, лактоза, инулин.
Биологическое значение: превращается в глюкозу, и может использоваться в тех же метаболических путях.
В какие молекулы или вещества входит: лактоза, гликопротеины, гликолипиды.
Биологическое значение: превращается в глюкозу, и может использоваться в тех же метаболических путях.
Производные моносахаридов: эфиры моносахаридов, альдуроновые кислоты, аминосахара, дезоксисахара, гликозиды.
Все производные моносахаридов входят в состав полисахаридов. По мимо этой основной функции производные моносахаридов могут выполнять свои специфические функции.
Альдуроновые кислоты участвуют в образовании витамина С и в процессах детоксикации.
Дезоксисахара входят в состав нуклеотидов (мономеры ДНК).
Аминосахара входят в состав антибиотиков.
Рисунок 19. Структура некоторых гликозидов. А-стрептомицин, Б-уабаин
Гликозиды — это соединения, образующиеся путем конденсации моносахарида (или моносахаридного остатка в составе более сложного сахара) с гидроксильной группой другого соединения, которым может быть другой моносахарид или вещество неуглеводной природы (тогда его называют агликоном). Гликозидная связь образуется в результате реакции полуацетальной (полукетальной) группы моносахарида и спиртовой группой другого соединения, такая связь называется О-гликозидная. Также полуацетальная (полукетальная) гидроксильная группа может вступать в реакцию с аминогруппой другого соединения тогда образуется N-гликозидная связь. Если полуацетальная группа принадлежит глюкозе, образующееся соединение называют глюкозидом, если галактозе — галактозидом и т. д. Гликозиды найдены в составе многих лекарств и пряностей, они являются также компонентами животных тканей. Агликонами могут быть метанол, глицерол, какой-либо стерол или фенол. Гликозиды, имеющие важное медицинское значение, например, влияющие на работу сердца (сердечные гликозиды), содержат в качестве агликонового компонента стероиды; так, из наперстянки и строфанта выделен гликозид уабаин — ингибитор Na/K-ATP-aзы клеточных мембран. К числу гликозидов относится ряд антибиотиков, в частности стрептомицин (Рисунок 19). N-гликозидами являются нуклеотиды и нуклеозиды. Но простейшими гликозидами являются дисахариды. В случае дисахаридов агликоном является молекула другого моносахарида.
Дисахариды состоят из двух ковалентно связанных друг с другом моносахаридов. У дисахаридов химическая связь между моносахаридными единицами называется гликозидной связью; она образуется в результате взаимодействия гидроксильной группы одного из сахаров с аномерным атомом углерода второго сахара. Гликозидные связи легко гидролизуются кислотами, но устойчивы к действию оснований. Поэтому дисахариды можно гидролизовать и получить в свободном виде их моносахаридные компоненты путем кипячения в разбавленной кислоте.
По составу дисахариды подразделяют на гомодисахариды (состоят из одинаковых мономеров) и гетеродисахариды (в состав входят разные моносахариды).
Все дисахариды являются гликозидами. Называя дисахарид необходимо учитывать факт, что это гликозиды. Кроме того, при номенклатуре дисахаридов необходимо учитывать также химическую связь между моносахаридами. То есть указываются номера атомов углерода, спиртовые группы при которых участвуют в образовании гликозидной связи, а также аномер моносахарида, чей полуацетальный гидроксил образует гликозидную связь.
Практически все дисахариды выполняют транспортную функцию, так как они легко растворимы, и при этом менее функционально активны чем моносахариды.
Часть дисахаридов, например мальтоза являются промежуточными продуктами гидролиза полисахаридов.
Дисахариды можно подразделить на дисахариды растений и дисахариды животных.
Рисунок 20. Структурные формулы основных дисахаридов
Мальтоза гомодисахарид, содержащий два остатка α D-глюкозы, соединенных α (1—4) гликозидной связью, то есть связь между гидроксилом при 1 углероде и гидроксилом при 4 углероде, причем полуацетальный гидроксил в α форме (Рисунок 20). Оба остатка глюкозы в молекуле мальтозы находятся в пиранозной форме. Мальтоза относится к восстанавливающим сахарам, поскольку она содержит одну потенциально свободную альдегидную группу, которая может быть окислена. Второй остаток глюкозы в молекуле мальтозы может существовать как в α-, так и в β-форме; мальтоза образуется при действии на крахмал содержащегося в слюне фермента — амилазы. Под действием секретируемого слизистой кишечника фермента мальтазы, специфически гидролизующего α (1—4) — связь, мальтоза подвергается гидролизу с образованием двух молекул D-глюкозы.
Лактоза гетородисахарид, при гидролизе которой образуется D-галактоза и D-глюкоза, моносахариды соединены β (1—4) гликозидной связью, присутствует только в молоке (Рисунок 20). Наличие в молекуле лактозы потенциально свободной карбонильной группы (в остатке глюкозы) делает ее восстанавливающим дисахаридом. Лактоза является молочным сахаром, это единственный дисахарид, синтезируемый млекопитающими.
В процессе переваривания пищи лактоза подвергается ферментативному гидролизу в результате воздействия лактазы, секретируемой мукозными клетками кишечника. У грудных младенцев активность этого фермента очень высока, однако в кишечнике взрослых людей лактазная активность наблюдается лишь у жителей севера Европы и некоторых африканских племен. У большинства взрослых людей, в том числе у жителей Востока, арабов, евреев, многих африканцев, индийцев и жителей Средиземноморья, лактазная активность в кишечнике очень низка, что часто приводит к непереносимости (интолерантности) лактозы. Описанная особенность обусловлена генетически. Причина непереносимости лактозы связана с тем, что этот дисахарид может всасываться в кишечнике только после гидролиза на моносахаридные компоненты: при низкой лактазной активности неусвоенная лактоза накапливается в кишечнике; в результате после потребления молока у человека с непереносимостью лактозы возникает тяжелый понос и боли в животе.
Трегалоза состоит из двух молекул α D-глюкозы, соединенных 1—1 α гликозидной связью. Трегалоза входит в состав гемолимфы насекомых, также выделяется из некоторых грибов. Является нередуцирующим дисахаридом (Рисунок 20). Трегалоза является транспортной формой моносахаридов в кровеносной системе насекомых.
Сахароза — гетеродисахарид, состоящий из глюкозы и фруктозы, соединенных β (1—2) гликозидной связью (Рисунок 20). Сахароза является нередуцирующим сахаром. Сахарозу синтезируют многие растения, у высших же животных она отсутствует. В отличие от мальтозы и лактозы у сахарозы нет свободного аномерного атома углерода, поскольку оба аномерных атома моносахаридных остатков связаны друг с другом; поэтому сахароза не является восстанавливающим сахаром. Сахароза основной промежуточный продукт фотосинтеза. У многих растений именно в форме сахарозы транспортируются по сосудистой системе сахара из листьев к другим частям растения. Преимущество сахарозы перед глюкозой как транспортной формы сахаров заключается, вероятно, в том, что ее аномерные атомы углерода связаны друг с другом: это предохраняет сахарозу от атаки окислительных или гидролитических ферментов в процессе ее переноса из одной части растений в другую. Животные не могут усваивать сахарозу как таковую, однако она становится доступной для усвоения после воздействия фермента сахаразы (другое его название — инвертаза), локализованного в клетках, выстилающих тонкий кишечник. Этот фермент катализирует расщепление сахарозы на D-глюкозу и D-фруктозу, которые легко проникают в кровоток.
В природе большинство углеводов представлено в виде полисахаридов с высокой молекулярной массой. Биологическое значение ряда полисахаридов состоит в том, что одни обеспечивают накопление моносахаридов для энергетического обмена в нерастворимой, а значит осмотически неактивной форме, другие же служат структурными элементами клеточных стенок и соединительной ткани. При полном гидролизе под действием кислоты или специфических ферментов полисахариды расщепляются с образованием моносахаридов или их производных.
Полисахариды, называемые также гликанами, отличаются друг от друга как природой составляющих их моносахаридных остатков, так и длиной и степенью разветвленности цепей. Их можно разделить на два типа: гомополисахариды, состоящие из остатков одного и того же моносахарида, и гетерополисахариды, содержащие остатки двух или большего числа моносахаридов. Пример гомополисахарида резервный углевод крахмал, состоящий из остатков только D-глюкозы. Примером гетерополисахарида может служить содержащаяся в соединительной ткани гиалуроновая кислота, которая состоит из чередующихся остатков двух разных моносахаридов.
В отличие от белков полисахариды нельзя характеризовать строго определенной молекулярной массой: как правило, они представлены смесями высокомолекулярных соединений; в зависимости от метаболических потребностей клеток моносахаридные остатки могут ферментативно присоединяться к полисахаридам или же отщепляться от них. Также, как и дисахариды, полисахариды делятся на редуцирующие и нередуцирующие. По наличию свободной альдегидной группы, которая, окисляясь, восстанавливает ионы некоторых металлов.
По функции полисахариды делят на структурные и запасающие.
Запасающие полисахариды обеспечивают накопление моносахаридов, участвующих в энергетическом обмене в виде компактных нерастворимых структур (включений). Нерастворимость обеспечивает отсутствие влияния на осмотическое давление в клетке.
Структурные полисахариды служат внеклеточными опорными элементами в стенках клеток одноклеточных микроорганизмов, грибов и высших растений, а также входят в состав соединительной ткани позвоночных и экзоскелета членистоногих. Структурные полисахариды защищают клетки, ткани и органы, придают им форму и поддерживают ее. У различных организмов запасающие и структурные полисахариды различаются.
Запасающие полисахариды животных и грибов
Рисунок 21. Структура гликогена
Гликоген — полисахарид, в виде которого углеводы запасаются в организме животного. Его часто называют животным крахмалом. В наибольшем количестве гликоген содержится в печени, где на его долю приходится до 7% общего веса органа; гликоген имеется также в скелетных мышцах. В клетках печени гликоген присутствует в виде крупных гранул, состоящих в свою очередь из меньших гранул; последние образованы единичными сильно разветвленными молекулами гликогена со средней молекулярной массой в несколько миллионов. С этими же гранулами прочно связаны ферменты, ответственные за синтез и распад гликогена. Гликоген откладывается в виде гранул в цитоплазме клетки.
У грибов гликоген запасается в клетках гифов.
Гликоген — редуцирующий гомополисахарид, образованный остатками α-D-глюкопиранозы. Гликоген характеризуется более разветвленной структурой, чем амилопектин, линейные отрезки цепи включают 11—18 остатков α-D-глюкопиранозы [соединенных α (1—4) — гликозидными связями], в точках ветвления остатки соединены α (1—6) — гликозидными связями (Рисунок 21).
Запасающие полисахариды бактерий
Самый распространенный полисахарид бактерий — гликоген, чья структура была рассмотрена в предыдущем разделе. Но также встречаются и другие типы (Рисунок 22).
Рисунок 22. Структура запасающих полисахаридов бактерий