Что относится к неметаллам
Неметаллы
Общая характеристика неметаллов
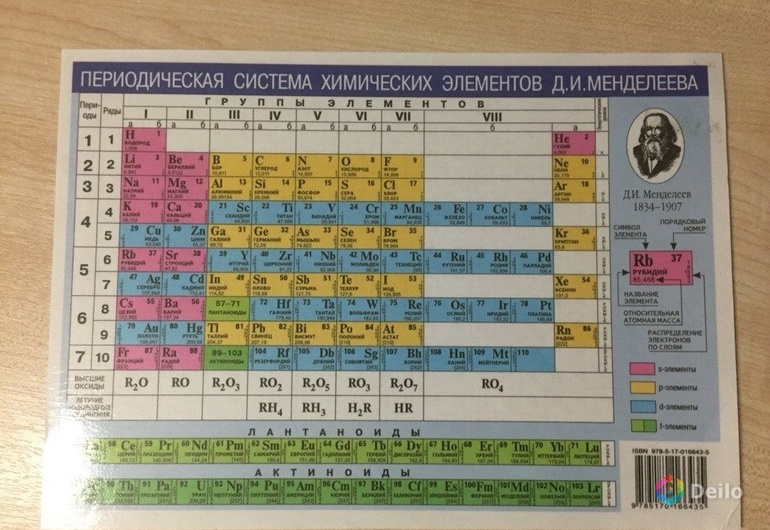
Неметаллы в периодической системе расположены справа от диагонали «бор – астат». Это элементы главных подгрупп III, IV, V, VI, VII, VIII групп. К неметаллам относятся: бор, углерод, кремний, азот, фосфор, мышьяк, кислород, сера, селен, теллур, водород, фтор, хлор, бром, йод, астат, а также благородные газы: гелий, неон, криптон, ксенон, радон.
Среди неметаллов два элемента – водород и гелий – относятся к s-семейству, все остальные принадлежат к р-семейству.
На внешнем электронном слое у атомов неметаллов находится различное число электронов: у атома водорода – один электрон (1s 1 ), у атомов гелия – два электрона (1s 2 ), у атома бора – три электрона (2s 2 2p 1 ). Однако атомы большинства неметаллов, в отличие от атомов металлов, на внешнем электронном слое имеют большое число электронов – от 4 до 8; их электронные конфигурации изменяются от ns 2 np 2 у атомов элементов главной подгруппы IV группы до ns 2 np 6 у атомов инертных газов.
Физические свойства
Элементы – неметаллы образуют простые вещества, которые при обычных условиях существуют в разных агрегатных состояниях:
Газы: гелий, неон, криптон, ксенон, радон, водород, кислород, азот, фтор, хлор.
Жидкость: бром
Твердые вещества: йод, углерод, кремний, фосфор, и др.
7 элементов-неметаллов образуют простые вещества, существующие в виде двухатомных молекул Э2 (H2, O2, N2, F2, Cl2, Br2, I2).

Кристаллические решетки металлов и твердых веществ-неметаллов отличаются между собой. Атомы металлов образуют плотно упакованную кристаллическую структуру, в которой между атомами существуют ковалентные связи. В кристаллической решетке неметаллов, как правило, нет свободных электронов. В связи с этим твердые вещества-неметаллы в отличие от металлов плохо проводят тепло и электрический ток, не обладают пластичностью.
Химические свойства
Неметаллы как окислители
В этой реакции сера – окислитель, а фосфор – восстановитель, так как ЭО фосфора меньше ЭО серы.
На разной окислительной активности основана способность одних неметаллов вытеснять другие из растворов их солей. Например, бром, как более сильный окислитель, вытесняет йод в свободном виде из раствора йодида калия:
Неметаллы как восстановители
Стоит отметить, что неметаллы (кроме фтора) могут проявлять и восстановительные свойства. При этом электроны атомов неметаллов смещаются к атомам элементов- окислителей. В образующихся соединениях атомы неметаллов имеют положительные степени окисления. Высшая положительная степень окисления неметалла обычно равна номеру группы.
— взаимодействие с кислотами-окислителями:
— взаимодействие с солями-окислителями:
Наиболее сильные восстановительные свойства имеют неметаллы углерод и водород:
Таким образом, практически все неметаллы могут выступать как в роли окислителей, так и в роли восстановителей. Это зависит от того, с каким веществом взаимодействует неметалл.
Реакции самоокисления – самовосстановления
Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления – самовосстановления (диспропорционирования). Например:
Скачать:
Скачать бесплатно реферат на тему: «Неметаллы» Неметаллы.docx (420 Загрузок)
Скачать рефераты по другим темам можно здесь
Характеристики и физические свойства
Хотя химических элементов-неметаллов всего 16, они являются настоящими кирпичиками жизни, из них состоят все органические соединения. Ученые выяснили, что земная кора на 76% состоит из кремния и кислорода, а водород является самым распространенным веществом во Вселенной, из него состоят все объекты космоса, а также наше светило.
В растительном и животном мирах неметаллы составляют больше 96% от общей массы и 96,7% от массы человека. Это органогенные элементы, формирующие молекулы белков, жиров, углеводов и нуклеиновых кислот. Безусловно, без этих простых веществ привычное существование было бы невозможным.
Основная масса металлов, кроме золота и меди, не обладает цветом, только металлическим блеском. Неметаллы ярко и разнообразно окрашены:
Значительное влияние на физические свойства неметаллов оказывают их молекулярное строение и вид кристаллической решетки. Кремний, как и алмаз с атомным кристаллическим строением решетки, обладает большой прочностью и высокой температурой плавления и кипения. Соединения с молекулярной решеткой (йод, сера и фосфор) начинают плавиться и кипеть при довольно низких температурах.
Простые вещества-неметаллы можно разделить на три вида агрегатных состояний: газы, жидкости и твердые вещества. Однако эта классификация будет верной только при стандартных параметрах окружающей среды, при крайне низких или высоких температурах состояние веществ может меняться.
Самую большую группу составляют газообразные неметаллы: кислород, азот, водород, белый фосфор, озон. Они обладают высокой сжимаемостью и расширяемостью, легко смешиваются между собой и заполняют весь объем сосуда. Кислород является сильным окислителем, необходимым для развития жизни на планете, а легко воспламеняющийся белый фосфор быстро образует активные токсичные соединения, поэтому смертельно опасен.
К жидким неметаллам можно отнести только бром — тяжелую темно-бурую вязкую жидкость, обладающую резким и неприятным запахом. Несмотря на то что в природе бром является смертельным ядом, даже его пары вызывают сильное раздражение слизистой и кожных покровов, он присутствует в организме человека, предохраняя от гормональных сбоев.
К твердым веществам относят бор, красный и черный фосфор, мышьяк, кремний, серу, йод и все стабильные аллотропные модификации углерода. В обычном состоянии они являются веществами с прочной атомной кристаллической решеткой, обладают высокой твердостью, но при этом хрупкие, легко слоятся и ломаются.
Интересным примером разных свойств одного и того же неметалла станет сравнение двух разновидностей углерода — алмаза и графита. Утверждение о твердости алмаза имеет научное обоснование — расположение атомов в кристаллической решетке этих веществ настолько различно, что алмаз разрушить практически невозможно, а графит легко ломается и крошится.
Место в периодической системе
Элементы, расположенные возле воображаемой диагонали, обладают двойственным характером и считаются полуметаллами (металлоидами). Список неметаллов в таблице Менделеева зависит от их положения в системе и количества электронов на внешнем слое:
Отдельно находятся водород и гелий, расположенные в левом и правом верхнем углу таблицы. Это объясняется уникальностью атома водорода, имеющего всего 1 электрон на внешнем слое. Причем водород может одинаково хорошо проявлять свойства как восстановителя, отдавая его, так и окислителя, принимая дополнительный электрон.
Химические особенности
Для большинства элементов этой группы характерна способность вступать в быстрые окислительно-восстановительные реакции, это обеспечивают особенности строения атомов неметаллов. Их атомы содержат большое количество электронов (4−8) на внешнем электронном уровне и способны принимать дополнительные для его устойчивой конфигурации. Благодаря этому образуются отрицательно заряженные ионы, увеличивающие заряд ядра, атом сжимается, а его радиус уменьшается.
Эти процессы ослабляют восстановительные свойства неметаллов, а окислительная способность и электроотрицательность увеличиваются. Некоторые, например, бром, являются окислителем для большинства металлов, но при этом выступают восстановителем для более сильных неметаллов.
Проявляемые химические свойства неметаллов, их активность, возможные степени окисления и характер получаемых соединений могут варьироваться в зависимости от их места в периодической системе и текущего агрегатного состояния.
Взаимодействие с другими веществами
Каждый неметалл обладает специфическими свойствами, характерными только для него, которые подробно рассматриваются при изучении неорганической химии. Общими свойствами является способность реагировать с металлами, водородом и кислородом.
При взаимодействии с металлами большинство неметаллов выступают окислителями и в образующихся бинарных соединениях проявляют отрицательную степень окисления:
Неметаллы могут вступать в реакции между собой, при этом более электроотрицательный элемент будет играть роль окислителя, а менее отрицательный станет восстановителем.
Получение и применение
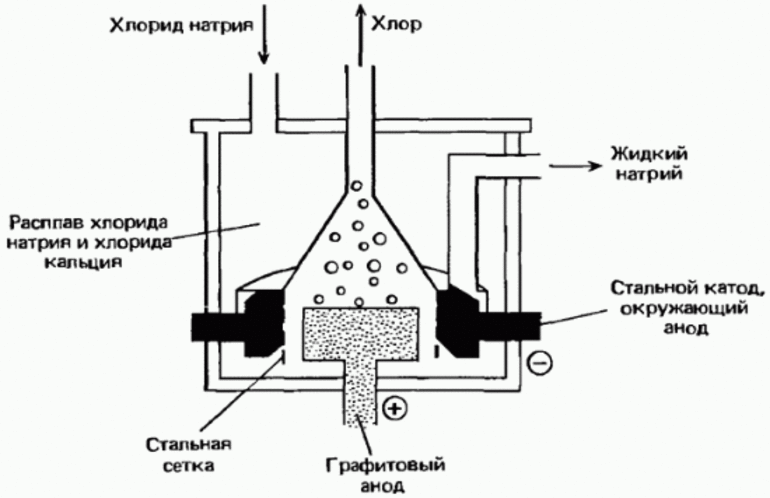
Некоторые элементы встречаются в природе в свободном виде, поэтому их можно выделить из смесей или очистить физическим методом. Фтор, хлор, бром и йод встречаются только в виде соединений, поэтому нужные вещества получают методом химических реакций:
В земных условиях водород встречается только в связанном состоянии в виде водородных соединений, поэтому для его выделения используют различные химические методы, в основном паровую конверсию метана или природного газа.
Учитывая разнообразные свойства неметаллов, они находят применение в большинстве отраслей нашей жизни: медицине, пиротехнике, сельском хозяйстве, пищевой промышленности и для подготовки высоких температур. Для дезинфекции воды используют хлор и озон, медицина невозможна без йода и активированного угля (углерод), жидкий азот применяют в косметологии, а сера помогает бороться с болезнями растений.
Химия
Лучшие условия по продуктам Тинькофф по этой ссылке
Дарим 500 ₽ на баланс сим-карты и 1000 ₽ при сохранении номера
. 500 руб. на счет при заказе сим-карты по этой ссылке
Лучшие условия по продуктам
ТИНЬКОФФ по данной ссылке
План урока:
Физические свойства металлов
Металлы – химические элементы, атомы которых в процессе реакции стремятся отдавать электроны. Они обладают металлической кристаллической решеткой и общими физическими свойствами. На данный момент известно более 87 металлов.
Для металлов характерен ряд свойств:
Металлы при ударах не разрушаются, а меняют форму. С этой особенностью связано то, что из них производят проволоку, металлические листы и др. Развитие бронзового и железного века связано с производством товаров из металлов.
Физические свойства неметаллов
Неметаллы – химические элементы, атомы которых стремятся принять чужие электроны. Для них характерны атомные и молекулярные кристаллические решетки. Для атомов неметаллов не характерны общие физические свойства. На данный момент существует 22 неметалла.
Для неметаллов характерен ряд свойств:
Расположение металлов и неметаллов в периодической таблице Д.И. Менделеева
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы Менделеева. Металлы располагаются ниже диагонали «водород-бор- кремний-мышьяк-теллур-астат», а неметаллы выше.
Красные ячейки – неметаллы, синие – металлы
Элементы, расположенные вблизи диагонали, обладают смешанными свойствами: проявляют как металлические, так и неметаллические свойства. Они называются полуметаллами.
Красные ячейки – полуметаллы
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной ковалентной связи, либо они не удерживаются достаточно прочно из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Закономерности в таблице Д.И. Менделеева
Каждый атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре, который несет положительный заряд. Вокруг ядра движутся отрицательно заряженные электроны. Атомный номер указывает на количество протонов.
Чем больше заряд ядра, тем сильнее к нему притягиваются электроны. Т.о., атому сложнее отдавать электроны. Поэтому в периоде слева направо, с увеличением порядкового номера металлические свойства ослабевают, а неметаллические – усиливаются.
Неметаллы стремятся принять электроны от других атомов. Период в таблице указывает на количество электронных уровней. По мере увеличения числа орбиталей электроны отдаляются от ядра и атому сложнее удерживать электроны на последних уровнях. Т.о., в группе сверху вниз количество орбиталей возрастает, поэтому металлические свойства усиливаются, а неметаллические – уменьшаются.
Способы получения металлов
Большую часть металлов получают из оксидов при нагревании.
Металлы, имеющие на внешнем уровне один-два электрона, получают с помощью электролиза расплавов.
Химические свойства металлов
Все металлы проявляют восстановительные свойства. Легкость в отдачи внешнего электрона применяется в фотоэлементах. Степень активности определяется рядом активности. У самых активных на внешнем уровне располагается по одному электрону.
Общие химические свойства металлов выражаются в реакциях со следующими соединениями.
Активные металлы реагируют с галогенами и кислородом. С азотом взаимодействуют только литий, кальций и магний. Большинство металлов при взаимодействии с кислородом образуют оксиды, а наиболее активные металлы – пероксиды (N2O2).
2 Ca + MnO2 → 2 CaO + Mn(нагревание)
Водород в кислотах вытесняют только те металлы, которые в ряду напряжений стоят до водорода.
Более активные металлы вытесняют из соединений менее активные.
2 Na + 2 H2O → 2 NaOH + H2
Способы получения неметаллов
Неметаллы синтезируют из природных соединений с помощью электролиза.
Также неметаллы получают в результате окислительно-восстановительных реакций.
SiO2 + 2 Mg → 2 MgO + Si
Химические свойства неметаллов
Неметаллы проявляют окислительные свойства. Самый активный неметалл – фтор. Он бурно реагирует со всеми веществами, а некоторые реакции сопровождаются горением и взрывом. В атмосфере фтора горят даже вода и платина. Фтор окисляет кислород и образует фторид кислорода OF2.
Неметаллы вступают в реакции со следующими веществами.
3 F + 2 Al → 2 AlF3 (нагревание)
S + Fe →FeS (нагревание)
Меньшей активностью обладают такие неметаллы как бор, графит, алмаз. Они могут проявлять восстановительные свойства.
2 C + MnO2 → Mn + 2 CO
Коррозия металла
Коррозия – это процесс разрушения металлов или металлических конструкций под действием кислорода, воды и вредных примесей. Не все металлы подвергаются коррозии. Их стойкость зависит от ряда факторов.
Различают несколько видов коррозии – химическую и электрохимическую.
Химическая коррозия
Химическая коррозия сопровождается химическими реакциями. Она образуется под действием газов.
Электрохимическая коррозия
Электрохимическая коррозия – процесс разрушения металлов или металлических конструкций, который сопровождается электрохимическими реакциями. В большинстве металлов находятся примеси. В процессе коррозии электродами могут служить не только металлы, но и его примеси.
Например, в железе могут находиться примеси олова. В этом случае на аноде электроны переносятся от олова к железу и металлы растворяются, т.е. железо подвергаются коррозии. На катоде восстанавливается водород из воды или растворенного кислорода. Электрохимическая коррозия может сопровождаться следующими процессами.
Способы защиты от коррозии
В промышленности популярны различные методы защиты металлов от коррозии.
Покрытия защищают поверхности от действия окислителей. Ими служат различные вещества:
Физические свойства сплавов и чистых металлов отличаются. Поэтому для повышения стойкости в сплав необходимо добавить дополнительные металлы.
Биологическая роль металлов и неметаллов
В организмах содержится множество различных металлов и неметаллов. Различных химических элементов в организме может не хватать, поэтому приходится потреблять их извне.Химические элементы можно разделить на две большие группы – макроэлементы и микроэлементы.
К макроэлементам относятся вещества, содержание которых в организме превышает 0,005 %. Эта группа включает водород, углерод, кислород, азот, натрий, магний, фосфор, сера, хлор, калий, кальций.Микроэлементы – элементы, содержание которых не превышает 0,005%. К ним относятся железо, медь, селен, йод, хром, цинк, фтор, марганец, кобальт, молибден, кремний, бром, ванадий, бор. Каждый макро- и микроэлемент в организме выполняет определенную функцию.
Применение металлов и неметаллов
В синтезе химических препаратов и лекарств применяются чистые металлы и неметаллы. В органической химии металлы используются в качестве катализаторов, а также при получении металлорганических соединений. Неметаллы служат исходным сырьем для получения чистых кислот и других химических соединений.
НЕМЕТАЛЛЫ
Смотреть что такое «НЕМЕТАЛЛЫ» в других словарях:
НЕМЕТАЛЛЫ — НЕМЕТАЛЛЫ, химические элементы, которые не обладают свойствами, характерными для металлов. Неметаллы как правило плохие проводники тепла и электричества (они обычно являются изоляторами тепла и электричества). К неметаллам относятся углерод,… … Научно-технический энциклопедический словарь
НЕМЕТАЛЛЫ — химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов. К неметаллам обычно относят 22 элемента: газы водород, азот, кислород, фтор, хлор и благородные газы; жидкость бром; твердые тела бор,… … Большой Энциклопедический словарь
НЕМЕТАЛЛЫ — хим. элементы, которые образуют в свободном состоянии простые вещества, не обладающие физ. и хим. свойствами (см.); устаревшее название металлоиды. К Н. принято относить 22 элемента Периодической системы элементов Д. И. Менделеева (см.): водород … Большая политехническая энциклопедия
Неметаллы — Неметаллы химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее: Группа III IV V VI VII VIII 2 й период … Википедия
неметаллы — химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов. К неметаллам обычно относят 22 элемента: газы водород, азот, кислород, фтор, хлор и благородные газы; жидкость бром; твёрдые тела бор,… … Энциклопедический словарь
Неметаллы — [nonmetals, metalloids] химические элементы, которые образуют простые тела, не обладающие характерными для металлов свойствами. К неметаллам относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии Н, N, О, F, Cl … Энциклопедический словарь по металлургии
Неметаллы — химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов (См. Металлы). Название Металлоиды, которое иногда применяют для Н., выходит из употребления. К Н. относятся 22 элемента. Из них при… … Большая советская энциклопедия
НЕМЕТАЛЛЫ — простые в ва, не обладающие св вами металлов. Хотя резкой границы между металлами и Н. провести нельзя, к Н. принято относить благородные газы, водород, галогены, кислород, халькогены, азот, фосфор, мышьяк, углерод, кремний и бор … Большой энциклопедический политехнический словарь
НЕМЕТАЛЛЫ — простые вещества, не обладающие свойствами металлов: они не имеют металлического блеска, нековки, плохо проводят теплоту и электричество. Резкой границы между неметаллами и металлами нет. К неметаллам относятся 22 элемента. Из них при нормальной… … Металлургический словарь
Неорганическая химия — Неорганическая химия раздел химии, связанный с изучением строения, реакционной способности и свойств всех химических элементов и их неорганических соединений. Это область охватывает все химические соединения, за исключением органических… … Википедия
неметаллы
Смотреть что такое «неметаллы» в других словарях:
НЕМЕТАЛЛЫ — НЕМЕТАЛЛЫ, химические элементы, которые не обладают свойствами, характерными для металлов. Неметаллы как правило плохие проводники тепла и электричества (они обычно являются изоляторами тепла и электричества). К неметаллам относятся углерод,… … Научно-технический энциклопедический словарь
НЕМЕТАЛЛЫ — химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов. К неметаллам обычно относят 22 элемента: газы водород, азот, кислород, фтор, хлор и благородные газы; жидкость бром; твердые тела бор,… … Большой Энциклопедический словарь
НЕМЕТАЛЛЫ — хим. элементы, которые образуют в свободном состоянии простые вещества, не обладающие физ. и хим. свойствами (см.); устаревшее название металлоиды. К Н. принято относить 22 элемента Периодической системы элементов Д. И. Менделеева (см.): водород … Большая политехническая энциклопедия
Неметаллы — Неметаллы химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее: Группа III IV V VI VII VIII 2 й период … Википедия
Неметаллы — [nonmetals, metalloids] химические элементы, которые образуют простые тела, не обладающие характерными для металлов свойствами. К неметаллам относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии Н, N, О, F, Cl … Энциклопедический словарь по металлургии
Неметаллы — химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов (См. Металлы). Название Металлоиды, которое иногда применяют для Н., выходит из употребления. К Н. относятся 22 элемента. Из них при… … Большая советская энциклопедия
НЕМЕТАЛЛЫ — простые в ва, не обладающие св вами металлов. Хотя резкой границы между металлами и Н. провести нельзя, к Н. принято относить благородные газы, водород, галогены, кислород, халькогены, азот, фосфор, мышьяк, углерод, кремний и бор … Большой энциклопедический политехнический словарь
НЕМЕТАЛЛЫ — хим. элементы, к рые образуют простые тела, не обладающие свойствами, характерными для металлов. К Н. обычно относят 22 элемента: газы водород, азот, кислород, фтор, хлор и благородные газы; жидкость бром; тв. тела бор, углерод, кремний, фосфор,… … Естествознание. Энциклопедический словарь
НЕМЕТАЛЛЫ — простые вещества, не обладающие свойствами металлов: они не имеют металлического блеска, нековки, плохо проводят теплоту и электричество. Резкой границы между неметаллами и металлами нет. К неметаллам относятся 22 элемента. Из них при нормальной… … Металлургический словарь
Неорганическая химия — Неорганическая химия раздел химии, связанный с изучением строения, реакционной способности и свойств всех химических элементов и их неорганических соединений. Это область охватывает все химические соединения, за исключением органических… … Википедия