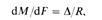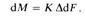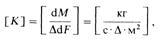Что относится к массообменным процессам
МАССООБМЕННЫЕ ПРОЦЕССЫ И АППАРАТЫ
Процессами массообмена называют такие процессы, в которых основную роль играет перенос вещества из одной фазы в другую. Движущей силой этих процессов является разность химических потенциалов (см. гл. 2). Как и в любых других процессах, движущая сила массообмена характеризует степень отклонения системы от состояния динамического равновесия. В пределах данной фазы вещество переносится от точки с большей к точке с меньшей концентрацией. Поэтому обычно в инженерных расчетах приближенно движущую силу выражают через разность концентраций, что значительно упрощает расчеты массообменных процессов.
Массообменные процессы широко используются в промышленности для решения задач разделения жидких и газовых гомогенных смесей, их концентрирования, а также для защиты окружающей природной среды (прежде всего для очистки сточных вод и отходящих газов). Например, практически в каждом химическом производстве взаимодействие обрабатываемых веществ осуществляется в реакторе, в котором обычно происходит только частичное превращение этих веществ в продукты реакции. Поэтому выходящую из реактора смесь продуктов реакции и непрореагировавшего сырья необходимо подвергнуть разделению, для чего эту смесь направляют в массообменную аппаратуру, из которой непрореагировавшее сырье возвращается в реактор, а продукты реакции направляются на дальнейшую переработку или использование.
Наибольшее распространение получили рассмотренные ниже массообменные процессы.
1. Абсорбция- избирательное поглощение газов или паров жидким поглотителем. Этот процесс представляет собой переход вещества из газовой (или паровой) фазы в жидкую. Наиболее широко используется для разделения технологических газов и очистки газовых выбросов.
Процесс, обратный абсорбции, т. е. выделение растворенного газа из жидкости, называют Десорбцией.
3. Экстракция (жидкостная)- извлечение растворенного в одной жидкости вещества другой жидкостью, практически не смешивающейся или частично смешивающейся с первой. Этот процесс представляет собой Переход извлекаемого вещества из одной жидкой /)азы в другую. Процесс применяют для извлечения растворенного вещества или группы веществ сравнительно невысоких концентраций.
4. АДсорбция- избирательное поглощение газов, паров или растворенных в жидкости веществ твердым поглотителем, способным поглощать одно или несколько веществ из смеси. Этот процесс представляет собой Переход веществ из газовой, паровой или жидкой 1шзы в твердую. Адсорбцию применяют для извлечения того или иного вещества (или веществ) достаточно низкой концентрации из six смеси. Процесс, обратный адсорбции, т. е. выделение сорби-рованного вещества из твердого поглотителя, называют Десорбцией.
5. Ионный обмен- избирательное извлечение ионов из растворов электролитов. Этот процесс представляет собой Переход извлекаемого вещества из жидкой фазы в твердую. Процесс применяют для извлечения веществ из растворов, в которых эти вещества находятся при низких концентрациях.
7. Растворение и экстрагирование из твердых тел-это процессы перехода твердой фазы в жидкую (растворитель). Извлечение на основе избирательной растворимости какого-либо вещества (или веществ) из твердого пористого материала называют Экстракцией из твердого материала, или выщелачиванием. Применяют ее для извлечения ценных или токсичных компонентов из твердых материалов.
8. Кристаллизация-выделение твердой фазы в виде кристаллов из растворов или расплавов. Этот процесс представляет собой Переход вещества из жидкой фазы в твердую. Применяется, в частности, для получения веществ повышенной чистоты.
9. Мембранные процессы- избирательное извлечение компонен- ов смеси или их концентрирование с помощью полупроницаемой перегородки-мембраны. Эти процессы представляют собой Пере-од вещества (или веществ) из одной фазы в другую через разделяющую их мембрану. Применяются для разделения газовых и жидких смесей, очистки сточных вод и газовых выбросов.
Таким образом, во всех перечисленных выше процессах общим является переход вещества (или веществ) из одной фазы в другую. Процесс перехода вещества (или нескольких веществ) из одной фазы ^ другую в направлении достижения равновесия называют массопе-редачей. В отличие от теплопередачи, которая происходит обычно через стенку, массопередача осуществляется, как правило, при непосредственном соприкосновении фаз (за исключением мембранных процессов). При этом граница соприкосновения-т. е. поверхность контакта фаз-может быть подвижной (система газ-жидкость, пар-жидкость, жидкость-жидкость) или неподвижной (газ-твердое тело, пар-твердое тело, жидкость-твердое тело).
Процессы массопередачи обычно обратимы. Причем направление перехода вещества определяется концентрациями вещества в фазах и условиями равновесия.
Процесс перехода вещества из одной фазы в другую в изолированной замкнутой системе, состоящей из двух или большего числа фаз, возникает самопроизвольно и протекает до тех пор, пока между фазами при данных условиях температуры и давления не установится подвижное фазовое равновесие. При этом в единицу времени из первой фазы во вторую переходит столько же молекул, сколько в первую из второй. Если теперь количество распределяемого вещества увеличить (например, в фазе Фу) на П молекул, то распределяемое вещество будет переходить из фазы Фу в фазу Ф^. Причем скорость перехода будет определяться не общим числом молекул (тА-п) вещества М, находящегося в фазе Фу, а числом молекул, избыточным по отношению к равновесному (т). Так как концентрация пропорциональна числу молекул, то скорость перехода распределяемого вещества из одной фазы в другую пропорциональна разности между фактической (или рабочей) концентрацией распределяемого вещества в данной фазе (т+п) и равновесной (w). А это означает, что чем больше такая разница, тем больше (при всех прочих равных условиях) перейдет вещества М из одной фазы в другую. Если эта разница отрицательна, то вещество М переходит из фазы Ф^ в фазу Фу (т. е. процесс пойдет в обратном направлении).
В неподвижной среде распределяемое вещество переходит из внутренних слоев данной (первой) фазы к поверхности раздела фаз и, пройдя ее, распределяется по всему объему другой фазы, находящейся в контакте с первой. Такой переход массы вещества из одной фазы в другую называют Молекулярной диффузией. Она является следствием теплового движения молекул (ионов, атомов), которому оказывают сопротивление силы внутреннего трения.
Конвективный перенос (конвективная диффузия) характеризуется перемещением (переносом) вещества движущимися частицами по-ока в условиях турбулентного движения фаз. Конвективный перенос вещества под действием турбулентных пульсаций иногда называют Турбулентной диффузией.
Основным кинетическим уравнением массообменных процессов является уравнение массопередачи, которое основано на общих кинетических закономерностях химико-технологических процессов.
1 i, c dM-количество вещества, перешедшего из одной фазы в другую в единицу времени; dF поверхность контакта фаз.
Обозначив /R = К, получим
В последнем выражении, называемом Основным уравнением массопередачи, величина К характеризует скорость процесса переноса вещества из одной фазы в другую. По аналогии с процессом теплопередачи коэффициент К называют Коэффициентом массо-чсредачи.
Найдем размерность коэффициента массопередачи:
I. e. Коэффициент массопередачи К показывает, какое количество /•^определяемого вещества переходит из фазы в фазу в единицу времени через единицу поверхности контакта фаз при движущей
Массообменные процессы



Они сопровождаются переходом одного или нескольких веществ из одной фазы в другую. Скорость массопередачи при заданной температуре зависит от интенсивности молекулярной диффузии, т.е. способности самопроизвольного проникновения одного вещества в другое за счет беспорядочного движения молекул. Процесс переноса массы из одной фазы в другую происходит за счет разности концентраций вещества в этих фазах до тех пор, пока не будет достигнуты условия равновесия. Движущая сила процесса массопередачи определяется разностью концентраций фаз (выражается через разницу между рабочими и равновесными концентрациями распределяемого компонента в первой и второй фазах соответственно). Количество массы, передаваемое из одной фазы в другую, зависит от поверхности раздела фаз, продолжительности процесса и разности концентраций.
Основными разновидностями массообменных процессов являются: абсорбция, адсорбция, перегонка, ректификация, кристаллизация, сушка и экстракция.
А б с о р б ц и е й называют процесс поглощения газа или пара жидким поглотителем. Обратный процесс – выделения из жидкостей растворенного газа – называют десорбцией. Абсорбция характеризуется избирательностью (селективностью), т.е. каждое вещество поглощается определенным поглотителем. Различают абсорбцию простую, основанную на физическом поглощении компонента жидким поглотителем, и хемосорбцию, которая сопровождается химической реакцией между извлекаемым компонентом и жидким поглотителем. Примером простой абсорбции служит производство газировки или соляной кислоты, хемосорбция широко применяется в производстве серной и азотной кислот, азотных удобрений и т.д. Аппараты, в которых идут данные процессы, называют абсорберами.
Для поглощения летучих растворителей и паров органических веществ чаще всего используют активированный уголь (противогазы), для сушки газов – силикагели и цеолиты, для очистки воды от растворенных солей – иониты. Адсорберы работают как фильтры (обычно с неподвижным слоем адсорбента). Все они периодического действия: после насыщения адсорбент должен быть восстановлен (регенерирован) обратным процессом – десорбцией. Последняя протекает при нагреве адсорбента острым паром, который отгоняет поглощенные вещества. Затем адсорбент сушат, охлаждают и используют снова.
Перегонка и ректификацияоснованы на различных температурах кипения фракций, составляющих жидкость. Существуют два принципиально отличных вида перегонки: простая (однократная) перегонка и ректификация.
Простая перегонка – это однократный процесс частичного испарения низкокипящей фракции с последующей конденсацией образовавшихся паров, а ректификация – это процесс многократного (или непрерывного) испарения и конденсации паров исходной смеси. В результате ректификации получают более чистые конечные продукты. Жидкость, полученная в результате этого, называют дистиллятом, или ректификатом. Процессы перегонки и ректификации находят широкое применение в химической и спиртовой промышленности, в производстве лекарственных препаратов, в нефтеперерабатывающей промышленности и т.д.
Кристаллизациейназывается выделение твердой фазы в виде кристаллов из растворов или расплавов. Кристаллизация начинается с образования центров (или зародышей) кристаллизации. Скорость их образования зависит от температуры, скорости перемешивания и т.д. С повышением температуры скорость роста кристаллов увеличивается, однако это приводит к образованию более мелких кристаллов и часто вызывает снижение движущей силы процесса. Крупные кристаллы легче получить при медленном их росте без перемешивания и небольших степенях пересыщения растворов, однако это снижает производительность процесса кристаллизации. Нахождение оптимальной скорости кристаллизации и составляет одну из основных задач этого процесса.
Широко применяются несколько способов кристаллизации: кристаллизация с охлаждением, кристаллизация с удалением части растворителя, а также вакуум-кристаллизация. В зависимости от способа кристаллизации применяют кристаллизаторы периодического и непрерывного действия.
Кристаллизация лежит в основе металлургических и литейных процессов, получения покрытий, пленок, применяемых в микроэлектронике, а также используется в химической, фармацевтической, пищевой и других отраслях промышленности. Кристаллизация является завершающей стадией в производстве минеральных солей, удобрений, органических и особо чистых веществ. Особое значение в промышленности имеет процесс кристаллизации металлов из расплавов.
Экстракция –это процесс избирательного поглощения жидкостью или паром ценных компонентов, содержащихся в исходном твердом сырье. (Пример – заварка чая, кофе и д.р.)
Сушкойназывают процесс удаления влаги из различных (твердых, жидких и газообразных) материалов. Влага может быть удалена испарением, сублимацией, вымораживанием, токами высокой частоты, адсорбцией и т.д. Однако наиболее распространена сушка испарением за счет подвода теплоты. Более экономичным является последовательное удаление влаги фильтрацией, центрифугированием ( с содержанием остаточной влаги 10…40 %), а затем тепловой сушкой. По способу подвода тепла к материалу различают: конвективную, контактную, радиационную, диэлектрическую (СВЧ) и другие.
Аппараты для этого процесса – сушилки – различаются по используемому теплоносителю (воздух, топочные газы, пар, электронагрев), организации (периодического и непрерывного действия), направлению движения потоков материала и теплоносителя (прямоточные и противоточные), состоянию слоя материалов (неподвижный, пересыпаемый, кипящий и т.д.).
В конвективных сушилках – поток теплого (горючего) воздуха движется на высушиваемый материал, который может находится в движении (противоток), либо в подвешенном состоянии и т.д.
В контактных сушилках теплота передается через греющую поверхность, с одной стороны которой находится нагреваемый материал, с другой – теплоноситель. Они предназначены для пастообразных и жидких продуктов, загрязнение которых недопустимо (пищевая и формацептическая промышленность).
В радиоционных сушилках теплота передается излучением керамических плит. Их применяют для сушки тонколистовых материалов и лакокрасочных покрытий. Остальные виды сушилок (вакуумная, криогенная, ультразвуковая, СВЧ) более дорогие и применяются реже.
Классификация массообменных процессов
ТЕМА 4. МАССООБМЕННЫЕ ПРОЦЕССЫ.
Содержание учебных материалов темы №4:
1. Аннотация к лекционным темам
2. План лекции с указанием временных затрат
3. Перечень основных источников
4. Перечень дополнительных источников
5. Учебное пособие (тексты лекции по темам)
6. Контрольные вопросы для самопроверки
7. Тестовые задания
8. Основные понятия по теме
Аннотация лекции
Основы массопередачи. Общие сведения. Движущая сила массообменных процессов. Перегонка и ректификация. Общие сведения. Теоретические основы процессов. Простая перегонка. Ректификация. Схема ректификационных установок. Абсорбция. Общие сведения. Принципиальные схемы абсорбции. Конструкции абсорберов. Адсорбция. Общие сведения. Характеристика и области применения адсорбентов. Адсорберы и схемы адсорбционных установок. Кристаллизация. Общие сведения. Методы кристаллизации. Устройство кристаллизаторов. Экстракция в системе твердое тело-жидкость. Общие сведения. Устройство экстрационных аппаратов. Экстракция в системе жидкость-жидкость. Общие сведения. Конструкции экстракторов.
Целью лекции является изучение теоретических основ массообменных процессов, их применение в пищевой промышленности. Осуществление поставленной цели обусловило необходимость решения следующих задач:
1) Рассмотреть классификацию массообменных процессов.
2) Ознакомиться с процессом перегонки и ректификации.
3) Ознакомиться с процессом абсорбции.
4) Ознакомиться с процессом адсорбции.
5) Ознакомиться с процессом кристаллизации.
6) Ознакомиться с процессом экстракции.
В результате изучения темы студент должен знать:
— классификацию массообменных процессов;
— определения процессов перегонки и ректификации, их практическое применение;
— схему ректификационной установки;
— определение процесса абсорбции, практическое применение;
— принципиальную схему абсорбции, конструкцию абсорбера;
— характеристику и область применения адсорбентов;
— конструкцию адсорберов и схему адсорбционной установки;
— определения процессов кристаллизации и экстракции, их практическое применение;
— устройство экстракционных аппаратов.
Студент должен уметь:
— составлять уравнения материального и теплового балансов процесса ректификации;
— определить рабочее флегмовое число;
— произвести расчет числа тарелок и высоты ректификационной колонны.
1. Классификация массообменных процессов
2. Перегонка и ректификация.
7. Контрольные вопросы для самопроверки.
8. Тестовые задания.
2. Кавецкий Г.Д., Васильев Б.В. Процессы и аппараты пищевой технологии М.: Колос, 1999. – 551 с.
4. Малахов Н.Н., Плаксин Ю.М., Ларин В.А. Процессы и аппараты пищевых производств: Учебник.- Орел: Изд. Орловского государственного технического университета, 2001.- 687 с.
2. Плановский А.Н., Николаев П.И. Процессы и аппараты химической и нефтехимической технологии. – М.: Химия 1987
Учебное пособие
Классификация массообменных процессов
Процессы массообмена, в которых исходный и конечный продукты обмениваются веществом, организуют для получения в концентрированном виде продуктов, содержащихся в сырье в малых концентрациях. Эти процессы ведут в массообменных аппаратах.
Массообменные процессы классифицируют (подразделяют) по трем основным признакам: агрегатному состоянию вещества, способу контакта фаз и характеру их взаимодействия.
Классификация массообменных процессов по агрегатному состоянию контактирующих фаз дана на рисунке 4.1.
Рисунок – 4.1 Классификация массообменных процессов по агрегатному состоянию рабочих тел: Г – газ; Ж – жидкость; Тв. т – твердое тело.
Можно представить шесть различных сочетаний из трех возможных фаз по две: газ — жидкость, газ — твердое тело, жидкость — жидкость, жидкость — твердое тело, газ — газ, твердое тело — твердое тело. Два последних сочетания практически не используют в массообменных аппаратах.
Когда два разделяемых компонента содержатся одновременно в газообразной и жидкой фазах, их разделение возможно в процессах перегонки (дистилляции) и ректификации.
Дистилляция (перегонка) — разделение жидких смесей на различающиеся по составу фракции.
Ректификация — способ разделения жидких смесей, состоящих из нескольких компонентов. Ректификация основана на многократном испарении жидкости и конденсации ее паров или на однократном испарении смеси с последующей многоступенчатой конденсацией компонентов. Ректификацию применяют, например, в спиртовой промышленности для получения спирта-ректификата. Так, если раствор этилового спирта в воде частично испарить, то в паровой фазе концентрация спирта окажется большей, чем в оставшейся жидкости и чем в исходном растворе. Если после этого пар сконденсировать, то в итоге получатся две жидкости с различными концентрациями спирта в них. Повторение этого процесса может обеспечить все более и более высокую концентрацию спирта, т. е. все более высокую степень разделения компонентов.
В том случае когда компонент растворим в каждой из фаз, которые сами одна в другой нерастворимы, процесс перехода компонента из газообразной фазы в жидкую называют абсорбцией (объемным поглощением), а обратный процесс — десорбцией. Например, если смесь аммиака с воздухом привести в контакт с водой, часть аммиака перейдет в воду (вода абсорбирует аммиак) и воздух частично очистится от него. В обратном процессе при контакте водного раствора аммиака с воздухом в последний перейдет часть аммиака — произойдет процесс десорбции.
Если при переходе одного из компонентов из фазы в фазу в одной из них уменьшается (увеличивается) количество жидкости (растворителя), такой процесс называют сушкой (увлажнением). Например, при контакте молока с горячим воздухом происходит переход воды в воздух. При этом молоко осушается, а воздух увлажняется.
Переход из твердого состояния в газообразное, минуя жидкую фазу, называют сублимацией. В том частном случае, когда и газ и твердое тело являются лишь носителями жидкости, находящейся в порах и на поверхности твердого тела, ее переход в пар при подводе теплоты называют сушкой или сублимационной сушкой. В частности, в овощах при этом происходит перенос влаги в жидком или парообразном состоянии к поверхности, а затем ее удаление с поверхности, т. е. типичный процесс сушки. Обратный процесс — переход компонентов смеси из газообразной фазы в твердую называют процессом адсорбции (поверхностного поглощения) или процессом ионного обмена. Примером адсорбции может служить проникновение частичек водяного пара из его смеси с воздухом в гранулы силикагеля и их удержание в его порах; при этом воздух осушается.
Если газовая фаза представляет собой смесь нескольких компонентов, которые в различной степени адсорбируются адсорбентом, возможно разделение смеси способом фракционной адсорбции.
При разделении в системе жидкость—жидкость в контакт вводятся две нерастворимые друг в друге жидкости, каждая их которых растворяет выделяемый компонент в различной степени. Пример: разделение этилового спирта и изобутанола при контакте их смеси с водой. При этом изобутанол активно переходит в воду. Если после этого водный раствор изобутанола отделить от его смеси с этиловым спиртом, в которой количество изобутанола существенно уменьшено (а они хорошо разделяются отстаиванием), то процесс можно повторить при новом контакте отделившейся смеси изобутанола и спирта со свежей водой и получить из нее изобутанол более высокой концентрации. Такой процесс называют жидкостной экстракцией.
Особо чистые вещества получают в процессах фракционной кристаллизации. Кристаллы, выпавшие из раствора и имеющие меньшее количество загрязняющих компонентов, чем исходный раствор, растворяются в чистом растворителе и из раствора вновь кристаллизуются. При этом часть загрязняющих веществ вновь отделяется.
Если обе фазы в системе жидкость — твердое тело представляют собой нейтральные вещества, а выделяемый компонент переходит из твердого тела в жидкость, процесс разделения называют экстрагированием в системе твердое тело — жидкость. Пример этого процесса — переход сока из свеклы в воду (в диффузионный сок).
Обратный процесс переноса вещества из жидкой фазы на поверхность твердой имеет место в процессах адсорбции и ионного обмена, а в объем — в процессах обратной экстракции. Пример адсорбции — очистка воды от примесей при пропускании ее через насадку активированного угля, адсорбирующего эти примеси. Примером обратной экстракции может быть посол мяса или рыбы.
По способу контакта фаз массообменные процессы разделяют на процессы с непосредственным контактом фаз, контактом через мембраны и без видимой (четкой) границы фаз. Если между фазами устанавливают мембраны, то процесс разделения относится к области мембранных технологий.
По характеру взаимодействия фаз массообменные процессы и аппараты разделяют на периодические и непрерывные. Кроме того, в непрерывных процессах возможна организация прямоточного, противоточного, перекрестного и комбинированного движения компонентов. В зависимости от конкретной организации процесса возможно разнообразное изменение концентраций участвующих в процессе веществ по длине аппарата и во времени. Их разнообразие увеличивается путем комбинирования процессов.
В инженерных расчетах массообменных аппаратов применяются коэффициенты связи между движущей силой процесса и реакциями на нее без глубокого проникновения в физическую или химическую сущность явлений. Движущая сила процессов массообмена — разность концентраций.
4.2. Перегонка и ректификация.
Перегонка и ректификация – наиболее распространенные методы разделения жидких однородных смесей, состоящих из двух или нескольких летучих компонентов.
Процессы перегонки и ректификации широко применяют в пищевой промышленности при получении технического и пищевого этилового спирта, в производстве ароматических веществ и др. Перегонку используют для грубого разделения смесей. Для наиболее полного их разделения применяют ректификацию.
Процессы перегонки и ректификации основаны на различной летучести компонентов смеси при одной и той же температуре. Компонент смеси, обладающий большей летучестью, называется легколетучим, а компонент, обладающий меньшей летучестью, труднолетучим. Соответственно легколетучий компонент кипит при более низкой температуре, чем труднолетучий. Поэтому их называют также низкокипящим и высококипящим компонентами.
В результате перегонки и ректификации исходная смесь разделяется на дистиллят, обогащенный легколетучим компонентом, и кубовый остаток, обогащенный труднолетучим компонентом. Дистиллят получают в результате конденсации паров в конденсаторе – дефлегматоре. Кубовый остаток получают в кубе установки.
Материальный и тепловой балансы ректификации составляют по принципиальной схеме (рис.4.2).
Рис. 4.2 – К составлению материального и теплового балансов ректификации:
1 – куб; 2 – колонна; 3 – разделительный стакан; 4 – дефлегматор.
В колонну ректификационной установки поступает исходная смесь, которая разделяется в результате ректификации на дистиллят и кубовый остаток. Выходящие из колонны пара конденсируются в дефлегматоре и попадают в сосуд 3, где разделяются на две части: одна часть, так называемая флегма Ф, направляемая на орошение колонны, а другая отбирается в виде продукта – дистиллята.
Материальный баланс описывается следующими уравнениями:

по легколетучему компоненту

| где: | G f, G d, G w | — массы соответственно смеси, поступающей на ректификацию, дистиллята и получаемого остатка, кмоль; |
| x f, x d, x w | — концентрации легколетучего компонента соответственно в исходной смеси, дистилляте и в остатке, мольные доли. |
Из уравнений (4.1) и (4.2) определяют массы дистиллята и кубового остатка:


Отнесем массы исходной смеси, кубового остатка и флегмы к 1 кмоль дистиллята и обозначим: G f /G d = F; G w /G d =W; Ф /G d =R. Последнее отношение называется флегмовым числом.
Тарелка питания разделяет ректификационную колонну на две части: верхнюю, или укрепляющую, и нижнюю – исчерпывающую.
Составим уравнение материального баланса для верхней и нижней частей колонны на основании общего уравнения

Количество жидкости, стекающей в укрепляющей части колонны, L = R G d.
Количество паров, поднимающихся по колонне,

Уравнение рабочей линии для укрепляющей части ректификационной колонны:

Уравнение рабочей линии для исчерпывающей части ректификационной колонны:


Число действительных тарелок определяется по уравнению:

nr – число ступеней изменения концентраций в верхней и нижней частях колонны.
Рабочая высота колонны, м:

| где: | h | — расстояние между тарелками, м. |
Диаметр колонны (м) определяется:

где 
где 
Рабочая скорость пара в колонне равна, м/с

Средняя плотность пара, кг/м 3 :

плотность пара, выходящего из куба и поступающего в дефлегматор, приближенно можно определить по формулам:


где 
Среднюю плотность жидкости в колоне находим как среднюю между плотностями спирта при t = 78 0 С (ρжd = 735 кг/м 3 ) и воды (ρжw = 958 кг/м 3 )

Тепловой баланс ректификационной колонны непрерывного действия (см. рис. 1) выражается равенством

| где: | Q1 | — расход теплоты в кубе, Дж/ч; |
| cf, cd, cw | — удельные теплоемкости соответственно исходной смеси, дистиллята и кубового остатка, Дж/(кгּК); | |
| tf, td, tw | — температуры соответственно исходной смеси, дистиллята и кубового остатка, К; | |
| rd | — теплота парообразования дистиллята, Дж/кг; | |
| Qп | — потери теплоты в окружающее пространство, Дж/ч. |
Из уравнения (4.10) находим расход теплоты в кубе ректификационной колонны

Если кипятильник нагревается водяным паром, расход его на проведение процесса составит

Рассмотрим построение процесса ректификации для случая питания колонны исходной смесью при температуре кипения.
Рис. 4.3 – Построение рабочих линий ректификации
Рабочие линии на y –x –диаграмме строят следующим образом. На оси абсцисс (см. рис. 4.3) откладывают концентрации, характеризующие составы жидкостей: xw, xf, xd. Учитывая, что xd = yd, из точки xd восстанавливают перпендикуляр и на пересечении его с диагональю находят точку А с координатами xd = yd. Зная флегмовое число R, определяют отрезок 

Положение рабочих линий при заданных концентрациях жидкости xw, xf, xd зависит только от величины отрезка В, определяемого значением рабочего флегмового числа R[см. уравнение (4.9)]. С уменьшением флегмового числа отрезок В увеличивается, и рабочая линия стремится к своему предельному верхнему положению Аb, соответствующему пересечению рабочей и равновесной линий в точке В1. Очевидно, что в этой точке движущая сила Δy = yр – y = 0 и, следовательно, ректификационная колонна должна иметь бесконечно большую поверхность фазового контакта. Действительно, в этом случае число теоретических ступеней изменения концентраций будет бесконечным и разделение смеси возможно только в условной колонне бесконечной высоты. При этом расход греющего пара и диаметр колонны будут минимальными. Флегмовое число при этом также будет минимальным и равным

Второму нижнему предельному положению рабочей линии соответствует бесконечно большое флегмовое число и соответственно отрезок В = 0. В этом случае обе рабочие линии совпадают с диагональю. Бесконечно большому флегмовому числу соответствует максимальная движущая сила процесса Δy max = yр – y и, следовательно, наименьшее число теоретических ступеней изменения концентрации и минимальная высота колонны. Однако расход пара в колонне, расход греющего пара в кипятильнике, диаметр колонны, а также расход охлаждающей воды в дефлегматоре будут максимальными. В этих условиях ректификационная колонна работает без отбора дистиллята, «сама на себя», что имеет место только при выводе колонны на рабочий режим.
Рабочее флегмовое число:

| где: | σ | — коэффициент избытка флегмы. |
Рис. 4.4 – Ректификационная установка непрерывного действия: 1 – сборник;
2 – подогреватель; 3 – ректификационная колонна; 4 – дефлегматор;
5 – разделительный сосуд; 6 – холодильники; 7 – насосы; 8 – кипятильник.
Ректификационная установка непрерывного действия показана на рис. 4.4. Исходная смесь, нагретая в подогревателе, подается на тарелку питания ректификационной колонны и за счет теплоты, поступающей из кипятильника, разделяется в результате ректификации на дистиллят и кубовый остаток. Пары, входящие из колонны, конденсируются полностью или частично в дефлегматоре. В случае полной конденсации паров полученный дистиллят в разделительном сосуде разделяется на две части. Одна часть – флегма через гидрозатвор поступает на орошение колонны на верхнюю тарелку, вторая часть – дистиллят охлаждается в холодильнике и направляется в сборник.
В случае неполной конденсации паров в дефлегматоре они поступают в конденсатор-холодильник, где конденсируются и охлаждаются. Кубовый остаток в зависимости от его ценности либо собирается в емкости, либо как сточные воды направляется на утилизацию.
На практике часто встречаются случаи разделения исходной смеси на три и более части. Так, в спиртовом производстве из бражки выделяют этиловый спирт, эфироальдегидную фракцию и сивушные масла.
Абсорбцией процесс поглощения газов или паров (абсорбтивов) из газовых или паровых смесей жидкими поглотителями – абсорбентами. Этот процесс является избирательным и обратимым, что позволяет применить его с целью получения растворов газов в жидкостях, а также для разделения газовых или паровых смесей.
После абсорбции одного или нескольких компонентов из газовой или паровой смеси, как правило, проводят десорбцию, т.е. выделение этих компонентов из жидкости. Таким образом, осуществляют разделение газовой смеси.
Процессы абсорбции в технике применяют для разделения углеводородных газов, и получения соляной и сернистой кислот, аммиачной воды, очистки отводящих газов с целью улавливания ценных продуктов или обезвреживания газосбросов.
Аппаратурно-технологическое оформление абсорбции несложно, поэтому процессы абсорбции широко используют в технике.
Аппараты для проведения процессов абсорбции называются абсорберами.
Рис. 4.5 – Распыливающий абсорбер
Распыливающие абсорберы работают по принципу контакта фаз в результате распыления или разбрызгивания жидкости в газовом потоке.
Простейшим примером распыливающих абсорберов является полый распыливающий абсорбер с механическими форсунками (рис. 4.5)
Наибольшие коэффициенты массопередачи имеют место в момент распыления жидкости, а затем они резко снижаются вследствие коалесценции капель и уменьшения поверхности фазового контакта. Часто форсунки устанавливают по всей высоте абсорбера.
Распыливающие абсорберы применяют для абсорбции хорошо растворимых газов.
Адсорбцией называют процесс поглощения газов или паров из газовых смесей или растворенных веществ из растворов твердыми поглотителями – адсорбентами. Поглощаемое вещество называется адсорбтивом.
Характерная особенность процесса адсорбции – избирательность и обратимость. Благодаря обратимости процесса возможно поглощение из парогазовых смесей или растворов одного или нескольких компонентов, а затем в определенных условиях выделение их из адсорбента.
Процесс, обратный адсорбции, называют десорбцией. Адсорбция широко распространена в различных отраслях промышленности для очистки и осушки газов, очистки и осветления растворов, разделения парогазовых смесей, для извлечения ценных летучих растворителей из их смеси с другими газами.
В пищевой технологии адсорбцию используют для очистки диффузионного сока и сахарных сиропов в сахарном производстве, осветления пива и фруктовых соков, очистки от органических и других соединений спирта, водки, коньяка и вин, сиропов в крахмалопаточном производстве и др.
В пищевых производствах широко используют следующие адсорбенты: активные угли, силикагели (гель кремниевой кислоты), алюмогели (гидроокись алюминия), цеолиты, глины и другие природные адсорбенты. Адсорбенты, которые непосредственно контактируют с продуктами, должны быть биологически безвредными, т.е. они должны быть нетоксичными и прочными, не засорять продукт.
Адсорбент (уголь) циркулирует непрерывно, извлекая из исходного газа, подаваемого также непрерывно, адсорбируемый компонент. Газ поступает в нижнюю часть поглотительной камеры 1, а уголь – из бункера 2, проходя при этом через холодильник 3, где он охлаждается. Насыщенный сорбтивом уголь направляется в десорбер 4, где он подогревается и обрабатывается перегретым водяным паром. Из десорбера уголь поступает в трубопровод 5. Уголь транспортируется пневматически. Воздух для транспортировки угля подается по штуцеру 6. В бункере 2 уголь задерживается, а транспортирующий газ уходит через штуцер в верхней части бункера.
Кристаллизация.
Кристаллизация – один из распространенных и наиболее эффективных методов получения вещества в чистом виде.
Кристаллизацией называют процесс выделения твердой фазы в виде кристаллов из растворов и расплавов. Кристаллы представляют собой твердые тела различной геометрической формы, ограниченные плоскими гранями. Кристаллы, содержащие молекулы воды, называют кристаллогидратами.
В пищевой технологии выделение твердой фазы из растворов или расплавов в виде кристаллического продукта является завершающей стадией технологического процесса получения сахарозы, глюкозы, соли и других кристаллических продуктов.
Кристаллизацию, как правило, проводят из водных растворов. При понижении температуры или удалении части растворителя уменьшается растворимость твердого вещества. Раствор становится пересыщенным, и твердое вещество выпадает из раствора в осадок.
Производственный технологический процесс кристаллизации состоит из нескольких стадий: кристаллизация, отделение кристаллов от маточных растворов, перекристаллизация (если требуется), промывка и сушка кристаллов.
Кристаллизаторы непрерывного действия состоят из концентратора, кристаллогенератора и камеры роста кристаллов. Конструкция аппарата должна обеспечивать интенсивную циркуляцию, препятствующую осаждению кристаллов в аппарате, улучшающую теплопередачу и обеспечивающую получение равномерных по величине кристаллов.
На рис.4.7 представлен вакуумный кристаллизатор непрерывного действия, применяемый в сахарном производстве.
1 – концентратор; 2 – кристаллизатор; 3 – камера роста кристаллов.
В концентраторе 1 исходный сироп за счет испарения части воды сгущается до пересыщенного раствора. Затем в кристаллизаторе 2 в него вводят затравку и происходит зарождение кристаллов с одновременным удалением части воды испарением для поддерживания необходимой степени пересыщения. Наконец, в камере роста кристаллов 3, состоящей из последовательно соединенных секций, происходит рост кристаллов в потоке пересыщенного раствора с одновременным испарением части воды. Из последней секции камеры роста раствор с кристаллами направляется на центрифуги для разделения.
Экстрагирование.
Экстракцией называют процессы разделения жидких смесей и извлечение необходимых компонентов из твердых веществ при помощи жидкого растворителя (экстрагента), избирательно растворяющего только извлекаемые компоненты.
Процесс экстракции аналогичен процессу растворения и отличается от него только тем, что при растворении вещество переходит в раствор. При экстракции же вследствие различной растворимости компонентов в раствор переходит только часть компонентов вещества, другая же часть остается в твердом состоянии. По агрегатному состоянию экстрагируемых веществ различают экстракцию из твердых тел и экстракцию из жидкостей. К первой категории относятся извлечение сахара из свекловичной стружки, растительного масла из масличных семян и др. Этот процесс называется диффузией, так как экстрагирование является диффузионным процессом.
Экстракция из жидкостей также получила применение на пищевых предприятиях. Так, при помощи экстракции выделяют молочную кислоту и антибиотики из ферментационных растворов.
Как при экстракции из твердого тела, так и при экстракции из жидкости имеются две фазы: в первом случае твердая и жидкая, во втором – две жидкие фазы. Чтобы в процессе экстрагирования между этими фазами происходил обмен компонентами, фазы должны находиться в тесном контакте.
На пищевых предприятиях при помощи экстракции извлекают компоненты из многих клеточных структур растительного происхождения. Возможны следующие варианты проведения этого процесса:
1) твердое тело и экстрагент находятся в течение определенного времени в аппарате с работающей мешалкой. В результате тесного контакта между ними концентрация извлекаемого вещества в твердом теле непрерывно уменьшается, а в экстрагенте увеличивается до состояния равновесия. Этот способ применяют в ликерно-водочном производстве для получения морсов;
2) через измельченное твердое тело, находящееся в аппарате периодического действия, называемом диффузором, перемещается экстрагент, извлекающий из твердого тела экстрагируемый компонент;
3) измельченное твердое тело и экстрагент непрерывно и противоточно перемещаются в аппарате (рис.1). При этом в любом сечении аппарата устанавливается постоянная концентрация в твердой и жидкой фазах. Следовательно, в каждой точке аппарата процесс стационарен, хотя за время прохождения твердого тела в аппарате концентрация в нем извлекаемого компонента непрерывно уменьшается. Этот способ применяют в свеклосахарном производстве при извлечении сахара из свекловичной стружки.
Рис. 4.8 – Экстрактор непрерывного действия.
Процесс экстракции проводится в аппаратах различной конструкции – э к с т р а к т о р а х.
Экстракцию широко используют для извлечения ценных продуктов из разбавленных растворов, а также для получения концентрированных растворов.
Основное преимущество экстракции – низкая рабочая температура процесса, что позволяет разделять жидкие смеси термолабильных веществ, например антибиотиков, разлагающихся при повышенных температурах.
Во многих случаях экстракцию применяют в сочетании с ректификацией. Поскольку расход теплоты на ректификацию уменьшается с увеличением концентрации исходного раствора, предварительное концентрирование раствора экстракцией позволяет сократить расход теплоты на разделение исходной смеси.
Контрольные вопросы для самопроверки
1) Какие признаки объединяют все массообменные процессы?
2) Перечислите процессы, относящиеся к группе массообменных процессов.
3) Что является движущей силой массообменных процессов?
4) Что такое простая перегонка? При разделении, каких смесей её применяют?
5) В чем заключается процесс ректификации?
6) Какими уравнениями описываются рабочие и равновесная линии?
7) Как определяется рабочее флегмовое число?
8) Как рассчитывается число тарелок и высота ректификационной колонны?
9) Какова сущность процесса абсорбции?
10) Какие конструкции абсорберов применяются в промышленности?
11) В чем сущность процесса адсорбции?
12) Какие адсорбенты применяют в пищевой промышленности?
13) Какими свойствами должны обладать адсорбенты?
14) Какие конструкции адсорберов применяют в пищевой промышленности?
15) В чем заключается сущность процесса кристаллизации?
16) Из каких стадий состоит кристаллизация?
17) Какими способами можно достигнуть пересыщения раствора?
18) В чем сущность процесса экстракции? Какие компоненты участвуют в процессе экстракции?
19) В каких аппаратах проводят процессы экстракции?
Тестовые задания
1) Процессом адсорбции называется:
а) процесс поглощения газов или паров из газовых смесей или растворенных веществ из растворов твердыми поглотителями
б) процесс поглощения газов или паров из газовых или паровых смесей жидкими поглотителями
в) процесс выделения твердой фазы из растворов и расплавов
г) процесс разделения жидких смесей и извлечение необходимых компонентов из твердых веществ при помощи жидкого растворителя, избирательно растворяющего только извлекаемые компоненты
д) процесс удаления влаги из твердых влажных и пастообразных или жидких материалов (суспензий) путем ее испарения и отвода образовавшихся паров
2) Изображенная схематично непрерывно действующая установка используется для проведения процесса…
3) Адсорбция от абсорбции отличается тем, что….
а) адсорбция происходит на поверхности сорбента
б) адсорбция происходит во всем объеме сорбента
в) абсорбция происходит на поверхности сорбента
4) Адсорбенты наиболее применимые в пищевой промышленности….
а) Активные угли, силикагели, глины, алюмогели
б) Соляная и уксусная кислота
в) Насыщенный и перегретый пар
г) Атмосферный воздух
5) Адсорбенты должны характеризоваться
а) Большой удельной поверхностью
б) Высокой поглотительной способностью
в) Высокой степенью адгезии
г) Высокой плотностью
6) Поглотительная способность адсорбента зависит от…
а) Температуры и давления
д) Коэффициента массопередачи
7) Процессом абсорбции называется:
а) процесс поглощения газов или паров из газовых смесей или растворенных веществ из растворов твердыми поглотителями