Что относится к катализаторам
Катализатор, их виды и свойства
Катализатор, их виды и свойства.
Катализатор – это химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции, и действующее повторно (неоднократно).
Катализатор (понятие и сущность):
Катализатор – это химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции, и действующее повторно (неоднократно).
Катализаторы – это вещества, которые ускоряют химические реакции, но не входят в состав их конечных продуктов.
Катализаторы – это вещества, ускоряющие скорость химической реакции, которые могут участвовать в реакции, входить в состав промежуточных продуктов, но не входят в состав конечных продуктов реакции и после окончания реакции остаются неизменными.
Термин катализатор (от греч. katalysis – «ослабление», «разрушение») впервые ввел в 1835 г. шведский химик И. Берцелиус, который установил, что в присутствии определенных веществ скорость некоторых химических реакций существенно возрастает.
Соответственно химические реакции, протекающие в присутствии катализаторов, именуются каталитическими реакциями. А процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами, именуется катализом.
Различают положительный катализ и отрицательный катализ. Положительным называют катализ, при котором скорость реакции возрастает, отрицательным (ингибированием) – при котором она убывает.
Вещества, замедляющие химическую реакцию, именуются ингибиторами. Однако ингибиторы в отличие от катализаторов могут расходоваться в процессе химической реакции.
Все химические реакции в прису тствии катализатора протекают быстрее, поскольку катализатор снижает энергию активации реакции.
В некоторых химических реакциях катализатор реагирует с одним или несколькими реагентами с образованием временного промежуточного продукта, который затем регенерирует исходный катализатор в циклическом процессе. Химическая реакция в таких случаях состоит из нескольких стадий:
X + K → XK,
Y + XK → XYK,
XYK → KZ,
KZ → K + Z,
Z – конечный продукт химической реакции X и Y,
При этом общее уравнение реакции записывается как:
В современном химическом производстве часто применяют каталитические системы из нескольких катализаторов, каждый из которых ускоряет разные стадии химической реакции.
Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня.
В настоящее время многие важнейшие химические производства, такие, как получение серной кислоты, аммиака, азотной кислоты, синтетического каучука, ряда полимеров и др., проводятся в присутствии катализаторов. Согласно оценкам, для производства 90 % всех коммерчески производимых химических продуктов на той или иной стадии процесса их изготовления использовались катализаторы.
Типы и виды катализаторов:
Катализаторы, как правило, подразделяются на гомогенные и гетерогенные.
Гомогенный катализатор – это катализатор, молекулы которого диспергированы (т.е. находятся) в одной и той же фазе (обычно в газообразной или жидкой), что и молекулы реагента.
Гетерогенный катализатор – это катализатор, молекулы которого находятся не в той же фазе, что и реагенты (которые обычно представляют собой газы или жидкости, адсорбированные на поверхности твердого катализатора). Гетерогенный катализатор образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества – реагенты.
Действие гомогенного катализатора, как правило, связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, что приводит к снижению энергии активации химической реакции. Впоследствии промежуточные вещества регенерируют исходный катализатор.
Гетерогенные катализаторы имеют, как правило, сильно развитую твердую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.). Их действие основано на ускорении химической реакции на своей твердой поверхности (либо на плоской открытой поверхности, либо на краях кристалла, либо вследствие сочетания этих двух факторов). Поэтому активность гетерогенного катализатора зависит от величины и свойств его поверхности.
Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Одни и те же химические реакции могут протекать как с гомогенными, так и с гетерогенными катализаторами. Для определенных химических реакций эффективны только определённые катализаторы.
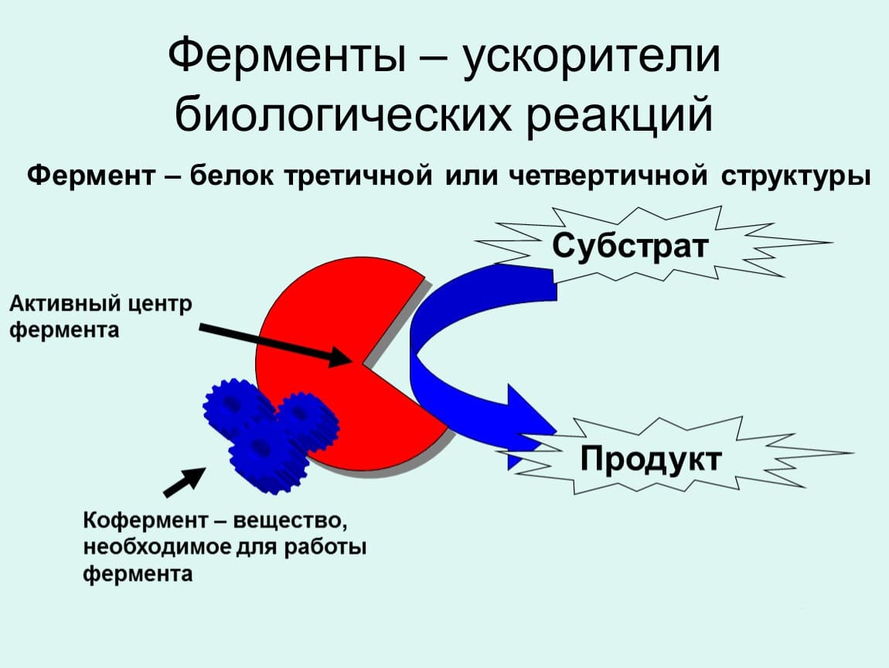
В биохимических реакциях роль катализаторов выполняют ферменты, которые часто рассматриваются как третья – отдельная категория.
Соответственно классификации катализаторов положительный катализ подразделяют на три типа:
а) гомогенный катализ, когда реакционная смесь и катализатор находятся или в жидком или в газообразном состоянии;
в) ферментативный катализ, когда катализатором служат сложные белковые образования, ускоряющие течение биологически важных реакций в организмах растительного и животного мира. Ферментативный катализ может быть как гомогенным, так и гетерогенным, но из-за специфических особенностей действия ферментов целесообразно выделение этого вида катализа в самостоятельную область.
Свойства катализаторов:
Катализаторы как вещества, ускоряющие химические реакции, обладают следующими свойствами:
– каталитической активностью. Каталитическая активность – это свойство катализатора ускорять химическую реакцию. Формально каталитическую активность можно определить как скорость каталитической реакции в данных условиях за вычетом скорости той же реакции в отсутствие катализатора или как соотношение скоростей каталитической и некаталитической реакций;
– селективностью. Селективность – это способность протекания химической реакции в определённом направлении, то есть свойство получать те продукты реакции, на которые направлена химическая реакция;
– неизменностью. Неизменность означает, что после участия в химической реакции они (катализаторы) остаются химически неизменными;
– активностью. Активность катализатора в процессе реакции может понижаться вследствие воздействия на катализатор вредных примесей. К последним относятся каталитические яды и ингибиторы. Каталитические яды – это вещества, вызывающие «отравление» катализатора, т. е. снижающие его каталитическую активность или полностью прекращающие каталитическое действие. Поэтому важно в процессе реакции исключить воздействие на катализатор вредных факторов.
Другими немаловажными свойствами катализаторов являются твердость, механическая прочность, устойчивость к истиранию и дроблению, срок службы, устойчивость к отравлению каталитическими ядами, размер и форма, масса единицы объема, пористость, удельная поверхность, термостойкость и стабильность.
Каталитические системы на основе катализаторов:
Современные промышленные твердые катализаторы обычно представляют собой сложные смеси, называемые контактными массами. В состав контактных масс входят прежде всего вещества, являющиеся собственно катализаторами, а также носители и активаторы.
Активаторы (промоторы) – это вещества, добавляемые к катализатору в небольших количествах с целью улучшения его свойств, таких, как активность, селективность или стабильность, которые сами по себе могут быть неактивными для данной реакции, но значительно улучшают свойства катализатора. Поэтому деление на сложные и активированные катализаторы носит лишь ориентировочный характер.
Улучшение свойств катализатора при добавлении промотора (активатора) значительно превосходит тот эффект, который можно было бы получить в результате независимого действия самого промотора, т.к. сам промотор может и не обладать каталитической активностью.
В общем случае по своему целевому назначению промоторы могут быть разделены на две группы:
– способствующие протеканию целевой реакции, т. е. увеличивающие активность катализатора;
– подавляющие нежелательные процессы, т. е. увеличивающие селективность катализатора.
Среди промоторов первой группы различают структурообразующие и активирующие. Структурообразующие промоторы, как правило, представляют собой инертные вещества, присутствующие в катализаторе в виде мелких частиц, препятствующих спеканию частиц активной каталитической фазы, что предотвращает уменьшение активной поверхности во время работы катализатора. Активирующие промоторы могут создавать дополнительные активные центры, воздействовать на электронную структуру активной фазы и т.п.
Катализ и катализаторы
Катализ – это процесс изменения скорости химической реакции при помощи катализаторов – веществ, принимающих участие в химической реакции, но в состав конечных продуктов не входящих и в результате реакции не расходующихся.
Одни катализаторы ускоряют реакцию (положительный катализ), другие – замедляют (отрицательный катализ). Отрицательный катализ называют ингибированием, а катализаторы, понижающие скорость химической реакции – ингибиторами.
Различают гомогенный и гетерогенный катализ.
Гомогенный катализ.
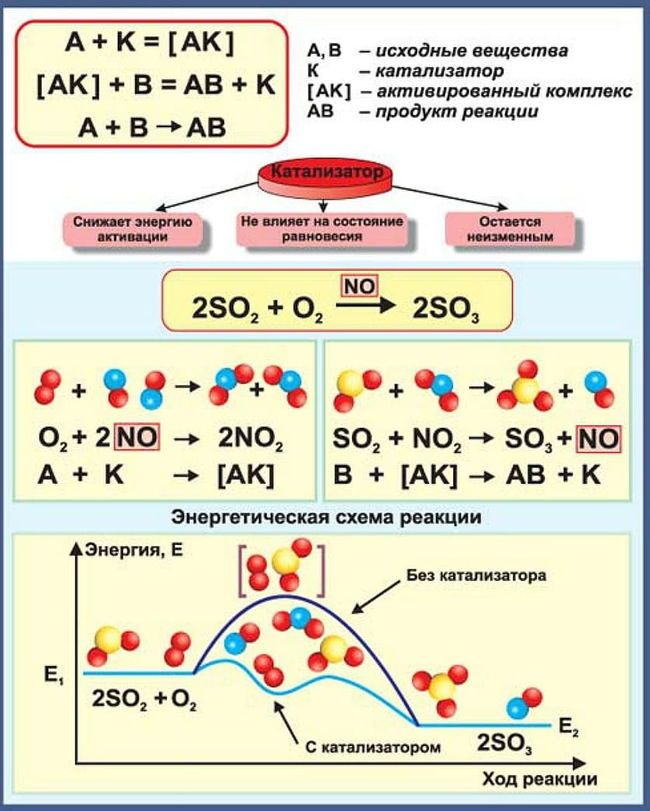
При гомогенном (однородном) катализе реагирующие вещества и катализатор находятся в одинаковом агрегатном состоянии и между ними отсутствует поверхность раздела. Пример гомогенного катализа – реакция окисления SO2 и SO3 в присутствии катализатора NO (реагирующие вещества и катализатор являются газами).
Гетерогенный катализ.
В случае гетерогенного (неоднородного) катализа реагирующие вещества и катализатор находятся в различных агрегатных состояниях и между ними существует поверхность (граница) раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – жидкости или газы. Пример гетерогенного катализа – окисление NN3 до NO в присутствии Pt (катализатор – твердое вещество).
Механизм действия катализаторов
Действие положительных катализаторов сводится к понижению энергии активации реакции Еа(исх), действие ингибиторов – противоположное.
Так, для реакции 2HI = H2+I2 Еа(исх)=184 кДж/моль. Когда же эта реакция протекает в присутствии катализатора Au или Pt, то Еа(исх)=104 кДж/моль, соответственно.
Механизм действия катализатора при гомогенном катализе объясняется образованием промежуточных соединений между катализатором и одним из реагирующих веществ. Далее промежуточное соединение реагирует со вторым исходным веществом, в результате чего образуется продукт реакции и катализатор в первоначальном виде. Так как скорость обоих промежуточных процессов значительно больше скорости прямого процесса, то реакция с участием катализатора протекает значительно быстрее, чем без него.
SO2 +1/2 O2 = SO3 протекает очень медленно, а если использовать катализатор NO
то реакции NO +1/2О2 = NO2 и NO2 +SO2 = SO3 +NO протекают быстро.
Механизм действия катализатора при гетерогенном катализе иной. В этом случае реакция протекает вследствие адсорбции молекул реагирующих веществ поверхностью катализатора (поверхность катализатора неоднородна: на ней имеются так называемые активные центры, на которых и адсорбируются частицы реагирующих веществ.). Увеличение скорости химической реакции достигается, в основном, за счет понижения энергии активации адсорбированных молекул, а также, отчасти, за счет увеличения концентрации реагирующих веществ в местах, где произошла адсорбция.
Каталитические яды и промоторы.
Некоторые вещества снижают или полностью уничтожают активность катализатора, такие вещества называют каталитическими ядами. Например, небольшие примеси серы (0,1%) полностью прекращает каталитическое действие металлического катализатора (губчатого железа), использующегося при синтезе аммиака. Вещества, повышающие активность катализатора, называют промоторами. Например, каталитическая активность губчатого железа значительно возрастает при добавлении примерно 2% метаалюмината калия KAlO2.
Применение катализаторов
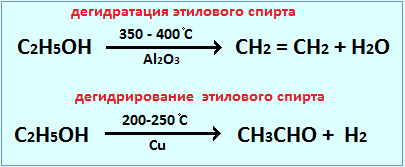
Действие катализатора избирательно и специфично. Это означает, что, применяя различные катализаторы, из одних и тех же веществ можно получить различные продукты. Это особенно характерно для реакций органических веществ. Например, в присутствии катализатора AlO3 происходит дегидратация этилового спирта, в присутствии Cu – дегидрирование:
Биологические катализаторы, принимающие участие в сложных химических превращениях, протекающих в организме, называются ферментами.
Катализаторы широко используются в производстве серной кислоты, аммиака, каучука, пластмасс и др. веществ.
Катализаторы
Примерно 90% объема современного химического производства основано на каталитических процессах.
Гидроочистка является наиболее крупнотоннажным каталитическим процессом в нефтепереработке.
В процессе гидроочистки понижается содержание серы в топливе.
Эффективность гидроочистки зависит от активности катализаторов, температурного режима и качества сырья.
И повышение эффективности процесса требует использования новых типов катализаторов.
Требования к катализаторам:
Селективность изменяется из-за изменения электронных свойств и окружения активных центров катализатора (эффект лиганда).
В реакциях сложных органических молекул большое значение имеет преимущественное образование продукта, близкого по своей форме и размерам к размерам микропор катализатора.
В сложных многостадийных реакциях применяют многофазные многокомпонентные катализаторы, селективность которых выше благодаря тому, что каждая стадия сложной реакции ускоряется своим компонентом катализатора. Селективность катализатора зависит также от его пористости, размера зерен и характера их укладки.
Термостойкость катализаторов важна для первых по ходу реагента слоев катализаторов в экзотермических реакциях, когда выделение тепла может вызвать рекристаллизацию и дезактивацию катализаторов.
Для предотвращения рекристаллизации катализаторы наносят на термостойкие носители.
Устойчивость катализатора к действию ядов каталитических определяется спецификой их взаимодействия с катализатором.
Металлические катализаторы отравляются соединениями кислорода (Н2О, СО), серы (H2S, CS2 и др.), N, Р, As и другими веществами, образующими более прочную химическую связь с катализатором, чем реагирующие вещества.
На оксидные катализаторы действуют те же яды, однако оксиды более устойчивы к отравлению.
В процессах крекинга, риформинга и других реакций углеводородов катализаторы отравляются в результате покрытия их слоем кокса.
Кроме того, катализаторы могут дезактивироваться из-за механического покрытия поверхности пылью, которая вносится извне или образуется при катализе.
Приготовление катализаторов
Катализаторы с развитой удельной поверхностью распространение получил метод осаждения из водных растворов солей с последующим прокаливанием образующихся соединений.
Так получают многие оксиды металлов. При этом лучше использовать водный раствор NH3, потому что отпадает необходимость отмывки осадка от щелочных металлов.
Охлажденный катализатор дробят, просеивают и восстанавливают азотно-водородной смесью в колонне синтеза.
Для получения правильной геометрической формы зерен катализатора используют специальные формовочные машины.
Цилиндрические гранулы получают экструзией (выдавливанием) влажной массы с помощью массивного винта (шнека) через отверстия нужного диаметра, после чего разрезают полученный жгут на отдельные цилиндрики, которые
закатываются в сферические гранулы в специальных грануляторах.
Плоские цилиндрические таблетки получают прессованием сухого порошка на таблеточных машинах

Высокое содержание вредных примесей в выхлопных газах двигателей внутреннего сгорания способно нанести существенный вред окружающей среде. Для решения этой проблемы используют катализаторы. В этом материале мы расскажем о том, что такое катализатор на автомобиле, какие существуют его модификации и в чем заключаются основные их отличия.
Зачем нужен катализатор

Принцип действия катализатора
Основное назначение катализатора на автомобиле — это сокращение содержания в выхлопных газах окисей углерода (СО) и азота (NO и NO2), а также соединений углеводородной группы (CH). Это реализуется с помощью более полного сжигания топлива или с помощью изменения физических и химических свойств применяемого топлива.
Где находится катализатор
Виды катализаторов
Керамические катализаторы
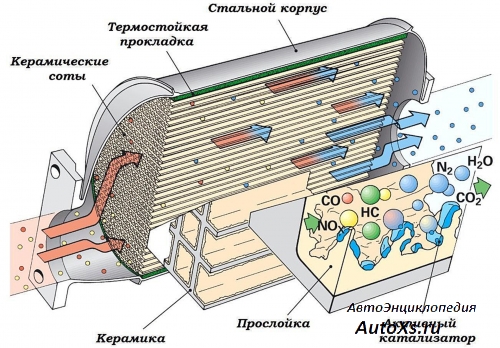
Устройство катализатора
Данное устройство использует механический способ снижения концентрации вредных веществ. Катализатор имеет сотовую конструкцию, поверхность которой покрыта сплавом платины и иридия. Именно такое покрытие из дорогих металлов совместно с увеличенной площадью соприкосновения выхлопных газов и катализатора обеспечивают удаление вредных компонентов до установленных норм.
Химические катализаторы
Химические катализаторы или анамегаторы это большая группа катализаторов, которые можно отнести к разряду присадок. Данные катализаторы добавляются в топливо и позволяют изменить его структуру и свойства. Благодаря этому снижается токсичность выхлопных газов, обеспечивается более высокая степень сгорания, минимизируется возможность возникновения нежелательных детонационных процессов.
Принцип действия катализатора основан на изменении ориентации молекулы углеводородов, что позволяет улучшить условия для реакции окисления кислородом. Благодаря этому появляется возможность обеспечить более полное его сгорание. В результате небольших изменений химического состава топлива повышается мощность двигателя, а концентрация токсичных веществ в выхлопных газах падает.
Производители предлагают различные анамегаторы. При выборе учитывайте то, что эффективность применения будет зависеть от правильной концентрации катализатора в топливе, поэтому руководствуйтесь требованиями и рекомендациями производителей.
Применение химических катализаторов так же способно увеличить расход топлива, примерно на 10%, что и считается главным его недостатком.
Магнитно-стрикционные катализаторы
Приборы данного типа считают наиболее перспективным видом катализаторов. Они позволяют улучшить характеристики топлива без корректировки его химического состояния. Принцип действия предполагает изменение ориентации углеводородной молекулы, все эти операции происходят под воздействием магнитного поля. То есть, изменению подвергается именно физические свойства горючего.
Катализаторы данного типа относятся к устройствам предварительной подготовки топлива. Благодаря правильной ориентации молекулы она получает способность соединяться с большим количеством кислорода. В результате топливо сгорает более полно, обеспечивая повышение мощности и снижение токсичности. Существует возможность снизить содержание вредных компонентов в 3-4 раза.
К преимуществам этого катализатора относят простую технологию его установки, которая занимает не более 20 минут времени. Монтируется прибор непосредственно перед карбюратором или инжектором, а для дизельных установок практикуется установка перед каждой форсункой и ТНВД.
Применение катализаторов любого типа позволит сократить количество выбросов токсичных веществ в окружающую атмосферу. Для обеспечения эффективности их работы, доверяйте установку профессионалам, именно ошибки при самостоятельном использовании снижают срок эксплуатации и качество очистки.
Также мы подробно разбирали, причины выхода из строя автомобильных катализторов. Обязательно рекомендуем изучить эту статью, чтобы не нанести вред своему автомобилю.
Удаление катализатора. Плюсы и минусы
Бывают моменты, когда приходится решать удалить катализатор или всё же искать ему замену. Поэтому давайте разберём плюсы и минусы решения удалить катализатор:
Видео что такое катализатор и как он работает:
Если Вы заметили ошибку, неточность или хотите дополнить материал, напишите об этом в комментариях, и мы исправим статью!
Виды и особенности катализаторов химических реакций
Химическая реакция – это процесс превращения реагентов в продукты реакции. Многие превращения в химии имеют очень долгий срок протекания, что абсолютно недопустимо для промышленности или для организма человека. Колоссальное ускорение превращений как в промышленности, так и в живых организмах, обеспечивают катализаторы химических реакций. Рассмотрим этот вопрос подробнее.
Что такое катализатор реакции?
Речь идет о веществе, которое способно ускорять протекание превращения многократно. Процесс в химии, протекающий в присутствии ускорителей превращений, называется катализом. Катализ характеризуется тем, что вещество, ускоряющее химический процесс, не расходует в ходе протекания последнего, а также не входит в состав конечных продуктов.
Катализ по своему результату может быть двух видов: положительный и отрицательный. Положительный катализ приводит к увеличению скорости превращения. Отрицательный катализ приводит к замедлению или прекращению протекания химического превращения. Вещества, реализующие, отрицательный катализ называются ингибиторами.
Разновидности веществ, ускоряющих химические реакции
Существуют две общепризнанных классификации веществ, которые ускоряют протекания превращений в химии. Первая основывается на агрегатном состоянии катализатора, вторая – на происхождении.
Классификация по агрегатному состоянию
По агрегатному состоянию вещества каталитические соединения можно подразделить на гомогенные и гетерогенные. Гомогенные вещества, ускоряющие химическую реакцию, находятся в одной фазе с реагентами. Гетерогенные вещества, ускоряющие химическое превращение, находятся в разных фаза с реагентами (например, катализатор представлен жидкость, а реагенты – газами).
Свойства гомогенных ускорителей реакции
К данной группе соединений относятся кислоты и основания. Например, серная кислота ускоряет протекание превращение органических субстратов. Основными свойствами гомогенных соединений являются:
Свойства гетерогенных ускорителей реакции
К данной группе соединений относятся оксиды большинства металлов (Al2O3, CaO, BaO, MgO, TiO2), а также алюмосиликаты и цеолиты. Обозначим основные свойства гетерогенных каталитических веществ:
Классификация по происхождению
По происхождению вещества, ускоряющие процесс протекания превращений в химии, подразделяются на органические и неорганические. Неорганические соединения в основном представлены тяжелыми металлами (свинец, палладий), спектр органический соединений намного шире. Основными представителями органических ускорителей превращений являются энзимы (соединения биологического происхождения). Энзимы – это катализаторы, увеличивающие скорость химических реакций в живых организмах. Ферменты (энзимы) имеют следующие особенности:
Свойства катализаторов
Каталитические вещества, ускоряющие протекание реакций в химии, имеют определенные свойства. Обозначим их:
Другие свойства каталитические соединений связаны с их строением и физическими параметрами:
Каталитические системы на основе катализаторов
Современные промышленные каталитические смеси состоят из нескольких компонентов:
Промотор
Добавление промоторов к каталитическому соединению улучшает следующие свойства последних: активность, избирательность и стабильность в системе. Сам по себе промотор может являться соединением, которое не участвует в протекающем процессе. По своему назначению активаторы подразделяются на две большие группы:
Также промоторы подразделены на две большие группы структурообразующие (инертные соединения, предотвращающие слипание частиц) и активирующие (изменяют электронную конфигурацию каталитического соединения в активную фазу катализа).
Носитель
Носитель представляет собой материю, на которую различными методами укладывают катализатор. При использовании носителя увеличивается площадь поверхности действия каталитического соединения, повышается его термостойкость. Благодаря использованию носителей возможна экономия в промышленных условиях достаточно дорогих каталитических элементов (палладий, никель, платина, серебро). Однако стоит отметь, что носитель также может положительно влиять на активность каталитического соединения, поэтому нельзя провести четкую границу между этими двумя понятиями. Носителями могут быть оксид алюминия, силикагель, пемза, каолин, асбест, алюмосиликаты и другие вещества.