Что относится к химическим элементам
Алфавитный список химических элементов
Алфавитный список химических элементов.
| Азот | N |
| Актиний | Ac |
| Алюминий | Al |
| Америций | Am |
| Аргон | Ar |
| Астат | At |
| Барий | Ba |
| Бериллий | Be |
| Берклий | Bk |
| Бор | B |
| Бром | Br |
| Ванадий | V |
| Висмут | Bi |
| Водород | H |
| Вольфрам | W |
| Гадолиний | Gd |
| Галлий | Ga |
| Ганий | Hn |
| Гафний | Hf |
| Гелий | He |
| Германий | Ge |
| Гольмий | Ho |
| Дармштадтий | Ds |
| Диспрозий | Dy |
| Дубний | Db |
| Европий | Eu |
| Железо | Fe |
| Жолиотий | Jo |
| Золото | Au |
| Индий | In |
| Иридий | Ir |
| Иттербий | Yb |
| Иттрий | Y |
| Иод | I |
| Кадмий | Cd |
| Калий | K |
| Калифорний | Cf |
| Кальций | Ca |
| Кислород | O |
| Кобальт | Co |
| Кремний | Si |
| Криптон | Kr |
| Ксенон | Xe |
| Кюрий | Cm |
| Лантан | La |
| Литий | Li |
| Лоуренсий | Lr |
| Лютеций | Lu |
| Магний | Mg |
| Мейтнерий | Mt |
| Марганец | Mn |
| Менделевий | Md |
| Мышьяк | As |
| Медь | Cu |
| Молибден | Mo |
| Натрий | Na |
| Неодим | Nd |
| Неон | Ne |
| Нептуний | Np |
| Никель | Ni |
| Ниобий | Nb |
| Нобелий | No |
| Олово | Sn |
| Осмий | Os |
| Палладий | Pd |
| Платина | Pt |
| Плутоний | Pu |
| Полоний | Po |
| Празеодим | Pr |
| Прометий | Pm |
| Протактиний | Pa |
| Радий | Ra |
| Радон | Rn |
| Резерфордий | Rf |
| Рений | Re |
| Рентгений | Re |
| Родий | Rh |
| Ртуть | Hg |
| Рубидий | Rb |
| Рутений | Ru |
| Самарий | Sm |
| Свинец | Pb |
| Селен | Se |
| Сиборгий | Sg |
| Сера | S |
| Серебро | Ag |
| Скандий | Sc |
| Стронций | Sr |
| Сурьма | Sb |
| Таллий | Tl |
| Тантал | Ta |
| Теллур | Te |
| Тербий | Tb |
| Технеций | Tc |
| Титан | Ti |
| Торий | Th |
| Тулий | Tm |
| Углерод | C |
| Унунбий | Uub |
| Унунгексий | Uuh |
| Унунквадий | Uuq |
| Унуноктий | Uuo |
| Унунпентий | Uup |
| Унунсептий | Uus |
| Унунтрий | Uut |
| Уран | U |
| Фермий | Fm |
| Фосфор | P |
| Франций | Fr |
| Фтор | F |
| Хассий | Hs |
| Хлор | Cl |
| Хром | Cr |
| Цезий | Cs |
| Церий | Ce |
| Цинк | Zn |
| Цирконий | Zr |
| Эйнштейний | Es |
| Эрбий | Er |
Полезное
Смотреть что такое «Алфавитный список химических элементов» в других словарях:
Список химических элементов по символам — См. также: Список химических элементов по атомным номерам и Алфавитный список химических элементов Содержание 1 Символы, используемые в данный момент … Википедия
Список химических элементов по атомным номерам — См. также: Список химических элементов по символам и Алфавитный список химических элементов Это список химических элементов, упорядоченный в порядке возрастания атомных номеров. В таблице приводятся название элемента, символ, группа и период в… … Википедия
ISO 4217 — (ИСО 4217) Коды для представления валют и фондов Codes for the representation of currencies and funds (англ.) Codes pour la représentation des monnaies et types de fonds (фр.) … Википедия
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ — простейшая форма материи, которая может быть идентифицирована химическими методами. Это составные части простых и сложных веществ, представляющие собой совокупность атомов с одинаковым зарядом ядра. Заряд ядра атома определяется числом протонов в … Энциклопедия Кольера
Хронология изобретений — Содержание 1 Эпоха палеолита 2 10 е тысячелетие до н. э. 3 9 е тысячелетие до н. э … Википедия
Изобретения человека — Содержание 1 Эпоха палеолита 2 10 е тысячелетие до н. э. 3 9 е тысячелетие до н. э … Википедия
Изобретения — Содержание 1 Эпоха палеолита 2 10 е тысячелетие до н. э. 3 9 е тысячелетие до н. э … Википедия
Русские — У этого термина существуют и другие значения, см. Русские (значения). Русские … Википедия
1: — Терминология 1: : dw Номер дня недели. «1» соответствует понедельнику Определения термина из разных документов: dw DUT Разность между московским и всемирным координированным временем, выраженная целым количеством часов Определения термина из… … Словарь-справочник терминов нормативно-технической документации
Химический элемент
Формой существования химических элементов в свободном виде являются простые вещества (одноэлементные) [3]
Содержание
История становления понятия
Слово «элемент» (лат. elementum ) использовалось еще в античности (Цицероном, Овидием, Горацием) как часть чего-то (элемент речи, элемент образования и т. п.). В древности было распространено изречение «Как слова состоят из букв, так и тела — из элементов». Отсюда — вероятное происхождение этого слова: по названию ряда согласных букв в латинском алфавите: l, m, n, t («el» — «em» — «en» — «tum»). [4]
Благодаря Джону Дальтону в начале XIX в. в химии возобладала атомно-молекулярная гипотеза, рассматривающая химический элемент как отдельный вид атомов и указывающая на природу простых и сложных веществ, как состоящих, соответственно, из атомов одного или различного видов. Дальтон же впервые указывает на атомный вес как важнейшее свойство элементов, определяющее его химическую природу. Благодаря усилиям Йенса Берцелиуса и его последователей были весьма точно определены атомные веса (атомные массы) известных элементов. Середина XIX в. ознаменовалась целым рядом открытий новых элементов. На международном съезде химиков в г. Карлсруэ в 1860 г. были приняты определения понятий молекулы и атома.
Ko времени открытия Периодического закона Д. И. Менделеевым (1869) было известно 63 элемента. Именно атомный вес был выделен им как свойство атомов, определяющее периодический характер изменения свойств химических элементов, а также образуемых ими простых и сложных веществ. Менделеев определял химические элементы как «материальные части простых или сложных тел, к-рые придают им известную совокупность физических и химических свойств». Oткрытие Mенделеева позволило предвидеть существование, a также свойства ряда неизвестных в то время элементов и послужило научной основой для их классификации.
Однако с открытием изотопов стало ясно, что различные совокупности атомов одного и того же элемента могут иметь различающиеся атомные массы; так, радиогенный гелий, выделенный из урановых минералов, в связи с преобладанием изотопа 4 He имеет атомную массу больше, чем гелий космических лучей.
Известные химические элементы
Право предложить название новому химическому элементу предоставляется первооткрывателям. Сообщение о новом открытии проверяется в течение нескольких лет независимыми лабораториями, и, в случае подтверждения, Международный союз теоретической и прикладной химии (ИЮПАК, IUPAC, en:International Union for Pure and Applied Chemistry) официально утверждает название нового элемента.
Не все из известных на сегодня 118 элементов имеют утвержденные ИЮПАК постоянные названия. Самым тяжёлым из официально признанных элементов, имеющих официальные постоянные названия, является 116-й, получивший в мае 2012 года имя ливерморий вместе со 114-м элементом флеровием.
Названия сверхтяжёлых элементов с номерами 113, 115, 117, 118, полученные в 2002—2010 годах в России и США, официально пока не утверждены. Они имеют временные систематические названия.
Символы химических элементов
Символы химических элементов используются как сокращения для названия элементов. В качестве символа обычно берут начальную букву названия элемента и в случае необходимости добавляют следующую или одну из следующих. Обычно это начальные буквы латинских названий элементов: Cu — медь (cuprum), Ag — серебро (argentum), Fe — железо (ferrum), Au — золото (aurum), Hg — ртуть (hydrargirum). Такая система химических символов была предложена в 1811 г. шведским химиком Я. Берцелиусом.
Цифрами меньшего размера возле символа элемента обозначаются: слева вверху — атомная масса, слева внизу — порядковый номер, справа вверху — заряд иона, справа внизу — число атомов в молекуле [7] :
| атомная масса | заряд иона |
| Символ элемента | |
|---|---|
| порядковый номер | число атомов в молекуле |
Временные символы элементов состоят из трёх букв, представляющих аббревиатуру их атомного номера на латыни.
В Периодической таблице карточка химического элемента обычно включает следующие характеристики:
Распространённость химических элементов в природе
Из всех химических элементов в природе найдено 88; такие элементы, как технеций Tc (порядковый номер 43), прометий Pm (61), астат At (85) и франций Fr (87), а также все элементы, следующие за ураном U (порядковый номер 92), впервые получены искусственно. Некоторые из них в исчезающе малых количествах обнаружены в природе.
Из химических элементов наиболее распространены в земной коре кислород и кремний. Эти элементы вместе с элементами алюминий, железо, кальций, натрий, калий, магний, водород и титан составляют более 99 % массы земной оболочки, так что на остальные элементы приходится менее 1 %. В морской воде, помимо кислорода и водорода — составных частей самой воды, высокое содержание имеют такие элементы, как хлор, натрий, магний, сера, калий, бром и углерод. Массовое содержание элемента в земной коре называется кларковым числом или кларком элемента.
Содержание элементов в коре Земли отличается от содержания элементов в Земле, взятой как целое, поскольку химсоставы коры, мантии и ядра Земли различны. Так, ядро состоит в основном из железа и никеля. В свою очередь, содержания элементов в Солнечной системе и в целом во Вселенной также отличаются от земных. Наиболее распространённым элементом во Вселенной является водород, за ним идёт гелий. Исследование относительных распространённостей химических элементов и их изотопов в космосе является важным источником информации о процессах нуклеосинтеза и об эволюции Солнечной системы и небесных тел.
Классификация химических элементов
Химические элементы как составная часть химических веществ
Химические вещества могут состоять как из одного химического элемента (простое вещество), так и из разных (сложное вещество или химическое соединение).
В обычных условиях 11 элементов существуют в виде газообразных простых веществ (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn), 2 — жидкости (Br и Hg), остальные элементы образуют твёрдые тела.
См. также
Ссылки
Примечания
 | Химический портал — мир химии, веществ и превращений на страницах Википедии. |
Полезное
Смотреть что такое «Химический элемент» в других словарях:
химический элемент — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN chemical element A substance made up of atoms with the same atomic number; common examples are hydrogen, gold, and iron. (Source: MGH)… … Справочник технического переводчика
ХИМИЧЕСКИЙ ЭЛЕМЕНТ — совокупность атомов, имеющих одинаковый заряд ядра и, следовательно, одинаковое число электронов в электронной оболочке. Многие из них имеют несколько (см.). Хим. элементы обозначают знаками химическими (см. (9)), а их закономерную взаимосвязь… … Большая политехническая энциклопедия
химический элемент — совокупность атомов с одинаковым зарядом ядра Z (одинаковым порядковым, или атомным, номером в периодической системе химических элементов). В таблицу химических элементов, издаваемую ИЮПАК, на 1998 внесено 109 элементов, имеющих названия (имеются … Энциклопедический словарь
химический элемент — ▲ атом ↑ с, определенный, заряд, атомное ядро элемент, химический элемент вид атомов, обладающих одинаковым зарядом ядра (железо #). атомный [порядковый] номер равен числу протонов в атомном ядре. атомный вес. ▼ водород, гидроген. кислород,… … Идеографический словарь русского языка
химический элемент — cheminis elementas statusas T sritis chemija apibrėžtis Atomų rūšis, turinti vienodą branduolio krūvį. atitikmenys: angl. chemical element; element rus. химический элемент; элемент ryšiai: sinonimas – elementas … Chemijos terminų aiškinamasis žodynas
химический элемент — cheminis elementas statusas T sritis Standartizacija ir metrologija apibrėžtis Atomų rūšis, turinti vienodą branduolio krūvį. atitikmenys: angl. chemical element vok. chemisches Element, n rus. химический элемент, m pranc. élément chimique, m … Penkiakalbis aiškinamasis metrologijos terminų žodynas
химический элемент — cheminis elementas statusas T sritis chemija apibrėžtis Elektrocheminio elemento tipas. atitikmenys: angl. chemical element rus. химический элемент … Chemijos terminų aiškinamasis žodynas
химический элемент — cheminis elementas statusas T sritis fizika atitikmenys: angl. chemical element vok. chemisches Element, n rus. химический элемент, m pranc. élément chimique, m … Fizikos terminų žodynas
ХИМИЧЕСКИЙ ЭЛЕМЕНТ — вид атомов, обладающих одинаковым зарядом ядра. X. э. в свободном состоянии являются простыми (не разложимыми хим. методами на более простые) в вами. Мн. X. э. состоят из неск. изотопов. Взаимосвязь X. э. отражает периодическая система элементов… … Большой энциклопедический политехнический словарь
ХИМИЧЕСКИЙ ЭЛЕМЕНТ — совокупность атомов с одинаковым зарядом ядра Z (одинаковым порядковым, или атомным, номером в периодической системе химических элементов). В таблицу X. э., издаваемую ИЮПАК, на 1998 внесено 109 элементов, имеющих названия (есть сведения о… … Естествознание. Энциклопедический словарь
Что относится к химическим элементам
Выдающийся русский учёный, химик, физик и энергетик. Самым значимым его вкладом в науку стало открытие периодического закона, графическое выражение которого получило название Периодической системы химических элементов.
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Существует легенда, якобы знаменитая таблица явилась Менделееву во сне. Но сам Дмитрий Иванович эту информацию не подтвердил. Он действительно нередко засиживался над работой до поздней ночи и засыпал, продолжая размышлять над решением задачи, однако факт мистического озарения во сне учёный отрицал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сел и вдруг — готово!».
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Структура Периодической системы элементов
На настоящий момент Периодическая таблица Менделеева содержит 118 химических элементов. Каждый из них занимает своё место в зависимости от атомного числа. Оно показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Периоды — это строки таблицы. На данный момент их семь. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Группы — это столбцы. В группы в Периодической таблице объединяются элементы с одинаковым числом электронов на внешнем энергетическом уровне их атомов. В кратком варианте таблицы, используемой в школьных учебниках, элементы разделены на восемь групп. Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.
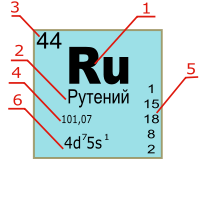
Каждый элемент обозначается одной или двумя латинскими буквами. Порядковый номер элемента (число протонов в его ядре) обычно пишется в левом верхнем углу. Также в ячейке элемента указана его относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учётом их содержания в природе. Поэтому обычно она является дробным числом.
Чтобы узнать количество нейтронов в ядре элемента, необходимо вычесть его порядковый номер из относительной атомной массы (массового числа).
Свойства Периодической системы элементов
Расположение химических элементов в таблице Менделеева позволяет сопоставлять не только их атомные массы, но и химические свойства.
Вот как они изменяются в пределах группы (сверху вниз):
В пределах периодов (слева направо) свойства элементов меняются следующим образом:
Элементы Периодической таблицы Менделеева
По положению элемента в периоде можно определить его принадлежность к металлам или неметаллам. Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Щелочные металлы
Первая группа главная подгруппа элементов (IA) — щелочные металлы. Это серебристые вещества (кроме цезия, он золотистый), настолько мягкие, что их можно резать ножом. Поскольку на их внешнем электронном слое находится только один электрон, они очень легко вступают в реакции. Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
Щелочноземельные металлы
Вторая группа главная подгруппа (IIА) представлена щелочноземельными металлами с двумя электронами на внешнем энергетическом уровне атома. Бериллий и магний часто не относят к щелочноземельным металлам. Они тоже имеют серебристый оттенок и легко взаимодействуют с другими элементами, хотя и не так охотно, как металлы из первой группы главной подгруппы. Температура плавления щелочноземельных металлов выше, чем у щелочных. Ионы магния и кальция обусловливают жёсткость воды.
Лантаноиды и актиноиды
В третьей группе побочной подгруппе (IIIB) шестого и седьмого периодов находятся сразу несколько металлов, сходных по строению внешнего энергетического уровня и близких по химическим свойствам. У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.
Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Переходные металлы
Элементы побочных подгрупп, кроме лантаноидов и актиноидов, называют переходными металлами. Они вполне укладываются в привычные представления о металлах — твёрдые (за исключением жидкой ртути), плотные, обладают характерным блеском, хорошо проводят тепло и электричество. Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Неметаллы
Правый верхний угол таблицы до инертных газов занимают неметаллы. Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Подгруппа углерода
Четвёртую группу главную подгруппу (IVА) называют подгруппой углерода. Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Углерод образует несколько аллотропных модификаций — вариантов простых веществ, отличающихся по своему строению, а именно: графит, алмаз, фуллерит и другие.
Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы). Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Подгруппа азота
Пятую группу главную подгруппу (VA) называют пниктогенами или подгруппой азота. В ходе реакций эти элементы могут как отдавать электроны, так и принимать их, завершая внешний энергетический уровень.
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
Азот — основное вещество в составе атмосферы нашей планеты. Некоторые элементы подгруппы азота токсичны для человека (фосфор, мышьяк, висмут). При этом азот и фосфор являются важными элементами почвенного питания растений, поэтому они входят в состав большинства удобрений. Азот и фосфор также участвуют в формировании важнейших молекул живых организмов — белков и нуклеиновых кислот.
Подгруппа кислорода
Халькогены или подгруппа кислорода — элементы шестой группы главной подгруппы (VIA). Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Кислород образует две аллотропные модификации — кислород и озон — тот самый газ, который образует экран в атмосфере планеты, защищающий живые организмы от жёсткого космического излучения.
Кислород и сера легко образуют прочные соединения с металлами — оксиды и сульфиды. В виде этих соединений металлы часто входят в состав руд.
Галогены
Седьмая группа главная подгруппа (VIIA) представлена галогенами — неметаллами с семью электронами на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей. Например, хлор входит в состав обычной поваренной соли.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
Инертные газы
Инертные газы, расположенные в последней, восьмой группе главной подгруппе (VIIIA) — элементы с полностью заполненным внешним электронным уровнем. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными», проводя параллель с представителями высшего общества, которые брезгуют контактировать с посторонними.
У инертных газов есть удивительная способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Гелий обладает массой всего в два раза больше массы молекулы водорода, но, в отличие от последнего, не взрывоопасен и используется для заполнения воздушных шаров.
У нас вы сможете учиться в удобном темпе, делать упор на любимые предметы и общаться со сверстниками по всему миру.

Интересное по рубрике
Найдите необходимую статью по тегам
Подпишитесь на нашу рассылку
Мы в инстаграм
Домашняя онлайн-школа
Помогаем ученикам 5–11 классов получать качественные знания в любой точке мира, совмещать учёбу со спортом и творчеством

Рекомендуем прочитать
Реальный опыт семейного обучения
Звонок по России бесплатный
Посмотреть на карте
Если вы не нашли ответ на свой вопрос на нашем сайте, включая раздел «Вопросы и ответы», закажите обратный звонок. Мы скоро свяжемся с вами.





.jpg)

.jpg)

.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)















