Что относится к газообразным
Газообразные тела
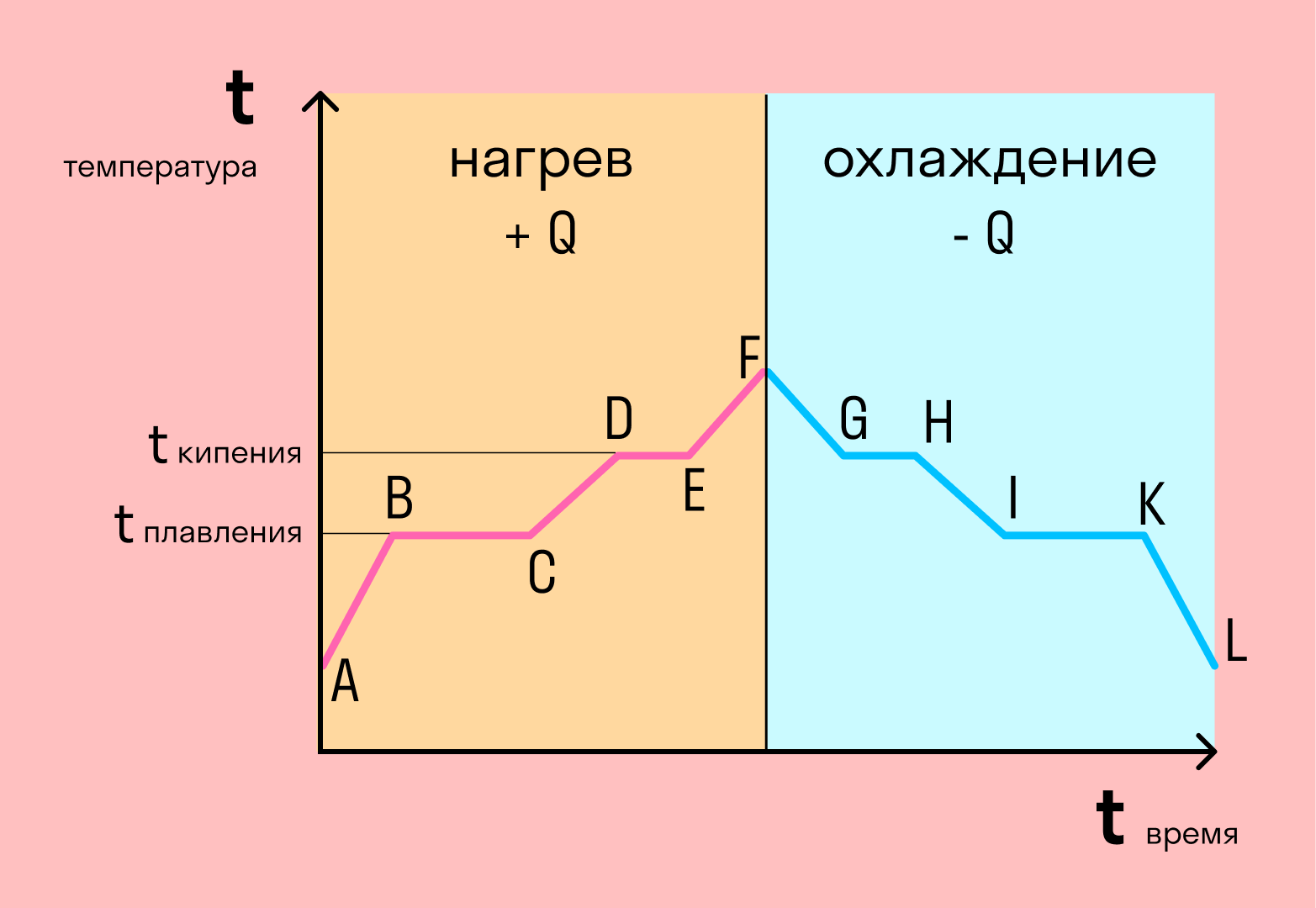
Изучив свойства и строение твёрдых, жидких и аморфных тел, для которых характерны дальний или ближний порядок в расположении частиц, перейдём к рассмотрению свойств и строения газообразных тел. Для газов характерно полное отсутствие порядка в расположении и движении частиц. Как говорят физики, во всех газах их частицы расположены и движутся хаотически (греч. «хаос» – беспорядок).
Вы знаете много газов: водород, кислород, углекислый газ, водяной пар, пары ртути, азот, озон, хлор, воздух (как смесь газов). Все они очень разные. Водород лёгкий, а углекислый газ тяжёлый; азот не пахнет, а озон «щиплет» нос; водяные пары безвредны, а пары ртути ядовиты; воздух бесцветный, а хлор имеет жёлто-зелёный цвет. Эти свойства у газов разные, но есть и общие.
Во-первых, все газы очень хорошо поддаются сжатию. Их можно сжать в 100 и более раз. Во-вторых, все газы подчиняются закону Паскаля, передавая оказанное на них давление в другие части сосуда. В-третьих, в отличие от жидкостей, газы всегда оказывают давление, даже в невесомости. Как же можно объяснить эти общие свойства всех газов? На этот вопрос отвечает молекулярно-кинетическая теория.
 |
Строение газообразных тел. При обычных условиях расстояния между частицами газа во много раз больше размеров самих частиц, а кинетическая энергия их движения гораздо больше (по модулю) потенциальной энергии их притяжения друг к другу и/или к Земле. Поэтому частицы газа практически свободно летают, сталкиваясь друг с другом и «бомбардируя» стенки сосуда, в котором находятся.
Таково объяснение давления газов. Оно будет справедливым и в условиях невесомости, где давление газов сохраняется в отличие от давления твёрдых и жидких тел.
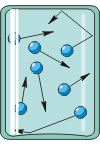
Заметим, что давление жидкости имеет совсем иное происхождение: вышележащие слои жидкости своим весом придавливают нижележащие слои (поэтому по мере опускания ко дну сосуда давление возрастает). В каждом слое из-за частых соударений частиц давление передаётся во все стороны, в том числе и на стенки сосуда. Поэтому в условиях невесомости (где жидкость и её отдельные слои не имеют веса) давление жидкости на дно и стенки сосуда будет равно нулю.
 |
Это важное отличие происхождения давления газа от давления жидкости подтверждает опыт. На рисунке изображены два сосуда: левый – с жидкостью, а правый – с газом. Сосуды снабжены манометрами: вблизи дна, в средней части и вблизи горловины. Взгляните: у сосуда с газом манометры показывают одинаковые давления, а у сосуда с жидкостью – возрастающие значения по мере опускания. Причина этого – различный «механизм» происхождения давления в жидкостях и газах.
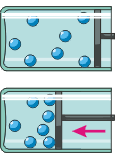 |
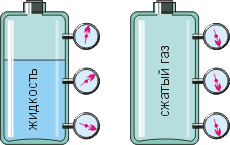
Объясним теперь свойство газов легко поддаваться сжатию и подчиняться закону Паскаля. Обратимся к рисунку. Вдвинув поршень, мы уплотним расположение частиц вблизи него. Однако вскоре эти частицы разлетятся по всему объёму сосуда, и в результате газ станет более плотным, а «бомбардировка» его частицами стенок сосуда – более интенсивной. То есть газ передаст оказанное на него давление поршня во все стороны.
Вспомним, что при увеличении температуры газа его давление возрастает (см. § 4-г). МКТ легко объясняет этот факт. Повышение температуры приводит к увеличению скорости движения частиц газа, поэтому «бомбардировка» частицами стенок сосуда усиливается, что и означает возрастание давления газа.
Газообразные вещества

Всего получено оценок: 365.
Всего получено оценок: 365.
Соединение, находящееся в одном из основных агрегатных состояний, при котором составные частицы слабо связаны между собой, называется газом или газообразным веществом. Частицы газа движутся хаотично и в некоторых случаях могут переходить в жидкое и твёрдое состояния.
Получение
Существуют вещества, которые при нормальных условиях сохраняются в газообразном агрегатном состоянии. Их можно разделить на две группы:
Газы выделяют из атмосферы или природного газа путём окисления и адсорбции примесей.
Образованию газообразного состояния веществ способствует изменение нормальных условий. Жидкие или твёрдые вещества нагревают, тем самым разрушая химические связи и высвобождая отдельные молекулы в воздух. Например, жидкая вода при нагревании легко превращается в водяной пар, а твёрдый йод выделяет фиолетовые пары.
В лабораториях газ получают путём разложения (сжигания) сложных веществ или реакцией жидких и твёрдых соединений. Способы получения некоторых газов:
Полученный газ обнаруживают разными способами. Например, пропускают через жидкость и наблюдают за изменением цвета, прозрачности (известковое молочко мутнеет в присутствии углекислого газа). Некоторые газы поддерживают горение или, наоборот, тушат тлеющую лучину.
Физические свойства
Молекулы газообразного вещества постоянно движутся, а расстояние между ними значительно превышает их диаметр. Благодаря такому расположению частиц газы не имеют формы, легко смешиваются и сжимаются.
Газообразные соединения приобретают форму сосуда, в котором находятся. Ударяясь о стенки сосуда с определённой скоростью, газы создают давление. Чем интенсивнее молекулы воздействуют на сосуд, тем выше давление.
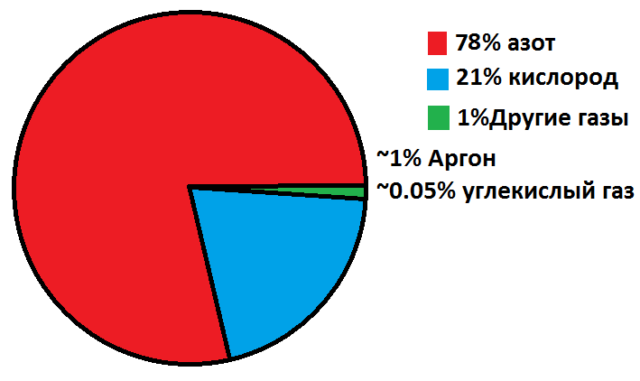
Различные газообразные соединения смешиваются между собой в любых пропорциях. Природный газ – это смесь метана, водорода, сероводорода, углекислого газа, азота, гелия. Атмосфера состоит из смесей простых и сложных газообразных веществ – азота, кислорода, водорода, углекислого газа, водяного пара.
При сжатии объём газов становится значительно меньше. Например, объём кислорода уменьшается в 200 раз.
Описание некоторых газообразных веществ представлено в таблице.
Формула
Физические свойства
Нахождение в природе
В земной коре – 1 %, незначительное количество в атмосфере. Большая часть водорода присутствует в виде соединений
47 % земной коры состоит из кислорода. Моря и пресные водоёмы содержат 85 % кислорода. В атмосфере – 20 %
В атмосфере – 78 %. Один из наиболее распространённых элементов, найденных за пределами Земли. Входит в состав белков
Наиболее распространённый галоген. В природе встречается только в составе минералов
В атмосфере содержится меньше 1 %
Бесцветный газ с резким запахом. В два раза тяжелее воздуха. Хорошо растворяется в воде
Образуется путём разложения азотсодержащих веществ
За счёт свободного движения молекул газ равномерно распространяется в ограниченном пространстве. Такое явление называется диффузией. Яркий пример диффузии – распространение запахов. При приготовлении пищи на кухне запах постепенно распространяется по всей квартире.
Что мы узнали?
Газ – вещество, состоящее из хаотично движущихся частиц – молекул или атомов. Газообразные соединения можно получить выделением из атмосферы путём адсорбции и окисления. Также газ получают из жидких и твёрдых веществ путём изменения условий или взаимодействием простых и сложных веществ. Газы не имеют формы, легко смешиваются между собой и равномерно распределяются в закрытом пространстве. Наиболее распространённый газ в атмосфере – азот. Самый лёгкий газ.
Газообразные вещества и их характеристика
Газообразные вещества – вещества со слабыми связями между частицами. Главные свойства газов – это подвижность и хаотичное движение частиц, направление которых меняется при столкновении. Газ – одно из 4 агрегатных состояний веществ, которые на сегодняшний день известны науке.
Четыре агрегатных состояния вещества
Газообразное состояние вещества – одно из трех «классических». Помимо него, выделяются также твердые и жидкие вещества. В последнее время в учебниках встречается определение и четвертого агрегатного состояния – плазмы. Это ионизированные (частично или полностью) газы. Четвертый тип агрегатного состояния был выявлен при изучении космоса, и, оказывается, он встречается во Вселенной чаще всего. Плазма – это составная часть многих планет, основа звезд, туманностей, высших слоев атмосферы Земли.
Далее речь пойдет о газах. Они были открыты сравнительно недавно, позже жидких и твердых веществ, так как не поддавались изучению человеческим глазом. Развитие науки в сфере газообразных соединений началось с XVII века.
Краткая история открытия газов
Современное название газам дал Жан Баптист ван Гельмонт (1580-1644), голландский химик. В первые годы XVII века он экспериментальным путем впервые получил «мертвый воздух» (углекислый газ). С этого и началось изучение газообразных соединений. Слово «газ» Гельмонт выбрал для названия по аналогии с греческим словом «хаос», так как, по его словам, видел в полученном им «паре» сходство с «хаосом древних». Но некоторые ученые спорят, что принятое сейчас обозначение все же пошло от немецкого «gasen», что в переводе означает «кипеть».
Больше всего открытий ученые совершили позже, уже в XVIII-XIX веках. В 1802 г. французский исследователь Гей-Люссак открыл закон теплового расширения газов: при повышении температуры увеличивается объем газообразных веществ. Вдохновленный его примером, в 1811 итальянский химик Амедео Авогадро открыл закон, который позднее назвали его же именем. Закон звучит так: «число молекул всегда одно и то же в одинаковых объемах любых газов». Иными словами, в 1 моле любого газообразного вещества при одинаковых условиях (давление, температура) одно и то же число частиц. Это число – число Авогадро: 6,02 * 1023.
Помимо выделения общих законов, в тот же период ученые постепенно открывали отдельные газы:
На июль 2017 года открыто 826 газов, а в будущем, возможно, к газообразному агрегатному состоянию припишут еще 90 веществ. Многие открытые газы не природные, они получены в лабораторных условиях.
Свойства газообразных веществ
Выделяется целый ряд физических и химических свойств газов. Основные физические свойства:
Если же газ подвергнуть высоким температурам, сначала он станет разреженным. Увеличится скорость теплового движения частиц. При достижении определенного температурного показателя произойдет тепловая ионизация, вещество перейдет в следующее агрегатное состояние – плазму.
Некоторые газы не имеют цвета, другие же заметны человеческому глазу. Например, I2, йод. Это вещество получают путем сублимации кристаллов йода, и его клубы имеют ярко выраженный фиолетовый оттенок. Но большинство соединений все же бесцветные, прозрачные и легкие, поэтому долгое время их не могли открыть и изучить.
Классификация газов
Вещества в газообразном состоянии принято делить на несколько категорий. Классификацию часто просят отразить в конспектах во время школьных занятий. Рассмотрим самые распространенные ее типы.
Органические и не органические
Органическими газами являются те вещества, которые содержат углерод. Примеры:
Простые и сложные
Органические и не органические газы, в свою очередь, делятся на простые и сложные. Перечисленные выше органические соединения – сложные. В них содержатся разные атомы: ацетилен (C2H2) – 2 атома углерода и 2 атома водорода, этилен (С2Н4) – 2 атома углерода и 4 водорода. Если же газ получается из одного или нескольких атомов одного и того же элемента таблицы Менделеева, его называют простым.
Простые газы: кислород O2, азот O3, водород H2, хлор Cl2. Перечислять можно и дальше.
Газообразные вещества в химии
Газы в химии начинают изучать в 8 классе. Рассмотрим основные свойства, которые принято включать в учебники по предмету.
Атомы или молекулы газов соединяются между собой ковалентными связями. Они очень слабые и часто рвутся, именно поэтому вещества в газообразном агрегатном состоянии способны заполнять произвольные объемы и емкости разных форм. Бывают два вида строения решеток у газов:
На уроках химии газообразные вещества часто получают в лабораторных условиях. Для этого могут пользоваться разными методами: нагревать жидкость, твердые вещества, добиваться реакции между сложными соединениями. Некоторые формулы реакций:
Zn + 2HCl = ZnCl2 + H2 – водород.
NH4Cl + NaOH = NaCl + H2O + NH3 – аммиак
CaCO3 + 2HCl = CaCl2 + H2O + CO2 – углекислый газ.
Так как многие газы прозрачны и не имеют запаха, используются дополнительные методы их обнаружения. Одни соединения усиливают пламя, другие останавливают горения. Ряд газообразных веществ может менять цвет взвешенной в воде извести, делать жидкость мутнее.
Примеры газов
В списке газов свыше 800 наименований. Стоит рассмотреть самые распространенные:
Все перечисленные газы входят в состав воздуха и образуют земную атмосферу. Но большая часть, 98-99%, приходится на азот и кислород.
Если имеется желание, познакомиться с газообразными веществами поближе всегда можно при помощи лабораторных экспериментов. Однако при работе с газами нужно соблюдать предельную осторожность.
Химия
Лучшие условия по продуктам Тинькофф по этой ссылке
Дарим 500 ₽ на баланс сим-карты и 1000 ₽ при сохранении номера
. 500 руб. на счет при заказе сим-карты по этой ссылке
Лучшие условия по продуктам
ТИНЬКОФФ по данной ссылке
План урока:
В мире множество веществ, которые могут принимать разную форму. Вода в чайнике жидкая, а если начать ее кипятить, то она станет паром. Если эту же воду поставить в морозильную камеру, то она затвердевает. Вещества на нашей планете как актеры, которые могут играть разные роли.
Агрегатное состояние – принятие химическими веществами разной формы в зависимости от изменений внешней среды. Всего существует четыре состояния – газовое, жидкое, твердое, плазменное. Но к агрегатным относятся только три состояния– газ, жидкость и твердые вещества. В плазменном состоянии не сохраняется атомно-молекулярный состав вещества, а в трех других – сохраняется.
Агрегатное состояние вещества и фазовые переходы. Гуглдиск
Процесс перехода одного состояния в другое называется фазовым переходом. Он характеризуется изменением структуры связей между атомами, молекулами или ионами. Фазовый переход сопровождается поглощением или выделением теплоты. Ему сопутствуют скачкообразные изменения физических и химических свойств — плотности, растворимости и др.
Вещество изменяет агрегатное состояние при следующих условиях.
Газообразное состояние
Газ – состояние, при котором частицы вещества слабо связаны друг с другом, занимают все пространство и движутся хаотично. Расстояния между атомами и молекулами значительно превышают их размеры. Газовое состояние можно сравнить с футбольным полем, на котором быстро и независимо друг от друга передвигаются спортсмены. Футболисты, как и молекулыв газообразном состоянии, взаимодействуют только когда сталкиваются или близко подходят друг к другу.
Расположение молекул газа.
Газообразное состояние находится в виде различных запахов. У газов нет формы и объема, поэтому частицы распространяются по всему пространству. Например, запах газа из невыключеннойплиты быстро охватывает всю квартиру благодаря хаотичности движения молекул и их стремлению заполнить все помещение.
Газы обладают следующими особенными свойствами.
Газообразноеагрегатное состояние веществаможно оценивать как насыщенный и ненасыщенный пар. Если число молекул, вылетающих из жидкости, станет равным числу молекул пара, возвращающихся в жидкость, то возникает динамическое равновесие между паром и жидкостью – состояние насыщенного пара. В ненасыщенном такого равновесия нет.
При нахождении жидкости в открытом сосуде, объем вещества уменьшается из-за испарения. Если поместить ту же жидкость в закрытый сосуд, объем вещества останется прежним. Сначала начнется процесс испарения и продолжается до тех пор, пока число покинувших жидкость молекул не станет равно возвратившимся назад из паров. Т.е. в закрытом сосуде возникает динамическое равновесие. Изменение внутренней энергии вещества определяется по формуле:
ΔU = ± mr, где m — масса тела, r — удельная теплота парообразования.
Переход веществиз газообразногов жидкое состояние, называется сжижением. Увеличение давления и понижение температуры приводит к уменьшению расстояний между молекулами, увеличению силы взаимодействия и превращению в жидкость. Сжижение характеризуется критической температурой. Она определяется в точке, в которой переход газа в жидкость невозможен.
Жидкое состояние
Жидкость – состояние, в котором происходит заполнение частицами всего объема. В отличие от газов, у жидкости есть поверхность. Также для нее характерно высокое межмолекулярное взаимодействие и низкая сжимаемость. Частицы в жидкости располагаются как гости, приглашенные в небольшую квартиру. Приглашенные, как и молекулы, свободно передвигаются в пространстве и ведут себя по-разному. Из-за того, что гостей много, человеку необходимо постоянно оглядываться, чтобы ни на кого не натолкнуться. Присутствующиенаходятся близко друг к другу.
Жидкие вещества. Гуглдиск:
Жидкое агрегатное состояниеобладает особенным свойством – текучестью. Она объясняется тем, что частицы колеблются внутри квазикристаллической решетки и перемещаются между ними. Получается сложная траектория — колебания вокруг центра, перемещающегося в пространстве.
Твердое состояние
Твердому состоянию свойственна высокая степень упорядоченности частиц. Каждая молекулаколеблется около среднего положения, оставаясь жестко связанной с соседями и образуя кристаллическую решетку. Твердое агрегатное состояние напоминает воинскую часть, в которой все подчиняется строгим правилам. В строю, как и в твердых веществах, каждому солдату предоставлено определенное место. Самостоятельное перемещение внутри строя запрещается. Солдаты стоят плотно плечом к плечу, расстояния между ними маленькие. Столкновения внутри строя невозможны.
Твердые вещества имеют форму и сохраняют свой объем. Их классифицируют на несколько видов.
Аморфные тела по свойствам напоминают жидкости,так как их молекулы передвигаются между хаотично расположенными условными центрами. Примерами аморфных веществ служат пластмассы, смолы и другие неметаллы. Примеры кристаллических тел – железо, серебро и другие металлы.
Нагревание кристаллических веществ ведет к нарушению расположения частиц и увеличению расстояний между ними. При достижении температуры плавленияпроисходит перестройка молекул, и твердое тело превращаетсяв жидкое. Количество теплоты, которое необходимо для расплавления некоторой массы веществ, подчиняется формуле:
Q = km, где k — удельная теплота плавления этого вещества, m — его масса.
Плазма
Плазма – не выдумка из фантастических фильмов и книг, а ионизированный газ. Она характеризуется одновременным присутствием нейтральных и заряженных частиц. Ионизаторы воздуха строятся на принципе перехода из газообразного вещества в плазму.
Получить плазму сложно, т.к. для этого вещество необходимо нагревать до температур порядка сотен тысяч градусов и выше. Полученная смесь состоит из электронов, ядер и положительно заряженных ионов. Плазма электронейтральна, но обладает высокой проводимостью. Внутри нее происходят непрерывные разрежения и сгущения, сопровождающиеся образованием плазмоидов — упорядоченных структур правильной формы. Хотя плазма на нашей планете – редкое явление, каждый человек хотя бы раз в жизни сталкивался с ней. Плазменное состояние характерно для северного сияния и молний. В масштабах Вселенной основная масса вещества находится в виде плазмы.
Сводная таблица агрегатных состояний
Области применения агрегатных состояний
Способность веществ переходить из одного агрегатного состояния в другой активно используется человеком. На ней основаны многие промышленные процессы.
Таким образом, без различных агрегатных состояний невозможно было бы представить жизнь на планете. Фазовые переходы веществ используются практически во всех областях жизнедеятельности.
Основные агрегатные состояния вещества
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Агрегатные состояния вещества
Чтобы разобраться с тем, какими бывают агрегатные состояния, предлагаю по ходу чтения статьи заполнять таблицу.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Лед, вода и водяной пар — это все три агрегатных состояния одного вещества. Лед — твердое состояние, вода — жидкая, пар — газообразное. Для каждого вещества существует три состояния.
Твердое состояние
Его очень легко представить — это любой предмет, который мы встречаем в жизни. В этом состоянии тело сохраняет форму и объем. Расстояние между молекулами, приблизительно равно размеру самих молекул, которые, в свою очередь, расположены очень структурированно.
Такая структура называется кристаллической решеткой — из-за четкой структуры молекулам сложно двигаться, и они просто колеблются около своих положений.
Заполняем нашу табличку
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
Жидкое состояние
В этом состоянии сохраняется объем, но не сохраняется форма. Например, если перелить молоко из кувшина в стакан, то молоко, имевшее форму кувшина, примет форму стакана. Кстати, в корове у молока тоже была другая форма.
Расстояние между молекулами в жидком состоянии чуть больше, чем в твердом, но все равно невелико. При этом частицы не собраны в кристаллическую решетку, а расположены хаотично. Молекулы почти не двигаются, но при нагревании жидкости делают это более охотно.
Вспомните, что происходит, если залить чайный пакетик холодной водой — он почти не заваривается. А вот если налить кипяточку — чай точно будет готов.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
Газообразное состояние
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
С агрегатными состояниями разобрались, ура! Но до сих пор неясно, каким образом у каждого вещества их целых три, и как одно переходит в другое. Для этого узнаем, что такое фазовые переходы.
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
График фазовых переходов
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.
Разбираемся по шагам. Сначала взяли лед, конечно, при отрицательной температуре, потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов).
После того, как лед нагрелся до температуры плавления, он начинает плавиться. Плавление происходит при постоянной температуре тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
Расправившись вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс аналогично плавлению происходит при постоянной температуре. Данный процесс нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой.
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
Первый шаг в обратную сторону — охлаждение до температуры кипения.
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
После кристаллизации лед охлаждается.
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Плавление
Кристаллизация
Q — количество теплоты [Дж]
λ — удельная теплота плавления вещества [Дж/кг]
m — масса [кг]
Парообразование
Конденсация
Q — количество теплоты [Дж]
L — удельная теплота парообразования вещества [Дж/кг]
m — масса [кг]
Онлайн-уроки физики в Skysmart не менее увлекательны, чем наши статьи!
Решение задач по фазовым переходам
С теорией разобрались — а теперь давайте практиковаться!
Задачка раз. Температура медного образца массой 100 г повысилась с 20 °С до 60 °С. Какое количество теплоты получил образец? Удельную теплоёмкость меди считать равной 380 Дж/(кг умножить на °С)
Q = 380 * 0,1*(60-20) = 1520 Дж
Ответ: образец получил 1520 Дж
Задачка два. Какое количество теплоты необходимо для плавления 2,5 т стали, взятой при температуре плавления? Удельная теплота плавления стали λ=80кДж/кг. Теплопотерями пренебречь.
80 кДж/кг = 80000 Дж/кг
Q = 80000*2500 = 200 000 000 Дж = 200 МДж
Ответ: для плавления 2,5 т стали необходимо 200 МДж теплоты.
Сублимация и десублимация
Мы уже рассказали про такие процессы, как сублимация и десублимация.
Примерчики из жизни🤓
Про принтеры. Цветные принтеры (только не лазерные) печатают путем сублимации. Вот как это работает: частицы краски быстро переходят из твердого состояния в газообразное и оседают на бумаге — так получается цветная картинка.
Рисуночки на окнах. Если вы решите проехаться на автобусе в холодную погоду — увидете на стеклах чудесные узоры. Из-за огромной разницы температур между улицей и автобусом, мы можем наблюдать процесс десублимации в виде красивых рисунков на стеклах. Иней образуется похожим способом — резкое похолодание приводит к десублимации воздуха.
Влажность воздуха: испарение и конденсация
Такие процессы, как испарение и конденсация, становятся более логичными и простыми, если их рассмотреть на примере влажности воздуха.
Влажность воздуха говорит нам о том, сколько в воздухе содержится водяного пара. Любое количество пара в воздух не запихнешь, поэтому, во-первых, его там очень мало, а во-вторых, при избыточном количестве водяного пара происходит конденсация — это когда образуется роса.
Как влажность влияет на человека
Для человека влажность очень важна, потому что мы состоим из воды на 90%. Если окружающей среде нечего испарять, она будет испарять нас. Поэтому при низкой влажности мы чувствуем сухость во рту, а при высокой — волосы впитывают влагу, разбухают и начинают виться. На этом принципе построены некоторые гигрометры — приборы для измерения влажности. Они так и называются — волосяные гигрометры. Только внутри не человеческий волос, а конский, но принцип от этого не меняется.
При высокой влажности холод и тепло воспринимаются более чувствительно. Это связано с потливостью человека при высокой температуре. Такой механизм помогает нам бороться с жарой, но при высокой влажности пот не может испариться. При испарении пота мы теряем избыточное тепло, а в данном случае этого не происходит.
При низкой влажности происходит нечто похожее. Как ни странно, в мороз мы тоже потеем (намного меньше, но все-таки это происходит). Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно, а при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве.
Влажностью можно управлять. Существуют мешочки с шариками адсорбентами, которые кладут в коробки с обувью, чтобы впитать лишнюю влагу. Чтобы окна не запотевали, можно насыпать в рамы соль, которая также впитает влагу. А если вам наоборот нужно больше влаги — берем увлажнитель воздуха (классная вещь!): он добавляет в воздух водяной пар.