Что определяют законы кристаллизации
ЗАКОН ПОСЛЕДОВАТЕЛЬНОСТИ КРИСТАЛЛИЗАЦИИ
Полезное
Смотреть что такое «ЗАКОН ПОСЛЕДОВАТЕЛЬНОСТИ КРИСТАЛЛИЗАЦИИ» в других словарях:
ТЕОРИЯ ГЕОЭНЕРГЕТИЧЕСКАЯ — метод анализа геохим. процессов, созданный в 1933 1937 гг. Ферсманом. Основан на следующем положении: разнообразные свойства атомов, реализуемые в разл. образующихся соединениях, а также свойства среды или условия существования атомов и их… … Геологическая энциклопедия
КРИСТАЛЛИЗАЦИЯ — процесс роста к ла с момента зарождения. К. может происходить из жидкого состояния (раствора, расплава; магмы; фазовый переход), газообразного (см. Сублимация) и твердого. См. Перекристаллизация, Метасоматоз, Потоки концентрационные, Регенерация… … Геологическая энциклопедия
Магма — (от греч. mágma густая мазь) расплавленная масса преимущественно силикатного состава, образующаяся в глубинных зонах Земли. Обычно М. представляет собой сложный взаимный раствор соединений большого числа химических элементов, среди… … Большая советская энциклопедия
Лад — (греч. armonia, лат. modulatio, modus, франц. и англ. mode, итал. modo, нем. Tongeschlecht; слав. лад согласие, мир, стройность, порядок). Содержание I. Определение лада 130 II. Этимология 130 III. Сущность лада 130 IV. Интонационная… … Музыкальная энциклопедия
КОГЕН — (Cohen) Герман (1842 1918) немецкий философ, основатель и виднейший представитель марбургской школы неокантианства. Основные работы: ‘Теория опыта Канта’ (1885), ‘Обоснование Кантом этики’ (1877), ‘Обоснование Кантом эстетики’ (1889), ‘Логика… … История Философии: Энциклопедия
Хлопин, Виталий Григорьевич — В Википедии есть статьи о других людях с такой фамилией, см. Хлопин. Виталий Григорьевич Хлопин Дата рождения … Википедия
МИНЕРАЛЫ И МИНЕРАЛОГИЯ — Минералы твердые природные образования, входящие в состав горных пород Земли, Луны и некоторых других планет, а также метеоритов и астероидов. Минералы, как правило, довольно однородные кристаллические вещества с упорядоченной внутренней… … Энциклопедия Кольера
Лекарственные средства — (лекарственные препараты, медикаменты) (новолат. praeparatum medicinale, новолат. praeparatum pharmaceuticum, новолат. medicamentum[1]; жарг. лечебное средство, лекарство) лекарственное вещество, субстанция или смесь… … Википедия
Лекарственное средство — Для термина «Препарат» см. другие значения. Различные формы твёрдых лекарственных средств: таблетки, капсулы … Википедия
Фюстель де Куланж — (Numa Denys Fustel de Coulanges, 1830 1889) знаменитый французский историк и одно из светил всей вообще новейшей европейской историографии. Собрат соотечественник (Г. Моно) сопоставляет Ф. де Куланжа, как умственную величину, с Монтескье и… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Законы кристаллизации, модифицирование, виды ликвации, строение стального слитка
Любое вещество может находиться в трех агрегатных состояниях: твердом, жидком, газообразном. Возможен переход из одного состояния в другое, если новое состояние в новых условиях является более устойчивым, обладает меньшим запасом энергии.
С изменением внешних условий свободная энергия изменяется по сложному закону различно для жидкого и кристаллического состояний. Характер изменения свободной энергии жидкого и твердого состояний с изменением температуры показан на рис. 3.1.
Рис.3.1. Изменение свободной энергии в зависимости от температуры
В соответствии с этой схемой выше температуры ТS вещество должно находиться в жидком состоянии, а ниже ТS – в твердом.
При температуре равной ТS жидкая и твердая фаза обладают одинаковой энергией, металл в обоих состояниях находится в равновесии, поэтому две фазы могут существовать одновременно бесконечно долго. Температура ТS – равновесная или теоретическая температура кристаллизации.
Для начала процесса кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Это возможно при охлаждении жидкости ниже температуры ТS. Температура, при которой практически начинается кристаллизация называется фактической температурой кристаллизации.
Охлаждение жидкости ниже равновесной температуры кристаллизации называется переохлаждением, которое характеризуется степенью переохлаждения ( 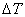
Степень переохлаждения зависит от природы металла, от степени его загрязненности (чем чище металл, тем больше степень переохлаждения), от скорости охлаждения (чем выше скорость охлаждения, тем больше степень переохлаждени).
Рассмотрим переход металла из жидкого состояния в твердое.
При нагреве всех кристаллических тел наблюдается четкая граница перехода из твердого состояния в жидкое. Такая же граница существует при переходе из жидкого состояния в твердое.
Кристаллизация – это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров.
Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию с минимумом свободной энергии.
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура. Кривая охлаждения чистого металла представлена на рис. 3.2.
Рис.3.2. Кривая охлаждения чистого металла


Процесс кристаллизации чистого металла:
До точки 1 охлаждается металл в жидком состоянии, процесс сопровождается плавным понижением температуры. На участке 1 – 2 идет процесс кристаллизации, сопровождающийся выделением тепла, которое называется скрытой теплотой кристаллизации. Оно компенсирует рассеивание теплоты в пространство, и поэтому температура остается постоянной. После окончания кристаллизации в точке 2 температура снова начинает снижаться, металл охлаждается в твердом состоянии.
Механизм и закономерности кристаллизации металлов.
При соответствующем понижении температуры в жидком металле начинают образовываться кристаллики – центры кристаллизации или зародыши. Для начала их роста необходимо уменьшение свободной энергии металла, в противном случае зародыш растворяется.
Минимальный размер способного к росту зародыша называется критическим размером, а зародыш – устойчивым.
Переход из жидкого состояния в кристаллическое требует затраты энергии на образование поверхности раздела жидкость – кристалл. Процесс кристаллизации будет осуществляться, когда выигрыш от перехода в твердое состояние больше потери энергии на образование поверхности раздела. Зависимость энергии системы от размера зародыша твердой фазы представлена на рис. 3.3.
Зародыши с размерами равными и большими критического растут с уменьшением энергии и поэтому способны к существованию.
Рис.3.3. Зависимость энергии системы от размера зародыша твердой фазы
Механизм кристаллизации представлен на рис.3.4.
Рис.3.4. Модель процесса кристаллизации
Центры кристаллизации образуются в исходной фазе независимо друг от друга в случайных местах. Сначала кристаллы имеют правильную форму, но по мере столкновения и срастания с другими кристаллами форма нарушается. Рост продолжается в направлениях, где есть свободный доступ питающей среды. После окончания кристаллизации имеем поликристаллическое тело.
Качественная схема процесса кристаллизации может быть представлена количественно кинетической кривой (рис.3.5).
Рис. 3.5. Кинетическая кривая процесса кристаллизации
Процесс вначале ускоряется, пока столкновение кристаллов не начинает препятствовать их росту. Объем жидкой фазы, в которой образуются кристаллы уменьшается. После кристаллизации 50 % объема металла, скорость кристаллизации будет замедляться.
Таким образом, процесс кристаллизации состоит из образования центров кристаллизации и роста кристаллов из этих центров.
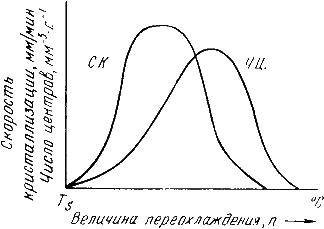
В свою очередь, число центров кристаллизации (ч.ц.) и скорость роста кристаллов (с.р.) зависят от степени переохлаждения (рис. 3.6).
Рис. 3.6. Зависимость числа центров кристаллизации (а) и скорости роста кристаллов (б) от степени переохлаждения
Размеры образовавшихся кристаллов зависят от соотношения числа образовавшихся центров кристаллизации и скорости роста кристаллов при температуре кристаллизации.
При равновесной температуре кристаллизации ТS число образовавшихся центров кристаллизации и скорость их роста равняются нулю, поэтому процесса кристаллизации не происходит.
Если жидкость переохладить до температуры, соответствующей т.а, то образуются крупные зерна (число образовавшихся центров небольшое, а скорость роста – большая).
При переохлаждении до температуры соответствующей т.в – мелкое зерно (образуется большое число центров кристаллизации, а скорость их роста небольшая).
Если металл очень сильно переохладить, то число центров и скорость роста кристаллов равны нулю, жидкость не кристаллизуется, образуется аморфное тело. Для металлов, обладающих малой склонностью к переохлаждению, экспериментально обнаруживаются только восходящие ветви кривых.
Условия получения мелкозернистой структуры
Стремятся к получению мелкозернистой структуры. Оптимальными условиями для этого являются: максимальное число центров кристаллизации и малая скорость роста кристаллов.
Размер зерен при кристаллизации зависит и от числа частичек нерастворимых примесей, которые играют роль готовых центров кристаллизации – оксиды, нитриды, сульфиды.
Чем больше частичек, тем мельче зерна закристаллизовавшегося металла.
Стенки изложниц имеют неровности, шероховатости, которые увеличивают скорость кристаллизации.
Мелкозернистую структуру можно получить в результате модифицирования, когда в жидкие металлы добавляются посторонние вещества – модификаторы,
По механизму воздействия различают:
1. Вещества не растворяющиеся в жидком металле – выступают в качестве дополнительных центров кристаллизации.
Строение металлического слитка
Схема стального слитка, данная Черновым Д.К., представлена на рис.3.7.
Рис. 3.7. Схема стального слитка
Слиток состоит из трех зон:
1. мелкокристаллическая корковая зона;
2. зона столбчатых кристаллов;
3. внутренняя зона крупных равноосных кристаллов.
Кристаллизация корковой зоны идет в условиях максимального переохлаждения. Скорость кристаллизации определяется большим числом центров кристаллизации. Образуется мелкозернистая структура.
Жидкий металл под корковой зоной находится в условиях меньшего переохлаждения. Число центров ограничено и процесс кристаллизации реализуется за счет их интенсивного роста до большого размера.
Рост кристаллов во второй зоне имеет направленный характер. Они растут перпендикулярно стенкам изложницы, образуются древовидные кристаллы – дендриты (рис. 3.8). Растут дендриты с направлением, близким к направлению теплоотвода.
Рис.3.8. Схема дендрита по Чернову Д.К.
Так как теплоотвод от незакристаллизовавшегося металла в середине слитка в разные стороны выравнивается, то в центральной зоне образуются крупные дендриты со случайной ориентацией.
Зоны столбчатых кристаллов в процессе кристаллизации стыкуются, это явление называется транскристаллизацией.
Для малопластичных металлов и для сталей это явление нежелательное, так как при последующей прокатке, ковке могут образовываться трещины в зоне стыка.
В верхней части слитка образуется усадочная раковина, которая подлежит отрезке и переплавке, так как металл более рыхлый (около 15…20 % от длины слитка)
Методы исследования металлов: структурные и физические
Металлы и сплавы обладают разнообразными свойствами. Используя один метод исследования металлов, невозможно получить информацию о всех свойствах. Используют несколько методов анализа.
Кристаллизация и осаждение
Оптимизация размера кристаллов, выхода реакции и чистоты продукта на специализированном оборудовании
Что такое кристаллизация?
Кристаллизация — процесс выстраивания атомов и молекул в жесткую кристаллическую решетку с хорошо определенной энергетически устойчивой структурой. Мельчайший структурный элемент кристаллической решетки — ячейка. Она способна принимать атомы и молекулы, и благодаря этому свойству формируется макроскопический кристалл. В процессе кристаллизации атомы и молекулы соединяются между собой под определенными углами, образуя характерную форму кристалла с гладкими поверхностями и гранями. Хотя кристаллизация происходит в природе, у нее также есть широкое промышленное применение. Она используется на этапе разделения и очистки при производстве фармацевтических и химических продуктов.
Условия процесса кристаллизации напрямую влияют на размер и форму кристаллов и чистоту кристаллического продукта. Важно понимать сущность процесса кристаллизации и правильно подбирать его параметры. Это позволит получать однородные кристаллы нужного размера, формы и чистоты, а также предотвратить проблемы на последующих этапах, такие как слишком долгое время фильтрации или недостаточная сушка.
Почему кристаллизация так важна?
Кристаллизация широко применяется для производства различных необходимых нам продуктов — начиная от пищи и лекарств и заканчивая топливом. Большинство продуктов агрохимической и фармацевтической промышленности в ходе разработки и производства подвергается нескольким этапам кристаллизации. С помощью этого процесса получают такие ключевые пищевые ингредиенты, как лактоза и лизин. Однако нежелательная кристаллизация может быть опасна — например, кристаллизация газовых гидратов в глубоководных трубопроводах.
Основные понятия кристаллизации
Кристаллизация
— это процесс образования твердой фазы в виде кристаллов из растворов или расплавов.
Кристалл
— тело, частицы которого (атомы, ионы или молекулы) расположены в трехмерной периодической структуре, принимающей естественную форму многогранника.
Осаждение
— синоним кристаллизации, однако этот термин чаще всего употребляется в отношении кристаллизации, которая происходит очень быстро в результате химической реакции.
Растворимость
— свойство вещества, его количество, которое способно раствориться в данном растворителе при данной температуре.
Насыщенный раствор
— раствор, содержащий максимальное количество вещества, которое способно раствориться в данном растворителе при данной температуре. Кристаллизация происходит в насыщенном растворе. Количество растворенного на тот момент вещества определяется его растворимостью.
Пересыщение
— разница между реальной и равновесной концентрациями растворенного вещества при данной температуре.
Виды кристаллизации
Кристаллизация происходит, когда растворимость вещества в растворе понижается каким-либо способом. Стандартные методы снижения растворимости:
b) добавление антирастворителя;
d) реакция (осаждение).
Выбор метода кристаллизации зависит от имеющегося оборудования, целей процесса кристаллизации, растворимости и стабильности растворенного вещества в выбранном растворителе.
Типичные сложности при кристаллизации
Кристаллизация происходит за счет нескольких взаимосвязанных процессов, на протекание которых влияют выбранные параметры. Основные этапы:
Данные процессы, которые часто протекают в скрытом виде, оказывают ключевое влияние на результат кристаллизации.
Этапы кристаллизации
Публикации по теме кристаллизации
Ознакомьтесь с подборкой статей по теме кристаллизации:
Классическая работа по нуклеации кристаллов из растворов
Jaroslav Nývlt, Kinetics of nucleation in solutions, Journal of Crystal Growth, Volumes 3–4, 1968.
Исследование механизмов выращивания кристаллов из раствора
Crystal Growth Kinetics, Material Science and Engineering, Volume 65, Issue 1, July 1984.
Описание причин, по которым в системах «растворенное вещество — растворитель» вместо кристаллизации происходит образование новой жидкой фазы
Kiesow et al., Experimental investigation of oiling out during crystallization process, Journal of Crystal Growth, Volume 310, Issue 18, 2008.
Подробное исследование причин агломерации кристаллов в процессе кристаллизации
Brunsteiner et al., Toward a Molecular Understanding of Crystal Agglomeration, Crystal Growth & Design, 2005, 5 (1), pp 3–16.
Исследование механизмов распада агломератов в процессе кристаллизации
Fasoli & Conti, Crystal breakage in a mixed suspension crystallizer, Volume 8, Issue 8, 1973, Pages 931–946.
Обзор алгоритмов разработки эффективных процессов кристаллизации в высокотехнологичных сегментах химической промышленности
Paul et al., Organic Crystallization Processes, Powder Technology, Volume 150, Issue 2, 2005.
Технологии, которые гарантируют получение нужной полиморфной формы в процессе кристаллизации
Kitamura, Strategies for Control of Crystallization of Polymorphs, CrystEngComm, 2009,11, 949–964.
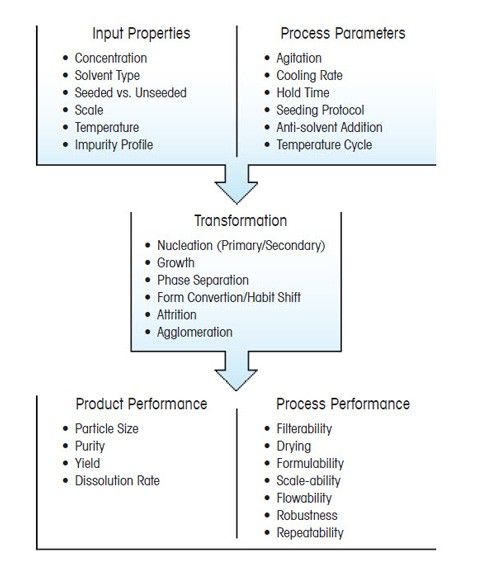
Основные параметры и превращения в процессе кристаллизации
Кристаллы обладают множеством характеристик, но, пожалуй, важнейшая из них — это распределение кристаллов по размерам. От этого параметра в значительной степени зависят качество конечного продукта и эффективность процесса его получения. Размер и форма кристаллов непосредственно влияют на основные технологические этапы, следующие за кристаллизацией, — фильтрацию и сушку. Конечный размер кристаллов также определяет качество кристаллического продукта. Например, биологическая доступность и эффективность фармацевтических составов тем выше, чем мельче получаемые кристаллы, так как они лучше растворяются.
Оптимизировать дисперсность кристаллов можно путем тщательного подбора условий и параметров процесса кристаллизации. Чтобы кристаллический продукт приобрел нужные свойства, важно понимать, как параметры процесса влияют на основные превращения в ходе кристаллизации — образование зародышей (нуклеацию), рост и распад кристаллов.
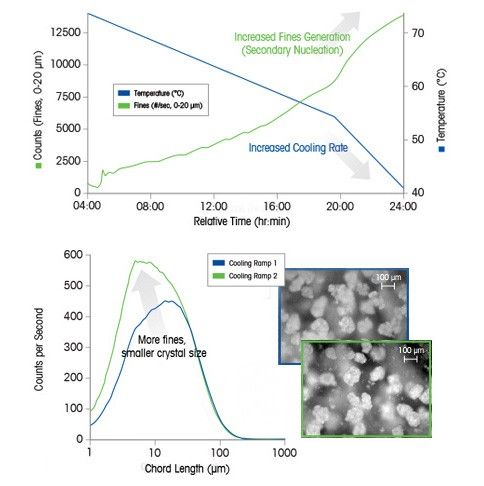
Практический пример: значение скорости охлаждения для кристаллизации
В этом примере охлаждение в конце цикла вызывает вторичную нуклеацию, которая приводит к образованию множества мелких частиц. Исследование проведено с использованием анализаторов размера частиц.
Увеличение скорости охлаждения раствора ведет к более быстрому пересыщению, в результате скорость образования зародышей кристаллов будет выше скорости их роста. Следовательно, чтобы получить нужное распределение кристаллов по размеру, чрезвычайно важно контролировать скорость охлаждения.
Дисперсность кристаллов льда, например, влияет на вкус и консистенцию мороженого: так, кристаллы размером менее 50 мкм предпочтительнее кристаллов, которые больше 100 мкм. Она влияет и на технологические свойства распыляемых агрохимикатов: их частицы должны быть малы настолько, чтобы не засорять сопла при распылении, но при этом достаточно большими, чтобы их не уносило на соседние поля.
При масштабировании получить кристаллический продукт нужного размера и формы с наименьшими издержками возможно лишь в случае понимания всех нюансов кристаллизации.
Оборудование для кристаллизации
Процессно-аналитическая технология для разработки процессов кристаллизации
Рабочая станция кристаллизации позволяет ученым получать максимум информации из каждого эксперимента с помощью централизованного программного решения. Средства процессно-аналитической технологии (PAT):
Автоматизированные реакторы
Точное регулирование критических параметров процесса
В дисперсных системах такие параметры, как температура, интенсивность перемешивания или режим дозирования, непосредственно влияют на качество процесса и конечного продукта. Приборы EasyMax, OptiMax, RC1 и RX-10 обеспечивают точное регулирование и регистрацию условий процесса для гибкого конструирования дисперсных систем.
Определение характеристик частиц
Изучение частиц в технологической среде
Размер, форма и концентрация — это важнейшие свойства частиц на каждой стадии процесса кристаллизации и на всех этапах масштабирования, поэтому они считаются критическими показателями качества (CQA). Анализаторы размера частиц оперативно отображают и количественно характеризуют частицы и важнейшие механизмы их формирования, что существенно облегчает разработку процессов кристаллизации.
Химический и структурный анализ
Достижение заданной конечной точки — в каждом эксперименте
Такие характеристики среды, как концентрация раствора, степень пересыщения и кристаллическая (полиморфная) модификация, часто связаны между собой и в совокупности определяют успех разработки технологического процесса кристаллизации. Системы ReactIR и ReactRaman анализируют состояние раствора и дисперсии для безошибочного достижения заданной конечной точки процесса.
Как разработать процесс кристаллизации
Разработка процесса кристаллизации для получения чистого продукта с оптимальным выходом и размером частиц включает в себя ряд важных элементов:
Основные понятия и законы теории кристаллизации металлов и сплавов



Охлаждение жидкости ниже равновесной температуры кристаллизации называется переохлаждением.
Указанные причины обуславливают и то, что обратное превращение из кристаллического состояния в жидкое может произойти только выше температуры ; это явление называетсяперенагреванием.
Величиной или степенью переохлажденияназывают разность между теоретической и фактической температурами кристаллизации.
Рис.3. Кривая Чернова-Таммана.
Структура литого слитка состоит из трёх основных зон. Первая зона – наружная мелкозернистая корка, состоящая из дезориентированных мелких кристаллов – дендритов. При первом соприкосновении со стенками изложницы в тонком прилегающем слое жидкого металла возникает резкий градиент температур и явление переохлаждения, ведущее к образованию большого количества центров кристаллизации. В результате корка получает мелкозернистое строение.
Вторая зона слитка – зона столбчатых кристаллов. После образования самой корки условия теплоотвода меняются (из-за теплового сопротивления, из-за повышения температуры стенки изложницы и других причин), градиент температур в прилегающем слое жидкого металла резко уменьшается и, следовательно, уменьшается степень переохлаждения стали. В результате из небольшого числа центров кристаллизации начинает расти нормально ориентированные к поверхности корки (то есть в направлении отвода тепла) столбчатые кристаллы.
Третья зона слитка – зона равноосных кристаллов. В центре слитка уже нет определённой отдачи тепла. «Температура застывающего металла успевает почти совершенно уравниваться в различных точках и жидкость обращается как бы в кашеобразное состояние, вследствие образования в различных её точках зачатков кристаллов. Далее зачатки разрастаются осями – ветвями по различным направлениям, встречаясь друг с другом» (Чернов Д.К.).
Кристаллизация, приводящая к стыку зон столбчатых кристаллов, носит название транскристаллизации.
Теория кристаллизации позволяет объяснить переход ряда веществ в стеклообразное состояние. W, что характерно для веществ со сложным строением молекул и кристаллов, или большой величиной энергии активаций Е, которая наблюдается у жидкостей с повышенной вязкостью. При быстром охлаждении подобных жидкостей кристаллические зародыши йе успевают заметно вырасти и вещество переходит в стеклообразное состояние. [2]
Теория кристаллизации позволяет объяснить переход ряда веществ в стеклообразное состояние. W, что характерно для веществ со сложным строением молекул и кристаллов, или большой величиной энергии активаций Е, которая наблюдается у жидкостей с повышенной вязкостью. При быстром охлаждении подобных жидкостей кристаллические зародыши йе успевают заметно вырасти и вещество переходит в стеклообразное состояние. [2]