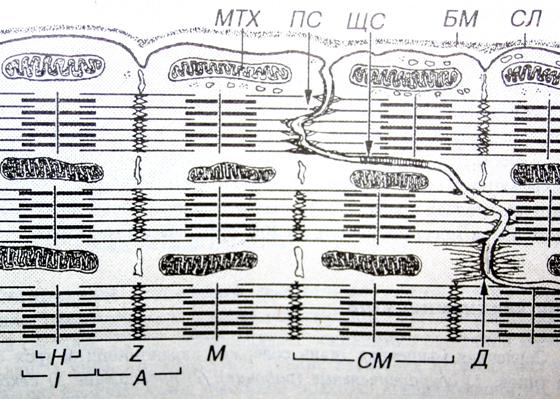
Что определяет способность мышечных тканей к сокращению
Что определяет способность мышечных тканей к сокращению
Выделяют несколько последовательных этапов запуска и осуществления мышечного сокращения.
1. Потенциал действия распространяется вдоль двигательного нервного волокна до его окончаний на мышечных волокнах.
2. Каждое нервное окончание секретирует небольшое количество нейромедиатора ацетилхолина.
3. Ацетилхолин действует на ограниченную область мембраны мышечного волокна, открывая многочисленные управляемые ацетилхолином каналы, проходящие сквозь белковые молекулы, встроенные в мембрану.
4. Открытие управляемых ацетилхолином каналов позволяет большому количеству ионов натрия диффундировать внутрь мышечного волокна, что ведет к возникновению на мембране потенциала действия.
5. Потенциал действия проводится вдоль мембраны мышечного волокна так же, как и по мембране нервного волокна.
6. Потенциал действия деполяризует мышечную мембрану, и большая часть возникающего при этом электричества течет через центр мышечного волокна. Это ведет к выделению из саркоплазматического ретикулума большого количества ионов кальция, которые в нем хранятся.
7. Ионы кальция инициируют силы сцепления между актиновыми и миозиновыми нитями, вызывающие скольжение их относительно друг друга, что и составляет основу процесса сокращения мыщц.
8. Спустя долю секунды с помощью кальциевого насоса в мембране саркоплазматического ретикулума ионы кальция закачиваются обратно и сохраняются в ретикулуме до прихода нового потенциала действия. Удаление ионов кальция от миофибрилл ведет к прекращению мышечного сокращения.
Далее мы обсудим молекулярные механизмы этого процесса.
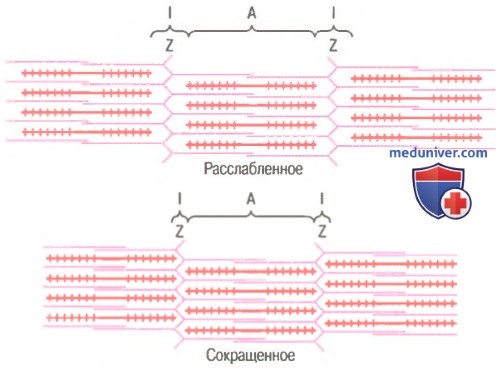
Молекулярные механизмы мышечного сокращения
Механизм скольжения нитей для мышечного сокращения. На рисунке показан основной механизм мышечного сокращения. Показано расслабленное состояние саркомера (вверху) и сокращенное состояние (внизу). В расслабленном состоянии концы актиновых нитей, отходящие от двух последовательных Z-дисков, лишь незначительно перекрываются. Наоборот, в сокращенном состоянии актиновые нити втягиваются внутрь между миозиновыми так сильно, что их концы максимально перекрывают друг друга. При этом Z-диски притягиваются актиновыми нитями к концам миозиновых. Таким образом, мышечное сокращение осуществляется путем механизма скольжения нитей.
Что заставляет нити актина скользить внутрь среди нитей миозина? Это связано с действием сил, генерируемых при взаимодействии поперечных мостиков, исходящих от нитей миозина, с нитями актина. В условиях покоя эти силы не проявляются, однако распространение потенциала действия вдоль мышечного волокна приводит к выделению из саркоплазматическо-го ретикулума большого количества ионов кальция, которые быстро окружают миофи-бриллы. В свою очередь, ионы кальция активируют силы взаимодействия между нитями актина и миозина, в результате начинается сокращение. Для осуществления процесса сокращения необходима энергия. Ее источником являются высокоэнергетические связи молекулы АТФ, которая разрушается до АДФ с высвобождением энергии. В следующих разделах мы приведем известные детали молекулярных процессов сокращения.
Молекулярные особенности сократительных нитей
Миозиновая нить. Она состоит из множества молекул миозина, молекулярная масса каждой составляет около 480000. На рисунке показана отдельная молекула; и также — объединение многих молекул миозина в миозиновую нить, а также взаимодействие одной стороны этой нити с концами двух актиновых нитей.
В состав молекулы миозина входят 6 полипептидных цепей: 2 тяжелые цепи с молекулярной массой около 200000 каждая и 4 легкие цепи с молекулярной массой около 20000 каждая. Две тяжелые цепи спирально закручиваются вокруг друг друга, формируя двойную спираль, которую называют миозиновым хвостом. С одного конца обе цепи изгибаются в противоположных направлениях, формируя глобулярную полипептидную структуру, называемую миозиновой головкой. Таким образом, на одном конце двойной спирали молекулы миозина образуются 2 свободные головки; 4 легкие цепи также включены в состав миозиновой головки (по 2 в каждой). Они помогают регулировать функцию головки во время мышечного сокращения.
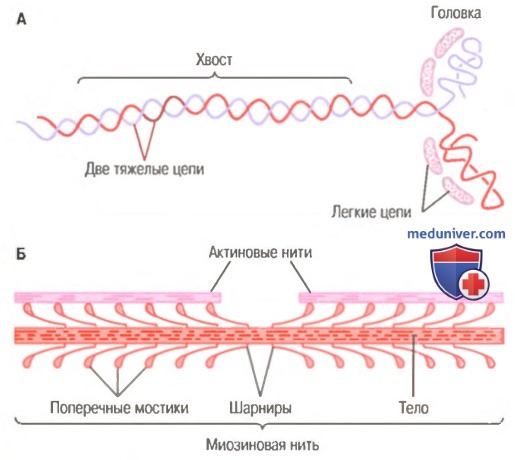
Б. Объединение многих молекул миозина в одну миозиновую нить.
Показаны также тысячи миозиновых поперечных мостиков и взаимодействие их головок с прилежащими актиновыми нитями.
Миозиновая нить состоит из 200 или более отдельных молекул миозина. Видно, что хвосты молекул миозина объединяются, формируя тело нити, а многочисленные головки молекул выдаются наружу по сторонам тела. Кроме того, наряду с головкой в сторону выступает часть хвоста каждой миозиновой молекулы, образуя плечОу которое выдвигает головку наружу от тела, как показано на рисунке. Выступающие плечи и головки вместе называют поперечными мостиками. Каждый поперечный мостик может сгибаться в двух точках, называемых шарнирами. Один из них расположен в месте, где плечо отходит от тела миозиновой нити, а другой — где головка крепится к плечу. Движение плеча позволяет головке или выдвигаться далеко наружу от тела миозиновой нити, или приближаться к телу. В свою очередь, повороты головки участвуют в процессе сокращения, что обсуждается в следующих разделах.
Общая длина каждой миозиновой нити остается постоянной и равна почти 1,6 мкм. В самом центре миозиновой нити на протяжении 0,2 мкм поперечных мостиков нет, поскольку снабженные шарнирами плечи отходят в стороны от центра.
Сама миозиновая нить сплетена таким образом, что каждая последующая пара поперечных мостиков смещена в продольном направлении относительно предыдущей на 120°, что обеспечивает распределение поперечных мостиков во всех направлениях вокруг нити.
АТФ-азная активность миозиновой головки. Есть и другая особенность миозиновой головки, необходимая для мышечного сокращения: миозиновая головка функционирует как фермент АТФ-аза. Как объясняется далее, это свойство позволяет головке расщеплять АТФ и использовать энергию расщепления высокоэнергетической связи для процесса сокращения.
Актиновая нить. Актиновая нить состоит из трех белковых компонентов: актина, тропомиозина и тропонина.
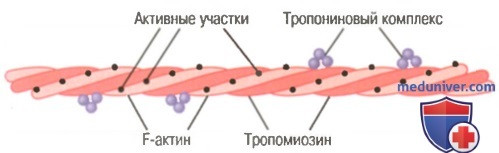
К одному концу каждой молекулы тропомиозина прикреплен тропониновый комплекс, который запускает сокращение.
Основой актиновой нити являются две цепи белковой молекулы F-актина. Обе цепи закручиваются в спираль так же, как и молекула миозина.
Каждая цепь двойной спирали F-актина состоит из полимеризованных молекул G-актина с молекулярной массой около 42000. К каждой молекуле G-актина прикреплена 1 молекула АДФ. Полагают, что эти молекулы АДФ являются активными участками на актиновых нитях, с которыми взаимодействуют поперечные мостики миозиновых нитей, обеспечивая мышечное сокращение. Активные участки на обеих цепях F-актина двойной спирали расположены со смещением таким образом, что вдоль всей поверхности актиновой нити встречается один активный участок примерно через каждые 2,7 нм.
Длина каждой актиновой нити — около 1 мкм. Основания актиновых нитей прочно встроены в Z-диски; концы этих нитей выступают в обоих направлениях, располагаясь в пространствах между миозиновыми молекулами.
Молекулы тропомиозина. Актиновая нить также содержит другой белок — тропомиозин. Каждая молекула тропомиозина имеет молекулярную массу 70000 и длину 40 нм. Эти молекулы спирально оплетают спираль из F-актина. В состоянии покоя молекулы тропомиозина располагаются поверх активных участков актиновых нитей, препятствуя их взаимодействию с миозиновыми нитями, лежащему в основе сокращения.
Тропонин и его роль в мышечном сокращении. По ходу молекул тропомиозина к ним периодически прикреплены другие белковые молекулы, называемые тропонином. Они представляют собой комплексы трех слабосвязанных белковых субъединиц, каждая из которых играет специфическую роль в регуляции мышечного сокращения. Одна из субъединиц (тропонин I) имеет высокое сродство к актину, другая (тропонин Т) — к тропомиозину, третья (тропонин С) — к ионам кальция. Считают, что этот комплекс прикрепляет тропомиозин к актину. Высокое сродство тропонина к ионам кальция, как полагают, инициирует процесс сокращения, о чем говорится в следующей статье.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Физиология человека.»
Что определяет способность мышечных тканей к сокращению
Частыми причинами травм скелетных мышц являются дорожно-транспортные происшествия, травмы, полученные при взрывах, боевые ранения, хирургические и ортопедические манипуляции (например, после синдрома длительного сдавливания или резекции опухоли) или повреждения, случившиеся в ходе занятий спортом, приводящие к острой потере мышечной ткани. Повреждения, превышающие 20% мышечной массы, нуждаются в реконструктивных хирургических вмешательствах. Прогрессирующая мышечная потеря может быть следствием метаболических нарушений или наследственных генетических заболеваний, таких как мышечная дистрофия Дюшена, латеральный амиотрофический склероз и детская болезнь Шарко-Мари-Тута [10]. Атрофия мышц также может быть следствием травм периферических нервов, хронической болезни почек, сахарного диабета и сердечной недостаточности [3]. Потеря мышечной массы до 20% может быть компенсирована высокой адаптивностью и регенеративным потенциалом скелетных мышц. За этим порогом функциональные нарушения неизбежны и могут привести как к тяжелой инвалидности, так и к косметическим деформациям, поэтому терапевтическое вмешательство крайне востребовано для таких пациентов.
Анализ и обсуждение. Мышечная регенерация зависит от гетерогенной популяции сателлитных клеток, интерстициальных клеток и кровеносных сосудов и в основном контролируется с помощью белков межклеточного матрикса и секретируемых факторов [4]. В норме мышечная масса поддерживается балансом между синтезом и катаболизмом белка. В большинстве случаев VML тормозит регенерационную способность скелетных мышц, поскольку физически удаляются необходимые регенеративные элементы, в основном сателлитные клетки, периваскулярные стволовые клетки и базальная мембрана. Через денервацию активируются сигнальные пути распада белков (протеасомальные и аутофагиально-лизосомальные пути). Поэтому скорость разложения белка превышает его синтез, что способствует атрофии мышц, сопровождающейся постепенным снижением мышечной массы и диаметров мышечных волокон. Реваскуляризация обычно нарушается. Вследствие наступают ишемические условия способствующие пролиферации фибробластов, фиброзу и формированию фиброзной рубцовой ткани, что приводит к дальнейшей дистрофии мышцы. Состав и степень белков межклеточного матрикса в рубцовых тканях влияют на многие аспекты миогенеза, функции мышц и реиннервации. При хронической потере мышечной массы, такой как мышечная дистрофия Дюшена, фиброз является серьезной проблемой. Вследствие того, что последовательное разрушение миофибрилл не может быть полностью компенсировано пролиферацией сателлитных клеток, следующие воспалительные процессы приводят к изменению продукции белков внеклеточного матрикса и последующему развитию фиброза, а также формированию рубцовой ткани. Рубцовое образование можно уменьшить либо путем введения, например, 5-фторурацила и блеомицина, которые противодействуют пролиферации фибробластов и неоангиогенезу, либо с помощью лазерной терапии и функциональными улучшениями через 6-12 месяцев лечения [1]. Регенерация с регрессией рубцовой ткани и функциональным восстановлением может быть также оптимизирована с помощью трансплантации жира. Тем не менее, уменьшение фиброзирования недостаточно для восстановления и регенерации мышечного волокна. Клинические и научные исследования способствуют восстановлению большой мышечной потери. Современный стандарт лечения VML, как правило, основан на хирургическом вмешательстве с аутологичным мышечным трансплантатом и физиотерапией. Другими способами, которые применяют в клинике, являются: иглоукалывание и применение скаффолдов.
Хирургическое лечение VML включает в себя в основном санацию рубцовой ткани и / или транспозицию мышц. Аутологичная пересадка мышц обычно выполняется в клинической ситуации, когда после травмы, резекции опухоли или повреждения нерва возникают большие участки мышечной потери, что значительно ухудшает двигательную функцию. Хирурги трансплантируют здоровую мышцу из донорского участка, не затронутого повреждением, для восстановления утраченной или нарушенной функции. При отсутствии прилегающей мышцы из-за высокого уровня повреждений нерва или тяжелой травмы может быть применена аутологичная трансплантация мышцы в виде свободной функциональной пересадки. Часто используемыми аутологичными мышцами являются m. latissimus dorsi и m. gracilis. Было показано, что пересадка m. latissimus dorsi является безопасной и эффективной для восстановления сгибания локтевого сустава [8]. В случае синовиальной саркомы, поражающей m. gluteus medius и m. gluteus minimus, функция пораженного тазобедренного сустава может быть полностью восстановлена с помощью свободной нейроваскулярной трансплантации m. latissimus dorsi. Трансплантация m. gracilis обычно используется для восстановления локтевого сустава после травмы плечевого сплетения. Хотя данные мышечные лоскуты могут приводить к значительным терапевтическим результатам, они вызывают прогрессирующую заболеваемость донорского участка и недостаточность иннервации. Более того, до 10% этих реконструктивных операций приводят к полному отторжению трансплантата из-за таких осложнений, как инфекция и некроз.
Заключение. Повреждение скелетной мышечной ткани или атрофия мышц встречается довольно часто. Хирургические методы достигли значительных результатов и могут гарантировать хорошие результаты для восстановления мышечных функций. Однако, при хирургическом вмешательстве всегда остается риск, обусловленный как человеческим фактором, так особенностями операции. Исследования в области тканевой инженерии и регенеративной клеточной терапии могут решить данную проблему. Тканевая инженерия использует биологические скаффолды, которые направляют развитие мышечной ткани при участии факторов роста. Эти клетки способствуют пролиферации миогенных клеток в поврежденных или атрофических мышцах, что отражается на их дальнейшей регенерации. Подобные творческие подходы опираются на глубокое понимание процесса, необходимого для функционального восстановления мышц (реакция клеток на скаффолды, васкуляризация, миогенез и иннервация), однако все равно нуждаются в дальнейших исследованиях.
Что определяет способность мышечных тканей к сокращению
Введение
В современной медицине все больший интерес вызывают вопросы лечения и профилактики заболеваний сердечно-сосудистой системы, возникновение которых в значительной мере связано с нарушением структуры и функций сердечной мышечной ткани (атеросклероз, инфаркт миокарда, гипертензия, астма и др.). В связи с необходимостью более глубокого изучения этиологии и патогенеза заболеваний сердечно-сосудистой системы, познания механизмов, лежащих в основе этих состояний, возрастает интерес к фундаментальным исследованиям структурно-функциональных особенностей сердечной мышечной ткани.
1 Общая характеристика сердечной мышечной ткани
Стенка сердца состоит из трех оболочек:
В организме человека все мышечные ткани, в том числе и сердечная мышечная ткань, специализированы на функции сокращения и развиваются на общей основе: гипертрофии и видоизменении сократимой механической актин-миозиновой системы.
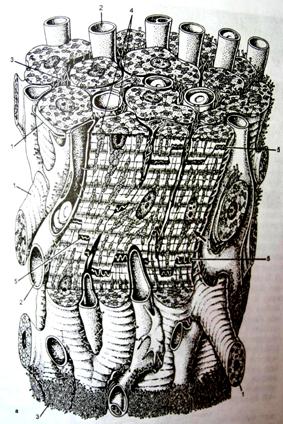
Сердечная мышечная ткань относится к поперечнополосатой мышечной ткани целомического типа, встречается только в мышечной оболочке сердца (миокарде) и устьях связанных с ним крупных сосудов; образована структурными элементами (клетками, волокнами), которые имеют поперечную исчерченность вследствие особого упорядоченного взаиморасположения в них актиновых и миозиновых миофиламентов и обладает спонтанными (непроизвольными) ритмическими сокращениями (рис. 1).
Основным функциональным свойством сердечной мышечной ткани является способность к спонтанным ритмическим сокращениям, на активность которых влияют гормоны и нервная система (симпатическая и парасимпатическая).
Для понимания структурно-функциональных особенностей сердечной мышечной ткани рассмотрим процессы ее формирования в период развития сердца и кардиомиогенеза.
2 Развитие сердца и кардиомиогенез
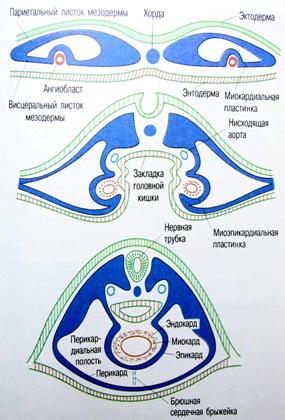
Закладка сердца человека происходит в начале 3-й недели развития (у эмбриона длиной 1,5 мм) и представлена парным скоплением мезенхимных клеток в задней части головного отдела эмбрионального щитка под висцеральным листком мезодермы (рис. 2, 3). С течением времени эти скопления превращаются в две удлиненные трубки, вдающиеся вместе с висцеральным листком мезодермы в целомическую полость тела, и выстилаются эндотелием. Позднее мезенхимные трубки сливаются и из их стенок образуется эндокард.
Рис. 3. Развитие сердца человека
Перикард формируется из париетального листка мезодермы.
Широкое пространство между эндотелиальными трубочками и миокардиальной пластинкой заполняется эндокардиальным гелем.
По мнению А.Г. Кнорре слой образующегося эпикарда (его мезотелиальное покрытие) нарастает на зачаток миокарда позднее, со стороны венозного синуса. Поэтому первичную закладку сердца предлагается называть не миоэпикардиальной пластинкой, а миокардиальной.
Клетки зачатка миокарда (миокардиальная пластинка), т.е. кардиомиобласты, производят процесс деления и на 2-м месяце эмбрионального развития в них появляются миофибриллы с поперечной исчерченностью. Z-полоски появляются одновременно с саркотубулярной сетью и поперечными инвагинациями клеточной мембраны (Т-системы). На плазмолеммах контактирующих миобластов образуются десмосомы. Формирующиеся миофибриллы прикрепляются к плазмолеммам, где позднее образуются вставочные диски.
В конце 2-го месяца начинает формироваться проводящая система сердца, завершение образования всех отделов которой завершается к 4-му месяцу. Развитие мышечной ткани левого желудочка происходит быстрее, чем правого.
Опорный скелет сердца образован фиброзными кольцами между предсердиями и желудочками и плотной соединительной тканью в устьях крупных сосудов. Кроме плотных пучков коллагеновых волокон, в состав опорного скелета сердца входят эластические волокна, а иногда встречаются хрящевые пластинки.
В процессе развития сердце человека увеличивается в объеме в 16 раз в сравнении с сердцем новорожденного, при этом в 15 раз возрастает объем кардиомиоцитов.
Таким образом, рост миокарда происходит из-за полиплоидизации ядер кардиомиоцитов и гипертрофии, которая свойственна внутриклеточной регенерации, т.е. умножением числа внутриклеточных структур и увеличением массы гиалоплазмы. Полиплоидизация и гипертрофия обеспечивают увеличение миокарда при его развитии, а также осуществляют компенсационный рост ответ на повышенную нагрузку на сердце, когда может происходить небольшой всплеск митотической активности, но часто без цитотомии.
В процессе развития сердечной мышечной ткани происходит инверсия митотического индекса: на ранних этапах развития максимальная пролиферативная активность наблюдается в желудочках, а позднее более интенсивно митозируют миоциты предсердий.
Итак, кардиомиоциты представляют собой некамбиальную, медленно растущую популяцию, не имеющую сателлитов.
2.1 Строение внутренней оболочки сердца эндокарда
Питание эндокарда производится в основном диффузно из-за наличия крови, находящейся в сердечных камерах. Кровеносные сосуды имеются только в наружном соединительнотканном слое эндокарда.
2.1.1 Клапаны сердца
Левый предсердно-желудочковый клапан появляется в виде эндокардиального валика, в который к 2,5 месяцам врастает соединительная ткань из эпикарда. На 4-м месяце из эпикарда в створку клапана врастает пучок коллагеновых волокон, образующий позже фиброзную пластинку. Правый предсердно-желудочковый клапан закладывается как мышечно-эндокардиальный валик. С 3-го месяца эмбриогенеза мышечная ткань правого атриовентрикулярного клапана уступает место соединительной ткани, врастающей со стороны миокарда и эпикарда. У взрослого человека мышечная ткань сохраняется в виде рудимента только с предсердной стороны в основании клапана. Таким образом, предсердно-желудочковые клапаны являются производными как эндокарда, так и соединительной ткани миокарда и эпикарда.
На границе между восходящей частью дуги аорты и левым желудочком сердца локализуются аортальные клапаны, которые по своему строению имеют много общего с предсердно-желудочковыми клапанами и клапанами легочной артерии.
2.2 Строение средней оболочки сердца миокарда
Различают два типа кардиомиоцитов:
2.2.1 Сердечные миоциты желудочков и предсердий
Рис. 4. Строение кардиомиоцита сердца.
Т-каналы желудочковых миоцитов имеют характер глубоких поперечных складок на уровне линий Z, их продольных ветвей и анастомозов вблизи дисков А. Объем Т-системы в желудочковых миоцитах составляет 27-36% от объема цитоплазмы. По каналам данной системы у кардиомиоцитов не только распространяется импульс, но и поступают метаболиты в клетку.
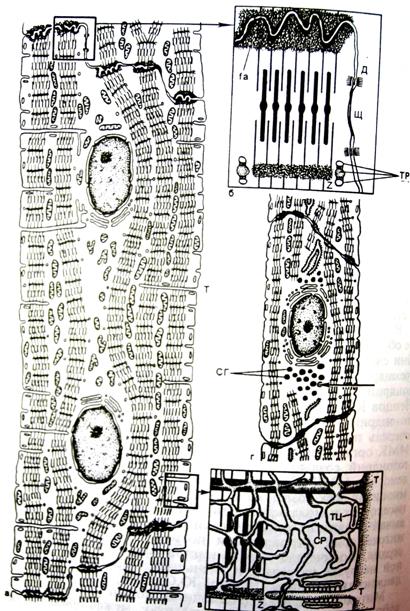
Специализированными структурами кардиомиоцитов являются «вставочные диски», которые представляют собой комплекс, состоящий из промежуточных соединений (fascia adherens), нексусов (щелевые контакты) и десмосом (рис. 5, 6). Вставочные диски всегда находятся на уровне линий Z и содержат плотный материал, в котором много липидов и ряд белков, в том числе α-актинин, виментин, винкулин, десмин, спектрин, коннектин и др.
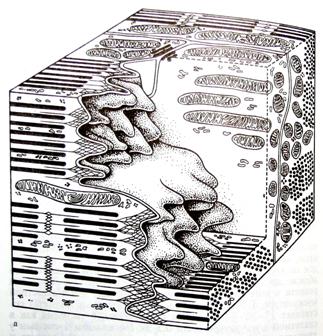
Рис. 5. «Вставочные диски» кардиомиоцитов
Объемная модель фрагментов двух кардиомиоцитов на уровне вставочного диска. Видны пальцевидные выросты клеток, которые на срезе имитируют рисунок «вставочного диска»
Рис. 6. Ультраструктурная организация области «вставочного диска» кардиомиоцитов
Клеточные соединения в виде десмосом имеют характерное строение, а нексусы в основном располагаются вдоль продольной оси клетки. В этих образованиях сближаются мембраны контактирующих клеток, образуя многочисленные коннексоны, при этом через гидрофильный канал распространяется нервный импульс и происходит обмен метаболитами между соседними миоцитами. Промежуточные соединения, или полоски слипания, представляют собой уплотненные участки плазмоллем контактирующих клеток и связывают конечные саркомеры соседних миоцитов. Вставочные диски соединяют друг с другом продольно лежащие миоциты с образованием тяжей или функциональных волокон. Часто плотные вставочные диски имеют ступенчатый вид.
Рабочие миоциты предсердий в отличие от желудочковых содержат секреторные гранулы и имеют способность к митозу. Данные миоциты мельче желудочковых и часто с отростками. Миофибриллярных элементов в них меньше на 40%, и реже наблюдаются лестничные структуры во вставочных дисках. Гранулярный эндоплазматический ретикулум и аппарат (комплекс) Гольджи развиты в этих клетках сильнее, чем в желудочковых миоцитах. Характерно, что Т-система в рабочих миоцитах предсердий почти не развита и если присутствуют, то каналы располагаются вдоль, а не перпендикулярно продольной оси клетки.
2.2.2 Сердечные миоциты проводящей системы сердца
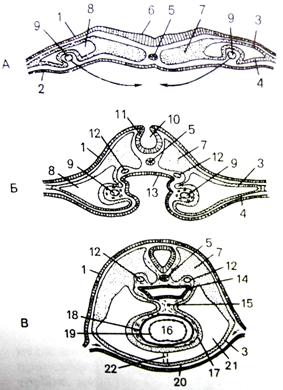
Миоциты проводящей системы сердца (рис. 7). К проводящей системе сердца (systema conducens cardiacum) относятся мышечные клетки, формирующие и проводящие импульсы к сократительным клеткам сердца. В состав проводящей системы входят синусно-предсердный и предсердно-желудочковый узлы, предсердно-желудочковый пучок (пучок Гиса), его ножки и концевые разветвления ножек, образованные клетками Пуркинье. В сердце человека клетки проводящей системы сильно отличаются по размерам и структуре от рабочих миоцитов. Различают три типа мышечных клеток, которые в разных соотношениях находятся в соответствующих отделах данной системы.
Рис. 7. Кардиомиоциты проводящей системы сердца
Другим типом клеток синусного узла, находящегося по его периферии, является переходный, или латентный тип. В таких клетках больше миофибрилл и нексусов, а в некоторых из них есть Т-каналы. Данные клетки проводят импульс из синусного узла к другим клеткам предсердия, а именно от Р-клеток к клеткам предсердно-желудочкового пучка и рабочему миокарду.
Предсердно-желудочковый узел имеет клетки, схожие с миоцитами синусного узла. Оба узла сильно иннервированы с преобладание адренергических терминалей. Каждый миоцит имеет и афферентную, и эфферентную иннервации.
Предсердно-желудочковый пучок (пучок Гиса) представляет прямое продолжение предсердно-желудочкового узла и покрыт «чехлом» из плотной соединительной ткани. Ножки пучка разветвляются под эндокардом, а также по толщине миокарда желудочков и проникают в сосочковые мышцы.
В проводящей системе сердца преобладают энзимы, принимающие участие в анаэробном гликолизе (фосфорилаза, дегидрогеназа молочной кислоты). В проводящих волокнах уровень калия ниже, а кальция и натрия выше в сравнении с сократительными кардиомиоцитами.
2.3 Строение наружной оболочки сердца эпикарда и перикарда
Наружная оболочка сердца, или эпикард (epicardium), представляет висцеральный листок перикарда (pericardium). Эпикард образован тонкой пластинкой соединительной ткани, плотно срастающейся с миокардом. Свободная поверхность ее покрыта мезотелием. В основе эпикарда различают поверхностный слой коллагеновых волокон, слой эластических волокон, глубокий слой коллагеновых волокон и глубокий коллагеново-эластический слой, составляющей до 50% всей толщины эпикарда.
В перикарде соединительнотканная основа развита сильнее, чем в эпикарде. Здесь много эластических волокон, особенно в глубоком его слое. Поверхность перикарда, обращенная к перикардиальной полости, также покрыта мезотелием. Эпикард и париетальный листок перикарда имеют многочисленные нервные окончания в основном свободного типа.
3. Васкуляризация сердца
Венечные (коронарные) артерии имеют плотный эластический каркас, в котором выделяются внутренняя и наружная эластические мембраны. Гладкие мышечные клетки в артериях обнаруживаются в виде продольных пучков во внутренней и наружной оболочках.
В основании клапанов сердца кровеносные сосуды в месте прикрепления створок разветвляются на капилляры, откуда кровь собирается в коронарные вены, впадающие в правое предсердие или венозный синус. В эпикарде и перикарде также находятся сплетения сосудов микроциркуляторного русла. Проводящая система сердца, особенно ее узлы, обильно снабжена кровеносными сосудами.
Кровоснабжение сердечной мышечной ткани чрезвычайно обильно: по уровню кровоснабжения (мл/мин/100г массы) миокард уступает только почке и превышает другие органы, включая головной мозг. В частности, этот показатель для сердечной мышцы в 20 раз выше, чем для скелетной.
Лимфатические сосуды в эпикарде сопровождают кровеносные. В миокарде и эндокарде они проходят самостоятельно и образуют густые сети. Лимфатические капилляры обнаружены также в атриовентрикулярных и аортальных клапанах. Из капилляров лимфа, оттекающая от сердца, направляется в парааортальные и парабронхиальные лимфатические узлы.
4 Иннервация сердца
В стенке сердца обнаруживается несколько нервных сплетений и ганглиев. Наибольшая плотность расположения нервных сплетений наблюдается в стенке правого предсердия и синусно-предсердного узла проводящей системы.
Рецепторные окончания в стенке сердца образованы нейронами ганглиев блуждающих нервов и нейронами спинномозговых узлов, а также ветвлениями дендритов равноотростчатых нейроцитов внутриорганных ганглиев (афферентные нейроны).
Пресинаптический аппарат в кардиомиоцитах синапсов характеризуется тем, что практически не удается выделить в миокардиоцитах локальные постсинаптические структуры, так как эффекторные влияния имеют модулирующий характер.
Электротоническое влияния в миокардиальной ткани распространяются далеко за пределы одной клетки, и как следствие, обнаружение высокого коэффициента передачи между кардиомиоцитами, что обусловлено наличием электрических синапсов (щелевых контактов) между клетками. При этом автоматизм сокращения связан с передачей импульса через указанные контакты.
В миокарде много афферентных и эфферентных нервных волокон. Раздражение нервных волокон, окружающих проводящую систему, а также нервов, подходящих к сердцу, вызывает изменение ритма сердечных сокращений. Это указывает на определяющую роль нервной системы в ритме сердечной деятельности, следовательно, и в передаче импульсов по проводящей системе сердца.
5. Функциональная адаптация сердца
Функциональная адаптация клеток в гистогенезе сердечной мышечной ткани проявляется в гетерохромном развитии мышечных элементов миокарда различных отделов сердца. По морфологическим, гистохимическим, гистоавторадиографическим и биометрическим признакам, а также скорости дифференцировки мышечных клеток миокард желудочков, предсердий и мышечные трабекулы отличаются друг от друга, что находится в связи с особенностями гемодинамики, трофики и функции этих отделов миокарда.
Генетически детерминированные основные параметры процессов дифференциации, пролиферации и интеграции клеток миокарда характеризуются известным диапазоном изменчивости, вследствие чего осуществляется адаптация миокарда к конкретным условиям функционировании на каждом этапе фило- и онтогенеза как в норме, так и под влиянием различных внутренних и внешних условий.
6. Возрастные изменения сердечной деятельности
В течение онтогенеза можно выделить три периода изменения гистоструктуры сердца:
В период 20-30 лет при обычной функциональной нагрузке сердце человека находится в стадии относительной стабилизации. В возрасте старше 30-40 лет в миокарде обычно начинается некоторое увеличение его соединительнотканной стромы. При этом в стенке сердца, особенно в эпикарде, появляются адипоциты.
Степень иннервации сердца также изменяется с возрастом. Максимальная плотность внутрисердечных сплетений на единицу площади и высокая активность медиаторов отмечаются в период полового становления человека. После 30-летнего возраста уменьшаются плотность холинергических сплетений и количество медиаторов в них сохраняется на постоянном уровне. Нарушение равновесия в вегетативной иннервации сердца предрасполагает к развитию сложных патологических состояний. В пожилом возрасте уменьшается активность медиаторов в холинергических сплетениях сердца.
При повышенных систематических функциональных нагрузках общее количество клеток не возрастает, но в цитоплазме увеличиваются содержание органелл общего значения и миофибрилл, а также размер клеток (функциональная гипертрофия); соответственно возрастает и степень плоидности ядер кардиомиоцитов.
7. Регенерация сердечной мышечной ткани
Для сердца как органа характерна способность к регенерации путем регенераторной гипертрофии, при которой масса органа восстанавливается, но форма остается нарушенной. Подобное явление наблюдается после перенесенного инфаркта миокарда, когда масса сердца может восстановиться как целое, при этом на месте повреждения образуется соединительнотканный рубец, но орган гипертрофируется, т.е. нарушается форма. Происходит не только увеличение размеров кардиомиоцитов, но и пролиферация в основном в предсердиях и ушках сердца.
Ранее полагали, что дифференцировка кардиомиоцитов является необратимым процессом, связанным с полной потерей этими клетками способности к делению. Но на современном уровне многочисленные данные показывают то, что дифференцированные кардиомиоциты способны к синтезу ДНК и митозу. В исследовательских работах П.П. Румянцева и его учеников показано, что после экспериментального инфаркта миокарда левого желудочка сердца в клеточный цикл возвращается 60-70% предсердных кардиомиоцитов, возрастает число полиплоидных клеток, но это не компенсирует повреждение миокарда.
Установлено, что кардиомиоциты способны к митотическому делению (в том числе и клетки проводящей системы). В миокарде сердца особенно много одноядерных полиплоидных клеток с 16-32-кратным содержанием ДНК, но встречаются и двуядерные кардиомиоциты (13-14%) в основном октоплоидные.
В процессе регенерации сердечной мышечной ткани кардиомиоциты участвуют в процессе гиперплазии и гипертрофии, возрастает их плоидность, но уровень пролиферации клеток соединительной ткани в области повреждения оказывается в 20-40 раз выше. В фибробластах активизируется синтез коллагена, в результате чего репарация происходит путем рубцевания дефекта. Биологическое представление подобной адаптационной реакции соединительной ткани объясняется жизненной важностью сердечного органа, так как задержка с закрытием дефекта может привести к гибели.
Считалось, что у новорожденных, а возможно, и в раннем детском возрасте, когда способные к делению кардиомиоциты еще сохраняются, регенераторные процессы сопровождаются увеличением количества кардиомиоцитов. При этом у взрослых физиологическая регенерация осуществляется в миокарде в основном путем внутриклеточной регенерации, без увеличения количества клеток, т.е. в миокарде взрослого человека отсутствует пролиферация кардиомиоцитов. Но недавно получены данные о том, что в здоровом сердце человека 14 миоцитов из миллиона находится в состоянии митоза, завершающегося цитотомией, т.е. количество клеток не значительно, но увеличивается.
Применение современных методов клеточной биологии в клинических и экспериментальных исследованиях позволило перейти к выяснению клеточных и молекулярных механизмов повреждения и регенерации миокарда. Особенно интересны данные о том, что в перинекротических областях и в функционально перегруженном сердце происходит синтез эмбриональных миоакрдиальных белков и пептидов, а также белков, синтезирующихся во время клеточного цикла. Это подтверждает положение о сходстве механизмов регенерации и нормального онтогенеза.
Выяснилось также и то, что дифференцированные кардиомиоциты в культуре способны к активному митотическому делению, что, возможно, объясняется не полной утратой, а подавлением способности кардиомиоцитов возвращаться в клеточный цикл.
Важной задачей теоретической и практической кардиологии является разработка способов стимуляции восстановления поврежденного миокарда, т.е. индукции миокардиальной регенерации и уменьшения соединительнотканного рубца. Одно из направлений исследований предоставляет возможность переноса регуляторных генов, которые превращают фибробласты рубца в миобласты или трансфекция в кардиомиоциты генов, контролирующих рост новых клеток. Другим направлением является перенос в область повреждения фетальных скелетных и миокардиальных клеток, которые могли бы участвовать в восстановлении сердечной мышцы. Также проводятся эксперименты по трансплантации скелетной мышцы в сердце, показывающие образование в миокарде участков сокращающейся ткани и улучшающие функциональные показатели миокарда. Перспективным может быть лечение с применением факторов роста, оказывающих как прямое, так и косвенное воздействие на поврежденный миокард, например, улучшение ангиогенеза.
8. Патологическая гистология сердечной мышечной ткани
Различные повреждающие воздействия на сердце (прекращение притока артериальной крови, травмы, воспаления и др.) могут вызвать некроз мышечной ткани, т.е. гибель мышечных клеток. Некроз, возникающий при нарушении или прекращении кровотока в артериях вследствие тромбоза, эмболии, длительного спазма или в условиях недостаточного коллатерального кровообращения, более характерен для миокарда. Артериальная сеть поперечнополосатых мышц в большом количестве имеет анастомозирующие сосуды, поэтому в случае полного закрытия артерии ишемии не наблюдается. Дистрофические и некротические изменения в мышцах развиваются только при длительном закрытии крупных артерий.
Для миокарда характерны следующие клинико-морфологические формы некроза: коагуляционный некроз, коагуляционный миоцитолиз, колликвационный некроз. В развитии разных типов некроза участвуют различные биохимические механизмы.
Колликвационный некроз развивается в результате пропитывания миокарда экссудатом из кровеносных сосудов. При этом в клетках возникает внутриклеточный отек и вакуолизация, что обычно может наблюдаться в периваскулярной и субэндотелиальной областях после инфаркта.
Вследствие воспалительной реакции происходит рассасывание омертвевшей мышечной ткани и последующим замещением рубцом. Вокруг пораженного участка наблюдается жировая дистрофия и липоматоз, а также отложение извести.
При атрофии миокарда тяжи кардиомиоцитов постепенно становятся тоньше. В случае сильной атрофии исчезает поперечная исчерченость, продольная же сохраняется дольше. В местах атрофии может развиться воспалительный процесс, образование межуточной соединительной ткани.
Наиболее типичной приспособительной реакцией миокарда на повышение физической нагрузки является гипертрофия. Гипертрофия сердечной мышцы часто относится к рабочим гипертрофиям, при этом наблюдается утолщение мышечных волокон и кардиомиоцитов, обусловленное увеличением количества саркоплазмы и миофибрилл. Установлено, что в миокарде гипертрофия является реакцией на пролиферативные стимулы и гемодинамическую нагрузку кардиомиоцитов, вышедшие из митотического цикла (исследования гипертрофии миокарда при различных воздействиях: бег, плавание, индивидуальные дозированные физические нагрузки, экспериментальная коарктация аорты и др.)
Процесс гипертрофии включает три основных стадии:
2. Стадия завершающейся гипертрофии и относительной устойчивости гиперфункции;
3. Стадия прогрессирующего кардиосклероза и постепенного истощения при явлениях нарушения синтеза нуклеиновых кислот и белков.
Заключение
Анализ структурно-функциональных особенностей сердечной мышечной ткани показал, что, несмотря на то, что миокардиальная ткань состоит из отдельных клеток, в функциональном отношении она представляет собой единую систему. Способность сердечной мышечной ткани к регенерации, а также адаптация миокарда к конкретным условиям функционирования позволяют по-новому посмотреть на вопросы лечения и профилактики заболеваний сердечно-сосудистой системы, возникновение которых связано с повреждением структуры сердечной мышечной ткани и, как следствие, дисфункцией сердечной деятельности.
На современном уровне полагают, что в проблеме микроциркуляции заложен целый ряд расстройств сердечно-сосудистой деятельности при различных заболеваниях организма. Данная область получила ускоренное развитие особенно во 2-й половине ХХ века и уже сегодня формирует новые принципы в лечении патологий сердца. Импульсом к этому послужило техническое совершенствование исследований трансорганной микрогемодинамики и разработка методологических подходов к анализу гемато-тканевых взаимодействий в системе микроциркуляции.
Проведение научных исследований в различных направлениях, в том числе и микроциркуляционного русла сердца, совершенствование существующих и развитие новых способов оперативного лечения врожденных и приобретенных пороков сердца, применение современного диагностирующего оборудования и эффективных лекарственных препаратов, а также просвещение общества в направлении здорового образа жизни представляют возможность достижения целей, направленных на обеспечение лечения заболеваний сердечно-сосудистой системы и сохранение здоровья человека.
3. Куприянов В.В., Караганов Я.Л., Козлов В.И. Микроциркуляторное русло. М.: Медицина, 1975.