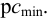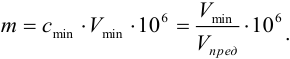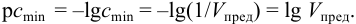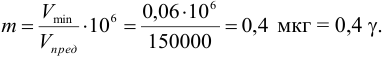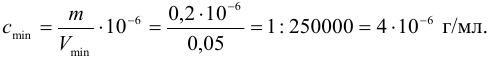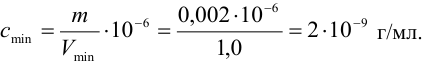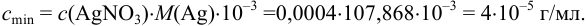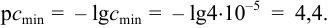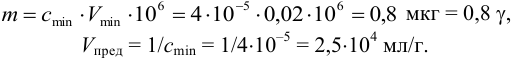Что определяет чувствительность реакции ее характеристики
Характеристика чувствительности аналитических реакций



Характеристика методов анализа по величине навески
| Метод анализа | Масса навески, г | Объем, мл |
| Макроанализ (грамм-метод) Полумикроанализ (сантиграмм-метод) Микроанализ (миллиграмм-метод) Ультрамикрометод (микрограмм-метод) Субмикроанализ (нанограмм-метод) | 1-10 0,05-0,5 10-3-10-6 10-6-10-9 10-9-10-12 | 10-100 1-10 10-1-10-4 10-4-10-6 10-7-10-10 |
Для химической идентификации чаще всего используют реакции окрашенных соединений, выделение или растворение осадков, газов, кристаллов характерной формы, окрашивание пламени газовой горелки соединений, люминесцирующих в растворах.
Окрашивание пламени соединениями некоторых элементов
| Элемент | Цвет пламени | Элемент | Цвет пламени |
| Литий | Карминово-красный | Индий | Сине-фиолетовый |
| Натрий | Желтый | Таллий | Изумрудно-зеленый |
| Калий | Фиолетовый | Свинец | Бледно-синий |
| Рубидий | Розово-фиолетовый | Мышьяк | Бледно-синий |
| Цезий | Розово-фиолетовый | Сурьма | Бледно-синий |
| Кальций | Кирпично-красный | Селен | Бледно-синий |
| Стронций | Карминово-красный | Теллур | Изумрудно-зеленый |
| Барий | Желто-зеленый | Медь | Зеленый, голубой |
| Бор | Зеленый | Молибден | Желто-зеленый |
Окрашивание пламени газовой горелки соединениями металлов используется в качественном анализе для открытия катионов металлов, дающих излучение в видимой области спектра.
Про аналитическую химию говорят, что это наука о методах и средствах химического анализа и в известной мере установления химического строения. Под средствами подразумевают приборы, реактивы, стандартные образцы, программы для компьютеров и т.д.
Методы и средства постоянно изменяются: привлекаются новые подходы, используются новые принципы явления из разных областей знаний. Аналитическая химия это сфера научного поиска, так за создание многих методов анализа присуждены Нобелевские премии (органический микроанализ, полярография, разные виды хроматографического анализа, фотоэлектронная спектроскопия и д. д.). Следует различать метод и методику анализа.
Метод анализавещества – это краткое определение принципов положенных в основу анализа вещества
Методика анализа – это подробное описание всех условий и операций, которые обеспечивают правильность, воспроизводимость и другие регламентированные характеристики результатов анализа.
Правильность анализа характеризует качество анализа, отражающее близость к нулю систематической погрешности результатов.
Воспроизводимость анализа – показывает степень близости друг к другу результатов отдельных измерений (определений) при анализе проб.
Таким образом под анализом подразумевают получение опытным путем данных о химическом составе и количестве вещества любыми методами – физическими,химическими,ифизико-химическими.
Современная аналитическая химия включает в себя три раздела: качественныйхимическийанализ,количественныйхимическийанализиинструментальные,т.е.физическиеифизико-химическиеметоды. Выделение инструментальных методов в самостоятельный раздел до некоторой степени условно, поскольку с помощью этих методов решаются задачи как качественного, так и количественного анализа.
Качественный химический анализ – это определение (открытие) химических элементов, ионов, атомов, атомных групп, молекул в анализируемом веществе.
Количественный химический анализ – это определение количественного состава, т.е. установление количества химических элементов, ионов, атомов, атомных групп, молекул в анализируемом веществе.
При проведении качественного и количественного анализов используют аналитические признаки веществ и аналитические реакции.
Аналитические признаки – это свойства анализируемого вещества или продуктов его превращения, которые позволяют судить о наличии в нём тех или иных компонентов.
Характерные аналитические признаки – цвет, запах, угол вращения плоскости поляризации света, радиоактивность, способность к взаимодействию с электромагнитным излучением и др.
Аналитическая реакция – это хим. превращение анализируемого вещества при действии аналитического реагента с образованием продуктов с заметными аналитическими признаками.
Чаще всего используют реакции:
Образования окрашенных соединений
Выделение или растворение осадков
Образование кристаллов характерной формы
Окрашивание пламени газовой горелки
Образование соединений, люминесцирующих в растворах На результаты проведения аналитических реакций влияют температура, концентрация растворов, pH среды, присутствие других веществ (мешающих, маскирующих, катализирующих процессы)
Характеристика чувствительности аналитических реакций
Аналитические реакции позволяют обнаруживать определяемое вещество в анализируемом растворе только тогда, когда это вещество содержится в растворе при достаточной концентрации, превышающей некоторый минимальный предел.
Если концентрация определяемого вещества ниже этого предела, то и
концентрация продуктов аналитической реакции окажется настолько незначительной, что их невозможно будет определить.Чувствительность аналитической реакции определяет возможность обнаружения вещества (ионов, молекул) в растворе.
Предельное разбавление (V) – максимальный объём раствора, в котором может быть однозначно (> чем в 50 опытах из 100 опытов) обнаружен один грамм данного вещества при помощи данной аналитической реакции. Предельное разбавление выражается в мл/г.
ХАРАКТЕРИСТИКА АНАЛИТИЧЕСКИХ РЕАКЦИЙ
Качественный химический анализ большей частью основан на реакциях, которые сопровождаются каким-либо характерным внешним эффектом. При этом не имеет большого значения количественная сторона химического процесса и стехиометрическое соотношение элементов, входящих в состав образующихся соединений. Существенными являются две характеристики химических реакций: чувствительность и избирательность.
Чувствительность реакций
Чувствительность реакции выражается двумя взаимно связанными величинами: чувствительностью определения (минимальная концентрация, или предельное разбавление) и абсолютной чувствительностью (открываемый минимум):
где m — открываемый минимум, мкг, с — минимальная концентрация, т. е. та наименьшая концентрация, которую еще удается обнаружить данным методом, мкг/мл, мкг/г, % и т. п.; V—объем пробы, мл; g — масса пробы, г.
Предельное разбавление характеризуется отношением одной весовой части обнаруживаемого иона или вещества к числу весовых частей анализируемого вещества (основы) или указывается как отношение числа весовых частей обнаруживаемого иона или вещества к 106 весовых частей анализируемого вещества (млн-1, международное обозначение, ррт.). Чувствительность выражается также в %
Значения тис могут изменяться в широких пределах в зависимости от условий реакции. Чувствительность реакции может быть повышена изменением концентрации реагентов, рН среды, порядка смешивания реагентов, экстракцией, флотацией, соосаждением, образованием смешанных соединений, а также путем использования различных методов проведения реакций (капельный анализ, пирохимический анализ и др.) и способов наблюдения продуктов реакции (в обычном световом или электронном микроскопе, в потоке ультрафиолетового света и т. д.). Ниже приведены границы чувствительности различных методов качественного анализа (в %):
Характеристики чувствительности аналитических реакций
Аналитические реагенты и аналитические реакции позволяют обнаруживать определяемое вещество в анализируемом растворе только тогда, когда это вещество содержится в растворе при достаточной концентрации, превышающей некоторый минимальный предел. Если концентрация определяемого вещества ниже этого предела, то и концентрация продуктов аналитической реакции окажется настолько незначительной, что их невозможно будет определить. Указанный минимальный концентрационный предел неодинаков для разных аналитических реакций, что обусловливаетих чувствительность.
Чувствительность аналитических реакций определяет возможность обнаружения вещества (ионов, молекул) в растворе. Она характеризуется предельным разбавлением Vlim, предельной концентрацией Clim(cmin), минимальным объемом предельно разбавленного раствора Vmin, пределом обнаружения (открываемым минимумом) m, показателем чувствительности p сmin.
Предельное разбавлениеVlim– максимальный объем раствора, в котором может быть однозначно (больше чем в 50% опытов) обнаружен один грамм данного вещества при помощи данной аналитической реакции. Предельное разбавление выражается в мл/г.
Так, например, при реакции ионов меди Сu 2+ с аммиаком в водном растворе
Предельная концентрацияClim(или сmin) – наименьшая концентрация, при которой определяемое вещество может быть обнаружено в растворе данной аналитической реакцией. Предельная концентрация выражается в г/мл.
Предельная концентрация и предельное разбавление связаны соотношением
Иногда (особенно в старой литературе) предельную концентрацию называют чувствительностью реакции и выражают в мкг/мл.
Так, например, ионы калия K + в водном растворе открывают аналитической реакцией с гексанитрокобальтатом(Ш) натрия Nа3[Со(N03)б]
Минимальный объем предельно разбавленного раствора Vmin – наименьший объем анализируемого раствора, необходимый для обнаружения открываемого вещества данной аналитической реакцией. Выражается в мл.
Так, минимальный объем предельно разбавленного раствора при открытии ионов меди(П) в виде аммиачного комплекса (см. реакцию, приведенную выше) равен
Vmin = 0,05 мл при clim = 4-10 –6 г/мл. Это означает, что в объеме предельно разбавленного раствора, меньшем 0,05 мл, нельзя открыть ионы Сu 2+ реакцией с аммиаком.
Предел обнаружения (открываемый минимум) m (в мкг) – наименьшая масса определяемого вещества, однозначно открываемого данной аналитической реакцией в минимальном объеме предельно разбавленного раствора. Выражается в мкг (1 мкг = 10 –6 г), иногда обозначаемых греческой буквой γ (гамма): 1 мкг = 1 γ.
Нетрудно видеть, что
m = clim • Vmin • 10 6 = Vmin •10 6 /Vlim
Так, предел обнаружения (открываемый минимум) ионов меди(П) в виде аммиачного комплекса [Cu(NH3)4] 2+ при предельной концентрации ионов меди Clim = 4-10 –6 г/мл и минимальном объеме предельно разбавленного раствора Vmin = 0,05 мл равен:
m = clim • Vmin • 10 6 = 4 • 10 –6 • 0,05 • 10 6 = 0,2 мкг = 0,2 γ
Это означает, что если масса ионов меди(П), содержащаяся в 0,05 мл предельно разбавленного раствора при концентрации 4-10 –6 г/мл, меньше 0,2 мкг, то невозможно открыть эти ионы указанной аналитической реакцией.
Показатель чувствительности аналитической реакции определяется как
Аналитическая реакциятем чувствительнее, чем меньше ее открываемый минимум, минимальный объем предельно разбавленного раствора и чем больше предельное разбавление. Чувствительность аналитической реакции зависит от природы открываемого вещества и аналитического реагента, температуры, рН среды, присутствия других (особенно – мешающих) веществ.
Необходимо заметить, что в отечественной Государственной Фармакопее чувствительность фармакопейных аналитических реакций обычно характеризуют, указывая предельную чувствительность реакции (в мг или мкг) в 1 мл раствора, т.е. приводя, в сущности, значение clim (cmin) в мг/мл или в мкг/мл. Так, например, чувствительность открытия катионов кальция Са 2+ реакцией с оксалатом аммония
характеризуется фразой: «Предельная чувствительность реакции 0,0035 мг (3,5 мкг) кальций-иона в 1 мл раствора». Это означает, что clim = 3,5 мкг/мл = 3,5.10 –6 г/мл,
Vlim = 1/clim = 1/(3,5.10 –6 ) = 2,9.10 5 мл/г.
Дата добавления: 2016-01-09 ; просмотров: 9560 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Чувствительность аналитических реакций с примерами решения
Чувствительность аналитических реакций
Аналитическими реакциями, пригодными для качественного анализа, являются реакции, сопровождающиеся каким-нибудь внешним эффектом: выпадением и растворением осадка, выделением газообразных веществ, изменением окраски. Выбирая реакции для химического анализа, руководствуются законом действующих масс и представлениями о химическом равновесии в растворах. Для успешного проведения аналитической реакции необходимо соблюдать ряд тех или иных условий, обеспечивающих получение достоверных результатов. Такими условиями являются pH раствора, температура, маскирование или удаление мешающих ионов. Однако даже при соблюдении всех этих условий аналитическая реакция может не дать положительного эффекта, если недостаточна концентрация обнаруживаемого иона в растворе. С концентрацией обнаруживаемого иона в растворе связано понятие «чувствительность» аналитической реакции.
Чувствительность аналитических реакций характеризуется пределом обнаружения 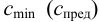
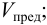
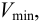
Предел обнаружения 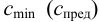
Предел обнаружения m (мкг) — открываемый минимум; это наименьшая масса определяемого компонента, с заданной доверительной вероятностью обнаруживаемая данной аналитической реакцией в минимальном объеме предельно разбавленного раствора.
Предельное разбавление, 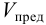
Минимальный объем предельно разбавленного раствора, 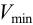
Эти характеристики чувствительности связаны между собой соотношением:
В качественном анализе обычно используют реакции с 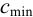
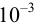
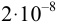
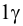
Показатель чувствительности, 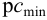
В количественном химическом анализе показателем чувствительности является нижняя граница определяемых содержаний 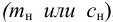
Пример 1.6.
Предельное разбавление ионов 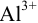
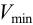
Решение:
По формуле (1.1) находим:
Пример 1.7.
Для обнаружения ионов меди действием раствора аммиака 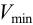
Решение:
С учетом формулы (1.1) рассчитываем 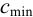
Пример 1.8.
Предельно допустимая концентрация (ПДК) иона аммония в питьевой воде 2,0 мг/л. Предел обнаружения его по реакции с реактивом Несслера составляет 0,002 мкг. Проверьте расчетами возможность обнаружения иона аммония в 1,0 мл воды при содержании, равном ПДК.
Решение:
Рассчитаем минимальную концентрацию иона аммония в растворе, при которой реакция с реактивом Несслера дает положительный эффект:
Сравнивая полученное значение 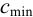
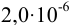
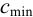
Пример 1.9.
Катионы серебра 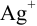
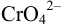
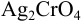
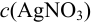
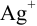
Решение:
Найдем 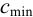
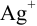
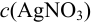
Вычислим показатель чувствительности:
Используя формулу (1.1), найдем 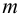
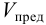
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Возможны вам будут полезны эти страницы:
Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института