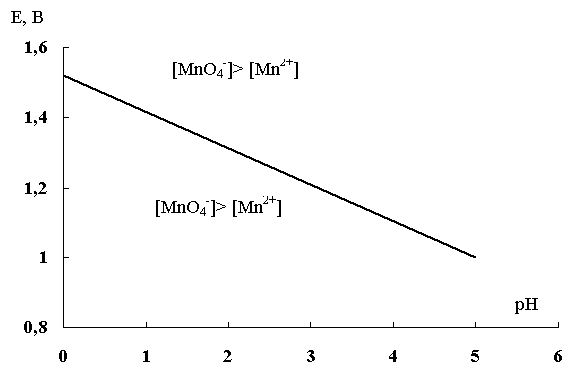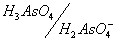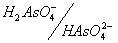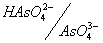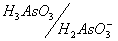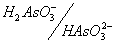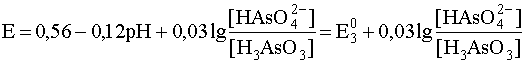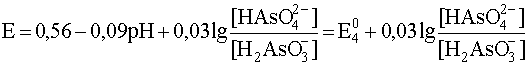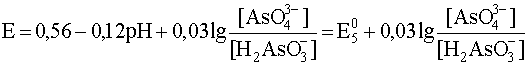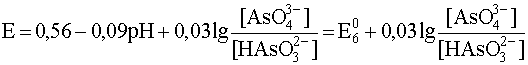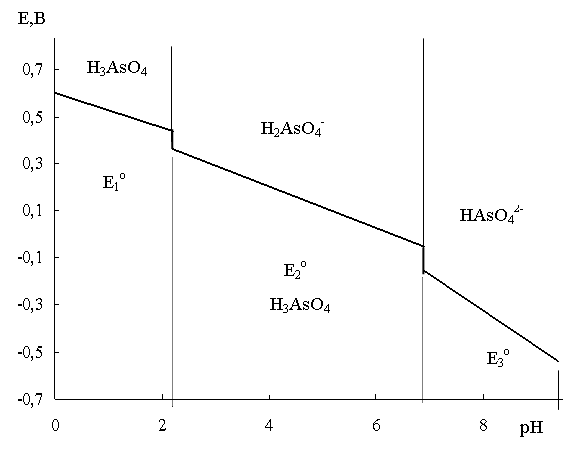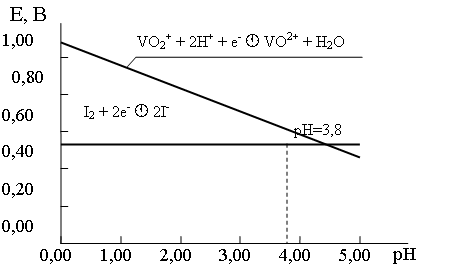Что описывает уравнение нернста
Уравнение Нернста
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Вывод уравнения Нернста

Если в формулу Нернста подставить числовые значения констант 


Литература
Полезное
Смотреть что такое «Уравнение Нернста» в других словарях:
уравнение Нернста — – уравнение, устанавливающее зависимость потенциала от природы редокс системы, активности ее компонентов и температуры. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
уравнение Нернста — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN Nernst equation … Справочник технического переводчика
уравнение Нернста — Nernsto lygtis statusas T sritis chemija apibrėžtis Apytikslė lygtis dujinių medžiagų reakcijos pusiausvyrai apskaičiuoti. atitikmenys: angl. Nernst equation rus. уравнение Нернста … Chemijos terminų aiškinamasis žodynas
уравнение Нернста — Nernsto lygtis statusas T sritis chemija apibrėžtis Lygtis, reiškianti elektrodo potencialo priklausomybę nuo jonų aktyvumo tirpale. atitikmenys: angl. Nernst equation rus. уравнение Нернста … Chemijos terminų aiškinamasis žodynas
Нернста теорема — Начала термодинамики Статья является частью серии «Термодинамика». Нулевое начало термодинамики Первое начало термодинамики Второе начало термодинамики Третье начало термодинамики Разделы термодинамики … Википедия
ДИФФУЗИИ УРАВНЕНИЕ — дифференциальное уравнение с частными производными 2 го порядка, описывающее процесс диффузии, т. е. процесс выравнивания концентрации в среде с неравномерным распределением вещества. Д. у. имеет вид (1) где с коэффициент пористости, D… … Математическая энциклопедия
ЭЛЕКТРОХИМИЯ — раздел физической химии, изучающий химические процессы, которые сопровождаются появлением электрического тока или, наоборот, возникают под действием электрического тока. Предметом электрохимических исследований также являются электролиты и… … Энциклопедия Кольера
Методы электроаналитической химии — Содержание 1 Методы электроаналитической химии 2 Введение 3 Теоретическая часть … Википедия
Каломельный электрод — Каломельный электрод электрод, использующийся в качестве электрода сравнения в гальванических элементах. Каломельный электрод состоит из платиновой проволочки, погружённой в каплю ртути, помещённую в насыщенный каломелью раствор хлорида… … Википедия
Каломельный — электрод электрод, использующийся в качестве электрода сравнения в гальванических элементах. Каломельный электрод состоит из платиновой проволочки, погружённой в каплю ртути, помещённую в насыщенный каломелью раствор хлорида калия определённой… … Википедия
Научная электронная библиотека
Таланов В. М., Житный Г. М.,
1.3.2. Уравнение Нернста и его различные формы
Окислительно-восстановительной системе, записанной в общем виде
соответствует наиболее общая форма уравнения Нернста:
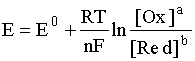
Если заменить натуральный логарифм десятичным и подставить соответствующие значения постоянных величин в предлогарифмическом сомножителе, то для температуры 298 К уравнение имеет вид
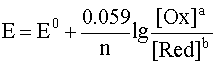
В дальнейшем будем пользоваться округленным значением числовой константы в логарифмическом слагаемом, что значительно упрощает расчеты, не внося в их результат существенной ошибки:
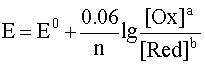
Например, для полуреакции
уравнение Нернста имеет вид:
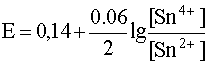
В различных частных случаях, в зависимости от характера полуреакции, уравнение Нернста записывается по-разному:
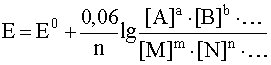
Например, для окислительно-восстановительной системы
потенциал выражается уравнением
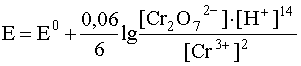
2. Если окислительно-восстановительная система включает в себя малорастворимое вещество, то его концентрация, будучи также величиной постоянной, не включается в логарифмический член уравнения Нернста. Так, для полуреакции
уравнение Нернста имеет вид
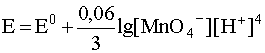
3. Для металлических электродов, то есть для окислительно-восстановительных систем, представляющих собой металл, контактирующий с раствором, содержащим катионы этого же металла, например, для электрода
уравнение Нернста включает только концентрацию катионов металла в растворе, то есть
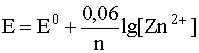
4. Если окислительно-восстановительная система включает в себя малорастворимый в воде газ (H2, O2, N2 и т.д.), то в уравнение Нернста входит не концентрация этого газа, а его парциальное давление. Например, для системы
уравнение Нернста должно быть записано следующим образом:
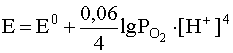
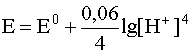
Научная электронная библиотека
Таланов В. М., Житный Г. М.,
1.6.3. Области существования ионов и молекул в зависимости от рН cреды и потенциала окислительно-восстановительной системы
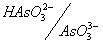
MnO4 – + 8H + + 5e – D Mn 2+ + 4 H2O
В случаях подобного рода влияние кислотности среды очевидно, так как концентрация водородных ионов входит в логарифмический член уравнения Нернста, которое для рассматриваемой полуреакции запишется следующим образом:
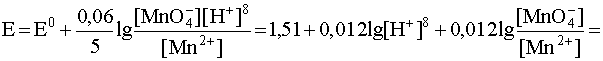
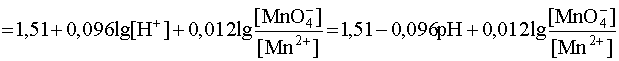
Данное выражение показывает, что с увеличением рН (уменьшением кислотности среды) окислительные свойства перманганат-иона снижаются. Другой важный вывод, вытекающий из рассмотрения данного примера, заключается в следующем: когда [MnO4 – ] = [Mn 2+ ] дробь под логарифмом равна 1, следовательно, логарифмический член равен нулю. Тогда потенциал данной системы линейно зависит от рН среды:
E1 = E 0 – 0,096pH = 1,51 – 0,096pH
Прямая, выражающая эту зависимость, разграничивает две области: над прямой лежит область, где преобладает окислитель, а под прямой – область преобладания восстановителя.
Обобщая рассмотренный случай, запишем уравнение подобной полуреакции в общем виде:
aOx + cH + + ne – D bRed + dH2O
Уравнение Нернста для этой обобщенной полуреакции имеет вид:
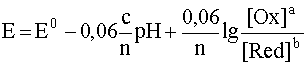
Рис. 5. Области существования окислителя и восстановителя пары Mn 2+ / MnO4 – в зависимости от рН среды
Графики зависимости E = f(pH) для уравнений полуреакций типа (38) представляют собой прямые линии с тангенсом угла наклона 0,06(c/n). Эти прямые выражают равновесные состояния для рассматриваемой окислительно-восстановительной полуреакции при изменении рН раствора.
В качестве типичного примера рассмотрим систему:
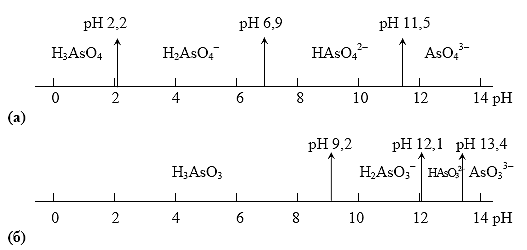
As(V) в зависимости от рН раствора может существовать в виде молекул ортомышьяковой кислоты H3AsO4 или в виде анионов этой кислоты: чем выше кислотность раствора (меньше его рН), тем больше сдвигается равновесие в сторону доминирования в растворе форм, более богатых водородом:
Соответствующие кислотно-основные пары имеют следующие значения констант кислотности:
То же самое относится и к восстановленной форме рассматриваемой системы: As(III) может существовать в виде ортомышьяковистой кислоты H3AsO3 и ее анионов:
Рис. 6. Области существования различных форм As(V) (а) и As(III)(б) в зависимости от рН среды
Учитывая, что стандартный потенциал пары As(V)/As(III) равен 0,56 В, запишем уравнение рассматриваемой полуреакции и уравнение Нернста для нее при 0
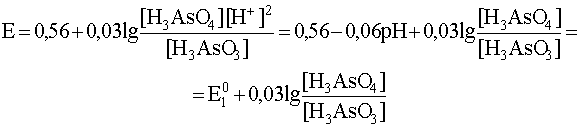
а уравнение Нернста для этой полуреакции
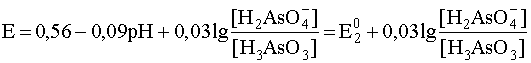
Подобным же образом напишем уравнения полуреакции и составим уравнение Нернста для других интервалов рН, внутри которых преобладает та или иная форма окислителя и (или) восстановителя:
12,1 3– + 3H + + 2e – ® HAsO3 2– + H2O
pH > 13,4
Рис. 7. Формы существования окислителя и восстановителя системы As(V)/ As(III) в зависимости от рН среды и потенциала системы
I2 + 2e – D 2I – 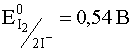
VO2 + + 2H + + e – D VO 2+ + H2O 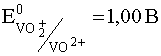
Потенциал этой последней полуреакции, как следует из ее уравнения, зависит от рН раствора и уравнение Нернста для нее на основании выражения (35) для случая, когда [VO2 + ] = [VO 2+ ] имеет вид:
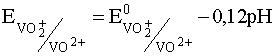
Рис. 8. Зависимость потенциалов систем I2/2I – и V(V)/V(IV) от рН среды
Содержание данного параграфа приводит к следующим важным практическим выводам:
1. Кислотность раствора существенно влияет на свойства окислителей и восстановителей, когда наряду с переносом электронов (окисление-восстановление) имеет место перенос протонов (протолитические взаимодействия).
2. Если в уравнении окислительно-восстановительной полуреакции протоны фигурируют среди исходных веществ, то для усиления окислительных свойств этой системы целесообразно подкисление cреды. В случае, когда ионы Н + являются продуктами полуреакции, то в раствор следует добавлять щелочь с целью связывания образующихся протонов в молекулы воды.
3. Когда взаимодействующие окислительно-восстановительные системы имеют достаточно близкие значения стандартных потенциалов, необходимо учитывать изменение направления суммарной окислительно-восстановительной реакции при изменении кислотности раствора.
Электродный потенциал. Уравнение Нернста
Стандартные электродные потенциалы. Понятие о гальваническом элементе. Возможность, направление протекания окислительно-восстановительных реакций. Окислительно-восстановительные процессы в живых организмах, брожение, фотосинтез в зеленых частях растений.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 27.07.2015 |
| Размер файла | 199,9 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Электродный потенциал. Уравнение Нернста
Если пластину любого металла погрузить в воду или раствор электролита, содержащий ионы этого металла, то небольшая часть металла перейдет в раствор, в форме положительно заряженных ионов, а сама пластина, концентрируя на себе избыток свободных электронов, приобретает отрицательный заряд.
Такому переходу содействует связывание ионов металла с молекулами воды (растворителя).В итоге устанавливается равновесие
Эту разность электрических потенциалов или скачок потенциала на границе металл-раствор электролита называют электродным потенциалом.
Величина электродного потенциала зависит от природы металла, концентрации, точнее активности ионов металла в растворе и температуры.
Математически эта зависимость выражается уравнением В.Г.Нернста (1888).
а в случае разбавленных растворов полностью диссоциирующих солей данного металла
где E 0 Me— стандартный электродный потенциал
R- универсальная газовая постоянная
F- постоянная Фарадея
После перехода от натурального логарифма к десятичному и подстановки значений
F=96500 Кл, точнее 96487 Кл уравнение примет вид
Стандартные электродные потенциалы
Экспериментально определить абсолютное значение электродного потенциала невозможно. Поэтому на практике измеряется разность потенциалов между электродным потенциалом исследуемой системы и потенциалом электрода сравнения. В качестве стандартного электрода сравнения используют водородный электрод. Он изготавливается из губчатой платины, погруженной в раствор H2SO4 с ан+=1, что соответствует примерно их концентрации, равной 1 моль/л, через раствор при 25 0 С под давлением 101,325 кПа пропускается газообразный водород, который поглощается платиной. Т.е. поверхность платинового электрода насыщена водородом, в результате в системе устанавливается равновесие
которое характеризуется определенным значением скачка потенциала на межфазной границе. Электродный потенциал называется стандартным водородным потенциалом Е 0 2Н+/H2, а его значение принято равным нулю. Сочетая электрод исследуемой окислительно-восстановительной системы со стандартным водородным электродом определяют потенциал Е данной системы.
Система с большим электродным потенциалом всегда является окислителем по отношению к системе с меньшим потенциалом. (Получают ряд стандартных электродных потенциалов металлов в водных растворах).
2) металлы, имеющие отрицательные значения электродных потенциалов, стоящие левее водорода, способны его вытеснять из разбавленных растворов кислот.
3) каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые имеют более высокий электродный потенциал.
4) с ростом потенциала полуреакций окислительная форма/ восстановительная форма (сверху вниз) в ряду стандартных электродных потенциалов уменьшаются восстановительные свойства восстанавленной формы и увеличиваются окислительные свойства окисленной формы.
Понятие о гальваническом элементе
Пластины цинка и меди опущены в раствор солей (сульфатов цинка и сульфата меди (II) ). На электроде из цинка происходит окисление атомов цинка в ионы (растворение):
или в молекулярной форме
ЭДС гальванического элемента можно вычислить по разности стандартных электродных потенциалов. Т.к. ЭДС должно быть > 0, поэтому надо из потенциала электрода имеющего большую алгебраическую величину, вычитать электрод- алгебраическая величина которого меньше.
В таблице стандартных электродных потенциалов
Электроны будут переходить от металла с более отрицательным потенциалом к металлу с более положительным. Для количественной оценки направленности процессов пользуются значениями G 0 обр реагентов и продуктов реакции.
В гальванических элементах материал электродов изменяется т.к. идут на электродах ОВР. Но могут быть построены гальванические элементы электроды которых не меняются, а служат лишь переносчиками электронов.
1) восстановительную полупару, включающую ион (атом) восстановитель, вместе со своей окисленной формой например для реакции
Любая полупара, играющая в одной ОВР роль окислителя, может выступать в другой реакции в роли восстановителя.
Для решения вопроса, может ли данная полупара при взаимодействии с другой полупарой выступать в качестве окислителей и восстановителей используют таблицу стандартных (нормальных) окислительных потенциалов при 25 0 С.
Окислительно-восстановительные полупары чаще располагают в порядке убывания соответствующих им значений стандартного окислительного потенциала. При этом вещество расположенное в левой колонке выше, может служить окислителем для вещества расположенного в правой колонке ниже.
значит реакция осуществима.
Пример: подобрать окислитель для окисления Fe 2+ до Fe 3+ Е 0 Fe 3+ /Fe 2+ = 0,771В, нужно искать окислитель в левой колонке таблицы окислительно-восстановительных потенциалов, окислительный потенциал которого > 0,771В.
ЭДС = 0,96-0,771 = 0,19В > 0.
Возможность и направление протекания ОВР
При обратимом осуществлении ОВР в условиях р = const и V= const изменение энергии Гиббса будет равно электрической работе Аэл., совершаемой системой.
Потенциал ОВ пары вычисляют по уравнению Нериста, которое можно представить в виде
В соответствии со II законом термодинамики самопроизвольно протекают только процессы имеющие Д G 0.
Если взаимодействует сильный окислитель с сильным восстановителем, то происходит односторонний процесс. Он практически протекает до конца, т.к. его продуктами обычно является соединения со слабо выраженными окислительно-восстановительными свойствами. При малом отличии окислительно-восстановительной активности исходных веществ и продуктов реакции процесс является двусторонним. Для количественной оценки направленности процессов пользуются значениями G 0 реагентов и продуктов реакции, а для частного случая ОВР, протекающих в разбавленных водных растворах при t=25 0 С, 101кПа можно пользоваться значениями нормальных электродных потенциалов.
Сопоставляя электродные потенциалы соответствующих систем,, можно заранее определять направление в котором будет протекать ОВР.
При условиях, отличающихся от стандартных, для системы
электродный потенциал определяется уравнением Нернста
C(Red) и Cox молярные концентрации восстановленной и окисленной форм.
Выбрать галогенид калия в качестве восстановителя для FeCl3
Только иодид калия будет восстанавливать FeCl3, т.к.Д Е 0 298 > 0.
Получение элементарных веществ, например: железа, хрома, марганца, никеля, кобальта, меди, серебра, серы, хлора, иода и т.д. и ценных химических продуктов, например, аммиака, щелочей, сернистого газа, азотной, серной и других кислот, основано на окислительно-восстановительных реакциях.
На процессах ОВ в аналитической химии основаны методы объемного анализа, перманганатометрия, иодометрия, броматометрия, и другие, играющие важную роль при контролировании производственных процессов и выполнении исследований.
ОВР играют важную роль в процессах почвообразования. Нормальный рост и развитие растений возможны только при определенном окислительно-восстановительном состоянии почвы, от окислительно-восстановительных условий в почве зависит подвижность, а следовательно доступность растениями таких элементов, как железо, марганец, азот и др.
Размещено на Allbest.ru
Подобные документы
Понятие окисления и восстановления. Типичные восстановители и окислители. Методы электронного и электронно-ионного баланса. Восстановление металлов из оксидов. Химические источники тока. Окислительно-восстановительные и стандартные электродные потенциалы.
лекция [589,6 K], добавлен 18.10.2013
Отличительные признаки окислительно-восстановительных реакций. Схема стандартного водородного электрода. Уравнение Нернста. Теоретические кривые титрования. Определение точки эквивалентности. Окислительно-восстановительные индикаторы, перманганатометрия.
курсовая работа [319,6 K], добавлен 06.05.2011
Окислительно-восстановительные реакции, при которых происходит процесс переноса электронов от одних атомов к другим. Направление самопроизвольного протекания реакций. Виды потенциалов и механизмы их возникновения, а также ряд напряжений металлов.
презентация [104,9 K], добавлен 18.05.2014
Важнейшие окислители и восстановители. Cоставление уравнений окислительно-восстановительных реакций и подбор стехиометрических коэффициентов. Влияние различных факторов на протекание реакций. Окислительно-восстановительный эквивалент, сущность закона.
лекция [72,5 K], добавлен 22.04.2013
реферат [55,9 K], добавлен 04.11.2011