Что опаснее кислота или щелочь
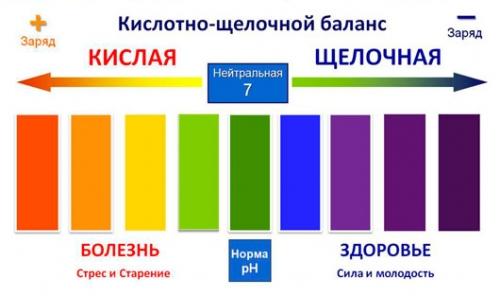
Если анализ показал кислотную среду (pH меньше 7,36), значит, что у вас развивается ацидоз, т.е снижается усвоение необходимых организму минералов: калия, кальция, магния, натрия. Последствием дефицита этих важных веществ уже скоро могут стать снижение иммунитета, хрупкость костей, слабость. А потом могут начаться боли в суставах и мышцах, проблемы с сердцем и кровообращением, скачки давления, мочекаменная болезнь и диабет. Также следует знать, что ацидоз предрасполагает к опухолям, в том числе злокачественым.
Если же показатель pH более 8,5, т.е. слишком сдвинут в сторону щелочи, то это тоже непорядок: может начаться дисфункция работы всего ЖКТ, плохое усвоение пищи и дурной запах изо рта. Но главное следствие щелочного сдвига pH вашего организма – захламление крови токсинами. Это состояние приводит к хроническим запорам, проблемам с печенью и, как следствие, к аллергии, невозможности противостоять грибковым заболеваниям и, опять же, склонности к онкологии.
Таким образом, для нормального функционирования организма человека, для правильного течения всех биохимических реакций необходимы и кислоты, и щелочи.
Однако не так давно стали появляться научные теории, в которых «окисление» напрямую связывается со старением организма, а борьба со старением стала приравниваться к борьбе с кислотностью, даже появилось название класса веществ–участников этой борьбы, получивших названием «антиоксиданты».
В основе этих теорий лежат факты: новорожденный ребенок имеет щелочной рН, равный 8-8,5. Щелочными являются такие жизненно важные среды организма как слюна человека, его слезы, женское грудное молоко и мужская семенная жидкость, панкреатический секрет. В отличие от желудочного сока с его высокой кислотностью, среда кишечника, особенно тонкого – преимущественно щелочная.
Поэтому сегодня особенно популярны теории Иосифа Локэмпер и Петера Ентшуры, итальянского доктора Симончини, который предлагает онкобольным проводить щелочную терапию, им вторит наш профессор Неумывакин, рекомендующий лечить целый ряд недугов пищевой содой – самой распространенным бытовым карбонатом.
И все же не стоит увлекаться экстремальными научными веяниями и опытам над собственным организмом. В организме, как и в любой природной системе, важна естественная гармония, которая, подчас, является очень тонкой и хрупкой. Доказательство – возьмем кислотно–щелочной баланс такой важной субстанции как кровь. Нормальный показатель рН человеческой крови 7,36-7,42. При самом незначительном сдвиге его в ту или иную сторону на 0,1 человек приобретает серьезную патологию, при сдвиге на 0,2 – впадает в кому, а при изменении всего лишь на 0,3 – умирает.
К щелочным относятся практически вся растительная пища, овощи и фрукты. Особенно (как ни странно!) лимоны; все виды огородной зелени; корнеплоды, такие как свёкла, редис, морковь; сельдерей; огурцы; чеснок; овощи крестоцветного вида и авокадо. Все это необходимо как можно чаще включать в свой рацион.
К сильно «закисляющим» наш организм продуктам относятся простые углевода – хлебо-булочные изделия из белой муки, разнообразная сдоба, макароны, шоколад и какао, пиво и сладкие безалкогольные напитки, а также говядина, свинина, моллюски, сыры. А из натурального растительного – грецкие орехи и арахис, черника, клюква, чернослив.
Важно помнить, что при нарушении гармонии веществ-антагонистов – кислот и щелочей – для нашего организма чревато дискомфортом и печальными последствиями. Однако пр разумном подходе каждый из нас может стать «хозяином» собственного кислотно-щелочного баланса! А значит – и здоровья, и активного долголетия.
Что опаснее кислота или щелочь
Кислоты и щелочи: В чем заключается их опасность
Кислоты и щелочи – это опасные для здоровья человека химические вещества. Они могут привести к химическим ожогам, нарушениям в работе дыхательной системы, а также стать причиной пожара. Особую опасность составляют концентрированные формы кислот и щелочей, но и разбавленные растворы несут в себе вред. Перед применением кислот или щелочей любого типа обязательно изучите правила техники безопасности при работе с конкретным веществом, а также правила хранения и утилизации. Разработайте план действий в случае разлития или контакта с веществом.
Опасность для дыхательных путей
Многие кислоты и щелочи высокотоксичны. Вдыхание испарений может вызвать раздражение слизистых носа, горла и легких. В особо тяжелых случаях может наступить отек легких – состояние, угрожающее жизни человека, при котором жидкость в легких блокирует доступ кислорода к кровеносному потоку.
Опасность при контакте
Концентрированные формы кислот и щелочей оказывают разъедающий эффект, и при попадании на кожу, глаза или во внутренние органы могут вызвать химические ожоги. Ожог кислотой характеризуется мгновенными болевыми ощущениями и повреждением ткани. Фтороводородная кислота быстро проникает под кожу и может даже вызвать костные повреждения. И, наоборот, при контакте со щелочью вы можете и не обратить внимания на это, т.к. боль наступает чуть позже. Но это означает, что и контакт со щелочью длится дольше. Никогда не добавляйте воду в кислоту, т.к. в результате брызги полетят во все стороны. Наоборот, медленно добавьте необходимый объем кислоты в воду.
Пожарная опасность
При смешивании кислот или щелочей с другими химическими веществами может произойти взрыв; вдобавок, кислота вступает в реакцию с некоторыми металлами, в результате чего образуется легковоспламеняющееся вещество – газообразный водород. Газообразный водород также может образоваться в результате реакции некоторых щелочей с алюминием, магнием, оловом и металлическим цинком. Никогда не курите и не разводите открытый огонь вблизи кислот и щелочей.
Защитное снаряжение
Всякий раз, как вы работаете с кислотами или щелочами, пользуйтесь средствами индивидуальной защиты: очками, лабораторными халатами или спецодеждой, закрытой обувью; защитными перчатками, подходящими для работы с конкретным веществом. Для работы с большинством кислот подходят нитриловые перчатки, но, тем не менее, обязательно проверьте, подходят ли они конкретно для того вещества, с которым вы собираетесь работать. В зависимости от объема вещества или продолжительности работы с ним, вам, возможно, понадобится респиратор или защитная маска для лица.
Если анализ показал кислотную среду (pH меньше 7,36), значит, что у вас развивается ацидоз, т.е снижается усвоение необходимых организму минералов: калия, кальция, магния, натрия. Последствием дефицита этих важных веществ уже скоро могут стать снижение иммунитета, хрупкость костей, слабость. А потом могут начаться боли в суставах и мышцах, проблемы с сердцем и кровообращением, скачки давления, мочекаменная болезнь и диабет. Также следует знать, что ацидоз предрасполагает к опухолям, в том числе злокачественым.
Если же показатель pH более 8,5, т.е. слишком сдвинут в сторону щелочи, то это тоже непорядок: может начаться дисфункция работы всего ЖКТ, плохое усвоение пищи и дурной запах изо рта. Но главное следствие щелочного сдвига pH вашего организма – захламление крови токсинами. Это состояние приводит к хроническим запорам, проблемам с печенью и, как следствие, к аллергии, невозможности противостоять грибковым заболеваниям и, опять же, склонности к онкологии.
Таким образом, для нормального функционирования организма человека, для правильного течения всех биохимических реакций необходимы и кислоты, и щелочи.
Однако не так давно стали появляться научные теории, в которых «окисление» напрямую связывается со старением организма, а борьба со старением стала приравниваться к борьбе с кислотностью, даже появилось название класса веществ–участников этой борьбы, получивших названием «антиоксиданты».
В основе этих теорий лежат факты: новорожденный ребенок имеет щелочной рН, равный 8-8,5. Щелочными являются такие жизненно важные среды организма как слюна человека, его слезы, женское грудное молоко и мужская семенная жидкость, панкреатический секрет. В отличие от желудочного сока с его высокой кислотностью, среда кишечника, особенно тонкого – преимущественно щелочная.
Поэтому сегодня особенно популярны теории Иосифа Локэмпер и Петера Ентшуры, итальянского доктора Симончини, который предлагает онкобольным проводить щелочную терапию, им вторит наш профессор Неумывакин, рекомендующий лечить целый ряд недугов пищевой содой – самой распространенным бытовым карбонатом.
И все же не стоит увлекаться экстремальными научными веяниями и опытам над собственным организмом. В организме, как и в любой природной системе, важна естественная гармония, которая, подчас, является очень тонкой и хрупкой. Доказательство – возьмем кислотно–щелочной баланс такой важной субстанции как кровь. Нормальный показатель рН человеческой крови 7,36-7,42. При самом незначительном сдвиге его в ту или иную сторону на 0,1 человек приобретает серьезную патологию, при сдвиге на 0,2 – впадает в кому, а при изменении всего лишь на 0,3 – умирает.
К щелочным относятся практически вся растительная пища, овощи и фрукты. Особенно (как ни странно!) лимоны; все виды огородной зелени; корнеплоды, такие как свёкла, редис, морковь; сельдерей; огурцы; чеснок; овощи крестоцветного вида и авокадо. Все это необходимо как можно чаще включать в свой рацион.
К сильно «закисляющим» наш организм продуктам относятся простые углевода – хлебо-булочные изделия из белой муки, разнообразная сдоба, макароны, шоколад и какао, пиво и сладкие безалкогольные напитки, а также говядина, свинина, моллюски, сыры. А из натурального растительного – грецкие орехи и арахис, черника, клюква, чернослив.
Важно помнить, что при нарушении гармонии веществ-антагонистов – кислот и щелочей – для нашего организма чревато дискомфортом и печальными последствиями. Однако пр разумном подходе каждый из нас может стать «хозяином» собственного кислотно-щелочного баланса! А значит – и здоровья, и активного долголетия.
Чем отличаются кислоты от щелочей
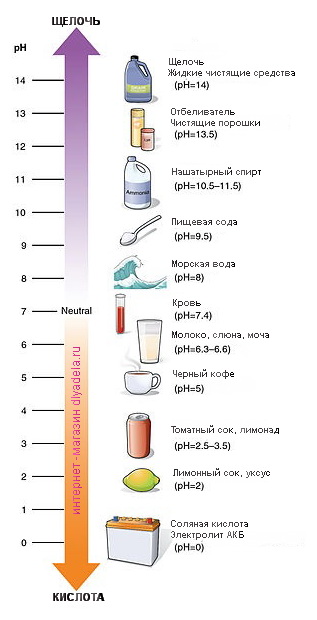
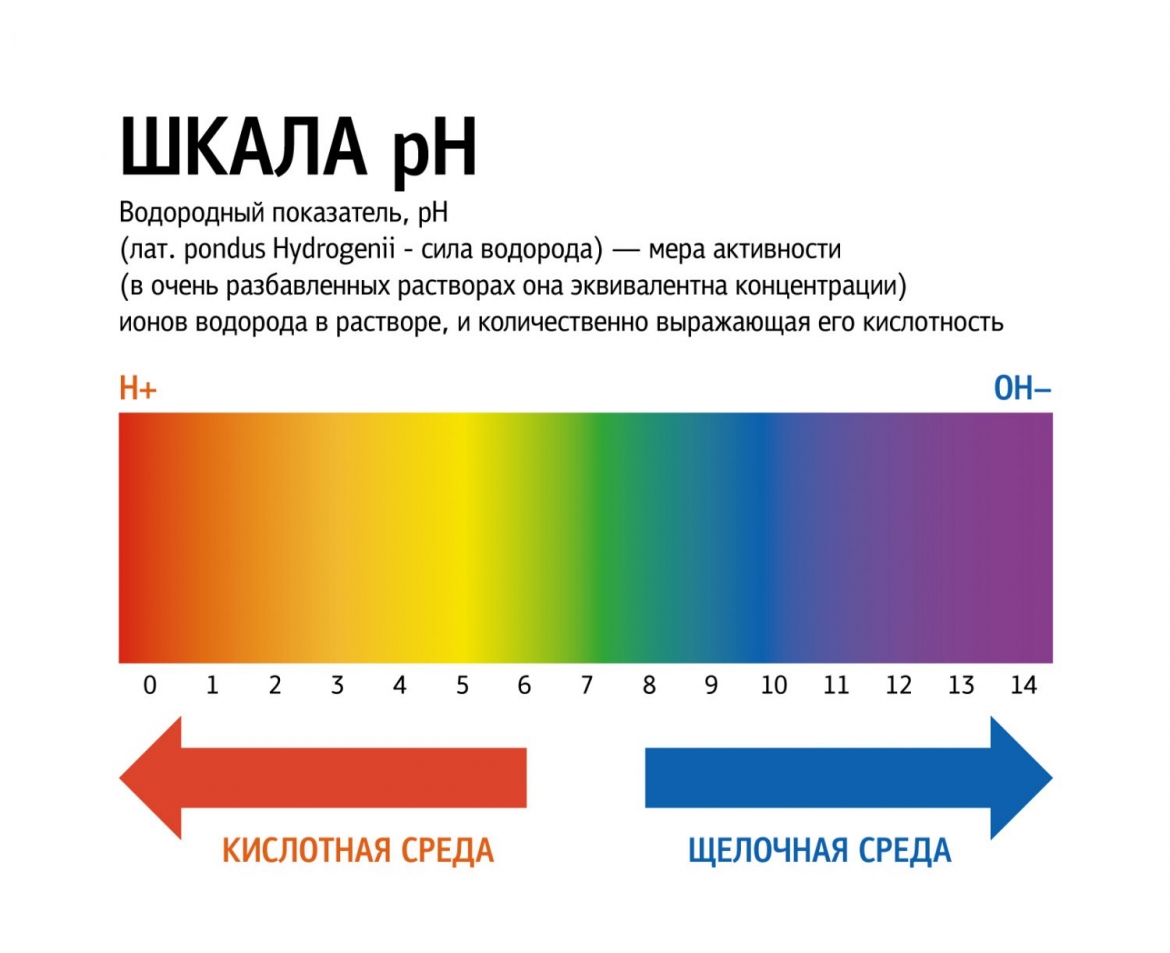
Кислоты и щёлочи отличают по показателям pH (шкала pH). Ниже Вы видите картинку – это специальная шкала, на которой имеются числа от 0 и до 14. Нулём обозначают самые сильные кислоты, а четырнадцатью – самую сильную щёлочь. Но какая же середина между этими числами? Может быть 5, может быть 7, а может быть 10? Серединой принято считать число 7 (нейтральное положение). То есть числа до 7 это все кислоты, а больше 7 это щёлочи.
Именно для этой шкалы разработаны специальные индикаторы — лакмусы. Это обычная полоска, которая реагирует на среду. В кислотной среде она окрашивается в красный цвет, а в щелочной среде – в синий цвет. Она необходима не только в химии, но и в быту.
Например, если у Вас есть аквариум, то немаловажную роль играет кислотность воды. От неё зависит вся жизнь аквариума. К примеру, показатель кислотности воды для аквариумных рыбок колеблется от 5 до 9 рН. Если будет больше или меньше, то рыбка будет чувствовать себя не комфортно, а может и вовсе умереть. Всё тоже самое и с растениями для аквариумов…
Кислоты
Кислоты — это соединения, содержащие водород и образующие ионы водорода (Н+) при растворении в воде. Ионы — это частицы с электрическим зарядом (см. статью «Химические связи»). Именно ионы придают кислотам их свойства, но существовать они могут только в растворе. Следовательно, свойства кислот проявляются исключительно в растворах. Молекула серной кислоты (H2SO4) состоит из атомов водорода, серы и кислорода. В состав соляной кислоты (НСl) входят водород и хлор. Кислота считается сильной, если большинство ее молекул распадаются в растворе, выделяя ионы водорода. Соляная, серная, азотная кислоты относятся к сильным. На контейнерах с сильными кислотами ставятся принятые во всем мире символы, означающие «опасно» и «высокая активность»Сила кислоты измеряется числом рН — водородным показателем. Сильные кислоты очень агрессивны; попав на поверхность предмета или на кожу, они прожигают её. На контейнерах с сильными кислотами ставятся принятые во всем мире символы, означающие «опасно» и «высокая активность».
Такие кислоты, как лимонная или уксусная, т.е. произведенные живыми организмами, называются органическими. Кислоты широко применяются в химической и медицинской промышленности, в производстве продуктов питания и синтетических волокон. Виноградный уксус содержит слабую кислоту, называемую уксусной. В помидорах есть органическая салициловая кислота. В цветных пятнах на коже морских улиток содержится кислота с неприятным вкусом, отпугивающая хищников. Для всех кислот характерно сходное поведение в химических реакциях. Например, при реакциях кислот с основаниями образуется нейтральное соединение — соль и вода. Реакции кислот с большинством металлов дают соль и водород. Реагируя с карбонатами, кислоты дают соль, углекислый газ и воду. Известный кулинарам пекарный порошок содержит гидрокарбонат натрия и винную кислоту. Когда в муку, содержащую пекарный порошок, добавляют воду, кислота и карбонат порошка вступают в реакцию, углекислый газ начинает выделятся в виде пузырьков, и это помогает тесту подниматься.
рН и индикаторы
Сила кислот и оснований определяется числом рН. Это мера концентрации ионов водорода в растворе. Число рН изменяется от 0 до 14. Чем меньше рН, тем выше концентрация водородных ионов. Раствор, рН которого меньше 7, — кислота. Апельсиновый сок имеет рН 4, значит, это кислота. Вещества с рН = 7 нейтральны, а вещества с рН больше 7 — основания или щелочи. рН кислоты или щелочи можно определить с помощью индикатора. Индикатор — это вещество, меняющее цвет при контакте с кислотой или щелочью. Так лакмус краснеет в кислоте и синеет в щелочи. Кислота окрашивает синюю лакмусовую бумажку в красные цвет, а красная лакмусовая бумажка в щелочи становится синей или фиолетовой. Лакмус получают из примитивных растений, называемых лишайниками. Другие растения, например, гортензия и краснокочанная капуста, также являются природными индикаторами.
Так называемый универсальный индикатор – это смесь нескольких красок. Он меняет цвет в зависимости от pH вещества. Он становится красным, оранжевым или желтым в кислотах, зеленым или желтым в нейтральных растворах и синим или фиолетовым в щелочах.
Серная кислота
Серная кислота играет важную роль в промышленности, прежде всего в производстве удобрений на основе суперфосфатов и сульфата аммония. Она также используется в производстве синтетических волокон, красителей, пластмасс, лекарств, взрывчатых веществ, моющих средств, автомобильных аккумуляторов. Когда-то серную кислоту называли минеральной кислотой, так как ее получали из серы — вещества, встречающегося в земной коре в виде минерала. Серная кислота очень активна и агрессивна. При растворении в воде она выделяет много тепла, поэтому ее нужно вливать в воду, но не наоборот — тогда кислота растворится, а вода поглотит тепло. Она — мощный окислитель, т.е. при реакциях окисления она отдает кислород другим веществам. Серная кислота также является осушителем, т.е. забирает воду, связанную с другим веществом. Когда сахар (C12H22O11) растворяется в концентрированной серной кислоте, кислота забирает у сахара воду, и от сахара остается пенящаяся масса черного угля.
Кислоты в почве
Цветы гортензии на кислотной почве синие, а на щелочной — розовыеКислотность почвы зависит от характера образовавших ее пород и от растущих на ней растений. На меловых и известняковых породах почва обычно щелочная, а на лугах, в песчаных и лесистых районах она более кислая. Кислотность также повышают кислотные дожди. Для земледелия лучше всего подходят нейтральные или слабокислые почвы, рН которых от 6,5 до 7. Разлагаясь, мертвые листья образуют органическую гуминовую кислоту и повышают кислотность почвы. Там, где почвы чересчур кислотные, в них добавляют измельченный известняк или гашеную известь (гидроксид кальция), т.е. основания, которые нейтрализуют кислоты почвы. Такие растения, как рододендроны и азалии хорошо растут на кислотных почвах. Цветы гортензии на кислотной почве синие, а на щелочной — розовые. Гортензия – природный индикатор. На кислотных почвах её цветы синие, а на щелочных розовые.
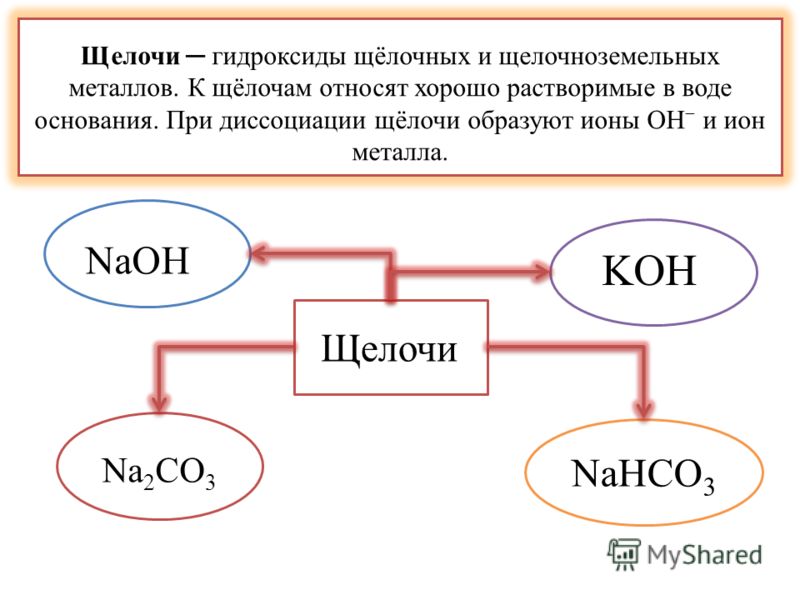
В настоящее время в химии принята теория Брёнстеда — Лоури и Льюиса, которая определяет кислоты и основания. В соответствии с этой теорией, кислоты — это вещества, способные отщеплять протон, а основания — отдавать электронную пару OH−. Можно сказать, что под основаниями понимают соединения, которые при диссоциации в воде образуют только анионы вида OH−. Если совсем просто, то щелочами называют соединения, состоящие из металла и гидроксид-иона OH−.
К щелочам принято относить гидроксиды щелочных и щелочно-земельных металлов. Все щелочи — это основания, но не наоборот, нельзя считать определения «основание» и «щелочь» синонимами.
Правильное химическое название щелочей — гидроксид (гидроокись), например, гидроокись натрия, гидроксид калия. Часто употребляются также названия, которые сложились исторически. Ввиду того, что щелочи разрушают материалы органического происхождения — кожу, ткани, бумагу, древесину, их называют едкими: например, едкий натр, едкий барий. Однако понятием «едкие щелочи» химики определяют гидроксиды щелочных металлов — лития, натрия, калия, рубидия, цезия.
Свойства щелочей
Щелочи — твердые вещества белого цвета; гигроскопичные, водорастворимые. Растворение в воде сопровождается активным выделением тепла. Вступают в реакции с кислотами, образуя соль и воду. Эта реакция нейтрализации является важнейшей из всех свойств щелочей. Кроме этого, гидроксиды реагируют с кислотными оксидами (образующими кислородосодержащие кислоты), с переходными металлами и их оксидами, с растворами солей.
Гидроксиды щелочных металлов растворяются в метиловом и этиловом спиртах, способны выдерживать температуры до +1000 °С (за исключением гидроксида лития).
Гидроксид натрия (едкий натр) используется в чистящих жидкостях, а также (как и гидроксид калия) для производства мыла. Мыло — это соль, образующаяся при реакции щелочей с кислотами растительных жиров. Жало осы выпускает щелочь, которую можно нейтрализовать кислотой, например уксусом.
Щелочи — активные химические реагенты, поглощающие из воздуха не только водяные пары, но и молекулы углекислого и сернистого газа, сероводорода, диоксида азота. Поэтому хранить гидроксиды следует в герметичной таре или, например, доступ воздуха в сосуд со щелочью организовать через хлоркальциевую трубку. В противном случае хим.реактив после хранения на воздухе будет загрязнен карбонатами, сульфатами, сульфидами, нитратами и нитритами.
Если сравнивать щелочи по химической активности, то она увеличивается при движении по столбцу таблицы Менделеева сверху вниз.
Концентрированные щелочи разрушают стекло, а расплавы щелочей — даже фарфор и платину, поэтому растворы щелочей не рекомендуется хранить в сосудах с пришлифованными стеклянными пробками и кранами, так как пробки и краны может заклинить. Хранят щелочи, обычно, в полиэтиленовых емкостях.
Именно щелочи, а не кислоты, вызывают более сильные ожоги, так как их сложнее смыть с кожи и они проникают глубоко в ткань. Смывать щелочь надо неконцентрированным раствором уксусной кислоты. Работать с ними необходимо в средствах защиты. Щелочной ожог требует немедленного обращения к врачу!
Применение щелочей
— В качестве электролитов.
— Для производства удобрений.
— В медицине, химических, косметических производствах.
— В рыбоводстве для стерилизации прудов.
Едкий натр. Самая популярная и востребованная в мире щелочь. Применяется для омыления жиров в производстве косметических и моющих средств, для изготовления масел в процессе нефтепереработки, в качестве катализатора и реактива в химических реакциях; в пищепроме.
Едкое кали. Применяется для производства мыла, калийных удобрений, электролитов для батареек и аккумуляторов, синтетического каучука. Также — в качестве пищевой добавки; для профессиональной очистки изделий из нержавеющей стали.
Гидроксид алюминия. Востребован в медицине как отличный адсорбент, антацид, обволакивающее средство; ингредиент вакцин в фармацевтике. Кроме этого, вещество применяется в очистных сооружениях и в процессах получения чистого алюминия.
Гидроокись кальция. Популярная щелочь с очень широким спектром применения, которую в быту знают под названием «гашеная известь». Используется для дезинфекции, смягчения воды, в производстве удобрений, едкого натра, «хлорки», строительных материалов. Применяется для защиты деревьев и деревянных сооружений от вредителей и огня; в пищепроме как пищевая добавка и реактив при производстве сахара.
Гидроокись лития. Востребованное соединение в химпроме как сырье; в стекольной, керамической, Фиксаналырадиотехнической индустрии; для производства смазочных материалов, электролитов; для поглощения вредных газов.
Гидроокись бария. Применяется в химпроме как катализатор, а также в пищепроме для очистки жиров, сахара.
• Кислоты и щелочи неспособны мирно сосуществовать даже одну секунду, находясь в соприкосновении. Перемешавшись, они мгновенно начинают бурное взаимодействие. Химическая реакция с ними сопровождается шипением и разогревом и длится до тех пор, пока эти ярые антагонисты не уничтожат друг друга.
• Кислотам свойственно образовывать кислую среду, а щелочам – щелочную.
• Химики отличают щелочь от кислоты по ее поведению с лакмусовой бумажкой или фенолфталеином.
Закисление организма разрушает кости и убивает почки
Введение в проблему
Мы знаем, что продукты питания снабжают нас энергией, строительными веществами (белками, жирами, углеводами) и витаминами.
Оказывается, пища обладает еще одним важным свойством. Она может либо закислять, либо защелачивать организм.
Американские ученые в начале XXI века сделали фундаментальное открытие. Они предложили способ для измерения кислотности рациона питания и показали, что именно хроническое закисление организма является одной из главных причин вымывания кальция из костной ткани и массивного выброса его через почки. В результате разрушаются кости и образуются камни в почках.
С помощью регулярного употребления 1-2 чайных ложек в день минерального препарата ОРТО КАЛЬЦИЙ + МАГНИЙ можно обеспечивать оптимальный уровень ощелачивания организма. Итак, подробнее.
Сила водорода
Процессы жизни протекают в водных средах, которые характеризуются определенной концентрацией атомов водорода. Вещества, которые отдают водородные атомы, называются кислотами, а те, которые их забирают, – щелочами.
Строгий контроль за кислотно-щелочным равновесием
В норме кровь имеет слабощелочную реакцию – 7,35-7,45. PН очень жестко выдерживается в узких границах, так как только в этих условиях возможна работа большинства ферментов.
При воздействии закисляющих или ощелачивающих факторов организм использует компенсаторные резервы организма. В целом, устойчивость организма к ощелачиванию в несколько раз выше, чем к закислению.
Кислотная нагрузка – новое измерение пищи
Мы привыкли оценивать пищу с позиций калорийности, содержания белков, углеводов, жиров, витаминов и других веществ.
Американские ученые в начале XXI века сделали подлинное открытие, когда показали, что любой продукт имеет еще один фундаментальный показатель, который имеет критическое значение для нашего здоровья. Они назвали его NEAP (net endogenous acid production – чистая продукция внутренней кислоты). Проще говоря, это кислотная нагрузка пищи. Она складывается из соотношения в пище компонентов, которые в ходе метаболизма образуют либо кислоту, либо щелочь.
Кислотная нагрузка измеряется по принципу: кислота минус щелочь. Когда в пище преобладают компоненты, образующие серную кислоту (серосодержащие аминокислоты) или органические кислоты (жиры, углеводы), то кислотная нагрузка имеет положительную величину. Если в пище больше компонентов, образующих щелочь (органические соли калия и магния), то кислотная нагрузка представляет собой отрицательную величину. Компьютерный анализ позволил определить кислотную нагрузку основных продуктов питания.
| Кислотная нагрузка основных продуктов питания* | |
| Продукт | Кислотная нагрузка |
| Кислые продукты | |
| Мясо | 67,9 |
| Зерновые | 13,8 |
| Сыр | 4,2 |
| Молоко и йогурт | 2,8 |
| Яйца | 2,5 |
| Нейтральные продукты | |
| Бобовые | 0,8 |
| Орехи | 0,1 |
| Щелочные продукты | |
| Листовая зелень | -59,1 |
| Овощи из группы плодовых** | -46,5 |
| Коренья | -26,4 |
| Овощи | -14,3 |
| Клубни | -10,6 |
| Фрукты | -5,8 |
| Примечания: * в миллиэквивалентах на 240 килокалорий ** Овощи из группы плодовых: помидоры, огурцы, кабачки, баклажаны, огурцы, арбузы, дыня, тыква и т.п. | |
Неправильное питание – причина хронического закисления организма
Биохимические процессы человека имеют длительную историю формирования применительно к тем условиям питания, которые сопровождали его в ходе эволюции.
 |
| Реконструкция образа неандертальца Источник рисунка: wikipedia.org |
Считается, что в истории питания человека можно выделить три больших этапа:
99% своей истории человек был охотником и собирателем. По данным антропологов, примерно треть его рациона составляло нежирное мясо диких животных и две трети – растительная пища. В этих условиях питание носило исключительно щелочной характер, кислотная нагрузка составляла в среднем минус 78 миллиэквалентов в день.
Ситуация принципиально изменилась с возникновением аграрной цивилизации, когда человек стал употреблять в пищу много зерновых культур, молочные продукты и жирное мясо одомашненных животных.
Но особенно драматические сдвиги в питании произошли в конце ХХ века, когда рацион заполонили промышленно обработанные «кислые» продукты питания. Кислотная нагрузка пищи современного человека составляет плюс 48 миллиэквалентов в день. Ежедневное «кислотное» питание приводит к хроническому пожизненному закислению (ацидозу) внутренней среды организма.
Хроническое закисление – источник многих бед для здоровья
Организм не допускает выхода рН крови за заданные пределы, но достается это дорогой ценой:
Измерь рН мочи и слюны
К счастью, существуют простые косвенные методы определения рН жидкостей с помощью тест-полосок, которые по разному изменяют свой цвет в зависимости от величины рН. Удобнее всего оценить состояние кислотно-щелочного равновесия по pН мочи и слюны. Для этого тест-полоска смачивается мочой или слюной. Сравнение цвета тест-полоски с цветовым эталоном позволяет определить уровень рН.
рН мочи Считается, что у первобытных людей моча имела щелочную реакцию, ее рН составлял приблизительно 7,5-9,0. У современных людей норма находится в слабокислом диапазоне: от 6,0-6,4 по утрам до 6,5-7,0 по вечерам. В среднем она составляет 6,4-6,5. PН мочи лучше измерять натощак, за 2 часа до и после приема пищи 2 раза в день несколько раз в неделю.
рН слюны Оптимальное время для измерения рН слюны: с 10 до 12 часов дня. В норме рН слюны находится в диапазоне 6,5-7,5.
Верни рН в норму
При отклонении рН в кислую сторону необходимо увеличить содержание в рационе щелочных продуктов (см. таблицу) и больше заниматься аэробными физическими упражнениями, например, хороши 30-40 минутные прогулки в быстром темпе 4-5 раз в неделю.
Орто Кальций + Магний против закисления организма
Простым и эффективным способом ощелачивания внутренней среды является прием ОРТО Кальция + Магния по 1-2 чайной ложке в день.
Быстрая нормализация кислотно-щелочного равновесия достигается благодаря мощному ощелачивающему действию кальция, магния и цитратов, которые усиливают друг друга. Эффект достигается в течение 1-3 дней.
ОРТО Кальций + Магний можно рассматривать в качестве ежедневного источника щелочных компонентов питания, которых так не хватает современному человеку.
Комплект тест-полосок для определения pH мочи и слюны (стоимость 100 рублей) может быть приобретен или доставлен вместе с ОРТО Кальцием + Магнием.
1. Боровский Е.В., Леонтьев В.К. Биология полости рта. – М.: Медицина, 1991, 301 с.
2. Зайчик А.Ш., Чурилов Л.П. Патофизиология кислотно-основного равновесия. В кн.: Основы патохимии. – СПб., Элби, с. 334-353. 3. Alpern RJ, Sakhaee S. The clinical spectrum of chronic metabolic acidosis: homeostatic mechanisms produce significant morbidity. Am J Kidney Dis 1997; 29:291–302. 4. Eaton SB et al. Paleolithic nutrition revisited. In: Evolutionary medicine. New York: Oxford University Press, Inc, 1999:313–32. 5. Eaton SB, Cordain L. Evolutionary aspects of diet: old genes, new fuels. Nutritional changes since agriculture. World Rev Nutr Diet 1997; 81:26–37. 6. Milton K. Hunter-gatherer diets—a different perspective. Am J Clin Nutr 2000; 71:665–7 7. Encyclopedia of Natural Medicine by Michael Murray, N.D. Prima Publishing (Revised 2nd Edition). 8. Sebastian A. et al. Estimation of the net acid load of the diet of ancestral preagricultural Homo sapiens and their hominid ancestors. American Journal of Clinical Nutrition. 2002; 76(6):1308-1316. 9. Simopoulos AP. Evolutionary aspects of nutrition and health: diet, exercise, genetics and chronic disease. Basel, Switzerland: S Karger, 1999.
7 июня 2008 года. Ред. 18 октября 2014 года.