Что нового в лечении болезни паркинсона
МРФУЗ — новая надежда больных с эссенциальным тремором и тремором при болезни Паркинсона
МРФУЗ — новая надежда больных с тремором и тремором при болезни Паркинсона
Современное неинвазивное лечение двигательных нарушений, тремора, болезни Паркинсона
Тряска рук, головы, ноги, которые не дают нормально жить пациентам с эссенциальным тремором и болезнью Паркинсона теперь могут быть излечены за одну-две процедуры. Это делается без разрезов, без имплантов и всего за 3-5 часов. Чтобы устранить дрожание рук применяется новейший метод лечения — фокусированный ультразвук под контролем магнитно-резонансной томографии (МРФУЗ). И ура, в 2020 году в России открылся первый центр МРФУЗ лечения эссенциального и связанного с болезнью Паркинсона тремора!
Технология фокусированного ультразвука под контролем МРТ позволяет найти и устранить очаг, вызывающий тремор или другие двигательные нарушения.
Как это делается?
Магнитно-резонансная томография строит изображение головного мозга. На карте головного мозга нейрохирурги рассчитывают предположительное место, вызывающее тремор. После чего, ультразвуком «усыпляется» на время эта область мозга. Размер этой области меньше 1 мм. Далее можно оценить вероятность побочных эффектов и правильность попадания.
При расположении очага там, где произведена эта гибернация (усыпление) нейронов, врачи видят исчезновение симптомов и отсутствие побочных эффектов. Тогда после этого воздействие в точке производится повторно и уже необратимо. Тремор проходит.
Если очаг расположен в другом месте, воздействие прекращается. Все нейроны «просыпаются» через 2-3 минуты. По карте взаимного расположения ядер головного мозга врач определяет следующую точку воздействия.
Таким образом, достигается контролируемое, необратимое воздействие. Поэтому возможно предотвратить большую часть побочных эффектов. Они проявляются на этапе усыпления (преднагрева), проходят самостоятельно через пару минут и не переводятся в необратимые.
Наглядное видео о методике:
Методика является хорошо апробированной. Сейчас уже никто из современных врачей не говорит, что она экспериментальная
Методика одобрена Росздравнадзором и FDA. В мире сделано более двух тысяч операций МРФУЗ с хорошими показателями эффективности и безопасности.
Карту мировых лидеров использующих эту методику можно увидеть на сайте производителя оборудования, компании Insightec. В Европе это: Великобритания, Испания, Германия, Швейцария, Италия и теперь Россия!
Что лучше DBS (глубокая стимуляция мозга), лечение лекарствами (консервативно), таламотомия гамма-ножом, радиочастотной аблацией (РЧА) или фокусированный ультразвук под контролем МРТ (МРФУЗ)?
Существует консервативная терапия. Но эффект от нее снижается со временем, есть побочные действия приема лекарств. Когда лекарственная терапия перестает быть эффективной, остаются следующие альтернативы: глубокая стимуляция мозга, таламотомия радиочастотной аблацией, таламотомия гамма-ножом.
Глубокая стимуляция мозга — эффективный метод, но он связан с проведением и имплантацией электродов в головной мозг! Для открытой операции с имплантацией инородного тела возможны следующие осложнения: кровотечение (геморрагический инсульт), инфекция и нагноение. Кроме того, электрод, в сравнении с миллиметровой точкой воздействия МРФУЗ достаточно громоздкий. Нужно понимать, что электрод тянется к стимулятору, который требует замены через каждые несколько лет в связи с разрядкой батареи. Электроды иногда переламываются.
Таламотомия радиочастотной аблацией, так же как и глубокая стимуляция мозга, требует разреза. В ткань мозга проводится электрод для аблации, который потом удаляется. Но в связи с работой инструментом через ткань мозга возможны кровотечения, инфекции, повреждения важных структур. Правильность воздействия проводится путем пробуждения пациента и проведением тестов.
Таламотомия гамма-ножом не позволяет изменить точку приложения воздействия. Поэтому, у части пациентов, которые имеют очаг в нетипичном месте, эффекта не будет. Возможно появление новых неврологических симптомов. Такая группа пациентов может быть достаточно большой.
При проведении МРФУЗ переносить расчетную точку воздействия в связи с отклонением в расположении очага приходится достаточно часто, почти в половине случаев. К счастью для МРФУЗ, перенос точки воздействия обратим и не приводит к побочным эффектам. Это отличает метод от других, когда воздействие либо механическое, либо лучевое.
Электроды, гамма-излучение, РЧА всегда оказывают какое-либо травмирующее воздействие сразу при их нанесении. Очаг воздействия облучения от гамма-ножа больше по размеру, если сравнивать с МРФУЗ.
Какие плюсы лечения эссенциального тремора (трясущихся рук) и тремора при болезни Паркинсона фокусированным ультразвуком под контролем МРТ
Для МРФУЗ не нужно разрезов, не нужно наркоза, не нужно имплантов, не нужно облучения. Пациент может идти домой в день процедуры. Методика позволяет сначала «прощупать» место воздействия, перед тем как воздействовать. А это настоящая мечта хирурга — скальпель, который режет только тогда, когда он приложен безошибочно туда, куда нужно.
Какие минусы МРФУЗ?
Прием лекарств после процедуры при болезни Паркинсона
Для пациентов с болезнью Паркинсона прием лекарств требуется в связи с измененным обменом веществ. Процедуры DBS, РЧА, ФУЗ убирают симптомы, но не устраняют болезнь. Это так же, как стентирование коронарного сосуда или шунтирование. Они не излечивают ишемическую болезнь сердца, а устраняют ее проявления. Паркинсоникам необходимо пить свои препараты, чтобы заболевание не прогрессировало, в том числе для контроля ригидности, депрессии и других симптомов. Устранение тремора позволяет пациентам самим обслуживать себя, улучшает качество жизни, устранив тремор они могут сами есть, пить чай, писать смс и звонить, спокойно спать.
МРФУЗ при эссенциальном треморе
Методика МРФУЗ при эссенциальном треморе очень эффективна. Именно при эссенциальном треморе фокусированный ультразвук под контролем МРТ сначала был одобрен FDA. FDA является одной из самых требовательных к эффективности и безопасности организаций в мире. МРФУЗ при эссенциальном треморе дает очень длительный результат, сравнимый с пожизненным.
Художественный короткометражный фильм об излечении пациента с эссенциальным тремором и первом центре в России
Всемирно известный пионер нейрохирургии профессор Jin Woo Chang (Director, Brain Research Institute Professor Department of Neurosurgery YONSEI UNIVERSITY COLLEGE OF MEDICINE) проводит лечение тремора при болезни Паркинсона.
Видео с результатами лечения тремора.
Я счастлив, что имею отношение к этому проекту, потому что всегда мечтал делать операции без разрезов, без боли, без необходимости наркоза и предсказуемо.
Новейшие методы лечения болезни Паркинсона
Болезнь Паркинсона: лечение неизлечимого?
Указанная в заголовке болезнь относится к дегенеративным неврологическим заболеваниям, при которых разрушаются нейроны и снижается синтез дофамина — одного из самых важных нейромедиаторов. Болезнь развивается медленно, но неотвратимо. Все начинается с почти незаметных симптомов — утраты обоняния, потливости, снижения настроения, затруднений при дефекации. Большинство больных не обращает на это внимания, пока не проявляются одни из самых характерных признаков болезни Паркинсона — замедленность и скованность движений. По мере развития заболевания скованность движений нарастает, присоединяется напряжение мышц (гипертонус, мышцы становятся ригидными). Может возникнуть одностороннее мелкоамплитудное дрожание пальцев руки и кисти, впоследствии распространяющееся и на другую сторону тела. На более поздних стадиях человек теряет возможность удерживать равновесие и самостоятельно передвигаться, мышление замедляется, развивается глубокая апатия и депрессия.
Средств, способных полностью остановить болезнь, не существует. Современная терапия направлена на облегчение состояния больного и замедление развития заболевания.
Лекарственные средства
Подбор медикаментозных средств для лечения болезни Паркинсона зависит от стадии заболевания. В самом начале развития болезни врачи применяют препараты, которые стимулируют синтез дофамина — нейромедиатора, количество которого при паркинсонизме снижается. Используются и препараты, останавливающие распад этого нейромедиатора, предупреждающие его обратный захват, стимулирующие соответствующие рецепторы в мозгу. Эти средства во многом схожи с антидепрессантами.
На ранних стадиях заболевания применяют агонисты дофаминовых рецепторов на основе действующих веществ:
На третьей из пяти стадий развития болезни назначают препарат с активным веществом леводопа. Если заболевание дебютировало в возрасте старше 70 лет, то, как правило, препарат на основе леводопы назначают сразу.
Есть ли нелекарственные способы лечения болезни Паркинсона?
Современное комплексное лечение болезни Паркинсона включает в себя и немедикаментозную терапию.
Нейрохирургический подход — глубокая стимуляция мозга
Этот радикальный подход к лечению болезни Паркинсона заключается во введении стереотаксическим методом электродов в строго определенные структуры головного мозга. При подаче электрических импульсов с определенной частотой и интенсивностью существенно уменьшаются двигательные нарушения при болезни Паркинсона, особенно тремор. В основном нейрохирургический подход показан пациентам устойчивым (резистентным) к медикаментозной терапии. При этой относительно малоинвазивной (для нейрохирургии) операции разрушаются некоторые подкорковые структуры мозга. Это один из самых эффективных хирургических способов лечения болезни Паркинсона.
Реабилитация
Направлена на восстановление нормального мышечного тонуса. Назначаются обычно бальнеотерапия, электростимуляция, рефлексотерапия, электрофорез. На любых стадиях болезни Паркинсона необходима лечебная физкультура, помогающая сохранять хорошую координацию и пластичность: упражнения на растяжку, поддержание баланса, кардиотренировки. Двигательная терапия помогает больным приспособиться к переменам, происходящим с телом, выработать верные алгоритмы движения, поскольку по мере развития заболевания старые перестают быть эффективными.
Реабилитационные мероприятия направлены на понижение уровня тревожности, улучшение настроения и борьбу с проявлениями депрессии. Все эти признаки весьма характерны для данной болезни.
Психотерапия
Нет сомнений в том, что болезнь Паркинсона существенно меняет жизнь человека. Справиться и смириться с этими изменениями очень трудно. Нередко больным нужна помощь психотерапевта. Только работа с хорошим специалистом поможет побороть депрессию. Поддержание бодрости духа — одна из первоочередных задач, которые стоят перед пациентом с таким диагнозом. Врачи давно заметили, что от настроя пациента во многом зависит и успех лечения.
Людям с болезнью Паркинсона придется пересмотреть весь образ жизни. Например, необходимо обращать особое внимание на диету. Пищеварение при этом заболевании страдает значительно, пациенты часто жалуются на запоры. Чтобы избежать этого, необходимо включить в рацион как можно больше продуктов, богатых клетчаткой, — овощи и фрукты, бурый рис, отрубной хлеб, бобы. Нельзя забывать и о белках — лучше всего в виде нежирного мяса и рыбы, а также яиц. Витамины требуются для нормального обмена веществ, особенно важен прием витаминов С и Е. Необходимо пить как можно больше воды, поскольку обезвоживание при болезни Паркинсона — частое явление.
Важен и режим приема прописанных препаратов. Их нужно принимать точно по часам в соответствии с рекомендацией врача.
Новое в лечении болезни Паркинсона
Европейские исследования ведутся по направлениям мягкой импульсной электростимуляции нейронов и генной терапии. Но до тех пор, пока причины болезни Паркинсона остаются неясными, средств, позволяющих полностью ее вылечить, найдено не будет. Доступное в данный момент лечение помогает улучшить качество жизни и отдалить развитие болезни, так что пациенты, которым этот диагноз был поставлен недавно, имеют все шансы сохранить способность к самообслуживанию на долгие годы.
Болезнь Паркинсона является одним из самых тяжелых недугов пожилых людей. Для того, чтобы облегчить его проявления и улучшить общее самочувствие больного, требуются профессиональный уход и солидная материально-техническая база. Все это могут предоставить современные гериатрические центры.
Куда обратиться для лечения пациентов с болезнью Паркинсона?
Рассказывает Мария Литвинова, заместитель генерального директора по медицинской части Senior Group:
«Мы принимаем в наши центры ухода и реабилитации лиц старшей возрастной группы с болезнью Паркинсона на кратковременное и длительное пребывание. Минимум — две недели, так как потребуется адаптация к новым условиям. Длительное пребывание может частично оплачиваться государством, поскольку наша компания официально является поставщиком социальных услуг по Москве и Московской области. Лечебная физкультура, занятия на современных тренажерах, комфортные палаты со специальной ортопедической мебелью, индивидуальная диета, лекарственная терапия — все это помогает человеку с болезнью Паркинсона чувствовать себя лучше и превозмогать депрессивное состояние. Мы стремимся поддерживать непринужденную, клубную атмосферу, в которой наши постояльцы могут свободно общаться друг с другом и своими родными. В то же время обеспечивается круглосуточный контроль за их состоянием и предпринимаются меры безопасности: навигация по территории, видеонаблюдение, профессиональная охрана. Все это соответствует высоким требованиям израильских гериатрических протоколов, в соответствии с которыми мы работаем. Междисциплинарная команда врачей: реабилитолог, гериатр, психиатр, нейропсихолог, инструктора ЛФК — ежедневно проводит занятия с пациентами с болезнью Паркинсона».
Болезнь Паркинсона: как с ней справляться
Рисунок 1. Применение антихолинергических препаратов, известных с прошлого века, для снятия тремора и ригидности ограничено из-за их побочных эффектов Каковы основные диагностические критерии болезни Паркинсона? Когда пациента необходимо
 |
| Рисунок 1. Применение антихолинергических препаратов, известных с прошлого века, для снятия тремора и ригидности ограничено из-за их побочных эффектов |
Каковы основные диагностические критерии болезни Паркинсона?
Когда пациента необходимо отправить к специалисту?
С каких препаратов начать лекарственную терапию?
Каким образом устранить побочное действие специфической терапии?
Причины паркинсонизма до сих пор неизвестны, а лечение остается симптоматическим, несмотря на то, что прошло уже четверть века с тех пор, как леводопа прочно внедрилась в жизнь больных паркинсонизмом.
Но не будем слишком пессимистичны — современные методы лечения продлевают жизнь таким больным и делают ее более или менее нормальной [1]. Один человек из тысячи страдает болезнью Паркинсона. Диагноз ставится на основании клинического синдрома, включающего гипокинезию, ригидность, тремор и нарушенные рефлексы позы. Уровень допамина снижается почти на 80% к моменту появления клинических признаков, поэтому неудивительно, что невозможно точно указать время появления первых симптомов.
Далеко не всегда просто отличить идиопатическую болезнь Паркинсона от других состояний, включая такое часто встречающееся, как эссенциальный тремор, и менее распространенные заболевания, которым присущи иные неврологические симптомы — супрануклеарный паралич, автономные нарушения или мозжечковые симптомы [2].
Патолого-анатомические исследования показывают, что каждый пятый диагноз в данной группе заболеваний ошибочен. Перед тем как поставить диагноз, важно убедиться в наличии по крайней мере двух из четырех основных клинических признаков, помня при этом, что у большинства пациентов симптоматика асимметрична. В сомнительных случаях помогает пробное лечение леводопой или допаминовыми агонистами [3].
 |
| Рисунок 2. Задержка мочи часто сопровождает болезнь Паркинсона |
Основной проблемой в контролировании болезни Паркинсона на сегодняшний день остается поздняя недостаточность допаминергической терапии, проявляющаяся в исчезновении или колебаниях реакции на препарат или в развитии дискинезий и прочих побочных эффектов у 75% пациентов после пяти лет лечения [4].
Расширение спектра препаратов и вновь возросший интерес к хирургическому лечению объясняется стремлением избежать или уменьшить проблемы длительного лечения.
Врач общей практики, подозревающий у пациента болезнь Паркинсона, должен решить, к кому его направить — к невропатологу, гериатру или другим специалистам. Особенно это важно в хронических прогрессирующих случаях у молодых людей, нуждающихся в длительном лечении.
Пациенту крайне необходимо рассказать о его болезни, прогнозе и сути применяемого лечения. Как и при астме, диабете и другом хроническом заболевании, врач и пациент должны действовать сообща, при активном участии последнего в принятии решений, касающихся лечения.
Как правило, с такими пациентами легко договориться, но по мере прогрессирования заболевания их приходится уговаривать принимать различные препараты несколько раз в день.
Контроль за заболеванием не сводится лишь к лекарственной терапии, напротив, психотерапия, трудотерапия, обучение навыкам речи и психологические методы существенно улучшают состояние пациентов [5]. Регулярная физиотерапия, назначаемая до допаминергических препаратов, замедляет прогрессирование заболевания [6], поэтому сразу после установления диагноза нужно советовать пациентам физические упражнения, соблюдение диеты, трудотерапию.
Весьма часто такие методы используются на более поздних стадиях заболевания, когда ничто другое уже не помогает, в то время как их нужно использовать для предупреждения развития болезни. Общество больных болезнью Паркинсона выпускает информационные сборники для персонала больниц и специальный обучающий материал для пациентов.
В ряде центров специально обученные сиделки помогают больным и тем, кто за ними ухаживает. Несмотря на отсутствие конкретных научных данных, многие пациенты признают эффект музыкотерапии, обучения, йоги и прочих дополнительных методов лечения.
Количество доступных препаратов и их новых форм в последние десять лет значительно увеличилось и обещает еще большее увеличение в ближайшем будущем. В табл. 1 приведены основные группы препаратов.
Таблица 1. Лекарственные препараты, применяемые для лечения паркинсонизма
антихолинергические препараты
Антихолинергические средства применялись еще в прошлом веке. Они до сих пор помогают справиться с тремором и, в меньшей степени, с ригидностью, практически не влияя на гипокинезию. Выбор среди них невелик. Все они имеют побочные эффекты: сухость во рту, нарушение аккомодации, запор и задержка мочи. У пожилых пациентов они склонны вызывать спутанность сознания и прочие психиатрические нарушения.
Следует отметить, что все антипаркинсонические средства способны вызывать подобные проблемы и любое нарушение ментальной функции требует пересмотра целесообразности применения и адекватности доз препарата. Леводопа, в настоящее время назначаемая вместе с ингибитором периферической декарбоксилазы (ИНД), остается пока самым эффективным лекарственным средством. В начале курса лечения могут возникать тошнота, рвота, поэтому пациенты предпочитают принимать их вместе с пищей или с противорвотными лекарствами — домперидоном и метоклопрамидом.
Необходимо учитывать, что большое потребление белка может мешать всасыванию леводопы.
Кроме психологических расстройств необходимо отметить и другие побочные эффекты — дискинезии или непроизвольные движения. Они бывают различными: движения языка и губ, гримасы, болезненные напряжения мышц, хореоатетоз, двигательное беспокойство. Снижение дозы препарата, как правило, уменьшает и дискинезию, однако пациенты часто предпочитают последнюю невозможности передвигаться вообще.
Другой элемент нарушений, возникающих при длительном лечении, — колебания реакции на препарат. Вначале это проявляется феноменом «выключения» — продолжительность действия леводопы-ИПД все время уменьшается. В тяжелых случаях человек внезапно переключается от движения, обычно с дискинезиями, к полной неподвижности.
 |
| Рисунок 3. Нарушение постуральных рефлексов — одна из составляющих клинического синдрома |
Для преодоления подобных проблем были разработаны формы с дозированным высвобождением препарата, позволяющие избежать колебаний концентраций лекарства в крови, и порошковые формы, обеспечивающие быстрое нарастание уровня лекарства в крови.
Агонисты допамина действуют на различные участки дофаминового рецептора. Соответственно разнится и их действие. Применяемые в одиночку, агонисты допамина менее эффективны, чем леводопа, но и реже приводят к колебаниям и дискинезиям [4]. Желудочно-кишечные побочные эффекты и воздействие на психику у них такие же. Апоморфин отличается от прочих упомянутых средств тем, что вводится путем инъекции.
По данным исследования, проведенного в Соединенных Штатах, селигин отсрочивает необходимость назначения леводопы, имеет нейропротекторные свойства и способен замедлять развитие болезни [7]. С тех пор, однако, было доказано, что селегилин сам по себе обладает умеренным допаминергическим эффектом, а также амфетаминоподобным и антидепрессантным воздействием; его защитные свойства в настоящее время находятся под сомнением [8].
Механизм действие селегилина — блокада моноаминоксидазы В, одного из основных ферментов допаминового метаболизма. Бытует мнение, что он потенциирует действие леводопы.
Ингибиторы катехол-о-метилтрансферазы (КОМТ) просто замедляют метаболизм допамина. По крайней мере два таких препарата уже готовятся к массовому производству [9, 10].
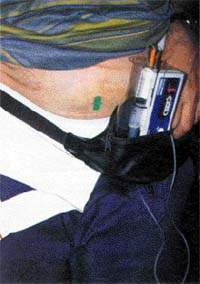 |
| Рисунок 4. Инъекции апоморфина применяют в трудно поддающихся лечению случаях |
Допаминергический эффект антивирусного препарата амантадина замечен еще много лет назад, но он менее эффективен, чем леводопы. Точный механизм его действия неизвестен, но все же его пытаются применять в случаях, резистентных к терапии леводопой; кроме того, его назначение совместно с леводопой позволяет уменьшить дозу последней.
Бесспорно, при назначении лекарственных препаратов следует учитывать возраст пациента, степень нарушений и индивидуальные особенности, однако невропатологи, как и другие специалисты, единого подхода к последовательности применения препаратов пока не разработали. Некоторые считают, что откладывать применение леводопы не имеет смысла, и начинают со стандартных схем ее использования.
Еще один подход заключается в использовании сначала пролонгированных форм, применении только дофаминового агониста или в сочетании с низкими дозами леводопы; или же назначают на какое-то время один селегилин, а затем присоединяют леводопу.
Какой бы схеме вы ни следовали, целесообразно начинать с низких доз, осторожно и постепенно подбирая необходимую дневную дозу. По возможности нужно избегать резких изменений в схеме приема или быстрого увеличения дозы.
При развитии феномена «выключения» нередко, хотя и на непродолжительное время, может оказаться полезным разделение дневной дозы препарата на несколько более мелких приемов. Можно попробовать присоединить к леводопе селегилин и/или агонист допамина, а также использовать вместо леводопы (или чаще дополнительно к ней) лекарственные формы пролонгированного действия. Биодоступность подобных форм меньше, чем у обычных препаратов, и их доза обычно несколько больше. У отдельных пациентов хороший результат дает прием препарата до, а не после еды или сокращение потребления белка.
В случаях с ярко выраженным феноменом включения-выключения используют те же приемы, в сочетании с индивидуальным подбором наиболее эффективной схемы лечения.
| Не рекомендуется устраивать длительные перерывы между приемами препаратов |
При отсутствии успеха от перорального приема препарата можно использовать такие новые методы, как подкожное введение апоморфина. Правда, для этого требуется обученный персонал, лучше всего — специальная сиделка для больных паркинсонизмом.
Другой подход — нейрохирургия. Проводят стереотоксическую паллидотомию или стимуляцию таламуса при феномене включения-выключения, а также при упорном треморе [11]. Имеющиеся на сегодняшний день данные обнадеживают. Они свидетельствуют об уменьшении дискинезии и удлинении периода включения. Однако, как и трансплантацию фетальных тканей, подобные хирургические методы пока следует считать экспериментальными, требующими дальнейшего изучения и оценки.
Кроме дискинезий и тремора, у многих пациентов при прогрессировании заболевания развиваются когнитивные и психические расстройства. При этом необходимо снижать дозу препарата.
Небольшие перерывы в приеме лекарств, отмена допаминергических препаратов на короткое время — такие «каникулы» (один-два дня каждую неделю) позволяют снизить психотоксичность [10]. Отмена препаратов на длительный срок не рекомендуется, поскольку может повлечь серьезные или даже необратимые нарушения способности двигаться.
Болезнь Паркинсона сопровождается нарушениями сна, депрессией, задержкой мочи, запорами, болями, расстройствами автономной нервной системы и сексуальными отклонениями. Все это поддается лекарственной коррекции. Просто надо дать возможность пациенту подробно описать все, что его беспокоит. Ограниченное время консультации вместе с тяжелыми проблемами общения, от которых страдают многие пациенты, могут быть преодолены посредством заранее подготовленного самим пациентом или сиделкой описания его состояния.
1. Clarke C. E. Mortality from Parkinson’s disease in England and Wales 1921-89. J. Neurol. Neurosurg Psychiatry 1993; 56:690-3.
2. Quinn N. Parkinsonism — recognition and differential diagnosis. BMJ 1995; 310:447-52.
3. Hughes A. J., Lees A. J., Stern G. M. Challenge test to predict the dopaminergic response in untreated Parkinson’s disease. Neurology 1991; 41:1723-5.
4. Marsden C. D. Parkinson’s disease. J. Neurol. Neurosurg Psychiat 1994; 57:672-81.
5. Patti F., Reggio A., Nicoletti F. et al. Effects of rehabilitation therapy on Parkinsonians’ disability and functional independence. J. Neurol. Rehab 1996; 10:223-231.
6. Doshay L. J. Method and value of physiotherapy in Parkinson’s disease. N. Eng. J. Med. 1962; 266:878-80.
7. Parkinson Study Group. Effects of tocopherol and deprenyl on the progression of disability in early Parkinson’s disease. N. Eng. J. Med. 1993; 328:176-83.
8. Jankovic J., Shoulson I., Weiner W. J. Early-stage Parkinson’s disease: to treat or not to treat. Neurology 1994; 44(suppl1):S4-S7.
9. Pouttinen H. M., Rinne U. K. A double-blind pharmocokinetic and clinical dose-response study of entacapone as an adjuvant to levadopa therapy in advanced Parkinson’s disease. Clin. Neuropharmac 1996; 19:283-96.
10. Stocchi F., Nordera G., Marsden C. D. Strategies for treating patients with advanced Parkinson’s disease with disastrous fluctuations and dyskinesias. Clin. Neuropharmac 1997; 20:95-115.
11. Obeso J. A., Guridi J., Delong M. Surgery for Parkinson’s disease. J. Neurol. Neurosurg. Psychiat 1997; 62:2-8.

