Что нейтрализует кислоту химия
Реакция нейтрализации в химии: объяснение, примеры, уравнения и решение
Содержание:
Реакция нейтрализации – это реакция между кислотой и основанием с формированием растворимой соли и воды.
Кислота + основание = соль + вода
Как правило, эти взаимодействия сопровождаются выделением тепла. Количество выделенной энергии — это тепловой эффект взаимодействия между соединениями. Реакция нейтрализации — это один из типов реакции обмена.
Характеристика нейтрализации
Реакцию нейтрализации можно записать сокращенным ионным уравнением:
Если поместить лакмусовую бумажку в пробирку с кислотой, то она становится красной. Если ее поместить в пробирку со щелочью, то она становится синей. При взаимодействии щелочи и кислоты лакмус приобретает фиолетовый оттенок, что указывает на нейтральную среду.
Если получившийся раствор нагреть, то вода испарится, а в колбе останутся кристаллы соли.
Примеры реакций нейтрализации
Реакции нейтрализации — это реакции ионного обмена. Необратимые реакции характерны для реакций сильной кислоты и сильного основания.
Полное ионное уравнение
Сокращенное ионное уравнение
Обратимые реакции наблюдаются при взаимодействии сильного основания и слабой кислоты.
Полное ионное уравнение
Сокращенное ионное уравнение
Также обратимые реакции характерны для взаимодействий слабого основания и сильной кислоты.
Полное ионное уравнение
Сокращенное ионное уравнение
Не характерно для данной реакции.
Задачи на реакции нейтрализации
Задача. Сколько мл гидроксида натрия NaOH необходимо для нейтрализации 0,1 моль серной кислоты H2SO4, при том что плотность гидроксида натрия NaOH равна 0,968 г/мл.
Дано:
Решение:
Ответ: V(NaOH)=8,264 мл
Найти: V(NaOH)-?
Применение реакций нейтрализации
Реакции нейтрализации активно используются в титровании. Их используют при определении уровня кислотности желудочного сока. Если в лаборатории проливается щелочь, то ее нейтрализуют и убирают. Таким образом, реакции нейтрализации активно используются человеком.
Общие принципы
Сущность реакции нейтрализации заключается в том, что кислота и основание вступают во взаимодействие. Они обмениваются активными компонентами. Происходит нейтрализация обоих составляющих. В итоге получается вода и соль, имеющие нейтральную реакцию среды.
Общий принцип взаимодействия выглядит следующим образом: кислота соединяется со щёлочью, обменивается активными компонентами, в результате чего получается нейтральная соль и вода.
Наиболее простым примером реакции нейтрализации может стать взаимодействие гидроксида натрия с соляной кислотой. Формула представлена так:
NaOH + HCl → NaCl + H2O.
Перед соединением этих веществ можно проверить их реакцию с помощью лакмусовой бумаги:
Если получившийся раствор нагреть, вода постепенно испарится. В колбе останется осадок — поваренная соль (хлорид натрия).
Чтобы лучше понять, что такое реакция нейтрализации в химии, важно помнить, что 2 сложных вещества обмениваются между собой частями. В итоге получается 2 новых сложных компонента. Таким образом, нейтрализация — это частный случай большой группы реакций обмена.
Некоторые основания не растворяются в воде, но хорошо растворяются в кислотах. В результате взаимодействия тоже образуется вода и соль. Примером может быть реакция между нерастворимым гидроксидом меди и серной кислотой. В итоге получается медный купорос и вода.
Виды реакции
Процесс химической нейтрализации может происходить между веществами с разной активностью: сильной кислотой и таким же основанием или между слабой кислотой и сильной щёлочью. В химии выделяют 2 типа реакции:
Реакции нейтрализации относятся к разряду экзотермичных. При взаимодействии выделяется много энергии в виде тепла. Количество выделенной энергии — относительный показатель, который получил название теплового эффекта химической реакции.
Мера энергии, накопленной веществом при образовании, называется энтальпией. В экзотермических реакциях значение энтальпии всегда бывает отрицательным.
Названия солей
Все международные химические названия солей, полученных в результате нейтрализации, строятся по единому принципу и состоят из двух слов. Первое слово — это наименование кислотного остатка. Оно является производным от латинского названия кислоты:
Второе слово в названии соли — это наименование металла. У некоторых элементов периодической таблицы валентность изменяется. В этом случае она указывается в скобках.
В качестве примера можно привести названия солей:
Это утверждение верно и для обратной ситуации — по названию соли можно определить её химическую формулу. Вначале записывается символ, которым металл обозначается в периодической таблице. Затем добавляется формула кислотного остатка.
Следующий шаг — определение валентности обеих частей. Теперь нужно найти для них наименьшее общее кратное и разделить его на валентность каждой части соли. Значит, в результате получается количество атомов металла в формуле и количество кислотных остатков.
Кислотный остаток может иметь сложную структуру и содержать в себе несколько разных атомов (азотная, серная, фосфорная кислоты и пр.). При составлении формулы соли кислотный остаток вписывается в скобки. За ними цифровым индексом обозначается количество остатков.
Титрование и химический эквивалент
Реакция нейтрализации связана с процедурой титрования. В химии так принято называть определение количества щёлочи или кислоты в растворе. Для этого берётся реагент с заданной заранее молярной концентрацией. Вычисляется, сколько его нужно для осаждения искомого вещества. При титровании используется понятие химической эквивалентности:
Если реагируют одинаковые химические эквиваленты, нейтрализация называется полной. В этом случае в растворе не останется кислоты или щёлочи, не вступившей в реакцию. Масса эквивалента кислоты или основания в граммах называется грамм-эквивалентом.
Все кислоты, которые выделяют из 1 молекулы 1 ион водорода, подчиняются следующей закономерности: их химический эквивалент равняется 1 молю вещества. Молекулярная масса таких соединений равна 1 грамм-эквиваленту.
Если вещество выделяет из 1 молекулы 2 иона водорода, его грамм-эквивалент равен половине молекулярной массы, а 1 моль соответствует 2 химическим эквивалентам.
С этим химическим процессом связано ещё одно понятие — нормальность или нормальная концентрация вещества. Этот фактор отражает, сколько эквивалентов содержит 1 литр раствора.
Применение на практике
Методы нейтрализации положены в основу титриметрического анализа. Титрование используется во многих сферах:
Нередко эта химическая реакция используется в быту. При проливе уксусной или другой кислоты на кожу может возникнуть ожог. В качестве первой помощи необходимо тщательно промыть место чистой водой, после чего обработать содовым раствором. Той же тактики придерживаются при ожоге едкой щёлочью. В качестве нейтрализатора используется лимонная или уксусная кислота в слабом разведении.
Как действовать в аварийных ситуациях, связанных с кислотами и щелочами
При строгом соблюдении техники безопасности при хранении и транспортировке кислот и щелочей, а также при работе с ними, вероятность аварийной ситуации крайне мала. Тем не менее, знать, как действовать в случае ее возникновения, надо обязательно. Это может спасти чье-то здоровье или даже жизнь!
Чем опасны кислоты и щелочи
Контакт с кислотами и щелочами может вызвать химические ожоги; 
Все сотрудники лабораторий, имеющих дело с едкими реактивами, обязаны уметь оказывать первую помощь при химических ожогах; знать, где расположены аптечка, нейтрализующие растворы, песок и опилки. По технике безопасности в аптечке должны находиться по 1 л раствора борной или лимонной кислоты и раствора соды, или комплект PLUM с нейтрализующими растворами.
Приготовление нейтрализующего раствора
Для приготовления нейтрализующего раствора берут 1 литр воды и 10 г реактива (лимонной кислоты, борной кислоты, соды). Размешивают до полного растворения всех твердых частиц и переливают в пластиковые сосуды подходящего размера. Потом на них наклеивается этикетка с хорошо читаемым указанием названия, концентрации и назначения («нейтрализующий раствор для кислоты», «нейтрализующий раствор для щелочи»).
Приготовленные растворы должны храниться в аптечке или рядом с ней.
Что делать при химических ожогах
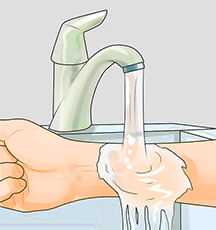
Место поражения щелочью обильно поливают 1%-ным раствором лимонной или борной кислоты.
Для химических ожогов специально предназначена нейтрализующая жидкость из комплекта PLUM (выливается весь флакон).
• Если кислота или щелочь попали в глаза, то они промываются нейтрализующим раствором, разведенным вдвое.
• После этого место ожога промывают водой, мылом и снова водой. Промывание водой должно длиться не менее 15 минут.
• Пострадавшего должен осмотреть врач для определения дальнейшего лечения. При необходимости вызывают «Скорую помощь».
Что делать при разливах
При разливе едкого хим. реактива крайне важно знать характер 
После того, как вся жидкость впиталась, песок или опилки сметают и утилизируют (захоранивают или передают на утилизацию сертифицированным организациям). Место пролива заливают нейтрализующим раствором (раствором соды или лимонной, борной кислоты), промывают водой и вытирают насухо.
Что делать при пожарах
Сами кислоты и щелочи, как правило, относятся к негорючим веществам, но они могут разлагаться при нагревании или вступать в реакции с металлами или органическими материалами, выделяя токсичные и горючие газы и вещества.
Если в зоне пожара оказались кислоты или щелочи, то все участвующие в тушении должны быть об этом проинформированы. Следует принять меры предосторожности, необходимые при контакте с кислотами или щелочами; использовать резиновую обувь, перчатки и респираторы, очки.
Пожар, в зоне которого оказались кислоты или щелочи, тушат песком, химической пеной, углекислым газом, мелкораспыленной водой.
Урок 17. Реакция нейтрализации
В уроке 17 «Реакция нейтрализации» из курса «Химия для чайников» рассмотрим процесс нейтрализации, а также понятия химический эквивалент вещества и грамм-эквивалент; кроме того научимся вычислять нормальную концентрацию раствора. С реакцией нейтрализации тесно связаны понятия «кислота» и «основание», поэтому настоятельно рекомендую подробно изучить урок 16 «Кислоты и основания»
Нейтрализация
Важным свойством кислот и оснований является их способность образовывать в растворе ионы H+ и OH-, которые могут атаковать другие имеющиеся там молекулы и вызывать химические превращения, с трудом или медленно протекающие в их отсутствии. Когда кислоты и основания реагируют друг с другом, ионы H + и OH — соединяются, образуя молекулы воды. Этот процесс называется нейтрализацией:
Химический эквивалент
С реакцией нейтрализации тесно связано процедура кислотно-основного титрования. Грубо говоря, титрование — это способ определения имеющегося количества кислоты или основания в растворе, путем измерения количества основания или кислоты с заданной концентрацией необходимого для полной нейтрализации имеющегося реагента. При титровании пользуются понятием химический эквивалент.
Полная нейтрализация происходит в том случае, если в реакцию вступают одинаковые количества химических эквивалентов кислоты и основания.
Грамм-эквивалент — это масса кислоты (или основания) в граммах, которая образует 1 моль ионов H + (или OH — )
В удобстве использования понятий химического эквивалента и грамм-эквивалента можно убедиться при рассмотрении нейтрализации фосфорной кислоты гидроксидом магния:
Рассмотрим решение конкретной задачи по химическим эквивалентам и грамм-эквивалентам:
Пример 1. Используя метод эквивалентов, найдите число граммов HNO3 необходимо для нейтрализации 100,0 г Ba(OH)2.
Первым делом выпишем молекулярные массы и грамм-эквиваленты для HNO 3 и Ba(OH) 2 :
| Реагент | Молекулярная масса, г/моль | Грамм-эквивалент, г/экв |
| Азотная кислота, HNO3 | 63,01 | 63,01 / 1 = 63,01 |
| Гидроксид бария, Ba(OH)2 | 171,34 | 171,34 / 2 = 85,67 |
Отлично! Теперь найдем сколько химических эквивалентов гидроксида бария содержится в 100,0 г:
В начале урока мы говорили, что полная нейтрализация получается, когда в реакцию вступают одинаковые количества химических эквивалентов кислоты и основания. Поэтому для нейтрализации 1,167 экв Ba(OH)2 потребуется 1,167 экв HNO3:
Ответ получен! Кстати, данную задачу можно решить по другому, используя полное уравнение реакции :
Число моль Ba(OH)2, вступающего в реакцию, равно:
Из полного уравнения реакции следует, что в ней должно принять участие вдвое большее молярное количество азотной кислоты, чем гидроксида бария:
А в граммах это составит:
Ответы совпадают, т.е оба метода решения верны, однако метод эквивалентов позволяет обойтись без использования полного уравнения реакции.
Нормальная концентрация
Нормальная концентрация, или нормальность раствора (н.) показывает, сколько эквивалентов вещества содержится в 1 л его раствора. Например, по аналогии с молярной концентрацией, 1,00 М раствор H3PO4 имеет нормальность 3,00 н, а 0,010 М раствор Mg(OH)2 имеет нормальность 0,020 н.
Пример 2. Определите молярность и нормальность 500 мл раствора, полученного при растворении в воде 4,00 г NaOH.
По таблице Менделеева находим молекулярную массу гидроксида натрия, она равна 40,0 г/моль. В нашем распоряжении ровно 4,00 г NaOH, и в них содержится:
Нам уже известно, что молярная концентрация представляет собой отношение числа моль растворенного вещества на общий объем раствора, следовательно молярность раствора гидроксида натрия равна:
В данном случае молярность раствора совпадает с его нормальностью, поскольку каждый моль гидроксида натрия дает 1 эквивалент OH — ионов. Следовательно нормальность полученного раствора равна также 0,200 н.
Пример 3. В 750 мл раствора содержится 10,0 г серной кислоты H2SO4. Определите молярность и нормальность данного раствора.
Надеюсь урок 17 «Реакция нейтрализации» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Счет на секунды: что делать при ожоге серной кислотой в первую очередь
Врач рассказал о правилах первой помощи при ожогах серной кислотой
Фото, видео: Depositphotos / belchonock; 5-tv.ru
Эксперт назвал основные правила, следуя которым, можно снизить фактор поражения и облегчить состояние пациента до приезда медиков.
Химические ожоги от воздействия серной кислоты могут привести к фатальным последствиям для организма. Для того, чтобы облегчить состояние пострадавшего и не усугубить факторы поражения, необходимо действовать четко и в соответствии с основными правилами.
Как рассказал в беседе с 5-tv.ru директор Национального совета по первой помощи Станислав Манеров, их не много, и они достаточно простые, поэтому важно о них помнить.
Тем, кто оказался рядом с пострадавшим от воздействия серной кислоты, нужно осень быстро найти поблизости большое количество простой воды.
Между тем, ранее стали известны подробности шокирующего происшествия в Петербурге, где 24-летний мужчина, предположительно, из ревности облил серной кислотой девушку, к которой питал романтические чувства, и ее молодого человека.
В результате трагедии больше всего пострадала девушка. По словам ее спутника, который вызвал скорую помощь, все время до приезда медиков она страшно кричала от боли, а он даже знал, чем ей помочь и не мог даже дотронуться до нее.
Страшная трагедия разыгралась в центре Северной столицы вечером 10 декабря. По версии следствия, 24-летний мужчина облил серной кислотой свою бывшую возлюбленную и ее парня. Молодой человек не получил серьезного поражения, а вот его 16-летняя спутница испытала страшные мучения. Девушку экстренно госпитализировали с химическим ожогом лица, волосистой части головы, шеи, туловища и рук III степени.
Кроме того, бедняжка не успела даже спрятать глаза. Медики установили ожог роговиц и коньюктив II степени. По данному факту возбуждено уголовное дело по статье о причинении вреда здоровью средней степени тяжести.
Сегодня Октябрьский районный суд Петербурга вынес решение об аресте для нападавшего. Он останется за решеткой до 8 января 2022 года.