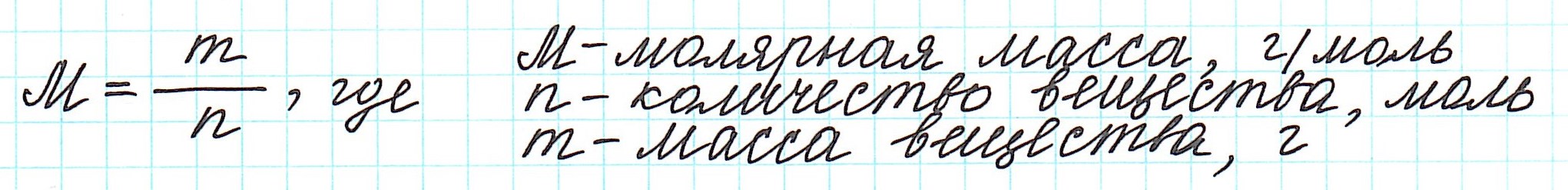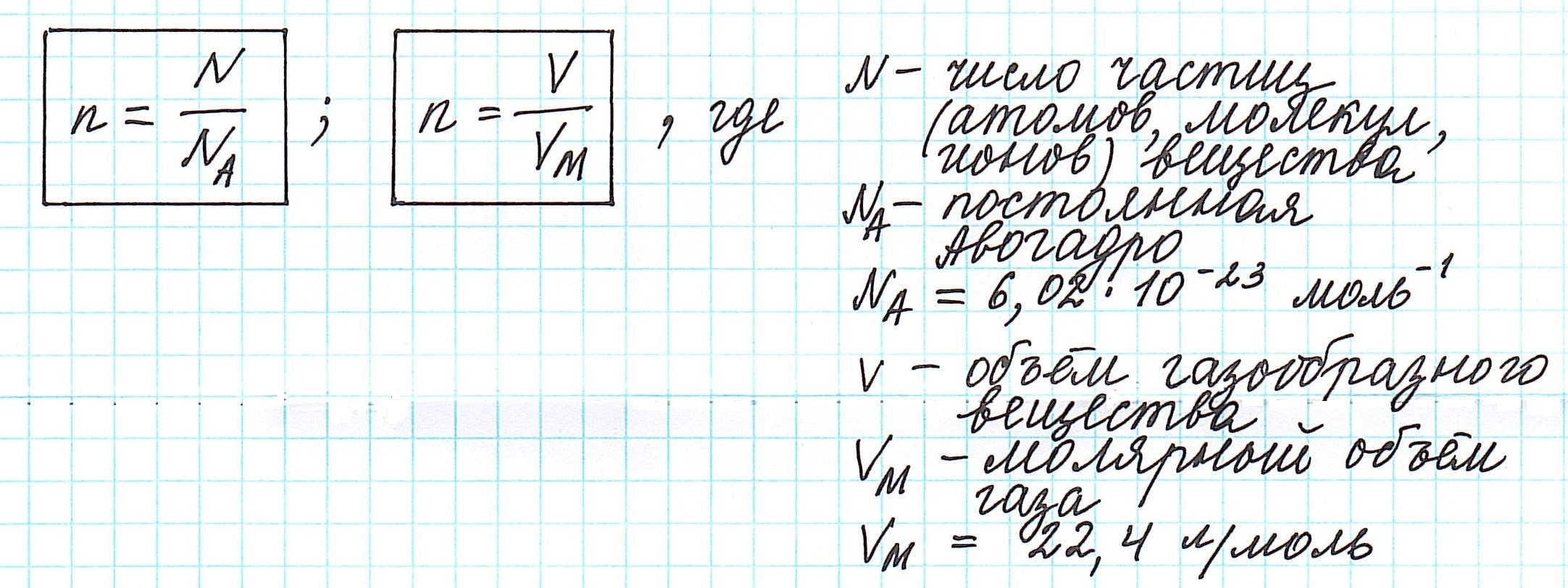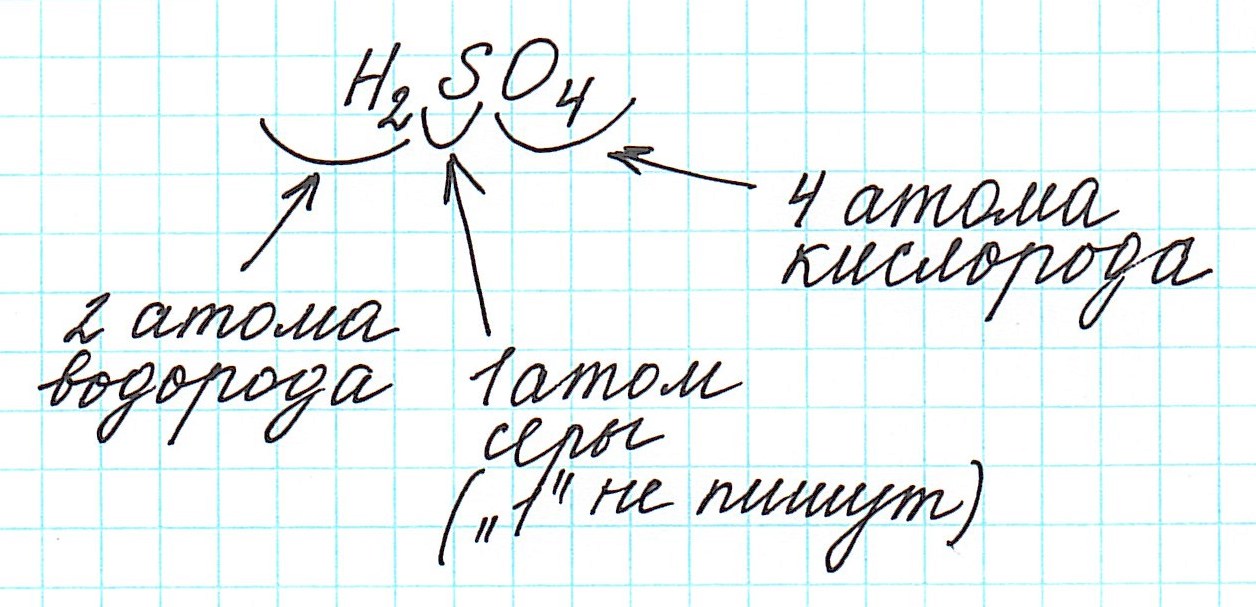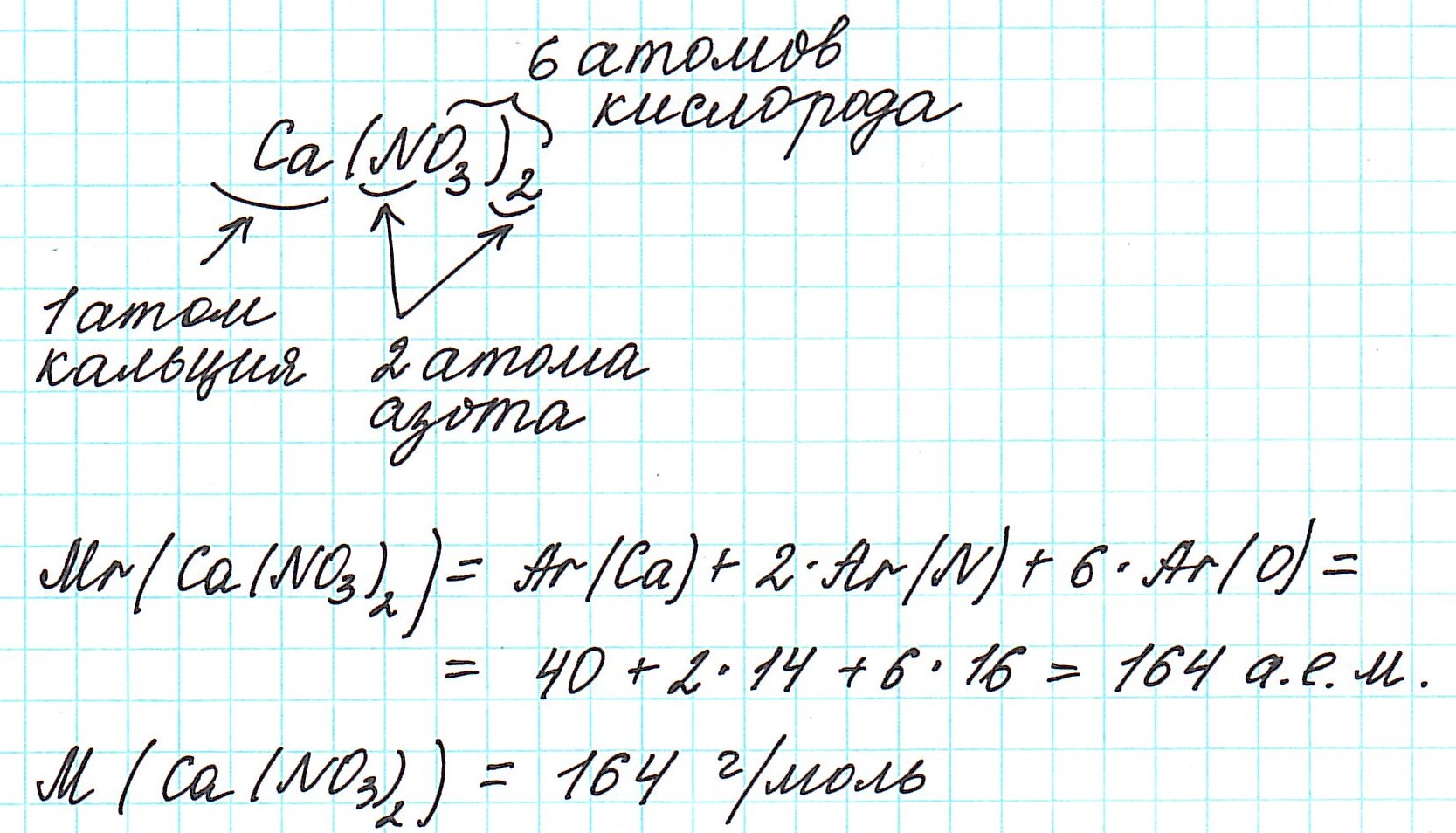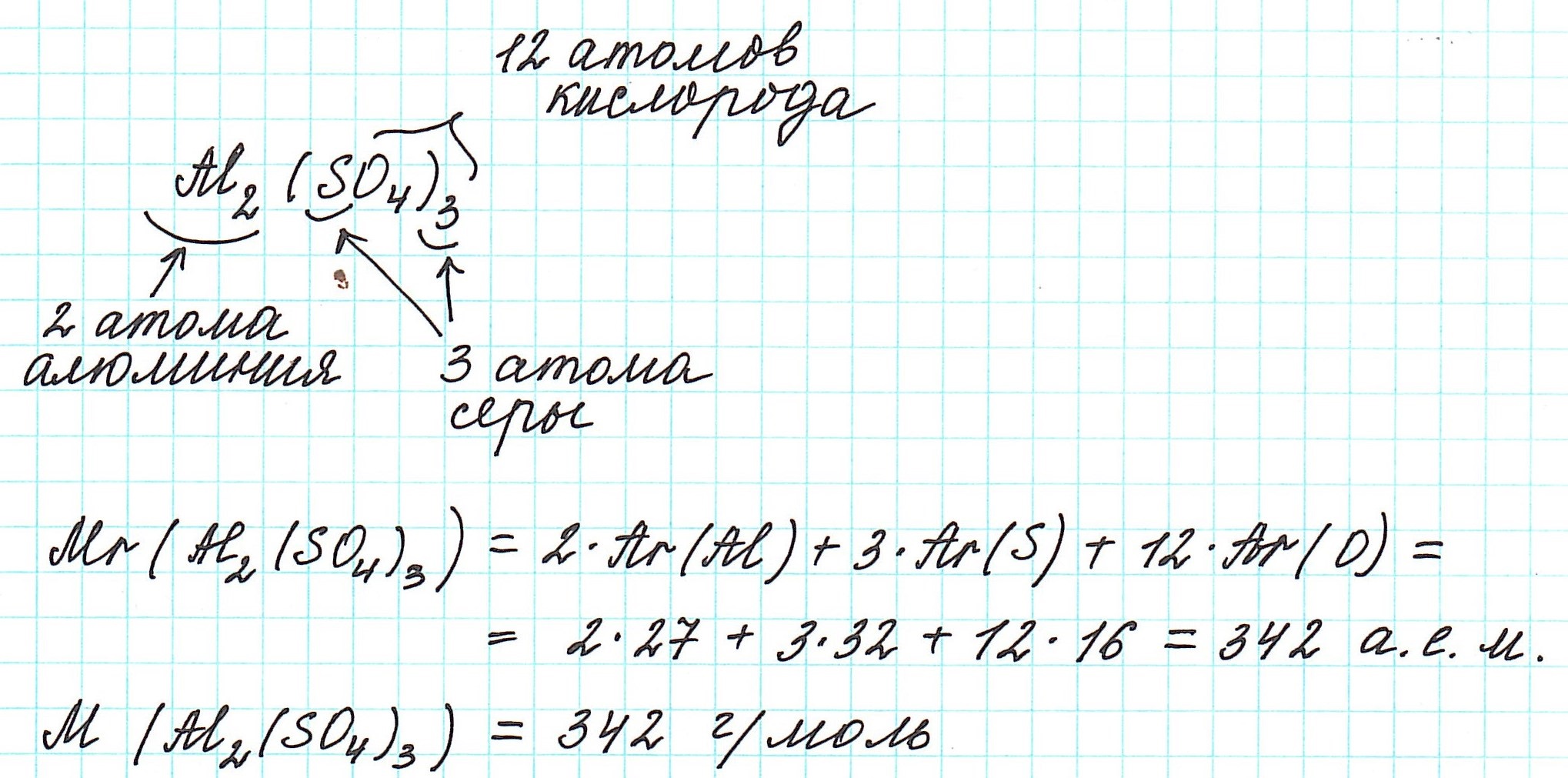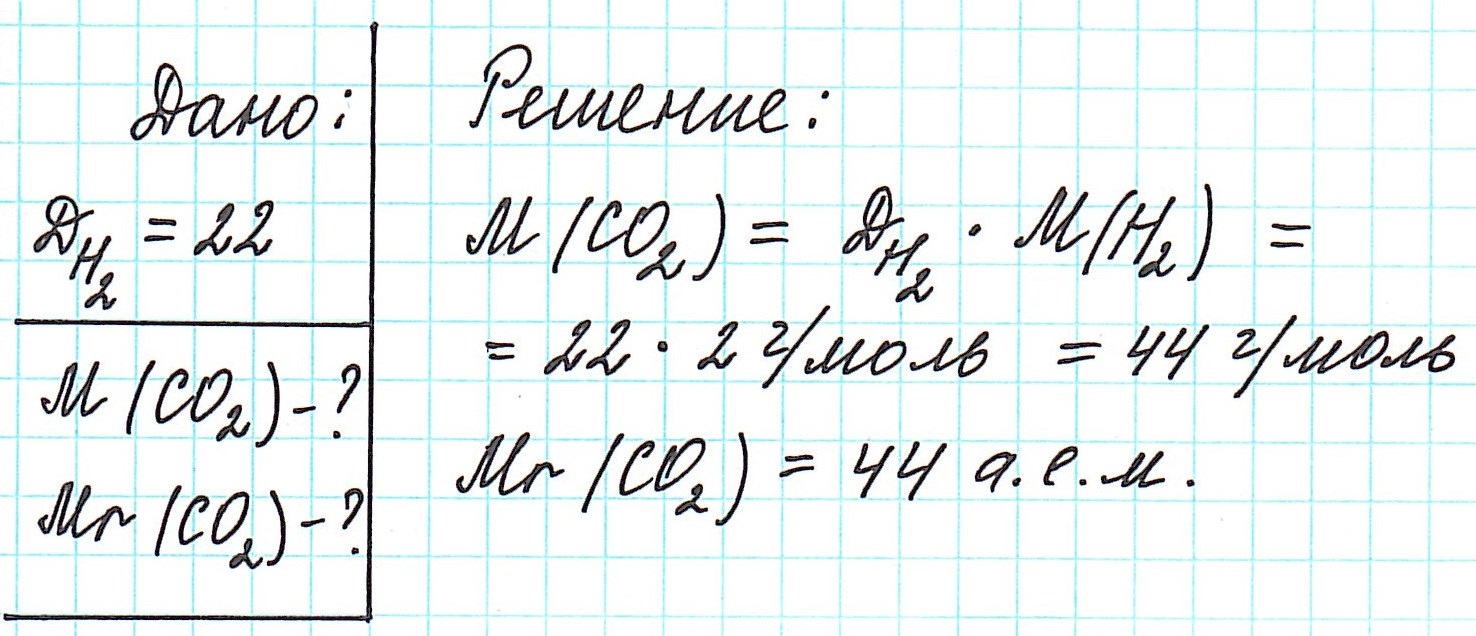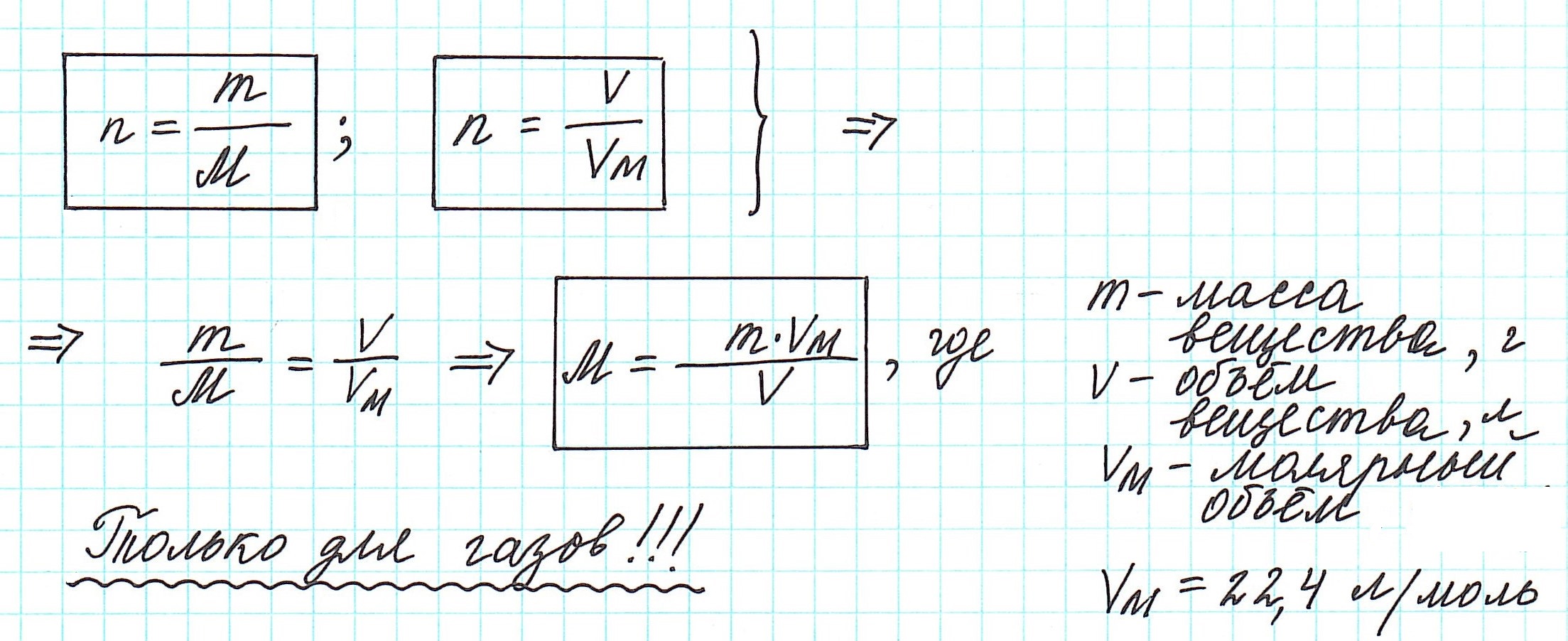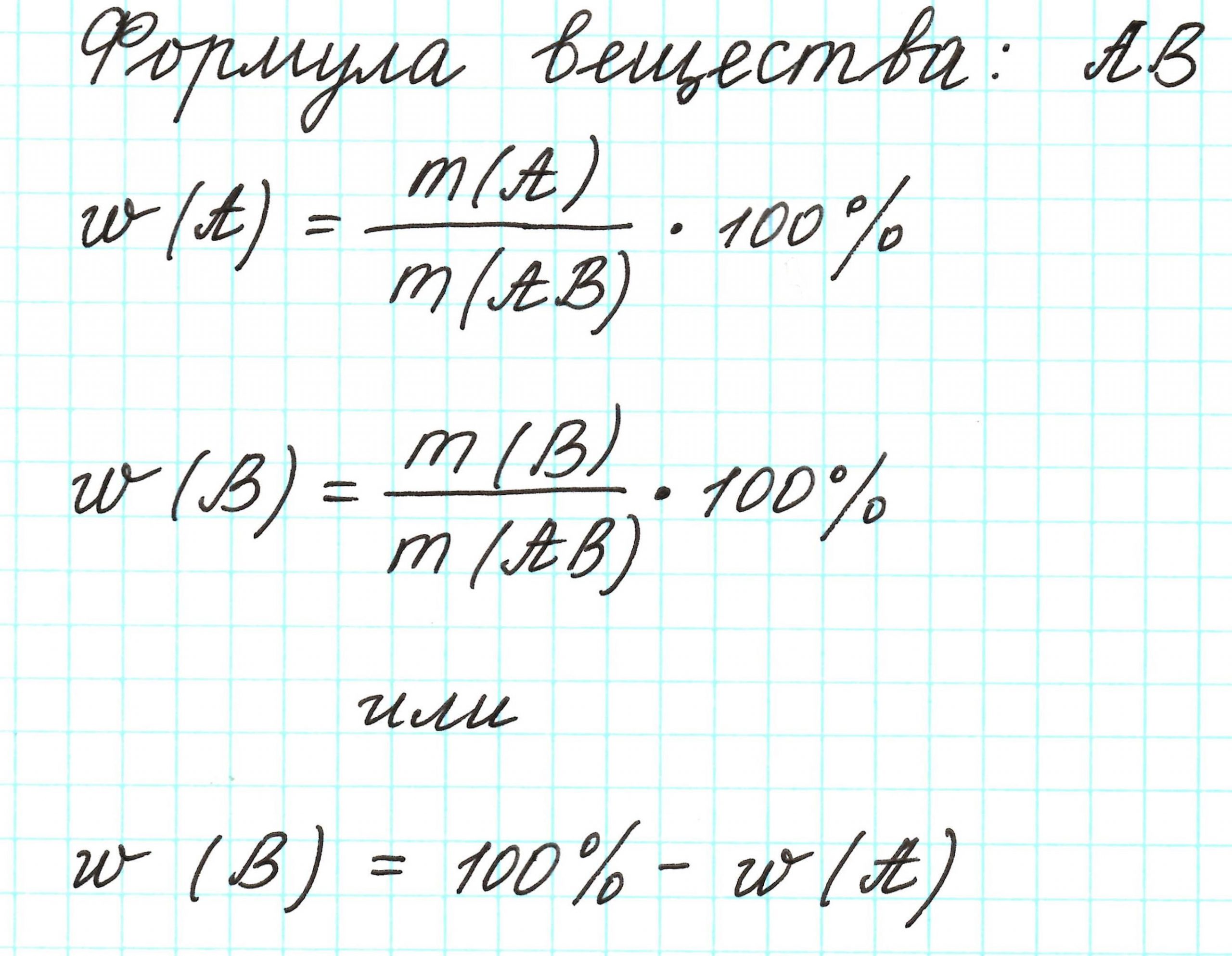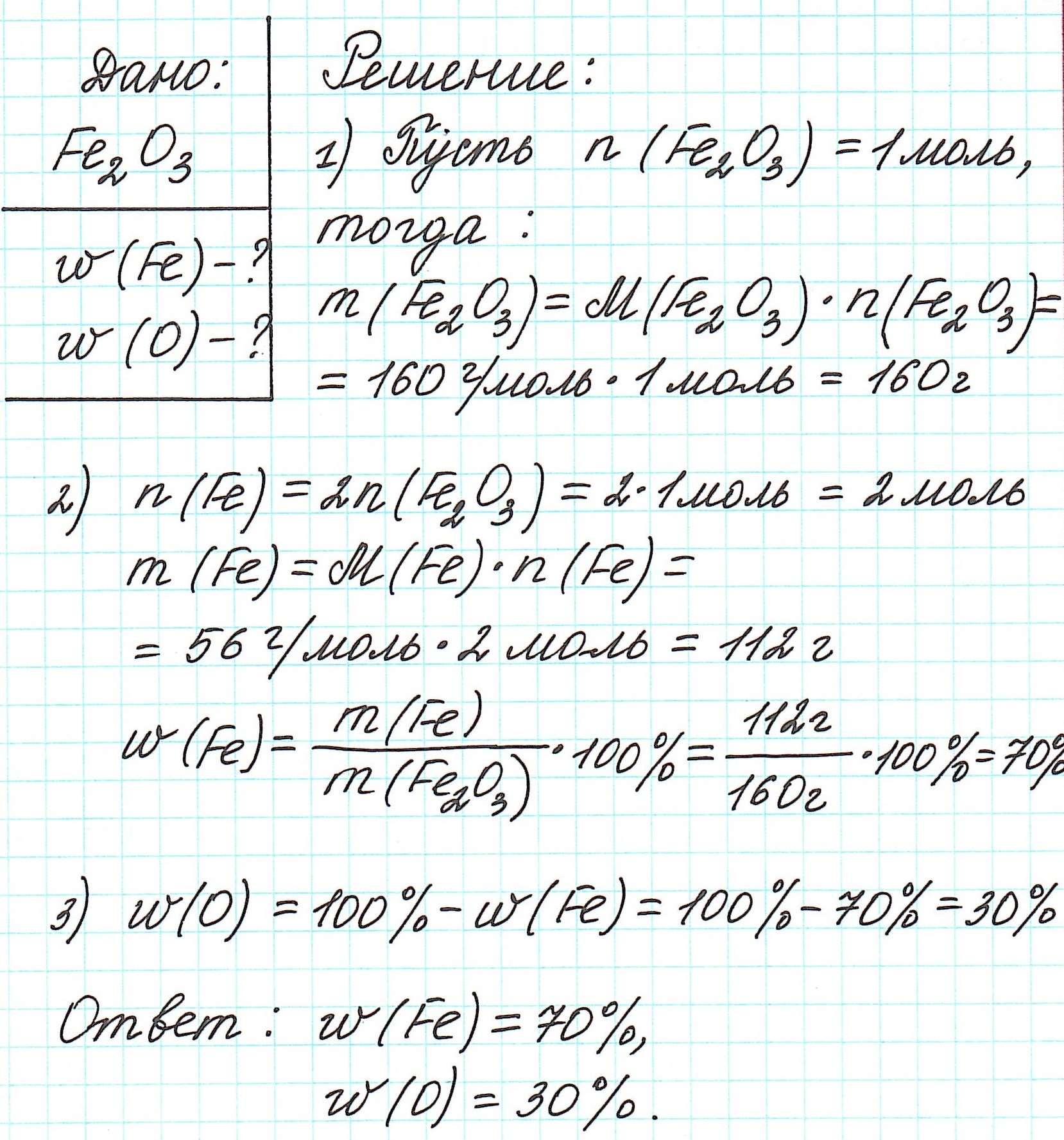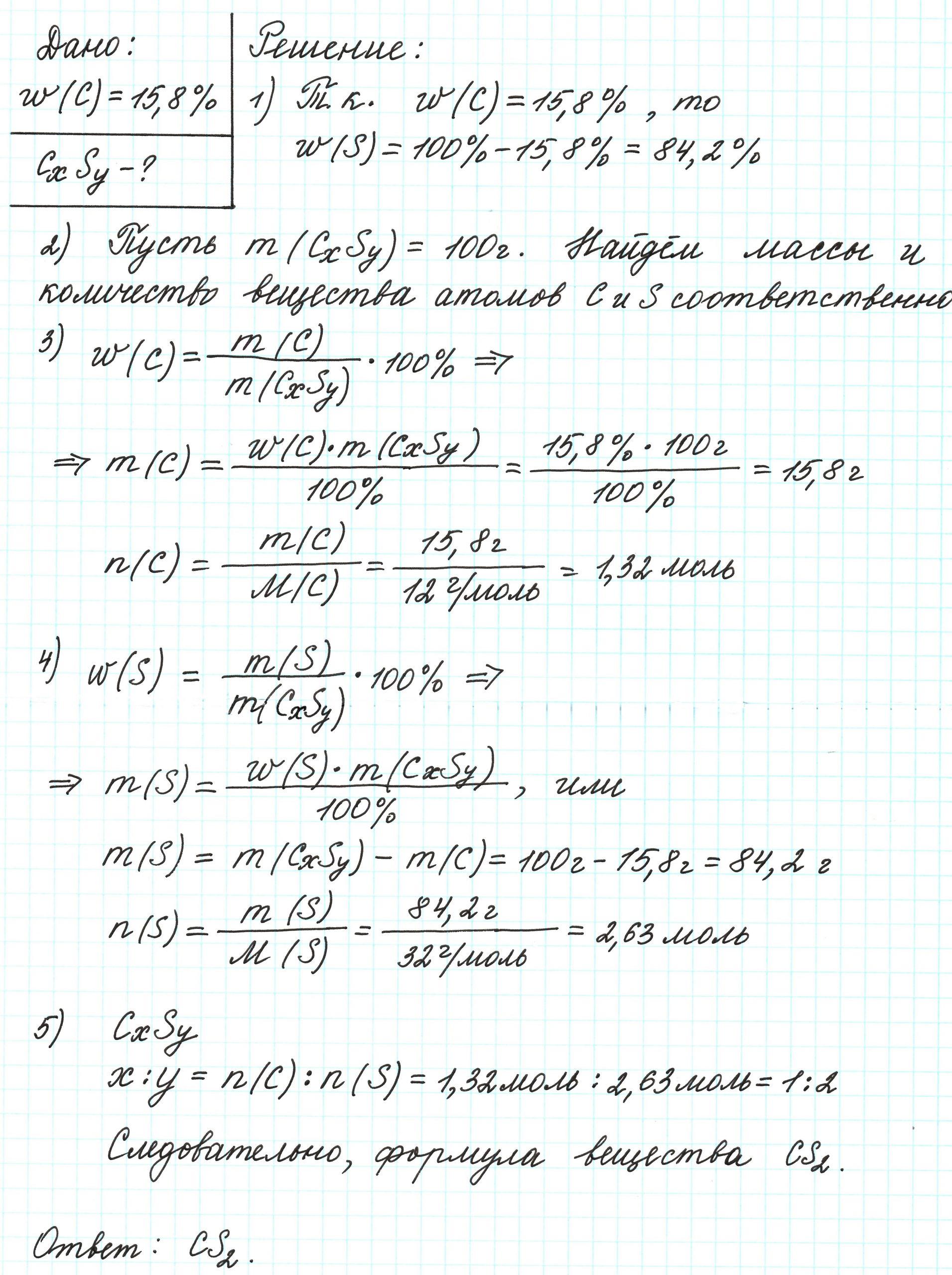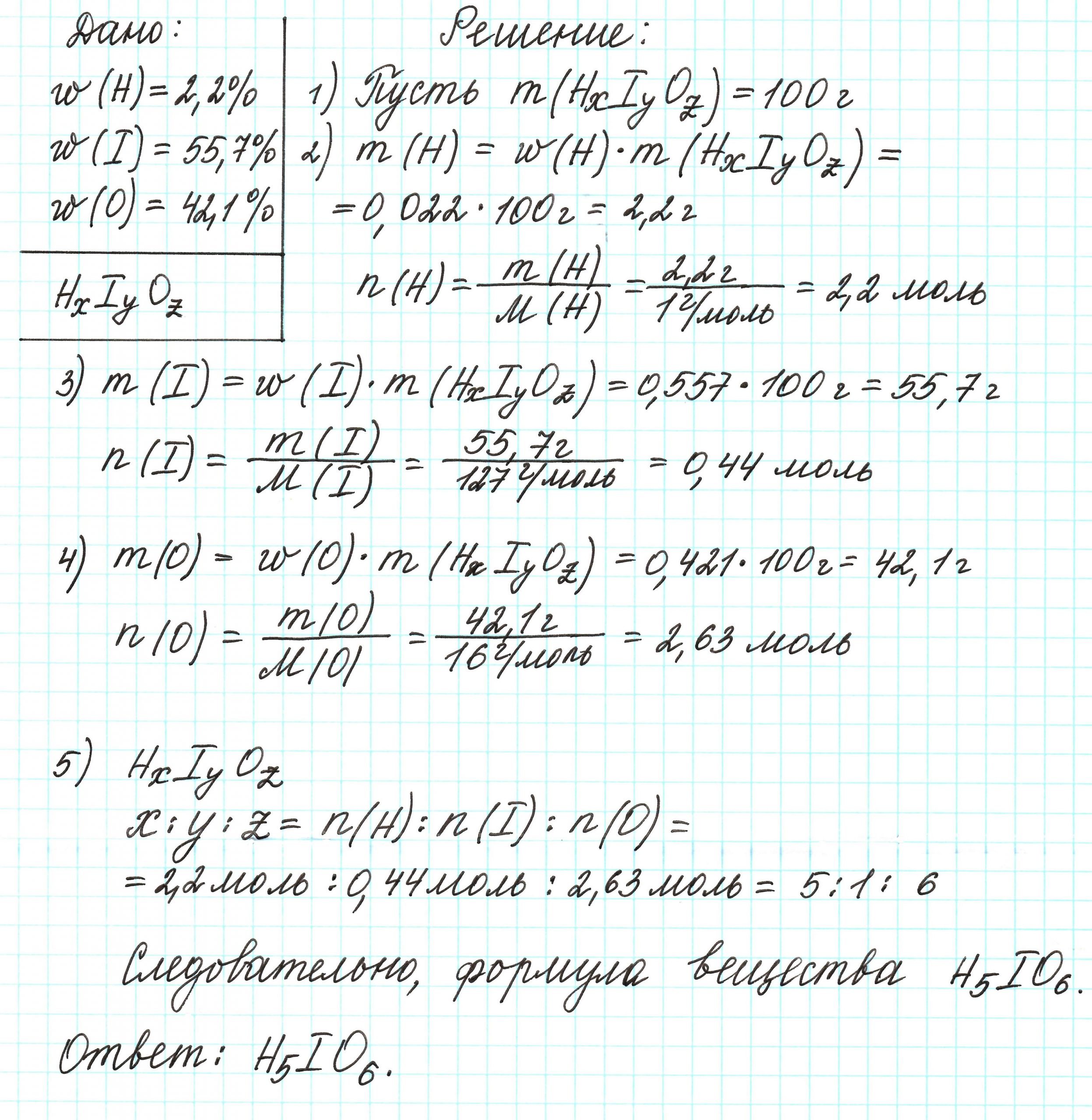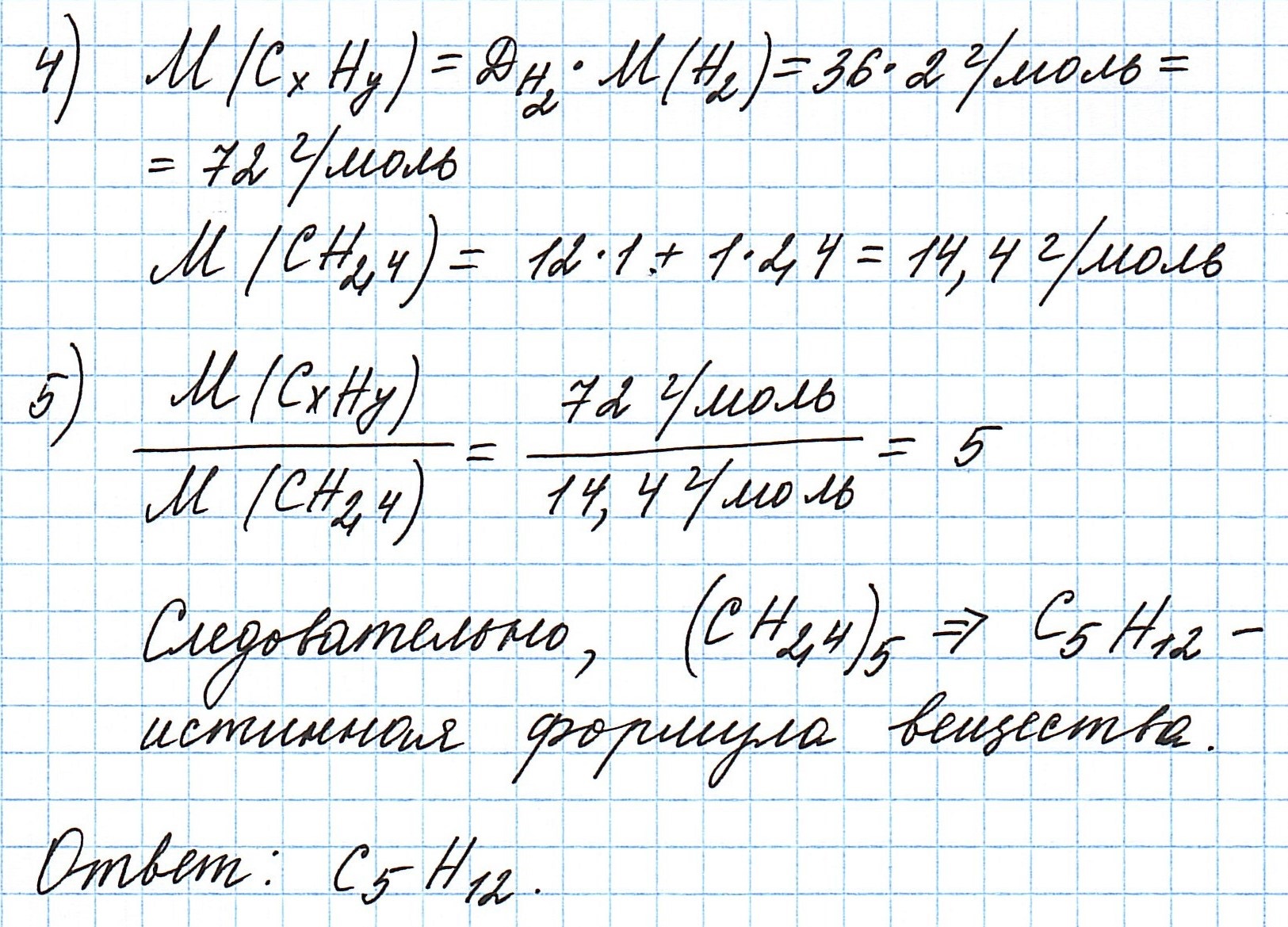Что необходимо сделать чтобы вычислить молекулярную массу
МОЛЯРНАЯ МАССА И ОТНОСИТЕЛЬНАЯ МОЛЕКУЛЯРНАЯ МАССА: В ЧЕМ ОТЛИЧИЕ И ПОЧЕМУ ОНИ ЧИСЛЕННО РАВНЫ
Как вычислить молярную массу вещества? В каких единицах она измеряется?
А еще есть относительная молекулярная масса. Почему она относительная и численно равна молярной массе? Может быть это одно и то же?
Вот сколько вопросов возникает сразу в отношении такого простого на первый взгляд понятия, как молярная масса.
Разберемся по порядку и научимся ее определять.
Относительная атомная масса
Огромнейший вклад в развитие и обоснование понятия относительная атомная масса внесли в разное время французский ученый Гей-Люссак, итальянский ученый А.Авогадро и шведский ученый Й.Я. Берцелиус.
Не углубляясь в историю вопроса, вспомним, что любой химический элемент представляет собой определенную разновидность атомов. Сегодня мы знаем, что атомы химических элементов имеют свои особые характеристики.
И самая главная из них, определяющая практически все остальные, это заряд ядра. А так как заряд ядра обусловлен присутствием в нем протонов, а заряд одного протона равен +1, то и количество протонов, соответственно, также является важнейшей характеристикой атомов химических элементов.
Основную массу атома составляет ядро, которое кроме протонов содержит еще и нейтроны. Масса последних сопоставима с массой первых. Оболочку атома составляют электроны.
По числу частиц в атоме, а точнее, по их суммарной массе, атомы химических элементов можно условно разделить на тяжелые и легкие. Например, легким элементом является водород, так как его атомы имеют самую маленькую массу. А свинец — это уже тяжелый элемент. Масса его атома в 302 раза тяжелее массы атома водорода.
Но тем не менее, как бы мы не делили все атомы на тяжелые или легкие, абсолютная масса (mA) каждого из них ничтожно мала, как мала и масса составляющих их частиц. Например,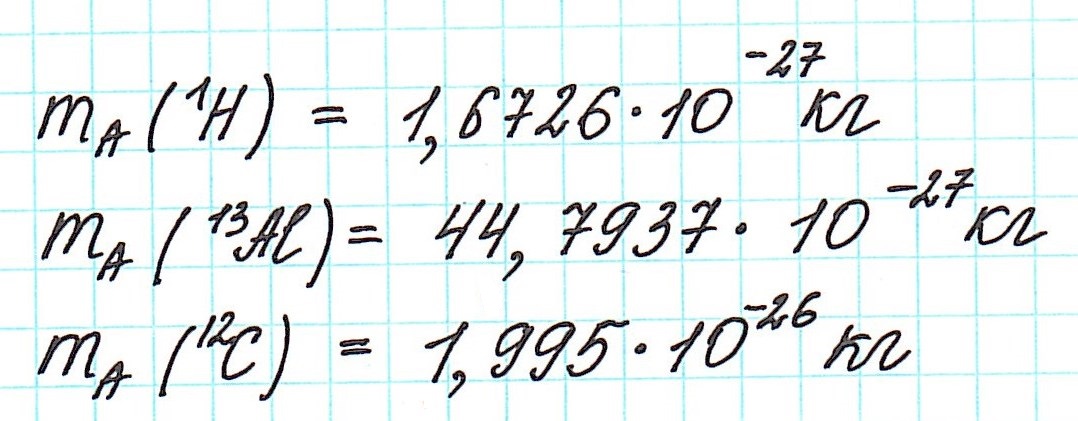
Величина, с которой сравнивают массу атома
Первоначально еще Дальтон сравнивал массы атомов с массой атома водорода, как самого легкого. Позднее появилась так называемая кислородная единица, равная 1/16 части массы атома кислорода. К ней перешли потому, что большинство атомов химических элементов образуют соединения с кислородом.
Однако, с развитием атомной физики и эта единица стала крайне неудобной. Все потому, что кислород в природе имеет несколько изотопов (а именно 3 устойчивых, всего же их 16). А изотопы, как известно, отличаются своей атомной массой. Из-за большого разнообразия изотопов и их различной устойчивости кислородная единица утратила свою актуальность.
Почему именно углерод? Да потому, что:
— у углерода всего 2 изотопа: 12 С и 13 С; причем первого 98,9%;
— количество органических веществ (их основу составляет, как известно, именно углерод) в сотни раз больше, чем неорганических;
— при переходе от кислородной единицы к углеродной уже посчитанные относительные атомные массы всех элементов изменились не существенно, что оказалось очень удобным.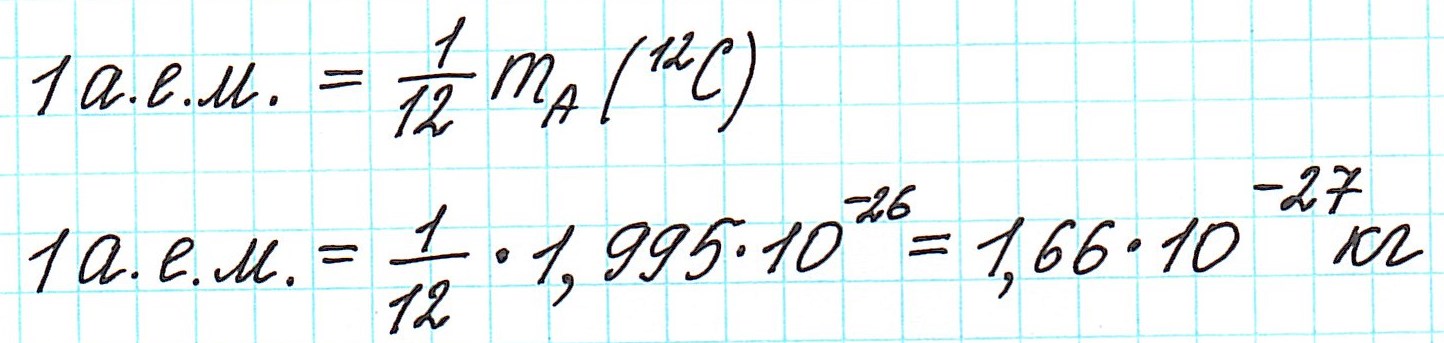
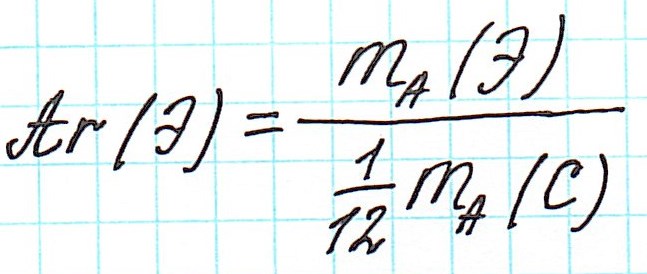
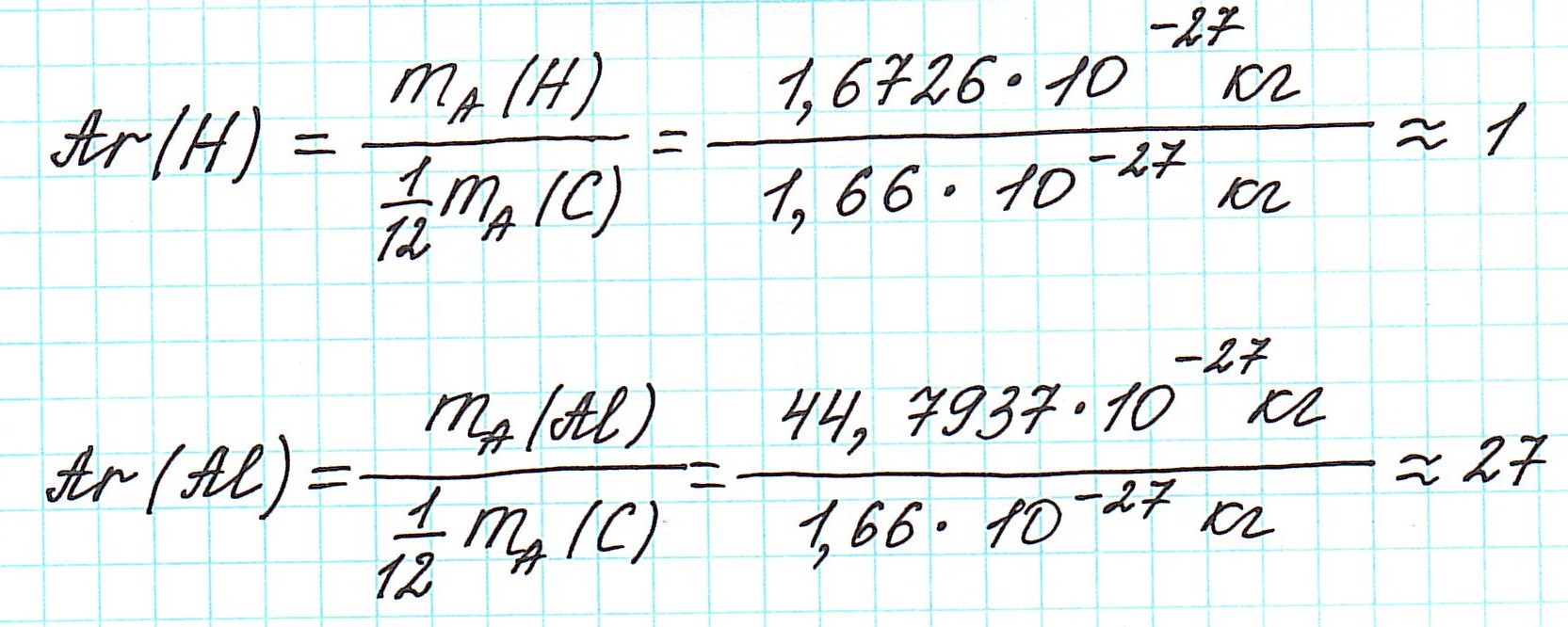
Почему атомная масса дробная?
Вернемся к строению атома.
Масса атома складывается из массы всех составляющих его частиц.
Массы протона и нейтрона приняты равными 1. А вот массой электрона обычно пренебрегают (по крайней мере в химии), так как даже относительная она безнадежно мала (0,0005485799090659(16) а.е.м.). То есть можно сказать, что масса атома определяется массой его ядра.
В составе ядра целое количество частиц. Например, в атоме одного из изотопов кислорода 8 протонов и 8 нейтронов. Значит, его Ar должна быть равна 16. Так почему же Ar представлена в периодической системе химических элементов в виде десятичной дроби? Для кислорода это Ar(О)=15,9994.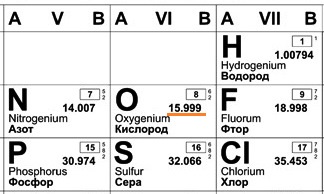
Например, химический элемент кислород в природе состоит на 99,76% из изотопа 16 О, на 0,04% из изотопа 17 О и на 0,20% из изотопа 18 О. Таким образом, Ar для кислорода является средним значением, учитывающим относительное содержание его изотопов.
Относительная молекулярная масса
А как же найти относительную молекулярную массу?
Дело в том, что молекулы характерны для веществ с ковалентными связями: вода H2O, серная кислота H2SO4, глюкоза C6H12O6 и т.д. И к ним в полной мере можно применить термин «относительная молекулярная масса».
Так как молекулы состоят из атомов, то относительная молекулярная масса (Mr) будет складываться из их относительных атомных масс. Например: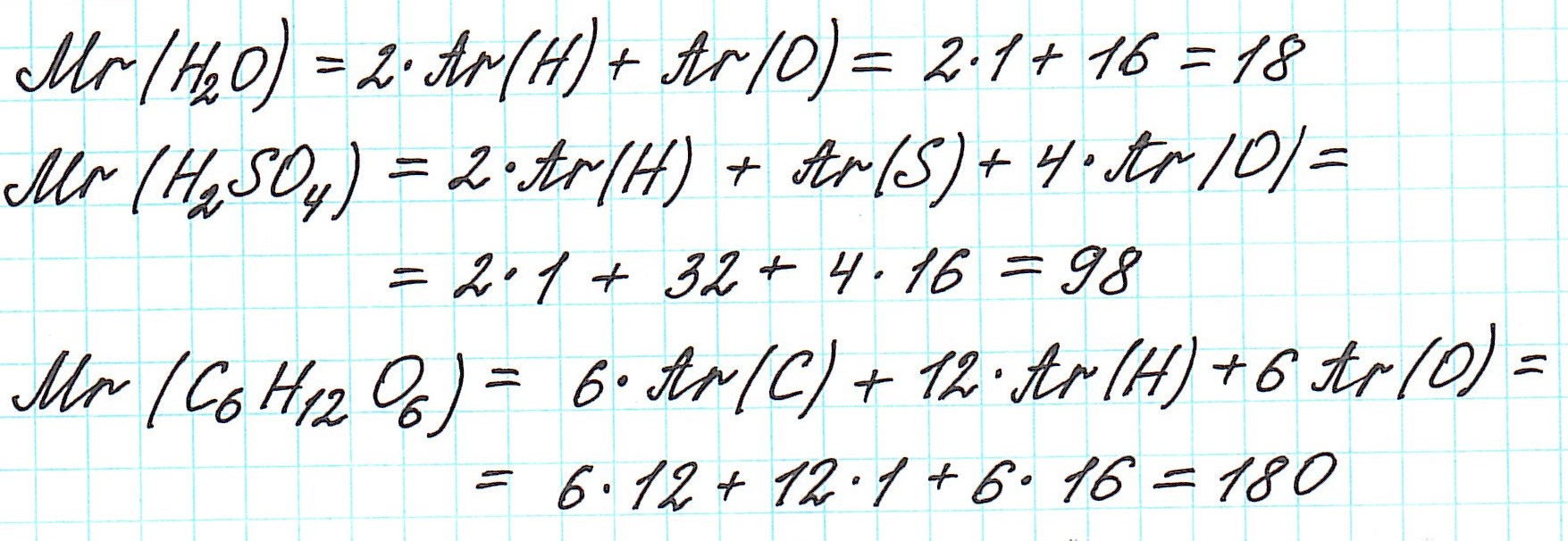
Точно так же, как относительную атомную массу (Ar), относительную молекулярную массу (Mr) будем сопоставлять с 1/12 частью атома изотопа углерода 12 С.
В последующем говорим о Mr.
Количество вещества и молярная масса
В практических расчетах все-таки требуется вычислять массы, взятые в граммах, килограммах ато и в тоннах (если речь идет о каком-то производстве, например).
Как же поступают тогда?
Количество вещества, которое содержит столько же частиц (атомов, ионов, молекул – в зависимости от строения), что и 12 г изотопа углерода 12 С, назвали молем.
Один моль вещества (любого!) всегда содержит 6,02·10 23 его частиц ( постоянная Авогадро ).
Ну, а так как атомы элементов отличаются по своей массе, то и 1 моль вещества тоже будет отличаться по массе.
Массу одного моля вещества называют молярной массой (М) и вычисляют в г/моль.
Таким образом, молярная масса и количество вещества связаны соотношением:
Можно также определить и такие отношения, связанные с количеством вещества:
Почему же относительная молекулярная и молярная массы равны?
Итак, относительная молекулярная и молярная массы, как следует из их определений – это не одно и то же.
Докажем, каким образом обе массы численно могут быть равны:
Как вычислить молярную массу вещества
Мы уже знаем, что относительная молекулярная масса складывается из относительных атомных масс.
При нахождении относительной молекулярной массы (Mr), а значит и молярной (М), выполняем следующие действия :
1) правильно записываем формулу вещества;
2) анализируем качественный состав (атомы каких элементов составляют вещество) и количественный состав (в каких количествах находятся эти атомы – смотрим по индексам, которые стоят справа внизу от знака химического элемента);
3) в периодической системе химических элементов находим элементы, атомы которых составляют вещество, и округляем относительную атомную массу, стоящую рядом со знаком элемента, до целого числа (! у хлора – до 35,5);
4) складываем относительные атомные массы всех элементов с учетом количества атомов.
Рассмотрим еще примеры:
Как вычислить молярную массу вещества, находящегося в газообразном состоянии
Это означает, что в данных условиях отношение масс газов друг к другу является отношением их молярных масс:


Вычислить молярную массу вещества (а, значит, и относительную молекулярную), находящегося в газообразном состоянии, можно, используя молярный объем газа (VM):
Итак, подведем итог:
Без вычисления молярной массы не обходится решение практически ни одной задачи. Если вы поняли, что такое молярная и относительная молекулярная массы и как их вычислять, но еще не умеете решать задачи с их применением, то самое время научиться.
Разбор простых типовых задач по химии в книге, которую вы можете совершенно БЕСПЛАТНО скачать здесь.
Как рассчитать молекулярную массу?
Как найти молярную массу соединения?
Кроме того, как рассчитать молекулярную массу?
Пример расчета молекулярной массы
Аналогично, в чем разница между молекулярной массой и молярной массой?
Здесь, как вы определяете молекулярную массу класса 9?
Умножьте атомный вес каждого элемента на количество атомов этого конкретного элемента.. Аналогичным образом сделайте это для всех элементов в молекуле или соединении. Сложите все значения, полученные на предыдущем шаге. Затем добавьте единицы измерения в граммах / моль, и вы получите молекулярную массу вещества.
Разница между молярной массой и молекулярной массой.
| База | Молярная масса | Молекулярная масса |
|---|---|---|
| Ед. изм | Кгмоль-1 | Единицы атомной массы |
Что такое молекулярная масса, объясните на примере?
Сумма атомных масс всех атомов в молекулена основе шкалы, в которой атомные массы водорода, углерода, азота и кислорода равны 1, 12, 14 и 16 соответственно. Например, молекулярная масса воды, которая имеет два атома водорода и один атом кислорода, равна 18 (т.е. 2 + 16).
Молекулярный вес выражен в граммах?
Молекулярная масса составляет масса одного моля вещества. Обычно для этого используются граммы на моль.
Одинаковы ли молекулярная масса и масса?
Что такое молекулярная масса, объясните на примере?
Сумма атомных масс всех атомов в молекулена основе шкалы, в которой атомные массы водорода, углерода, азота и кислорода равны 1, 12, 14 и 16 соответственно. Например, молекулярная масса воды, состоящей из двух атомов водорода и одного атома кислорода, равна 18 (т.е. 2 + 16).
Какая молекулярная масса 9 класса?
Какая масса у 9 класса?
Какая минимальная молекулярная масса?
(относительная) молекулярная масса соединения, определяемая анализом одного из его структурных элементов, например атома металла, лиганда, концевого остатка и т. д.
Что подразумевается под молекулярной массой?
Слушайте произношение. (muh-LEH-kyoo-ler mas) Сумма атомных масс всех атомов в молекулена основе шкалы, в которой атомные массы водорода, углерода, азота и кислорода равны 1, 12, 14 и 16 соответственно.
Как еще называют молекулярную массу?
В химии молярная масса химического соединения определяется как масса образца этого соединения, деленная на количество вещества в этом образце, измеренное в молях. Это масса 1 моля вещества или 6.022 × 10 23 частицы, выраженные в граммах.
Почему важна молекулярная масса?
Аму равно г моль?
Масса одного атома элемента [аму] равна численно равна массе [г] 1 моля этого элемента, независимо от элемента.
Что такое молекулярная масса вкратце?
Молекулярная масса (м) равна масса данной молекулы: измеряется в дальтонах (да или и). … Молекулярная масса и относительная молекулярная масса отличаются от молярной массы, но связаны с ней. Молярная масса определяется как масса данного вещества, деленная на количество вещества, и выражается в г / моль.
Какой элемент имеет молекулярную массу 160?
| PubChem CID | 177487 |
|---|---|
| Структура | Найти похожие конструкции |
| Молекулярная формула | Gd |
| Синонимы | Гадолиний-160 Гадолиний, изотоп массы 160 14834-81-2 160Gd DTXSID90163971 |
| Молекулярная масса | 159.92706 |
Что такое молекулярная масса 1 г?
Молекулярная масса в граммах составляет равный молекулярной массе вещества или сумме всех атомных масс в его молекулярной формуле. Он равен молекулярной массе молекулы в граммах. Например; Молекулярная масса диоксида углерода (CO2) в граммах: 12+ (2 × 16)
Что такое принцип Архимеда 9 класса?
9 класс физики гравитации. Принцип Архимеда. Принцип Архимеда. Когда тело полностью или частично погружено в жидкость, на него действует направленная вверх сила, равная весу вытесняемой им жидкости. Если вес вытесненной воды меньше веса объекта, объект утонет.
В чем разница между массой и 9-й весовой категорией?
В чем разница между весом и массой?
Как определить минимальную молекулярную массу соединения?
Какая минимальная молекулярная масса соединения?
Следовательно, минимальная молекулярная масса соединения составляет 500 г.
Какая минимальная молекулярная масса инсулина?
Относительная молекулярная масса

Всего получено оценок: 565.
Всего получено оценок: 565.
В химии чрезвычайно важным является понятие «молекулярная масса». Молекулярную массу часто путают с молярной массой. Чем отличаются эти величины, и какими свойствами обладают?
Молекулярная масса
Атомы и молекулы – мельчайшие частицы любых химических вещества. Если постараться выразить их массу в граммах, то получится число, в котором перед запятой будет находиться около 20 нулей. Поэтому измерять массу в таких единицах, как граммы, неудобно. Чтобы выйти из этой ситуации, следует какую-нибудь очень малую массу принять за единицу, а все остальные массы выражать по отношению к ней. В качестве этой единицы используют 1/12 массы атома углерода.
Относительна молекулярная масса – это масса молекулы вещества, которую измеряют в атомных единицах массы. Молекулярная масса равна отношению массы молекулы того или иного вещества к 1/12 части массы атома углерода. Она показывает, во сколько раз масса молекулы определенного вещества больше 1/12 массы атома углерода.
Молекулярную массу часто путают с молярной массой, единицей измерения которой является г/моль. И действительно численно эти две величины абсолютно идентичны, однако размерность у них абсолютно разная.
Относительную молекулярную массу можно найти, сложив между собой атомные массы
Чтобы вычислить молекулярную массу простых и сложных веществ, необходимо найти сумму относительных атомных масс атомов, входящих в состав молекулы. Например, относительная молекулярная масса воды Mr (H2O), которая состоит, как известно, из двух атомов водорода и одного атома кислорода, равна 1*2+16=18.

Атомная масса
Атомная масса химического элемента – также одно из важнейших обозначений в химии. Атомная масса – это средняя величина из атомных масс устойчивых природных изотопов этого элемента с учетом их относительного содержания в природе (их природного распространения). Так, в природе существуют два устойчивых изотопа элемента хлора Cl с массовыми числами 35 и 37:
Ar(Cl)=(34.97*0.7553)+(36.95*0.2447)=35.45 – именно такая величина принята для элемента хлора в качестве его относительной атомной массы.
Впервые вычисление атомных весов были сделаны Д. Дальтоном. Атомные веса элементов он относил к атомному весу водорода, приняв его за единицу. Однако вычисленные в соответствии с его принципом «наибольшей простоты» вес атома кислорода и некоторых других элементов оказались неверными.

Что мы узнали?
В школьной программе по химии (8 класс) большое внимание уделяется таким понятием, как относительная атомная и молекулярная масса вещества. Учащиеся изучают их отличия и особенности, а также учатся определять массы газов и веществ.
КАК ВЫЧИСЛИТЬ ФОРМУЛУ ВЕЩЕСТВА
Способов, как определить формулу вещества, достаточно много. Все зависит от исходных данных. Наиболее разнообразны подобные вычисления в органической химии. И это не удивительно, так как органических соединений значительно больше, чем неорганических.
1.Понятие простейшей и истинной формулы вещества
В одних задачах на определение формулы вещества необходимо найти его простейшую формулу, а в других – истинную. В чем разница?
Так, например: СН2 – простейшая формула алкена – показывает, что на каждый 1 атом углерода приходится 2 водородных атома. То есть существует соотношение 1:2. Поэтому для нахождения простейшей (эмпирической) формулы вещества важно рассчитать количество вещества атомов, которые входят в его состав, то есть n(C) и n(H).
Например, для пропилена, относящегося к классу алкенов, истинная (молекулярная) формула будет C3H6. Она говорит о том, что молекула данного вещества включает 3 атома С и 6 атомов Н. Это вполне соответствует простейшей формуле, отвечающей соотношению атомов 1:2. Для нахождения истинной (молекулярной) формулы соединения требуется посчитать его относительную молекулярную (Mr) или молярную массу (M).
2.Массовая доля химического элемента: что означает и как высчитывается
Массовая доля – это отношение массы компонента системы к массе системы, выраженное в процентах или долях от единицы.
Молекула имеет массу. Все атомы в молекуле также имеют свои массы. Атомов одного химического элемента в молекуле может быть 1 или несколько. Важна масса всех атомов одного элемента. Если ее разделить на массу молекулы, то получится массовая доля этого элемента. Ее выражают либо в процентах, которые всегда меньше 100%, либо в долях от единицы, которые всегда меньше 1.
Пример 1. Каковы массовые доли элементов в оксиде железа (III) Fe2O3.
3.Как определить формулу вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов применимо как к органическим, так и к неорганическим соединениям.
Пример 2. Сероуглерод содержит 15,8% углерода по массе. Какова простейшая формула этого вещества?
Поскольку речь идет о массовых долях элементов, то необходимо знать массу вещества. В нашем случае – массу сероуглерода. В условии задачи о ней ничего не говорится. Поэтому допускаем, что масса вещества равна 100 г.
Почему 100 г? Это «круглое» число, и его использование облегчает все расчеты. Так как в итоге будем находить соотношения количеств веществ элементов, то какое-то особенное значение массы вещества не играет никакой роли.
Попробуйте ради эксперимента принять массу сероуглерода равной 23 г, 467 г и т.п. Результат будет один и тот же.
Допустим, что атомов углерода в молекуле х, а атомов серы – у. В таком случае формула вещества примет вид: СхSу.
Пример 3. Содержание углерода в углеводороде составляет 83,33%. Плотность паров соединения по водороду – 36. Какова молекулярная формула углеводорода?
Чтобы не загромождать записи, массовую долю элементов будем считать не в процентах, а в долях от единицы.
Пусть вас не удивляет получившаяся простейшая формула. Ведь, исходя из определения простейшей формулы, на каждый 1 атом углерода приходится 2,4 атома водорода. Это всего лишь соотношение. Соединения с формулой СН2,4 в принципе не существует. Не всегда простейшая и истинная формулы совпадают друг с другом.
А если полученная формула СН2,4 вас все же смущает, вы можете решать задачу и вторым способом. Но это несколько более сложный способ, когда требуется составить и решить уравнение с двумя неизвестными.
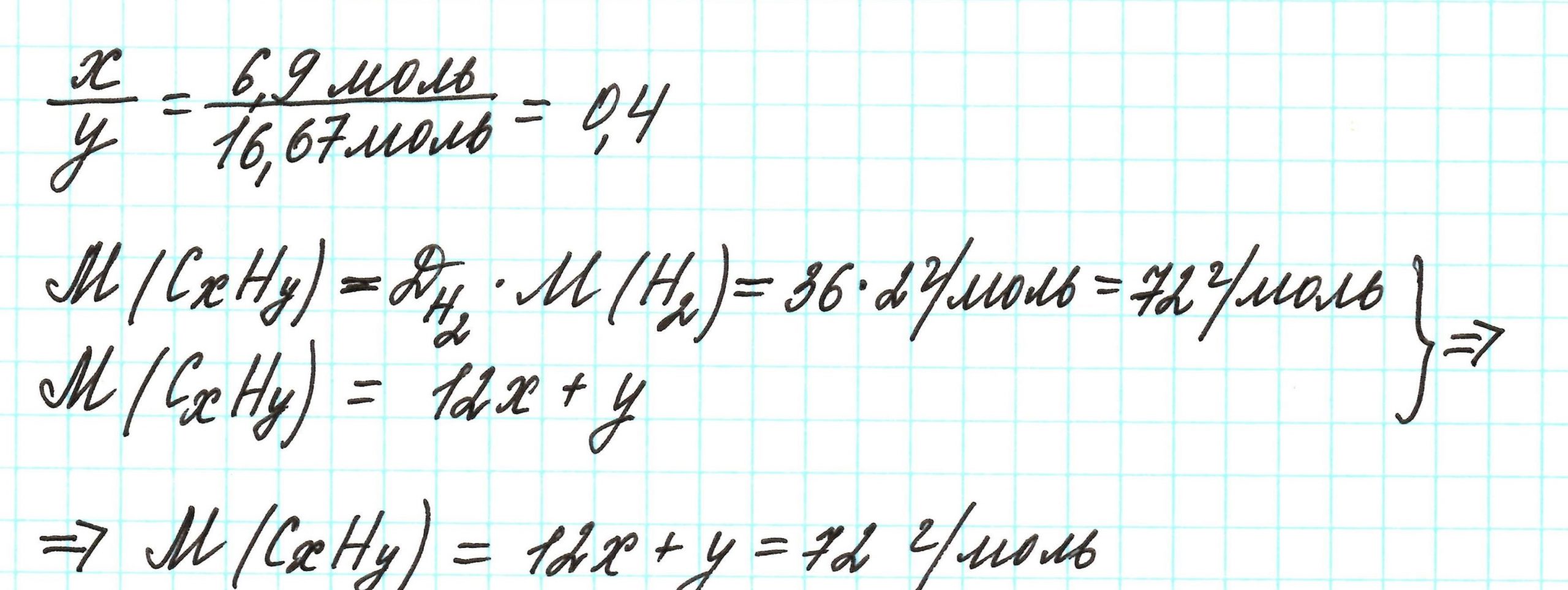
Не все химические вещества являются бинарными, то есть состоят из атомов двух химических элементов. Но в любом случае, алгоритм решения задачи тот же.
Пример 4. Некоторая кислота содержит водород (2,2%), иод (55,7%) и кислород (42,1%). Определите простейшую формулу этой кислоты.
4.Как определить формулу органического соединения
Определить формулу органического вещества можно не только зная массовые доли элементов в его составе.
4.1. Как определить формулу органического соединения
по общей молекулярной формуле вещества
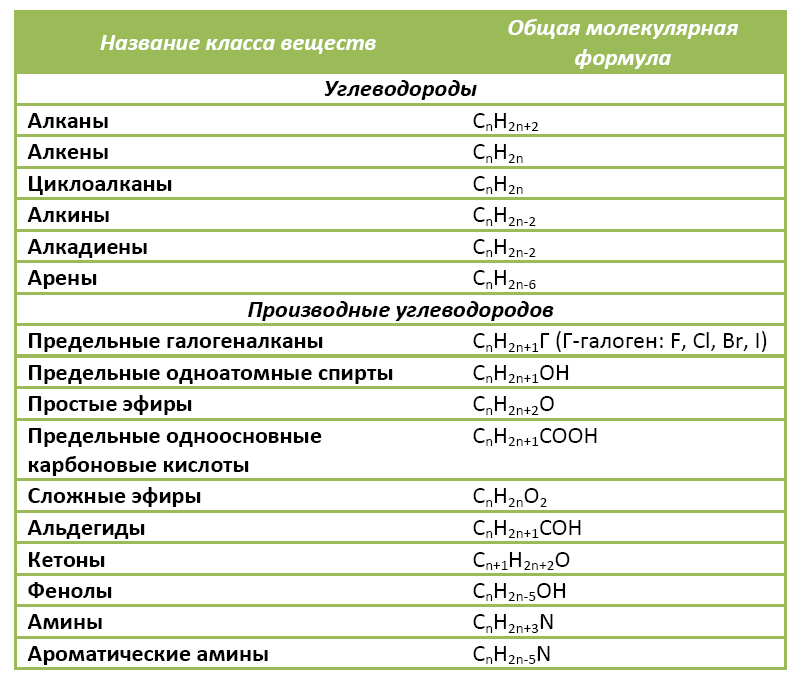
Органические вещества сгруппированы по самостоятельным классам на основе общности строения и свойств. Каждый класс соединений характеризуется своей общей молекулярной формулой. Особенно это наглядно видно на примере углеводородов.
Если другие органические вещества рассматривать как их производные, в молекулы которых введена какая-либо функциональная группа, то и для них также можно составить общую молекулярную формулу.
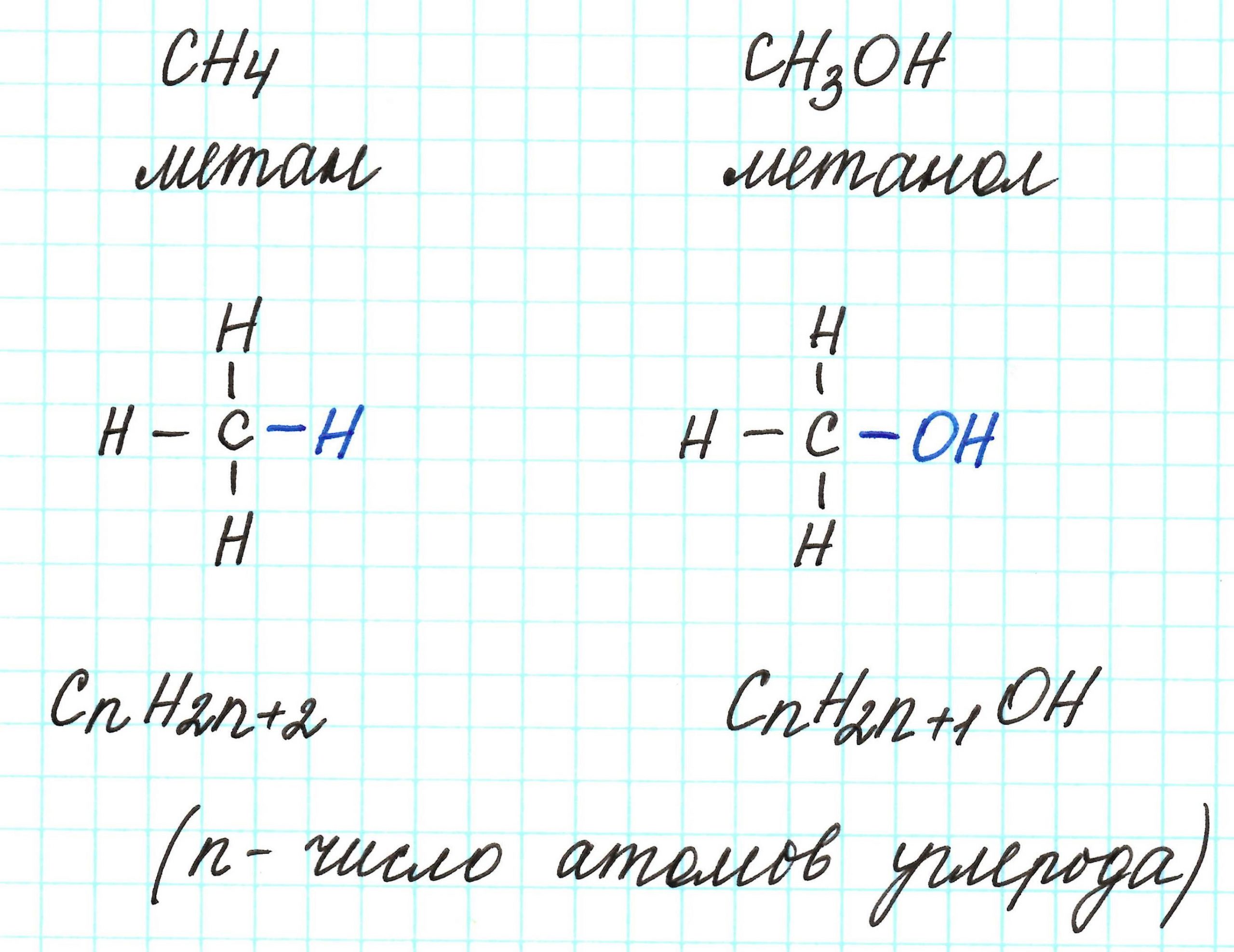
Предельные одноатомные спирты можно рассматривать как производные алканов, в молекулах которых 1 атом водорода замещен на гидроксильную группа –ОН. Таким образом, их общая молекулярная формула такая: СnH2n+1ОН.
Ниже в таблице приведены общие молекулярные формулы основных классов органических соединений.
Пример 5. Плотность паров по воздуху некоторого алкана 4,414. Какова формула алкана?

4.2. Как определить формулу органического соединения
по продуктам его сгорания
Это еще один распространенный тип задач на определение формулы органического соединения.
Необходимо запомнить и понять основные моменты:
— так как все органические вещества содержат атомы С, Н, а также атомы О (кислородсодержащие соединения), то всегда при их сгорании выделяется углекислый газ СО2 и образуется вода Н2О;
— все углеродные атомы, входящие в состав органического соединения, окажутся в составе углекислого газа СО2; следовательно, n(С) как в соединении, так и в СО2 – это одна и та же величина;
— все атомы водорода Н, которые имеются в составе вещества, перейдут в состав воды Н2О; следовательно, n(Н) и в данном веществе, и в Н2О – это одна и та же величина;
— при сгорании веществ, включающих в себя азот (например, амины), кроме СО2 и Н2О, образуется еще и N2.
Разберем несколько примеров.
Пример 6. Сожгли 7,2 г углеводорода. Плотность его паров по водороду составляет 36. В результате реакции образовалось 22 г оксида углерода (IV) и 10,8 г воды. Какова молекулярная формула соединения?
Пример 7. В результате сгорания 4,8 г органического соединения выделилось 3,36 л (н.у.) оксида углерода (IV) и образовалось 5,4 г воды. Плотность паров искомого соединения по кислороду равна 1. Вычислите молекулярную формулу вещества.
Пример 8. Результатом сжигания 0,31 г газообразного органического соединения, имеющего плотность 1,384 г/л, стало выделение 0,224 л (с.у.) оксида углерода (IV), 0,112 л азота и образование 0,45 г воды. Вычислите молекулярную формулу этого вещества.

5. Как определить формулу вещества: комбинированные задачи
Наибольший интерес и некоторую трудность представляют комбинированные задачи, сочетающие в себе необходимость найти формулу соединения:
— используя приемы, применяемые в рассмотренных выше задачах;
— используя сведения не только о химических, но и физических свойствах вещества.
Вот несколько примеров.
Пример 9. Какова молекулярная формула предельного углеводорода, при полном сгорании 8,6 г которого выделилось 13, 44 л (н.у.) оксида углерода (IV).
1) известен класс вещества, поэтому возможно применить его общую молекулярную формулу;
2) речь идет о сгорании вещества, поэтому количество атомов в составе молекулы будем искать, используя данные о продукте сгорания – СО2.
Пример 10. Алкен нормального строения содержит двойную связь при первом углеродном атоме. Образец этого алкена массой 0,7 г присоединил бром массой 1,6 г. Вычислите формулу алкена и назовите его.
В предлагаемых условиях:
1) известен класс вещества, следовательно, применим его общую молекулярную формулу;
2) речь идет об одном из химических свойств: способности алкенов присоединять галогены по месту разрыва двойной связи.
Пример 11. После полного сжигания в кислороде арена, имевшего массу 0,92 г, выделился оксид углерода (IV). Пропуская газ через избыток раствора щелочи Ca(OH)2, получили 7 грамм осадка. Какова молекулярная формула арена?
В предлагаемой задаче:
1) известен класс вещества;
2) речь идет о сжигании соединения и образовании в качестве продукта горения углекислого газа, который при взаимодействии со щелочью Са(ОН)2 привел к выпадению осадка известной массы.
Следующий пример очень характерен для задач, встречающихся в заданиях второй части ЕГЭ по химии.
Пример 12. Некоторое соединение, образующее альдегид в реакции окисления, взаимодействует с избытком бромоводородной кислоты, образуя 9,84 г продукта (выход составляет 80% от теоретического), имеющего плотность паров по Н2 61,5. Определите строение этого соединения, а также его массу, вступившую в реакцию?
1) говорится о химических свойствах искомого соединения; анализируя их, приходим к выводу, что заданным веществом является предельный одноатомный спирт;
2) известна общая молекулярная формула предельных одноатомных спиртов;
3) более подробно говорится о взаимодействии заданного вещества с бромоводородной кислотой; спирт, реагируя с HBr, дает галогеналкан, для которого известны его масса, практический выход и относительная плотность по Н2; именно от этих данных и нужно отталкиваться при решении данной задачи.
Итак, способов, как определить формулу вещества, действительно, множество. Мы рассмотрели лишь основные из них. Важно правильно уяснить понятия «простейшая формула вещества» и «истинная формула вещества», чтобы не путать их.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь в нашу группу ВКонтакте.
Пожалуйста, оцените публикацию