Что необходимо для построения новых клеток и тканей в организме человека
Роспотребнадзор
Роспотребнадзор
Значение основных питательных веществ, их энергетическая ценность
Значение основных питательных веществ,
их энергетическая ценность
Рациональное (от лат. ratio — разум) питание является важнейшим фактором здорового образа жизни и основано на балансе в энергетическом отношении и по содержанию питательных веществ в зависимости от пола, возраста и рода деятельности.
В настоящее время у большей части нашего населения питание не соответствует этому понятию не только из-за недостаточной материальной обеспеченности, но еще из-за отсутствия или недостатка знаний по данному вопросу. Прежде чем перейти к рекомендациям по питанию в повседневной жизни, остановимся на роли пищевых веществ в организме.
Питание является неотъемлемой частью жизни, так как поддерживает обменные процессы на относительно постоянном уровне. Роль питания в обеспечении жизнедеятельности организма общеизвестна: энергообеспечение, синтез ферментов, пластическая роль и т. д. Нарушение обмена веществ приводит к возникновению различных болезней. Неправильно организованное питание приводит к снижению трудоспособности, повышению восприимчивости к болезням и, в конечном счете, к снижению продолжительности жизни. Энергия в организме высвобождается в результате процессов окисления белков, жиров и углеводов.
Белки — жизненно необходимые вещества в организме. Они используются в качестве источника энергии (окисление 1 г белка в организме дает 4 ккал энергии), строительного материала для регенерации (восстановления) клеток, образования ферментов и гормонов. Потребность организма в белках зависит от пола, возраста и энергозатрат, составляя в сутки 80-100 г, в том числе животных белков 50 г. Белки должны обеспечивать примерно 15 % калорийности суточного рациона. В состав белков входят аминокислоты, которые подразделяются на заменимые и незаменимые. Чем больше белки содержат незаменимых аминокислот, тем они полноценнее. К незаменимым аминокислотам относятся: триптофан, лейцин, изолейцин, валин, лизин, метионин, фенилаланин, треонин. Поэтому в рационе должны присутствовать блюда из говядины, печени, мяса птицы, рыбы, сыр, яйца.
Жиры являются основным источником энергии в организме (окисление 1 г жиров дает 9 ккал). Жиры содержат ценные для организма вещества: ненасыщенные жирные кислоты, фосфатиды, жирорастворимые витамины А, Е, К. Суточная потребность организма в жирах составляет в среднем 80-100 г, в том числе растительных жиров 20-25 г. Жиры должны обеспечивать примерно 35 % калорийности суточного рациона. Наибольшую ценность для организма представляют жиры, содержащие ненасыщенные жирные кислоты – оливковое масло, рыба, рыбий жир, подсолнечное масло, маслины, мясо птицы.
Кроме белков, жиров и углеводов важнейшей составляющей рационального питания являются витамины — биологически активные органические соединения, необходимые для нормальной жизнедеятельности. Недостаток витаминов приводит к гиповитаминозу (недостаток витаминов в организме) и авитаминозу (отсутствие витаминов в организме). Витамины в организме не образуются, а поступают в него с продуктами. Различают водо- и жирорастворимые витамины. Больше всего витаминов содержится в молодых овощах и фруктах, чем в зрелых.
Кроме белков, жиров, углеводов и витаминов организму необходимы минеральные вещества, которые используются в качестве пластического материала и для синтеза ферментов. Различают макроэлементы (Са, Р, Mg, Na, К, Fe) и микроэлементы (Сu, Zn, Мn, Со, Сr, Ni, I, F, Si). Больше всего минеральных вещетв содержит чай, тыквенные семечки, соленые мясо и рыба, орехи, творог и сыр, рыба, мясо и печень, бобовые и крупы, а также овощи, фрукты, салаты и ягоды, сушеные грбы.
Немного практики
Есть еще несколько правил, которые могут помочь рационализировать питание:
Фрукты необходимо употреблять в пищу отдельно от других блюд, причем желательно за 20 минут до еды и через 1-2 часа после еды, можно сочетать с орехами.
Зерновые и бобовые между собой смешивать нельзя. Исключение составляют блюда, обильно приправленные зеленью и некрахмалистыми овощами.
Овощи не употребляют с фруктами, исключая случаи, когда они «встретились» в одном соке.
Плохи для желудка блюда, в которых тесто совмещено с мясом – чебуреки, макароны по-флотски, пирожки, блины с мясом и пельмени.
Цельное молоко вообще не стоит совмещать с другой пищей, и помнить, что взрослый организм может и не воспринимать его.
Жидкости стоит употреблять перед едой. Также лучше начинать прием пищи с сырых овощей, это очистит желудок от лишних веществ.
Не стоит есть блюда с хлебом.
Рациональное питание человека – это не диеты и не особая строгость к своему организму. Это та норма, освоив которую, вы почувствуете себя лучше. А ваш организм скажет вам за это «спасибо!».
Что необходимо для построения новых клеток и тканей в организме человека
Питание является одним из важнейших факторов, определяющих здоровье человека. Питание должно быть безопасным, качественным, соответствовать физиологическим и возрастным потребностям человека и обеспечивать поступление всех необходимых питательных веществ.
Пищевые вещества (нутриенты) — это химические вещества, составные части пищевых продуктов, которые организм использует для построения, обновления и исправления своих органов и тканей, а также для получения из них энергии для выполнения работы.
Помимо этого, пищевые вещества подразделяются на незаменимые и заменимые. Незаменимые пищевые вещества – это 10 аминокислот, в ходящие в состав белков, некоторые жирные кислоты, витамины, минеральные вещества, которые не образуются в организме, но необходимы для нормального обмена веществ.
Среди всех пищевых веществ есть вещества, которые не образуются в организме человека. Эти пищевые вещества называются незаменимыми или эссенциальными.
Заменимые пищевые вещества могут образоваться в организме человека из незаменимых пищевых веществ. Поэтому они называются заменимыми, т.е. их можно заменить, имея в достатке незаменимые пищевые вещества. Однако заменимые пищевые вещества также должны поступать с пищей в определенных количествах, так как они служат источниками энергии.
Кроме того, пища содержит большое количество других биологически активных веществ, имеющих значение для сохранения здоровья и профилактики многих хронических заболеваний. К ним относится множество химических компонентов, содержащихся преимущественно в растительных продуктах, объединяемых общим названием фитосоединения.
Потребление необходимого количества пищевых веществ и в нужных соотношениях составляет один из основных научных принципов оптимального, здорового питания.
Именно об этих питательных веществах здесь поговорим подробнее.
Белки, жиры, углеводы. Справка
В пищеварительном тракте белки расщепляются до аминокислот и простейших полипептидов, из которых в дальнейшем клетками различных тканей и органов, в частности печени, синтезируются специфические для них белки. Синтезированные белки используются для восстановления разрушенных и роста новых клеток, синтеза ферментов и гормонов.
Функции белков:
1. Основной строительный материал в организме.
2. Являются переносчиками витаминов, гормонов, жирных кислот и др. веществ.
3. Обеспечивают нормальное функционировании иммунной системы.
4. Обеспечивают состояние «аппарата наследственности».
5. Являются катализаторами всех биохимических метаболических реакций организма.
Организм человека в нормальных условиях (в условиях, когда нет необходимости пополнения дефицита аминокислот за счет распада сывороточных и клеточных белков) практически лишен резервов белка (резерв – 45 г: 40 г в мыщцах, 5 г в крови и печени), поэтому единственным источником пополнения фонда аминокислот, из которых синтезируются белки организма, могут служить только белки пищи.
Вне зависимости от видоспецифичности все многообразные белковые структуры содержат в своем составе всего 20 аминокислот.
Различают заменимые аминокислоты (синтезируются в организме) и незаменимые аминокислоты (не могут синтезироваться в организме, а поэтому должны поступать в организм в пищей). К незаменимым аминокислотам относятся: валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин.
Недостаток незаменимых аминокислот в пище приводит к нарушениям белкового обмена.
Незаменимыми аминокислотами являются валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан, цистеин, незаменимыми условно — аргинин и гистидин. Все эти аминокислоты человек получает только с пищей.
Заменимые аминокислоты также необходимы для жизнедеятельности человека, но они могут синтезироваться и в самом организме из продуктов обмена углеводов и липидов. К ним относятся гликокол, аланин, цистеин, глутаминовая и аспарагиновая кислоты, тирозин, пролин, серин, глицин; условно заменимые — аргинин и гистидин.
Белки, в которых нет хотя бы одной незаменимой аминокислоты или если они содержатся в недостаточных количествах называются неполноценными (растительные белки). В связи с этим для удовлетворения потребности в аминокислотах наиболее рациональной является разнообразная пища с преобладанием белков животного происхождения.
Функции жиров в организме:
• являются важнейшим источником энергии. При окислении 1 г вещества выделяется максимальное по сравнению с окислением белков и углеводов количество энергии. За счёт окисления нейтральных жиров образуется 50% всей энергии в организме;
• являются компонентом структурных элементов клетки — ядра, цитоплазмы, мембраны;
• депонированные в подкожной клетчатке, предохраняют организм от потерь тепла, а окружающие внутренние органы — от механических повреждений.
Различают нейтральные жиры (триацилглицеролы), фосфолипиды, стероиды (холестерин).
Уровень жирных кислот в организме регулируется как отложением (депонированием) их в жировой ткани, так и высвобождением из нее. По мере увеличения уровня глюкозы в крови жирные кислоты под влиянием инсулина, депонируются в жировой ткани.
Высвобождение жирных кислот из жировой ткани стимулируется адреналином, глюкагоном и соматотропым гармоном, тормозится — инсулином.
Жиры, как энергетический материал используется главным образом при выполнении длительной физической работы умеренной и средней интенсивности (работа в режиме аэробной производительности организма). В начале мышечной деятельности используются преимущественно углеводы, но по мере уменьшения их запасов начинается окисление жиров.
Обмен липидов тесно связан с обменом белков и углеводов. Поступающие в избытке в организм углеводы и белки превращаются в жир. При голодании жиры, расщепляясь, служат источником углеводов.
Жирные кислоты являются основными продуктами гидролиза липидов в кишечнике. Большую роль в процессе всасывание жирных кислот играют желчь и характер питания.
К незаменимым жирным кислотам, которые не синтезируются организмом, относятся олеиновая, линолевая, линоленовая и арахидовая кислоты (суточная потребность 10–12 г).
Линолевая и лоноленовая кислоты содержатся в растительных жирах, арахидовая — только в животных.
Недостаток незаменимых жирных кислот приводит к нарушению функций почек, кожным нарушениям, повреждениям клеток, метаболическим расстройствам. Избыток незаменимых жирных кислот приводит к повышенной потребности токоферола (витамина Е).
Функции углеводов в организме:
• Являются непосредственным источником энергии для организма.
• Участвуют в пластических процессах метаболизма.
• Входят в состав протоплазмы, субклеточных и клеточных структур, выполняют опорную функцию для клеток.
Углеводы делят на 3 основных класса: моносахариды, дисахариды и полисахариды.
На углеводы должно приходиться до 50 – 60% энергоценности пищевого рациона.
В пищеварительном тракте полисахариды (крахмал, гликоген; клетчатка и пектин в кишечнике не перевариваются ) и дисахариды под влиянием ферментов подвергаются расщеплению до моносахаридов (глюкоза и фруктоза) которые в тонком кишечнике всасываются в кровь. Значительная часть моносахаридов поступает в печень и в мышцы и служат материалом для образования гликогена.
В печени и мышцах гликоген откладывается в резерв. По мере необходимости гликоген мобилизуется из депо и превращается в глюкозу, которая поступает к тканям и используется ими в процессе жизнедеятельности.
Содержание гликогена в печени составляет 150–200 г.
Продукты распада белков и жиров могут частично в печени превращаться в гликоген. Избыточное количество углеводов превращается в жир и откладывается в жировом «депо».
Около 70% углеводов пищи окисляется в тканях до воды и двуокиси углерода.
Углеводы используются организмом либо как прямой источник тепла (глюкозо–6–фосфат), либо как энергетический резерв (гликоген);
Основные углеводы – сахара, крахмал, клетчатка – содержатся в растительной пище, суточная потребность в которой у человека составляет около 500 г (минимальная потребность 100–150 г/сут).
При недостаточности углеводов развивается похудание, снижение трудоспособности, обменные нарушения, интоксикация организма.
Избыток потребления углеводов может привести к ожирению, развитию бродильных процессов в кишечнике, повышенной аллергизации организма, сахарному диабету.
Материал подготовлен на основе информации из открытых источников
Тканевая инженерия — окно в современную медицину
Тканевая инженерия — окно в современную медицину
В перспективе тканевая инженерия, если и не приведет к бессмертию, то уж точно сделает решение многих современных проблем медицины более чем реальным.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Петр I мечтал «прорубить окно в Европу», а ученые нашего времени — окно в современную медицину. Сочетание «медицина + биотехнология» нашло свое отражение в тканевой инженерии — технологии, открывающей возможность восстановления утраченных органов без трансплантации. Методы и результаты тканевой инженерии поражают: это получение живых (а не искусственных!) органов и тканей; регенерация тканей; печать кровеносных сосудов на 3D-принтере; использование «тающих» в организме хирургических шовных нитей и многое другое.
Конкурс «био/мол/текст»-2011
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2011 в номинации «Лучшая обзорная статья».
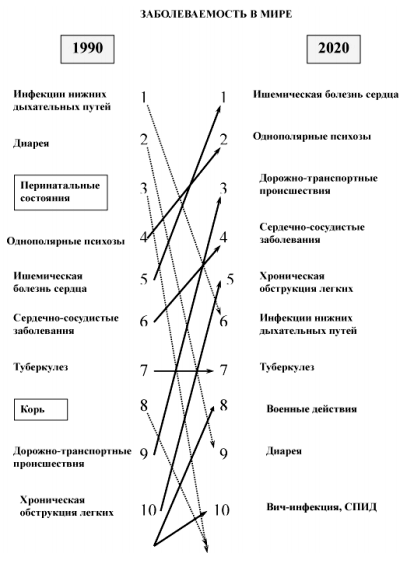
В последние десятилетия стали отчетливо проявляться тревожные тенденции старения населения, роста количества заболеваний и инвалидизации людей трудоспособного возраста, что настоятельно требует освоения и внедрения в клиническую практику новых, более эффективных и доступных методов восстановительного лечения больных. На рисунке 1 показано, как изменяется структура заболеваний в настоящее время.
Рисунок 1. Мировая динамика частоты заболеваний.
На сегодняшний день наука и техника предлагает несколько альтернативных путей восстановления или замены поврежденных или пораженных патологией тканей и органов:
В рамках данной статьи мы подробнее остановимся на возможностях и перспективах тканевой инженерии.
Тканевая инженерия — современная инновационная технология
Принципиально новый подход — клеточная и тканевая инженерия — является последним достижением в области молекулярной и клеточной биологии. Этот подход открыл широкие перспективы для создания эффективных биомедицинских технологий, с помощью которых становится возможным восстановление поврежденных тканей и органов и лечение ряда тяжелых метаболических заболеваний человека.
Цель тканевой инженерии — конструирование и выращивание вне организма человека живых, функциональных тканей или органов для последующей трансплантации пациенту с целью замены или стимуляции регенерации поврежденных органа или ткани. Иными словами, на месте дефекта должна быть восстановлена трехмерная структура ткани.
Важно отметить, что обычные имплантаты из инертных материалов могут устранить только физические и механические недостатки поврежденных тканей, — в отличие от тканей, полученных методом инженерии, которые восстанавливают, в том числе, и биологические (метаболические) функции. То есть, происходит регенерация ткани, а не простое замещение ее синтетическим материалом.
Однако для развития и совершенствования методов реконструктивной медицины на базе тканевой инженерии необходимо освоение новых высокофункциональных материалов. Эти материалы, применяемые для создания биоимплантатов, должны придавать тканеинженерным конструкциям характеристики, присущие живым тканям:
Клетки и матриксы — основа основ для тканевой инженерии
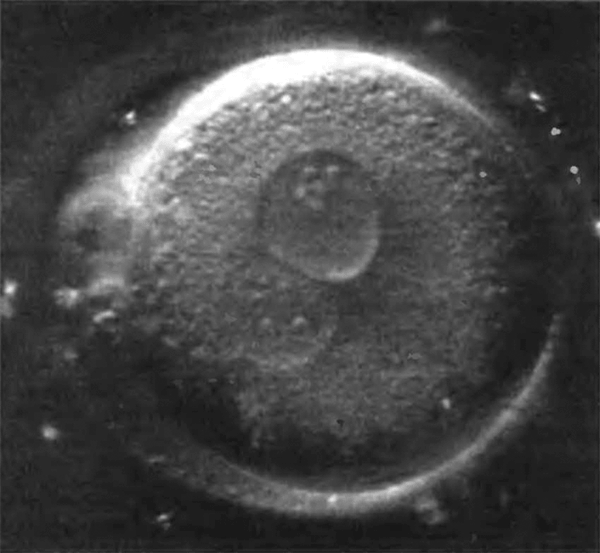
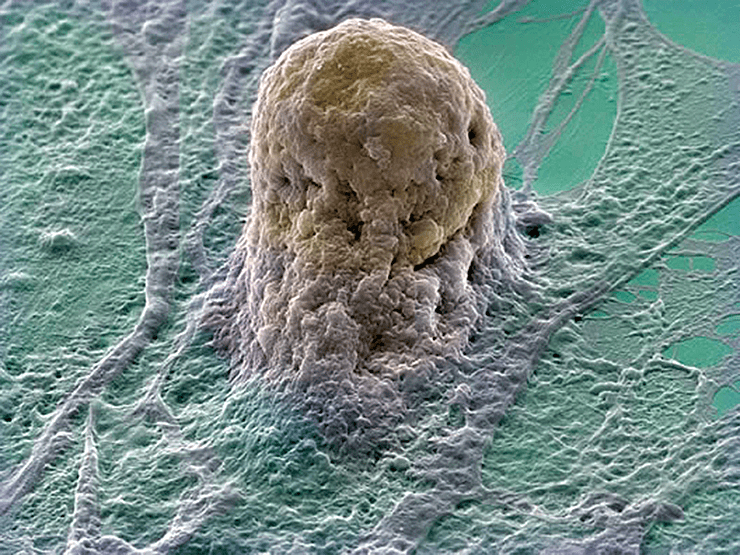
Наиболее важным элементом успеха является наличие необходимого количества функционально активных клеток, способных дифференцироваться, поддерживать соответствующий фенотип и выполнять конкретные биологические функции. Источником клеток могут быть ткани организма и внутренние органы. Возможно использование соответствующих клеток от пациента, нуждающегося в реконструктивной терапии, или от близкого родственника (аутогенных клеток). Могут быть использованы клетки различного происхождения, в том числе первичные (рис. 2) и стволовые клетки (рис. 3).
Рисунок 2. Первичная клетка человека.
библиотека Федерации Киокушинкай г. Южноуральска
Рисунок 3. Стволовая клетка человека.
Первичные клетки — это зрелые клетки определенной ткани, которые могут быть взяты непосредственно от организма-донора (ex vivo) хирургическим путем. Если первичные клетки взяты у определенного организма-донора, и впоследствии необходимо имплантировать эти клетки ему же в качестве реципиента, то вероятность отторжения имплантированной ткани исключается, поскольку присутствует максимально возможная иммунологическая совместимость первичных клеток и реципиента. Однако первичные клетки, как правило, не способны делиться — их потенциал к размножению и росту низок. При культивировании таких клеток in vitro (посредством тканевой инженерии) для некоторых типов клеток возможна дедифференцировка, то есть потеря специфических, индивидуальных свойств. Так, например, хондроциты, вводимые в культуру вне организма, часто продуцируют фиброзный, а не прозрачный хрящ.
Поскольку первичные клетки не способны делиться и могут потерять свои специфичные свойства, возникла необходимость альтернативных источников клеток для развития технологий клеточной инженерии. Таковой альтернативой стали стволовые клетки.
Рисунок 4. Биокерамические изделия из ортофосфатов кальция.
Стволовые клетки — недифференцированные клетки, которые имеют способность к делению, самообновлению и дифференцировке в различные типы специализированных клеток под воздействием конкретных биологических стимулов (см.: «Была клетка простая, стала стволовая» [3]). Стволовые клетки подразделяются на «взрослые» [2] и «эмбриональные». Эмбриональные стволовые клетки образуются из внутренней клеточной массы развития зародыша на ранней стадии, а взрослые — из тканей взрослого организма, пуповины или даже плодных тканей. Однако существует этическая проблема, связанная с неизбежным разрушением человеческого эмбриона при получении эмбриональных стволовых клеток [4]. Поэтому предпочтительнее «добыча» клеток из тканей взрослого организма. Так, например, в 2007 году Шинью Яманакой (Shinya Yamanaka) из Киотского университета Японии были открыты индуцированные плюрипотентные стволовые клетки (ИПСК), получаемые из покровных тканей человека (в основном, из кожи). ИПСК открывают поистине невиданные возможности для регенеративной медицины, хотя, прежде чем они всерьез войдут в медицинскую практику, предстоит решить еще немало проблем (см.: «Снежный ком проблем с плюрипотентностью» [5]).
Для направления организации, поддержания роста и дифференцировки клеток в процессе реконструкции поврежденной ткани необходим специальный носитель клеток — матрикс, представляющий из себя трехмерную сеть, похожую на губку или пемзу (рис. 4). Для их создания применяют биологически инертные синтетические материалы, материалы на основе природных полимеров (хитозан, альгинат, коллаген) и биокомпозиты. Так, например, эквиваленты костной ткани получают путем направленной дифференцировки стволовых клеток костного мозга, пуповинной крови или жировой ткани в остеобласты, которые затем наносят на различные материалы, поддерживающие их деление (например, донорскую кость, коллагеновые матрицы и др.).
«Фирменная» стратегия тканевой инженерии
На сегодняшний день одна из стратегий тканевой инженерии такова:
Матриксы через некоторое время после имплантации в организм хозяина полностью исчезают (в зависимости от скорости роста ткани), а в месте дефекта останется только новая ткань. Также возможно внедрение матрикса с уже частично сформированной новой тканью («биокомпозит»). Безусловно, после имплантации тканеинженерная конструкция должна сохранить свои структуру и функции в течение периода времени, достаточного для восстановления нормально функционирующей ткани в месте дефекта, и интегрироваться с окружающими тканями. Но, к сожалению, идеальные матриксы, удовлетворяющие всем необходимым условиям, пока не созданы.
Кровеносные сосуды из принтера
Перспективные тканеинженерные технологии открыли возможность лабораторного создания живых тканей и органов, но перед созданием сложных органов наука пока бессильна. Однако сравнительно недавно ученые под руководством доктора Гунтера Товара (Gunter Tovar) из Общества Фраунгофера в Германии сделали огромнейший прорыв в сфере тканевой инженерии — они разработали технологию создания кровеносных сосудов. А ведь казалось, что капиллярные структуры создать искусственно невозможно, поскольку они должны быть гибкими, эластичными, малой формы и при этом взаимодействовать с естественными тканями. Как ни странно, но на помощь пришли производственные технологии — метод быстрого прототипирования (другими словами, 3D-печать). Подразумевается, что сложная трехмерная модель (в нашем случае кровеносный сосуд) печатается на трехмерном струйном принтере с использованием специальных «чернил» (рис. 5).
Рисунок 5. Технология «печати» искусственного кровеносного сосуда.
Принтер наносит материал послойно, и в определенных местах слои соединяются химически. Однако заметим, что для мельчайших капилляров трехмерные принтеры пока недостаточно точны. В связи с этим был применен метод многофотонной полимеризации, используемый в полимерной промышленности. Короткие интенсивные лазерные импульсы, обрабатывающие материал, так сильно возбуждают молекулы, что они взаимодействуют друг с другом, соединяясь в длинные цепочки. Таким образом, материал полимеризуется и становится твердым, но эластичным, как естественные материалы. Эти реакции настолько управляемы, что с их помощью можно создавать мельчайшие структуры по трехмерному «чертежу».
А для того, чтобы созданные кровеносные сосуды могли состыковаться с клетками организма, при изготовлении сосудов в них интегрируют модифицированные биологические структуры (например, гепарин) и «якорные» белки. На следующем этапе в системе созданных «трубочек» закрепляются клетки эндотелия (однослойный пласт плоских клеток, выстилающий внутреннюю поверхность кровеносных сосудов) — для того, чтобы компоненты крови не приклеивались к стенкам сосудистой системы, а свободно транспортировались по ней.
Однако прежде чем действительно можно будет имплантировать выращенные в лаборатории органы с собственными кровеносными сосудами, пройдет еще какое-то время.
Давай, Россия, давай вперед!
Без ложной скромности скажем, что и в России создана научная основа для практического применения биомедицинских материалов нового поколения. Интересную разработку предложила молодой учёный из Красноярска Екатерина Игоревна Шишацкая (рис. 6) — растворимый биосовместимый полимер биопластотан [7]. Суть своей разработки она объясняет просто: «в настоящее время практические медики испытывают большой дефицит материалов, способных заменить сегменты человеческого организма. Нам удалось синтезировать уникальный материал, который в состоянии заменить элементы органов и тканей человека». Разработка Екатерины Игоревны найдет применение, прежде всего, в хирургии. «Самое простое — это, например, шовные нити, сделанные из нашего полимера, которые растворяются после того, как зарастает рана, — говорит Шишацкая. — Также можно делать специальные вставки в сосуды — стенты. Это маленькие полые трубки, которые используют, чтобы расширить сосуд. Через некоторое время после операции сосуд восстанавливается, а полимерный заменитель растворяется» [8].
Рисунок 6. Лауреат премии Президента РФ Екатерина Игоревна Шишацкая.
Первый опыт трансплантации тканеинженерной конструкции в клинике
Рисунок 7. Паоло Маккиарини, мастер-класс которого «Клеточные технологии для тканевой инженерии и выращивания органов» прошел в Москве в 2010 году.
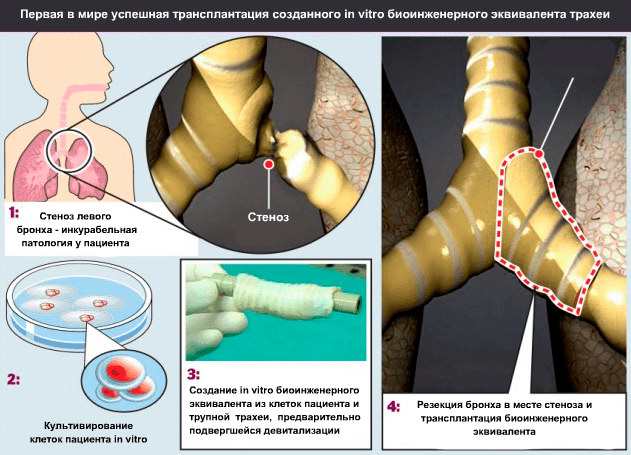
Осенью 2008 года руководитель клиники Университета Барселоны (Испания) и Медицинской школы Ганновера (Германия) профессор Паоло Маккиарини (Paolo Macchiarini; рис. 7) провел первую успешную операцию по трансплантации биоинженерного эквивалента трахеи пациентке со стенозом главного левого бронха на протяжении 3 см (рис. 8) [11].
В качестве матрикса будущего трансплантата был взят сегмент трупной трахеи длиной 7 см. Чтобы получить природную матрицу, по свойствам превосходящую все то, что можно сделать из полимерных трубок, трахею очистили от окружающей соединительной ткани, клеток донора и антигенов гистосовместимости. Очищение заключалось в 25 циклах девитализации с применением 4%-деоксихолата натрия и дезоксирибонуклеазы I (процесс занял 6 недель). После каждого цикла девитализации проводили гистологическое исследование ткани для выявления количества оставшихся ядросодержащих клеток, а также иммуногистохимическое исследование на наличие в ткани антигенов гистосовместимости HLA-ABC, HLA-DR, HLA-DP и HLA-DQ. Благодаря биореактору собственной разработки (рис. 9) ученые на поверхность медленно вращающегося отрезка трахеи равномерно нанесли шприцем суспензию клеток. Затем трансплантат, наполовину погруженный в среду для культивирования, вращался вокруг своей оси с целью попеременного контакта клеток со средой и воздухом.
Рисунок 8. Операция по пересадке пациентке трахеи.
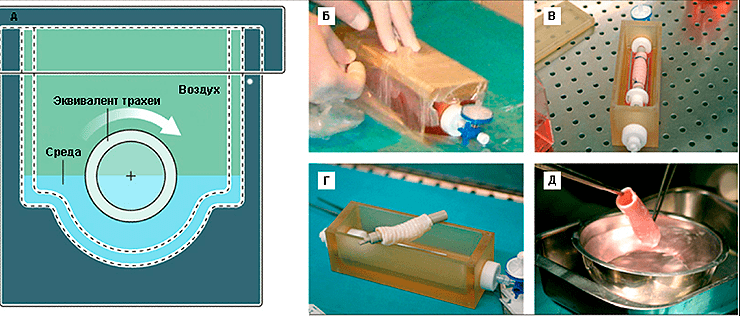
Рисунок 9. Биореактор для создания тканеинженерного эквивалента трахеи. А — схема биореактора, вид с боку. Б — герметизация биореактора. В — биореактор с тканеинженерным эквивалентом трахеи in situ. Г — биореактор после удаления эквивалента трахеи. Д — вид эквивалента трахеи непосредственно перед операцией.
Эквивалент трахеи находился в биореакторе 96 часов; затем его трансплантировали пациентке. При операции был полностью удален главный левый бронх и участок трахеи, к которому он примыкал. В образовавшийся промежуток вшили трансплантат, а некоторое несоответствие диаметров просветов тканеинженерного эквивалента и бронха реципиента было преодолено благодаря эластичности донорской ткани.
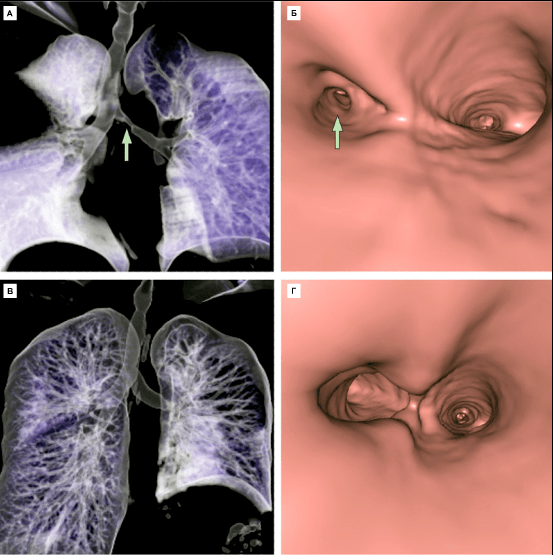
По истечении десяти суток после операции пациентка была выписана из клиники без признаков дыхательной недостаточности и иммунной реакции отторжения трансплантата. По данным компьютерной томографии, с помощью которых была сделана виртуальная 3D реконструкция дыхательных путей, тканеинженерный эквивалент был практически неотличим от собственных бронхов пациентки (рис. 10).
Рисунок 10. Виртуальная 3D-реконструкция дыхательных путей по данным компьютерной томографии и бронхоскопии перед операцией (А, Б) и через 1 месяц и после замены стенозного участка левого главного бронха тканеинженерным эквивалентом (В, Г). Стрелкой указан стеноз.