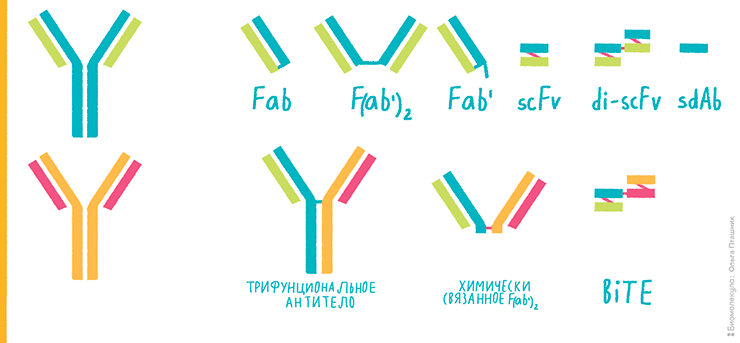Что необходимо для получения поликлональных антител гаптен
Научная электронная библиотека
Морозова В. С., Габрильянц О. А., Мягкова М. А.,
3.1.2. Антитела в ИХМ
В ИХМ используются специфические, или диагностические антитела для распознавания анализируемого антигена. Получают специфические антитела с помощью различных лабораторных животных (кролик, коза, овца, лама, курица, мышь). Для этого животное иммунизируют антигеном, к которому необходимо получить специфичные антитела, либо модифицированным антигеном, дающим наилучший иммунный ответ. Например, низкомолекулярные вещества обладают слабой иммуногенностью (способностью вызывать иммунный ответ), поэтому для иммунизации используют конъюгат аналога определяемого вещества с белком-носителем. Соединение (субстанция, конъюгат), используемый для иммунизации и вызывающий в организме животного иммунный ответ, называется иммуногеном. Часто для усиления иммунного ответа животным вместе и иммуногеном вводят адъювант – специальный реагент, активирующий иммунную систему.
Процесс получения специфических антител в ИХМ является длительным и многостадийным. Основные стадии этого процесса, на каждой из которых происходит подбор условий и оптимизация процесса:
1. Подбор структуры и синтез иммуногена (конъюгата).
2. Иммунизация животного:
● вид иммунизируемого животного;
● форма представления антигена (с адъювантом или без него);
● способ введения антигена реципиенту, доза и сроки.
3. Получение и характеризация сыворотки.
4. Очистка (выделение) антител, либо получение моноклональных Ат.
Одной из основных характеристик антител является их аффинность. По аффинностью понимают силу связывания активного центра молекулы антитела с соответствующей детерминантой антигена.
Другой важной характеристикой антител (антисыворотки) является специфичность. Под специфичностью антител понимают способность антител отличать иммуноген от любого другого антигена (замена).
Специфичность получаемых при иммунизации антител к гаптену прежде всего зависит от структуры конъюгированного антигена гаптен – носитель. Другими словами, используя иммуногены различной структуры, можно получать антитела как высокоспецифичные, т.е. узнающие только определяемое вещество (или вещество и самые близкие к нему по структуре соединения), так и антитела с широким спектром специфичности, способные реагировать с родственными соединениями, например, с метаболитами.
В ИХМ используются 2 типа антител – моноклональные и поликлональные. Поликлональные антитела – антитела, образующиеся в сыворотке крови в разных клонах B-лимфоцитов и связывающиеся с различными антигенными детерминантами (эпитопами) молекулы-мишени (антигена). Смесь антител, выделенную из сыворотки крови, называют поликлональным препаратом. Для получения поликлональных антител используются различные иммунизированные животные (чаще всего кролики).
Использование поликлональных антител имеет два недостатка, существенных для некоторых методов диагностики:
● содержание отдельных антител в поликлональном препарате может варьировать от одной партии к другой;
● поликлональные антитела нельзя применять, если необходимо различить две подобные мишени, например, когда патогенная (мишень) и непатогенная (не-мишень) формы различаются единственной детерминантой; либо когда нужно различить два вещества из одной группы.
Для реализации вышеприведенных целей были разработаны препараты антител, специфичные к одной определённой антигенной детерминанте, то есть препараты моноклональных антител. Моноклональные антитела – антитела, вырабатываемые иммунными клетками, принадлежащими к одному клеточному клону, то есть произошедшими из одной плазматической клетки-предшественницы. Моноклональные Ат характеризуются одной константой аффинности и узкой специфичностью. Все молекулы моноклональных Ат и, соответственно, структуры их центров связывания, являются идентичными.
Моноклональные Ат успешно применяются для создания узкоспецифи ческих тест-систем, способных опреде-лять индивидуальное вещество или узкий круг близкородственных веществ.
Например, с использованием моноклональных Ат разработаны тест-системы для определения героина (не специфичные к морфину, кодеину), экстази (неспецифичные к близким по структуре амфетамину и метамфета-мину).
Получение моноклональных Ат является длительным высокотехнологичным процессом. В данном случае в качестве иммунизируемых животных используются мыши. У иммунизированных мышей, давших хороший иммунный ответ к введенному иммуногену, отбирают лимфоузлы, содержащие большое количество B-лимфоцитов. Их смешивают с линией миеломных (раковых) клеток, которые потеряли способность синтезировать свои собственные антитела, после чего происходит гибридизация – образование гибридных клеток, интенсивно синтезирующих нужное антитело. Затем клоны гибридных клеток тести-руют, отбирают один или несколько клонов, синтезирующих Ат с нужной специфичностью, и клонируют уже отобранный нужный клон. В результате можно наработать большое количество антител заданной специфичности.
В различных вариантах ИХМ могут использоваться как поликлональные, так и моноклональные антитела, в зависимости от поставленной задачи.
Рис. 8. Схема получения моноклональных антител
В гетерогенных форматах ИХМ используется еще один вид антител – антивидовые Ат. Антивидовые антитела (т.е. антитела против вида животных) – это антитела, полученные против антител животного другого вида. Например, есть антитела «овца против кролика», «кролик против мыши», «кролик против человека» и др. Это означает, что нормальными антителами животного, против которого хотят получить антивидовые Ат, иммунизируют животное другого вида. В результате получают иммунный ответ на любые Ат первого вида. Антивидовые Ат удобно использовать для получения универсального меченого реагента – например, конъюгата с ферментом. Такой конъюгат можно использовать для выявления иммунных комплексов с антителами любой специфичности, полученных у данного вида животного. Т.е., например, для ИФА наркотических веществ любого класса можно использовать один меченый ферментом реагент (см. раздел Иммуноферментный анализ).
Что необходимо для получения поликлональных антител гаптен
Иммуноглобулины для внутривенного введения (ВВИГ) являются наиболее часто используемыми препаратами, изготовленными из плазмы крови доноров. Государственный реестр лекарственных средств и Анатомо-терапевтическо-химическая (Anatomical Therapeutic Chemical) классификация (АТХ) относят ВВИГ к фармацевтической группе «медицинские иммунобиологические препараты» (код по АТХ JO6BA02) [3].
Современные ВВИГ получают фракционированием плазмы крови человека. Они представляют собой препараты поликлональных антител класса IgG, синтезированных В-лимфоцитами в ответ на антигенные стимулы, имевшие место на протяжении жизни человека-донора. IgG – гликопротеин с молекулярной массой около 150 кДа, содержащийся в плазме человека в количестве от 7 до 12 г⁄л [12]. Класс IgG классифицируют на четыре подкласса (IgG1, IgG2, IgG3, IgG4), класс IgA – на два подкласса (IgA1, IgA2). Все классы и подклассы составляют девять изотипов, которые присутствуют в норме у всех индивидов. Каждый изотип IgG определяется последовательностью аминокислот константной области тяжелой цепи [2].
Современные препараты ВВИГ подразделяются на три группы [3]:
I. Стандартные препараты – содержат в основном IgG (иммуноглобулин человека нормальный для внутривенного введения).
II. Стандартные специфические (гипериммунные) препараты – содержат в основном IgG, но имеют более высокое содержание противовирусных антител.
III. Обогащенные препараты ВВИГ – содержат антитела классов IgG, IgM, IgA против патогенных вирусов и бактерий.
Эффективность и безопасность медицинского применения ВВИГ определяются дуализмом функции IgG: они могут специ фически взаимодействовать с чужеродными антигенами и одновременно способны вызывать неспецифические эффекты. Такая функциональная дихотомия является следствием особенностей структуры молекулы IgG. Ее вариабельный регион (два Fab-фрагмента) состоит из легкой и частично из тяжелой цепей и специфически взаимодействует с антигенами, что обусловлено меняющейся от белка к белку последовательностью аминокислотных остатков в N-концевой части молекулы. Константный регион (Fc- или кристаллизующийся фрагмент) связывает компонент комплемента 1 (С1) и взаимодействует с Fc-рецепторами макрофагов или нейтрофилов. Активация эффекторной функции Fc-фрагмента антитела происходит после агрегации IgG на поверхности антигена, структура молекулы меняется, что служит сигналом для запуска системы комплемента или индукции опсонизации через фагоцитоз (рис. 1) [2].
Рис. 1. Схематическое строение иммуноглобулина G. Обработка пепсином приводит к расщеплению в участке молекулы на С-концевой стороне, за дисульфидной связью, соединяющей две тяжелые цепи вариабельного участка IgG. В результате образуются один сдвоенный F(аb’)-фрагмент [F(аb’)2] и один Fc-фрагмент. Расщепление IgG папаином происходит в N-концевом участке, непосредственно перед дисульфидной связью, в результате образуются два одинаковых Fab-фрагмента и один Fc-фрагмент [12]
Обобщение опыта клинического применения ВВИГ позволило Е.К. Донюш [3] утверждать, что они обеспечивают:
– увеличение бактерицидной активности сыворотки, стимуляцию фагоцитоза, нейтрализацию некоторых бактериальных токсинов;
– блокаду дифференцировки В-лимфоцитов, продуцирующих антитела;
– предотвращение или блокаду взаимодействия аллергена с IgE, фиксированного на тучной клетке, за счет IgG4 блокирующих антител;
– подавление продукции аллерген-специфических и ауто-антител за счет воздействия антиидиотипических антител;
– снижение продукции и активности провоспалительных цитокинов;
– предупреждение комплемент-зависимого повреждения тканей за счет связывания C3b и C4b компонентов комплемента;
– предохранение от дополнительных вирусных инфекций, обладающих триггерным эффектом при аутоиммунных заболеваниях.
Первыми неспецифическими иммуноглобулинами, использованными в клинической практике, были иммуноглобулины для внутримышечного применения (intramuscular immunoglobulin, IMIG). В России разрешены иммуноглобулин человека нормальный, противоаллергический и 6 специфических иммуноглобулинов, получаемых из плазмы крови иммунизированных людей (противооспенный, антирабический, антистафилококковый, противостолбнячный, против гепатита В и клещевого энцефалита) [1].
Технология приготовления таких иммуноглобулинов разработана в 1940-х гг. Включает этапы получения плазмы крови человека и осаждения из нее IgG этанолом при температуре ниже 0 °С и определенном значении рН [1, 2]. Дополнительной очистки IgG не проводится. Получаемый препарат содержит 70–80 % мономерных IgG и значительные количества IgA и IgM. Вводимые в его составе в организм человека антитела имеют обычный период полураспада, активируют комплемент в присутствии антигена и обладают опсонизирующими свойствами. Применение нормальных иммуноглобулинов оказалось эффективным для профилактики и лечения кори, гепатита А и для предупреждения бактериальных инфекций у детей с наследственной агаммаглобулинемией [3, 12].
Непреодолимыми в рамках данной технологии получения IgG недостатками данных препаратов, стали болезненность в месте введения, низкая скорость поступления антител в системный кровоток и невозможность быстро создавать высокие концентрации антител в ургентных ситуациях. При попытках внутривенного введения у пациентов развивались опасные анафилактоидные реакции и гипотония, что связано с неспецифической активацией комплемента в результате спонтанного образования агрегатов иммуноглобулинов и наличием в препарате следовых количеств протеаз [7]. Поэтому применение препаратов, полученных по данной технологии, ограничено внутримышечным введением.
Попытки повысить безопасность ВВИГ в 1960-х гг. привели к значительному снижению терапевтической эффективности таких препаратов. Сделав правильный вывод о ключевой роли Fc-фрагмента IgG в неспецифической активации комплемента, разработчики предприняли попытки получить ВВИГ либо без такого фрагмента, либо инактивировав его в составе IgG. Для этого IgG расщепляли пепсином, но F(аb’)2 исчезали из кровотока в течение 2 суток; расщепление плазмином приводило к получению моновалентных F(аb’) с низкой нейтрализующей способностью; не удавалось добиться и полной инактивации Fc-фрагмента в составе IgG обработкой алкилирующими и ацетилирующими соединениями. К тому же энзиматические и химические модификации IgG приводили к утрате ими важной физиологической функции – активации комплемента комплексом «антиген-антитело», что необходимо для эффективного лизиса бактерий и вирусов, поглощенных лейкоцитами [12]. В настоящее время выпуск таких препаратов прекращен [2].
Низкая терапевтическая эффективность энзиматических и химических производных IgG вынудила разработчиков ВВИГ в начале 1970-х гг. вернуться к получению интактного IgG. Особую значимость для потребителей препаратов крови в те годы приобрела их вирусная безопасность. Проблемы качества и безопасности ВВИГ на основе интактного IgG решались строгой государственной регламентацией процессов сбора и фракционирования плазмы доноров, контроля производства. Были разработаны национальные и международные документы, регулирующие производство ВВИГ. Система таких мер приведена в табл. 1.
Меры безопасности и контроля качества при производстве ВВИГ [12]
Требования к этапу, критические для обеспечения качества/безопасности ВВИГ
Учреждение по заготовке крови (лицензирование и проверяются национальным регулирующим органом; контроль оборудования, фракционирующего плазму)
Скрининг донор крови и плазмы
Эпидемиологический надзор за населением, идентификация доноров, конфиденциальное анкетирование кандидатов в доноры на наличие факторов риска, анализ их медицинских документов и анкеты
Процедура сбора крови/плазмы
Контроль длительности процедуры забора крови у доноров, смешивания с растворами, предотвращающими коагуляцию, температуры от момента забора крови до ее направления в блок переработки и др. параметров процесса, определенных нормативным документом
Тестирование донора на вирусоносительство перед забором крови
Выявление антител к ВИЧ 1 и 2, вирусам гепатитов А, В и С, HBsAg, парвовируса В19. Исследование должно проводится индивидуально или минипулами, использованные методы должны быть валидированы
Другие тесты у доноров
Тестирование на изоагглютинины к антигенам А, В, D, не использование крови доноров с высокими титрами антител к этим антигенам
Должна использоваться плазма, замороженная в течение 24–72 ч после забора
Замораживание и хранение плазмы
Должен использоваться быстрый способ замораживания плазмы, в процессе ее хранения температура не должна меняться
Во время транспортировки должен вестись постоянный мониторинг температуры ее хранения с записью соответствующим оборудованием. Температура хранения при транспортировке должна быть минус 20 °С или менее
Предприятия по фракционированию плазмы крови (лицензирование и инспекция национальным регулирующим органом)
Используются технологии амплификации нуклеиновых кислот. Определяется нуклеиновая кислота ВИЧ 1 и 2, вирусов гепатитов А, В и С, парвовируса В19
Тестирование производственного пула
Антитела на ВИЧ 1 и 2, вирус гепатита С, HBsAg (обязательно); РНК вируса гепатита С (обязательно в Европе). Исследование нуклеиновых кислот других вирусов – в соответствии с регулирующими документами
Предприятие по фракционированию плазмы
Должно быть разработано, построено и функционировать в соответствии с GMP
Этапы очистки белков и инактивация вирусов
Все процессы должны быть валидированы, все операции должны выполняться в соответствии с утвержденной СОП
Стерилизующая фильтрация и асептическое заполнение упаковок
Лиофильное высушивание (когда необходимо)
Проверка конечного продукта
Все операции должны выполняться в соответствии с утвержденной СОП
Устранение недостатков, характерных для ВВИГ на основе интактного IgG, проводилось путем более тщательной очистки препарата от агрегатов иммуноглобулинов, протеаз, плазмина, плазминогена, активатора прекалликреина, примесей IgA и IgM. Е.К. Донюш [3] выделяет 4 поколения ВВИГ.
Препараты первого поколения – начало 1970-х гг., это энзиматически и химически модифицированные IgG, не имевшие функционального Fc-фрагмента.

Рис. 2. Основные технологии, используемые для получения коммерческого ВВИГ и других компонентов крови из плазмы человека [12]. А, Б, В и Г – технологии, описанные в работах Bertolini J. [8], Teschner W. et al. [17], Terpstra F.G. et al. [16] и Stucki M. еt al. [15] соответственно
Препараты второго поколения – конец 1970-х гг., включали полностью интактную молекулу IgG с активной Fc-функцией и могли применяться не только с целью заместительной, но и иммуномодулирующей терапии. Однако степень их очистки оставалась низкой, они содержали IgA в количествах, вызывающих анафилактические реакции при внутривенном введении, показатель Fc-функции не превышал 70–75 %.
Препараты третьего поколения создавались в середине-конце 1980-х гг., характеризовались высокой чистотой и полной активностью Fc-фрагмента, высокой степенью вирусной безопасности, достигаемой многоступенчатым процессом производства. Выпускались в жидком виде и могли храниться при температуре 2–8 °С.
Препараты четвертого поколения – препараты, удовлетворяющие более жестким требованиям вирусной безопасности и физиологического распределения IgG по подклассам. Разработаны в 1990-х гг. и широко используются в настоящее время. Имеют высокую чистоту IgG с нормальным распределением по подклассам, содержание мономеров и димеров более 95 %. Активность Fc-фрагмента молекулы IgG приближается к 100 %. Препараты получают, используя многоступенчатую схему инактивации вирусов, включающую не менее двух самостоятельных методов (сольвент-детергентная обработка + инкубация при низких значениях рН или пастеризация в сочетании с обработкой полиэтиленгликолем). Препараты выпускают в жидком виде, допускается хранение при комнатной температуре.
В качестве стабилизаторов ВВИГ четвертого поколения используются вещества, безопасные для пациентов с нарушением углеводного обмена и дисфункцией почек, 10 %-е растворы ВВИГ позволяют снизить объемную нагрузку на пациента. Учитывая, что степень очистки IgG в препаратах четвертого поколения приближается к 100 %, их можно считать пределом развития всего направления получения ВВИГ из плазмы крови доноров. Отдельные усовершенствования будут касаться повышения эффективности технологий получения и клинического применения ВВИГ (препарат для подкожного применения, комбинации различных иммуноглобулинов в препарате и др.), их вирусной безопасности, способов очистки от примесей компонентов, которые раньше не считали способными влиять на результат клинического применения (растворимые молекулы CD4, CD8, HLA, следовые количества факторов свертывания крови VIII, IX, X, XI, XII и др.). Основные технологии, используемые в настоящее время для получения ВВИГ и других компонентов крови, показаны на рис. 2.
Получение коммерческого ВВИГ из плазмы человека начинается с отделения от нее так называемого «криопреципитата». Для этого замороженную плазму оттаивают в контролируемых условиях, затем центрифугируют с помощью центрифуг непрерывного действия (при температуре 2–3 °С). Полученный криосупернатант («cryosupernatant» или «cryo-poor plasma») используют для хроматографического выделения белков протромбинового комплекса, антитромбина или C1-ингибитора системы комплемента крови. Для осаждения фибриногена супернатант может подвергаться первой этанольной преципитации (8 % этанола при нейтральном значении pH). Для выделения ВВИГ используют три или четыре этапа осаждения этанолом при низких значения рН (осаждение по Кону) и обработку пепсином в низких концентрациях – при этом получают так называемую фракцию II (fraction II). Для уменьшения антикомплементарной активности ВВИГ и более глубокой очистки от IgА, осаждение этанолом может быть дополнено комбинацией этапов хроматографической очистки на катионных и анионных обменниках (с заменой третьего и четвертого осаждения по Кону). Выход фракции II при таком способе очистки плазмы составляет 3–6 г/л, в зависимости от исходного количества IgG в плазме и использованных методов его преципитации и последующей очистки [12].
Стандартная технология производства позволяет из 1 литра плазмы получить до 2,5 упаковок альбумина 10 %, до 3,5 упаковок иммуноглобулина для внутривенного введения 5 % и около 200–250 МЕ фактора VIII [4].
Основной тенденцией в стабилизации препаратов ВВИГ в настоящее время считается использование высокой концентрации IgG (100 мг/ мл по белку); слабокислой среды (рН 4,5–5,5); включение в лекарственную форму стабилизаторов, таких как полиолы (сорбит), сахара (мальтоза, глюкоза), или аминокислоты (глицин, пролин, изолейцин); отсутствие в препаратах хлорида натрия и сахарозы; осмолярность, близкая к физиологической; отсутствие консервантов и антибиотиков [1, 10].
Требования к свойствам ВВИГ следующие [3]:
– они должны иметь оптимальный спектр антител в соответствии с инфицированностью населения (более 1000 доноров);
– обладать доказанной эффективностью (с помощью контролируемых клинических исследований);
– распределения IgG по подклассам должно соответствовать их содержанию в плазме крови;
– для каждой партии препарата должен быть задекларирован титр антител;
– макроагрегаты должны составлять менее 1 % общего содержания IgG;
– антикомплементарная активность не должна превышать 1,0 СН50/1 мг белка протеина;
– гемолизины не должны содержаться в препарате, титр АВ-антител должен быть менее 1:8;
– активаторы прекалликреина, консерванты, активированные ферменты, токсические вещества не должны присутствовать в препарате;
– если предусмотрено применение у пациентов с врожденным дефицитом IgA; содержание IgA должно быть минимальным;
– высокая противовирусная очистка.
Возможность получения IgG с высокой степенью очистки позволила в последнее десятилетие вернуться к практике их подкожного введения, оказавшейся неудачной в 1940–1950-е гг. из-за большого количества реакций на балластные компоненты иммуноглобулинов, получаемых по технологиям того времени. Иммуноглобулины для подкожного введения (subcutaneous immunoglobulin, SCIG) в основном используются для лечения пациентов с врожденными нарушениями антителообразования (низкий уровень IgA), с повышенным содержанием в сыворотке крови воспалительных маркеров, флебитами, заболеваниями почек и другой патологией, создающей условия для осложнения при введении ВВИГ [6]. В настоящее время за рубежом в клинической практике используется не менее 6 SCIG. Сравнение свойств SCIG с аналогичными свойствами ВВИГ приведено в табл. 2.
Для улучшения проницаемости внеклеточного матрикса для IgG в SCIG добавляется рекомбинантная человеческая гиалуронидаза (rHuPH20), что позволяет сократить расход препарата на курс лечения пациента и добиться более высоких уровней антител в плазме крови [9]. По совокупности свойств и благодаря более простому применению в клинике, SCIG, особенно препараты с rHuPH20, способны вытеснить ВВИГ с рынка фармацевтических препаратов.
Существует серьезное противоречие между требованиями к качеству и эффективности ВВИГ, и его безопасностью. Прежде всего, оно имеет отношение к вирусной безопасности ВВИГ и других препаратов крови. Чтобы ВВИГ был эффективным и соответствовал критериям качества, плазма должна быть получена от как можно большего количества доноров, более 1000. Но чем больше донаций использовано для получения плазмы, тем больше риск того, что она будет инфицирована опасными для человека вирусами. Когда ВВИГ начали применять в клинической практике, считалось, что если IgG фракционируют холодным этанолом, то это обеспечивает вирусную безопасность полученных препаратов. Но эти надежды не оправдались, вирусы, особенно возбудитель гепатита С, продолжали находить в крупных партиях ВВИГ [19].
12 методов в картинках: иммунологические технологии
Авторы
Редакторы
За сотни тысяч лет эволюции иммунная система выработала множество инструментов для сражений с патогенами. Один из главных — антитело: белок, способный необычайно избирательно связываться с характерными кусочками молекул — антигенами. Несколько десятилетий назад биологам удалось «приручить» антитела: научиться производить их к нужным антигенам в любом количестве. И это открыло новую страницу в молекулярной биологии: появились иммунологические методики. Благодаря им мы можем «поймать» в растворе, клетке или срезе ткани почти любые молекулы и понять, сколько их, где именно они находятся и как взаимодействуют с другими молекулами.
12 биологических методов в картинках
Генеральный партнер цикла — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Партнер этой статьи — GE Healthcare
GE Healthcare Life Sciences — производитель высокотехнологичного оборудования, предоставляющий опыт, инновационные решения и широкий спектр услуг для создания крупносерийного биофармацевтического производства, разработки новых лекарств и вакцин, исследования клеток и белков. Обладая всеми биотехнологическими, инженерными и производственными возможностями, мы помогаем нашим заказчикам по всему миру занимать лидирующие позиции на рынке. Глубокая экспертиза, ресурсы, международное присутствие и инновационные разработки GE Healthcare Life Sciences дают возможность нашим клиентам создавать гибкое и экономически эффективное производство биофармпрепаратов.
Одна из главных миссий «Биомолекулы» — докопаться до самых корней. Мы не просто рассказываем, какие новые факты обнаружили исследователи — мы говорим о том, как они их обнаружили, стараемся объяснить принципы биологических методик. Как вытащить ген из одного организма и вставить в другой? Как проследить в огромной клетке за судьбой нескольких крошечных молекул? Как возбудить одну крохотную группу нейронов в огромном мозге?
И вот мы решили рассказать о лабораторных методах более системно, собрать воедино в одной рубрике самые главные, самые современные биологические методики. Чтоб было интереснее и нагляднее, мы густо проиллюстрировали статьи и даже кое-где добавили анимации. Мы хотим, чтобы статьи новой рубрики были интересны и понятны даже случайному прохожему. И с другой стороны — чтобы они были так подробны, что даже профессионал мог бы обнаружить в них что-то новое. Мы собрали методики в 12 больших групп и собираемся сделать на их основе биометодический календарь. Ждите обновлений!
Что такое иммунные методы и почему они имеют к иммунитету самое отдаленное отношение
Распознавать молекулы — это значит связываться с ними куда прочнее, чем с другими молекулами; для измерения прочности связывания существует специальная величина — сродство, или константа диссоциации.
Если говорить совсем точно, то антиген — это не всегда целая молекула, а иногда просто характерный кусочек молекулы.
В какой-то момент ученые поняли, что если антитела умеют специфично узнавать различные антигены, то можно это их свойство использовать в собственных, научных интересах. Так исследователи в своих лабораториях стали получать антитела с заданной специфичностью — очень избирательно узнающие один, определенный, нужный исследователям антиген, и ничего больше. И это стало огромным прорывом.
Представьте, например, что нам нужно исследовать опасный белок, который вырабатывают только раковые клетки и не вырабатывают здоровые. Антитело к этому белку — своеобразная «удочка», которая ловит только его и никого больше. Выловив на антительный «крючок» нехорошую молекулу, мы можем внимательно ее изучить, сделать какие-то важные выводы о ее функционировании, определить концентрацию, попытаться найти слабые места, чтобы в дальнейшем сделать против нее лекарство. Можем обнаружить все производящие ее клетки (в нашем случае — раковые!) — их распространение, количество и так далее.
Можно антитела использовать и для других, более сложных, целей. Например, к ним можно «пришивать» разноцветные флуоресцентные молекулы, а потом «сажать» на соответствующие антигены. В результате эти антигены станут светиться, и мы сможем изучать взаимодействия важных молекул даже в живой клетке. Также использование антител позволяет изучать и такие белки, которые связаны с ДНК и оказывают непосредственное влияние на процесс транскрипции.
Как правило, методы, которые в качестве инструментов используют антитела, несут в своем названии приставку «иммуно-»: иммунопреципитация, иммунохроматография, иммуноферментный анализ (рис. 1). Именно о таких методах мы и расскажем в этой статье.
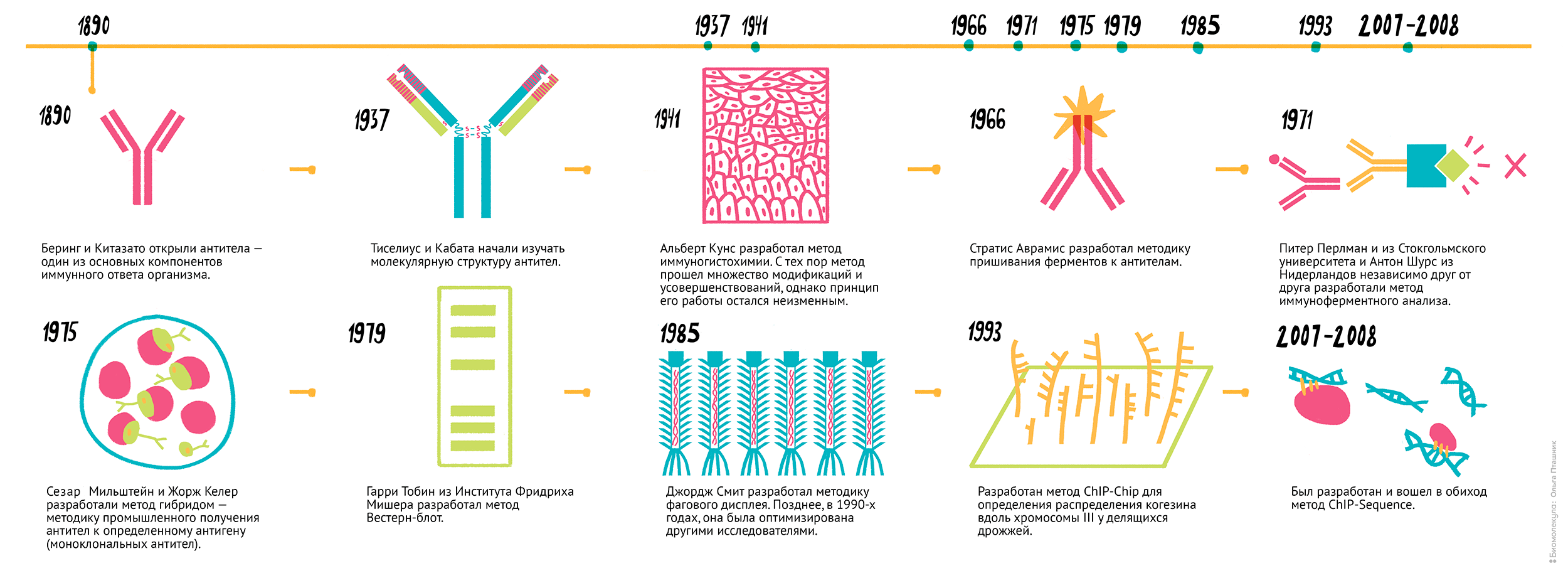
Рисунок 1. Несколько вех на пути развития иммунологических технологий. 1890 г. — Беринг и Китазато открыли антитела — один из основных компонентов иммунного ответа организма. 1937 г. — Тиселиус и Кабата начали изучать молекулярную структуру антител. 1941 г. — Альберт Кунс разработал метод иммуногистохимии [1]. С тех пор метод прошел множество модификаций и усовершенствований, однако принцип его работы остался неизменным. 1966–1969 г. — Стратис Аврамис разработал методику пришивания ферментов к антителам (чуть позже вы поймете, насколько это важно) [2]. 1971 г. — Питер Перлман из Стокгольмского университета и Антон Шурс из Нидерландов независимо друг от друга разработали метод иммуноферментного анализа [3], [4]. 1975 г. — Сезар Мильштейн и Жорж Келер разработали метод гибридом — методику промышленного получения антител к определенному антигену (моноклональных антител). 1979 г. — Гарри Тобин из Института Фридриха Мишера разработал метод вестерн-блоттинг [5]. 1985 г. — Джордж Смит разработал методику фагового дисплея [6]. Позднее, в 1990-х годах, ее оптимизировали другие исследователи. 1999 г. — Разработали метод ChIP-chip для определения распределения когезина вдоль хромосомы III у делящихся дрожжей [7]. 2007–2008 г. — Появился и вошел в обиход метод ChIP-sequence [8].
Чтобы увидеть рисунок в полном размере, нажмите на него.
Действующие лица
В этом разделе мы представляем вам главные молекулы-инструменты, используемые в иммунологических методах.
Антитела
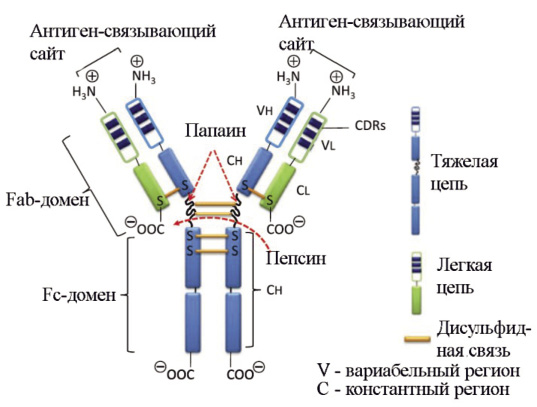
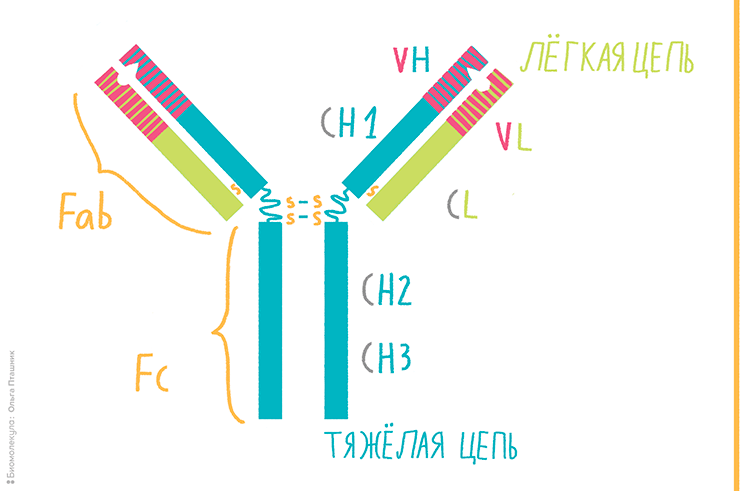
Антитело, или иммуноглобулин, — это крупный белок, состоящий, как правило, из двух тяжелых и двух легких цепей. Тяжелые и легкие цепи, в свою очередь, состоят из вариабельных (V) и константных (С) доменов. Тяжелые цепи содержат один вариабельный (VH) и три константных домена (СH1, СH2, СH3), легкие цепи — один вариабельный (VL) и один константный (СL) домены (рис. 2) [9]. Именно такое строение обеспечивает способность антител узнавать конкретные антигены (это называется вариабельностью антител и осуществляется V-доменами) и взаимодействовать с клетками собственной иммунной системы (эффекторная функция антител; за нее ответственны C-домены).
Рисунок 2. Строение антитела. Вариабельные домены легкой и тяжелой цепей (VH и VL) вместе с ближайшими к ним константными доменами (CH1 и CL1) образуют Fab-фрагменты антител (fragment antigen binding). Именно этими фрагментами антитело «цепляется» за свой антиген. Остальную часть, представленную C-концевыми константными доменами тяжелых цепей, обозначают как Fc-фрагмент (fragment crystallizable), которым антитело может цепляться за Fc-рецепторы, расположенные на некоторых иммунных клетках. На границе Fab и Fc фрагментов располагается гибкая «шарнирная область», благодаря которой фрагменты антитела могут двигаться друг относительно друга; эта область содержит дисульфидные связи, соединяющие тяжелые цепи между собой [9].
Каждое антитело распознает свой антиген и только его. А вот на каждый антиген может быть множество разных антител, которые распознают разные его участки (эпитопы). Разные антитела на один антиген называются поликлональными, то есть, состоящими из множества клонов — популяций антител. А идентичные друг другу, одинаковые молекулы антител называют моноклональными [10]. Поликлональные антитела куда дешевле и проще в производстве, чем моноклональные, но в иммунологических методиках чаще используют моноклональные, потому что они — абсолютно одинаковые молекулы, они гарантированно распознают один и тот же участок одного и того же антигена и потому гораздо стабильнее ведут себя в иммунологических методиках.
Антитело по своей структуре — эдакий Тянитолкай. С одной стороны у него находится связывающая антиген область (Fab-фрагмент), с другой стороны — «хвосты» тяжелых цепей — Fc-фрагмент. И для некоторых задач исследователю выгодно использовать не всё антитело, а лишь какую-то его часть. Так, можно взять Fc-фрагмент и пришить к нему какую-то другую молекулу (например, главный комплекс гистосовместимости (MHC)). Это увеличит время жизни молекулы в сыворотке крови и позволит связываться с рецепторами для антител (Fc-рецепторами). А можно использовать лишь Fab-фрагмент или комбинировать Fab-фрагменты различной специфичности, создавая так называемые биспецифические антитела. Кроме того, можно использовать не весь Fab-фрагмент, а лишь пару вариабельных доменов антитела и также комбинировать их. На рисунке 3 представлены различные варианты таких конструкций.
Рисунок 3. Конструкции на основе комбинаций фрагментов антител. Исходные антитела нарисованы слева сине-зеленым и оранжево-розовым. Пояснения — в тексте.
Их фрагменты и комбинации представляют собой:
Ловушки для антител
Для многих иммунных методик важно надежно закрепить молекулы антител на каком-то твердом носителе. Этих носителей есть несколько типов (рис. 4):
Рисунок 4. Ловушки для антител — носители, на которых можно надежно закрепить антитела. Пояснения — в тексте.
Как увидеть антитела
Антитела — это бесцветные белки, и сами по себе увидеть их в реакционной смеси невозможно. Поэтому если мы что-то пометили антителами, то эти самые антитела нам потом нужно как-то визуализировать, сделать видимыми. Для этого есть несколько остроумных способов (рис. 5).
Фермент и субстрат
Можно пришить к антителу какой-нибудь фермент, катализирующий «цветную» химическую реакцию. Обычно это пероксидаза хрена или щелочная фосфатаза. Теперь, когда мы добавляем в реакционную смесь субстрат используемого фермента (DAB или BCIP/NBT соответственно), то, если там есть антитело с пришитым к нему ферментом, субстрат расщепится, произойдет «цветная» реакция, и по изменению цвета реакционной смеси мы сможем понять, есть ли в этой смеси фермент и сколько его — а значит, и сколько там антител.
Флуоресцентная метка
Можно не заморачиваться с двухэтапной системой «фермент—субстрат» и сразу пришить к антителу цветную флуоресцентную метку [11]. Правда, в этом случае, чтобы увидеть результат, нам придется использовать флуоресцентный микроскоп [12].
Рисунок 5. Визуализация антител. Слева: к антителу пришит фермент, катализирующий «цветную» реакцию (то есть, такую, в которой субстрат меняет цвет). И чтобы узнать, есть ли в смеси эти антитела, достаточно добавить в эту смесь субстрат для данного фермента. Если смесь поменяла цвет — значит, антитела есть. Измерив с помощью спектрофотометра, насколько смесь поменяла цвет, можно определить и количество антител. Справа: антитела с пришитыми к ним флуоресцентными метками можно увидеть с помощью флуоресцентного микроскопа и определить, где эти антитела находятся и в каких количествах. К тому же, это очень красиво.
Иммунологические методы
А теперь, когда мы овладели всей подготовительной информацией, пришло время перейти собственно к иммунологическим методикам.
Иммунопреципитация и коиммунопреципитация
Уникальное свойство антител — возможность налипать только на соответствующие антигены — делает их своего рода «волшебными магнитами» в руках биотехнолога. С помощью антител можно обнаруживать нужные молекулы (как правило, белки) среди ненужных; выделять эти нужные молекулы, очищать их, определять их количество и так далее. Методы, основанные на использовании антител, можно применять и для изучения сложной белковой смеси, или, говоря научным языком, протеома. Рассмотрение иммунных методов мы начнем с одного из самых простых — иммунопреципитации.
Иммунопреципитация — способ, с помощью которого можно выделить из смеси и осадить (precipitate) ту молекулу, которая нас интересует (как правило, это белок; назовем его «Белок Х»).
Рисунок 6. Анимированная схема иммунопреципитации. Пояснения — в тексте.
Последовательность действия при иммунопреципитации такова (рис. 6):
Коиммунопреципитация похожа на иммунопреципитацию, только немного сложней. Она предназначена для выделения антигена вместе с белками, которые с ним связаны. В таких случаях известный антиген называют белком-приманкой (bait protein), а белки, с которыми он взаимодействует, белками-жертвами (prey protein(s)). Жертвами могут быть структурные белки, сигнальные молекулы, кофакторы и т. д.
Анализ белок-белковых взаимодействий со скоростью света!
Метод иммунопреципитации используют также при проведении анализа белков с использованием технологии интерферометрии слоя биомолекул (bio-layer interferometry, BLI), позволяющей не только определять количество целевых макромолекул в растворе, но и анализировать взаимодействие лигандных молекул с молекулами-рецепторами в динамике.
Системы Blitz и Octet, производимые компанией ForteBio (Pall) используют специальный биосенсор, который представляет собой светопроводящую иглу, чей конец покрыт биосовместимым матриксом.
На матриксе иммобилизованы структуры, которые способны специфически связываться с определенными биомолекулами, например, с Fab- или Fc-фрагментами антител человека или мыши, аффинными концевыми структурами белков (GST или олигогистидиновыми), биотинилированными молекулами.
При взаимодействии анализируемых молекул с биосенсором происходит изменение преломления светового пучка внутри биосенсора, которое регистрируется прибором и отображается на мониторе компьютера в виде кривых ассоциации/диссоциации.
Приборы Blitz и Octet применяют как для измерения концентрации специфических белков в диапазоне от 25 нг/мкл до 2 мг/мл, так и для изучения констант ассоциации/диссоциации при изучении межмолекулярных взаимодействий. При этом измерение констант происходит в режиме реального времени, не требуется специфического мечения анализируемых молекул, а образец остается интактным.
Материал предоставлен партнёром — компанией «Диаэм»
Анализ белок-белковых взаимодействий с помощью прибора Biacore TM T200 от компании GE Healthcare
Biacore* T200 — это универсальная система для изучения взаимодействий биомолекул как на ранних этапах исследований, так и во время поиска и разработки новых лекарств. Принцип действия прибора — плазмонный резонанс.
Система Biacore T200 позволяет получить надежные данные о кинетике, сродстве, концентрации, специфичности, селективности и термодинамических свойствах исследуемых взаимодействий в режиме реального времени.
Производительность и универсальность Biacore T200 позволяют использовать ее для широкого спектра приложений:
Компания GE Healthcare поддерживает проведение ежегодной школы по плазмонному резонансу в Москве: «В Москве прошла научная школа „Применение SPR-биосенсоров Biacore в разработках лекарств“» [13].
Материал предоставлен партнёром — компанией «GE Healthcare»
Иммуноферментный анализ
Иммуноферментный анализ (ИФА, по-английски ELISA — enzyme-linked immunosorbent assay) используется для определения, присутствует ли в растворе искомый Белок Х, и если да, то в каких количествах. Этот метод, как и иммунопреципитация, похож на сказку «Репка», но цепочка «тянущих репку» немного длиннее. Схема ИФА показана на рисунке 7:
Рисунок 7. Анимированная схема иммуноферментного анализа. Пояснения — в тексте.
В принципе, можно избавиться от шагов 8 и 9, если сразу к антителам к Белку Х пришить фермент. Но вторичные антитела прекрасны тем, что «размножают» сигнал: на одно первичное антитело может налипнуть сразу несколько вторичных, и тогда можно будет «поймать» даже ничтожно маленькую концентрацию Белка Х. Кроме того, вторичные антитела можно использовать в экспериментах с любыми Белками Х, потому что они специфичны не к ним, а к антителам, «поймавшим» белок.
Другие варианты ИФА
Это был классический вариант ИФА, а теперь рассмотрим его модификации.
Например, для детекции малых количеств антигена в пробе используют так называемый сэндвич-ИФА. В лунки планшета изначально вносят антитела, специфичные к детектируемому антигену, которые прилипают к поверхности пластика. Дальше повторяются уже известные нам шаги: добавляется антиген, а следом за ним еще одни антитела, специфичные к нему. Получается структура, действительно напоминающая сэндвич: антиген оказывается между двумя антителами и «не теряется»: удается определить даже крохотные его количества.
Конкурирующий ИФА — еще одна модификация метода, в которой исследуют концентрацию не антигена, а наоборот, антител. Если вы когда-нибудь сдавали кровь на антитела, то анализ проводили именно этим способом. В этом случае в лунки планшета, в которые нанесен антиген, добавляют исследуемые антитела (например, сыворотка крови) — назовем их «антителами А» — и антитела, помеченные ферментом, специфичным к антигену («антитела Б»). Между антителами разгорается нешуточная борьба за право связаться с антигеном. Соответственно, чем меньше в пробе «антител А», тем больше «антител Б» свяжется с антигеном и тем ярче будет сигнал.
Мультиплексная ИФА, технология xMAP: море информации в капле образца
Многие процессы, происходящие в живых организмах, динамичны и многокомпонентны. Иногда требуется проводить иммуноферментный анализ нескольких десятков белков, дабы определить общую картину. Учитывая количество аналитов и длительность ИФА, такой подход не очень удобен и совсем не быстр.
Для решения таких комплексных задач применяют мультиплексный анализ на основе технологий микрочастиц. Компания Merсk (Millipore) предлагает оборудование и реактивы для мультиплексного анализа с использованием технологии Luminex xMAP, позволяющей одновременно определять до нескольких сотен аналитов в одном образце.
В основе технологии — использование полимерных микросфер, несущих на поверхности зонды к определенным молекулам. Микросферы содержат два флуорофора в различных концентрациях, соотношение которых позволяет создавать разные спектральные характеристики у разных микросфер. Каждый тип частиц несет уникальный вид зонда и обладает уникальным спектром. Этот спектр распознается анализатором Luminex — MAGPIX, Luminex 200, Bio-Plex 3D.
Материал предоставлен партнёром — компанией «Диаэм»
Вестерн-блоттинг
Вестерн-блоттинг (англ. western blot) — еще один метод, в котором с помощью антител ученый может поймать нужный ему белок среди множества других. Последовательность этой «молекулярной рыбалки» очень похожа на ИФА, только «ловля» происходит не в лунке планшета, а на нитроцеллюлозной мембране (см. раздел «Ловушки для антител»). Схема вестерн-блоттинга показана на рисунке 8:
Рисунок 8. Анимированная схема вестерн-блоттинга. Пояснения — в тексте.
При проведении вестерн-блоттинга можно, конечно, использовать все те же ферменты и субстраты, что и в ИФА. Однако чаще удобнее получить сигнал в виде «светящейся» реакции — хемилюминесценции, которую легко детектировать при помощи рентгеновской пленки. Так у исследователя есть возможность попробовать разное время экспозиции пленки и, соответственно, получить серию снимков, из которых позже выбрать нужный с оптимальным соотношением сигнал—фон. К тому же, после проведения эксперимента вторичные антитела можно легко отмыть и использовать мембрану еще раз. Наиболее часто в качестве фермента при вестерн-блоттинге используется пероксидаза хрена, окисляющая люминол в присутствии пероксида водорода.
«Компас-блоттинг»
Любопытна история происхождения названия «вестерн-блоттинг». В середине 70-х годов XX века исследователь Эдвин Саузерн опубликовал новый метод детекции определенных последовательностей ДНК, позже названный в его честь, — саузерн-блоттинг (southern blot, то есть буквально — южный блоттинг). Двумя годами позже придумали похожий метод для детекции РНК, который по аналогии назвали нозерн-блоттингом (northern blot — северный блоттинг). Вестерн-блоттинг (western blot — западный блоттинг; см. видео) как метод детекции белков и истерн-блоттинг (eastern blot — восточный блоттинг) для изучения посттрансляционных модификаций белков появились вслед за ними. Волна увлечения «географическими» названиями на этом не закончилась, и сейчас в биохимии и молекулярной биологии можно найти такие экзотические методы, как саусвестерн-блоттинг (southwestern blot — юго-западный блоттинг) — метод идентификации ДНК-связывающих белков, и другие.
Видео. Производственная драма из лабораторной жизни. Увы! Не всегда миллион сделанных вами вестерн-блотов приведет к всемирной славе и публикации в Cell.
Оборудование «Диаэм» для иммуноблоттинга
Компания «Диаэм» предлагает широкий спектр оборудования и справочных материалов по методике иммуноблоттинга:
Материал предоставлен партнёром — компанией «Диаэм»
Сократите время эксперимента посредством регистрации трех белков на одном блоте с помощью прибора Amersham TM Typhoon TM NIR Plus от GE Healthcare
Один из возможных методов визуализации белков при вестерн-блот-анализе — использование специального прибора-сканера, считывающего флуоресцентный сигнал от меток, пришитых к вторичным антителам. Компания GE Healthcare представляет сканер нового поколения Amersham TM Typhoon TM * NIR Plus, позволяющий визуализировать и делать количественную оценку целых трех сигналов на одном блоте. Такой подход существенно уменьшает время эксперимента, позволяет избежать вариабельности между различными блотами и экономит количество исследуемого образца.
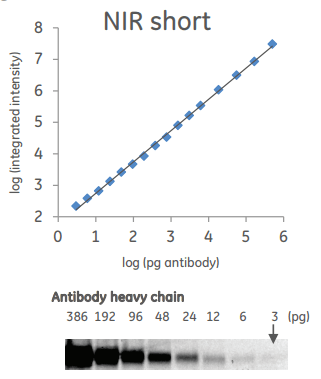
Визуализация двух исследуемых белков и нормализация по общему количеству белка в пробе на приборе Amersham TM Typhoon TM NIR Plus с использованием реагентов Amersham TM QuickStain Reagents.
Количественная оценка содержания детектируемого белка в пробах, анализируемых методом вестерн-блоттинг
Amersham TM Typhoon TM NIR Plus обладает большой площадью сканирования (40×46 см 2 ) и разрешением в 10 мкм, что позволяет использовать его не только для проявки вестерн-блота, но и для сканирования 96-луночных планшетов при считывании результатов иммуноферментного анализа. Таким образом, этот прибор можно использовать при проведении широкого спектра экспериментов.
Типы проб, которые можно анализировать при помощи Amersham TM Typhoon TM NIR Plus:
Базовая комплектация прибора Amersham TM Typhoon TM NIR Plus включает в себя три лазера, однако она может быть доукомплектована еще двумя лазерными модулями, что существенно расширяет ее функциональность. Простой и понятный интерфейс программного обеспечения сделает работу на приборе максимально комфортной и продуктивной.
Материал предоставлен партнёром — компанией «GE Healthcare»
Иммунохроматография
Иммунохроматография — очень остроумный метод обнаружения белка в анализируемой жидкости, в котором сам факт наличия жидкости используется для проведения реакции [15].
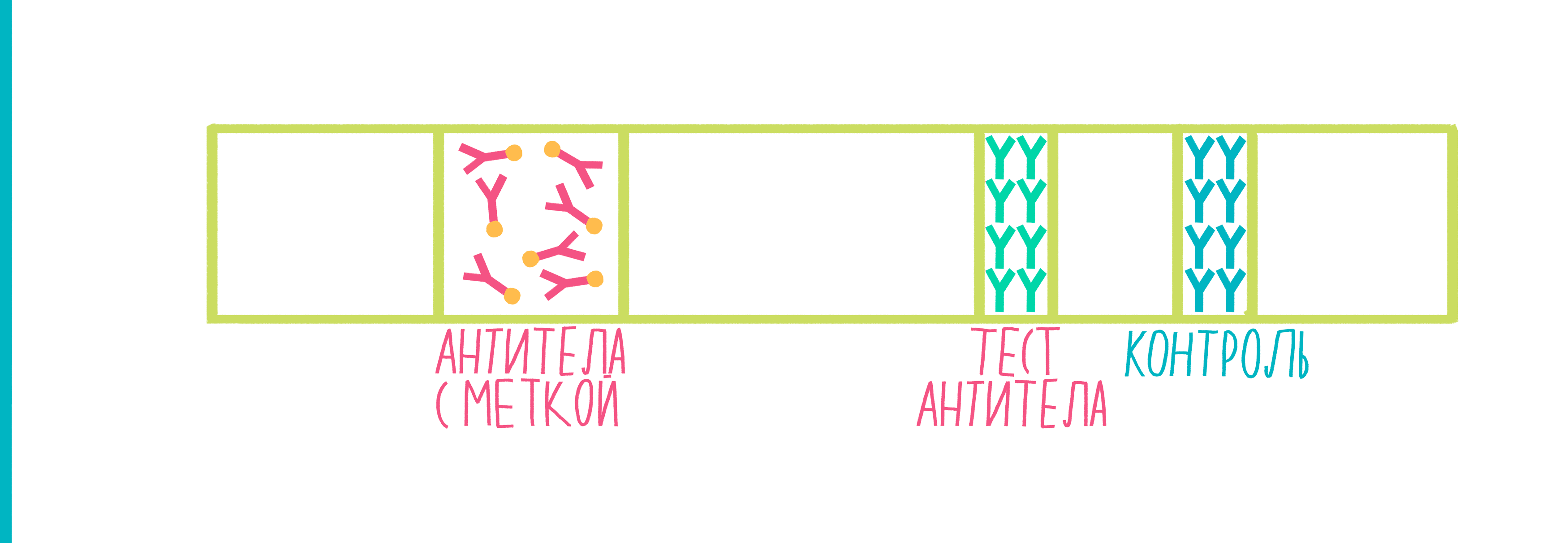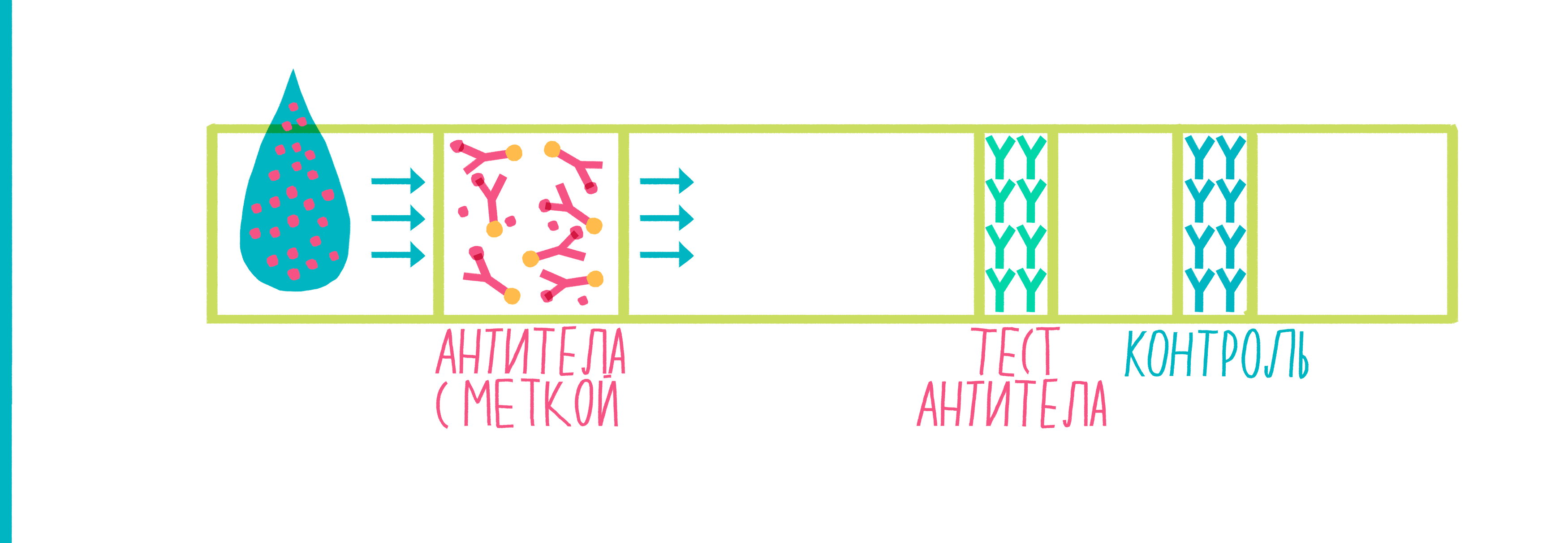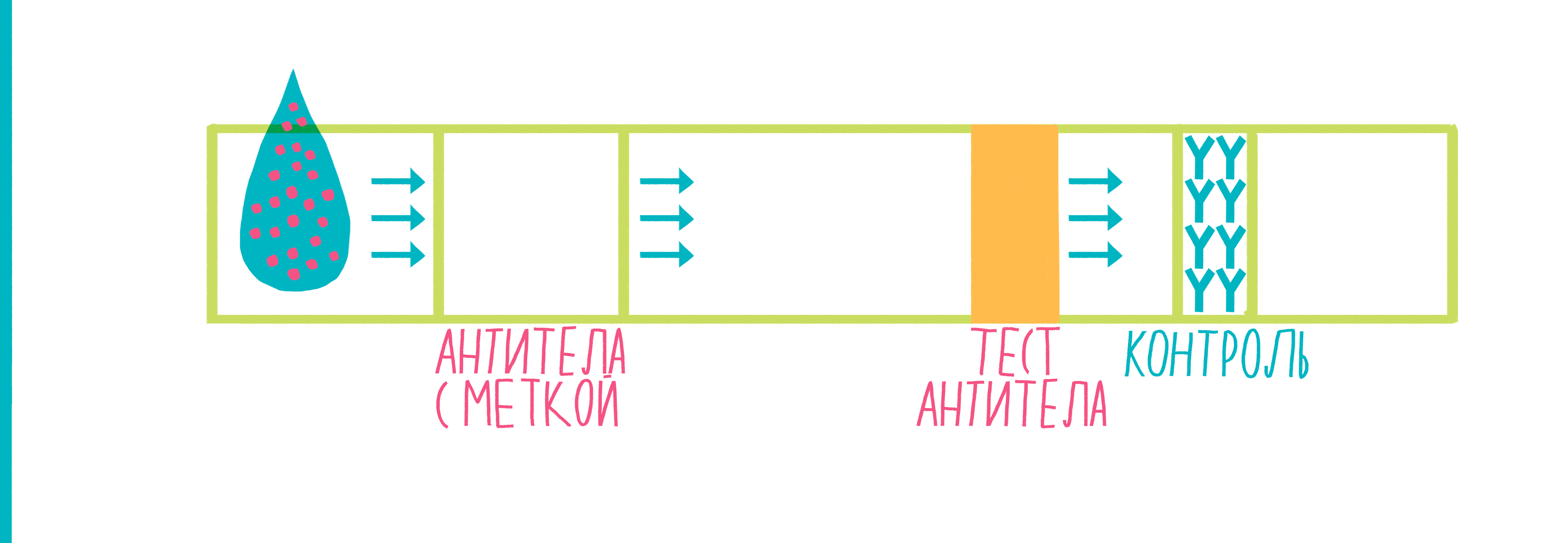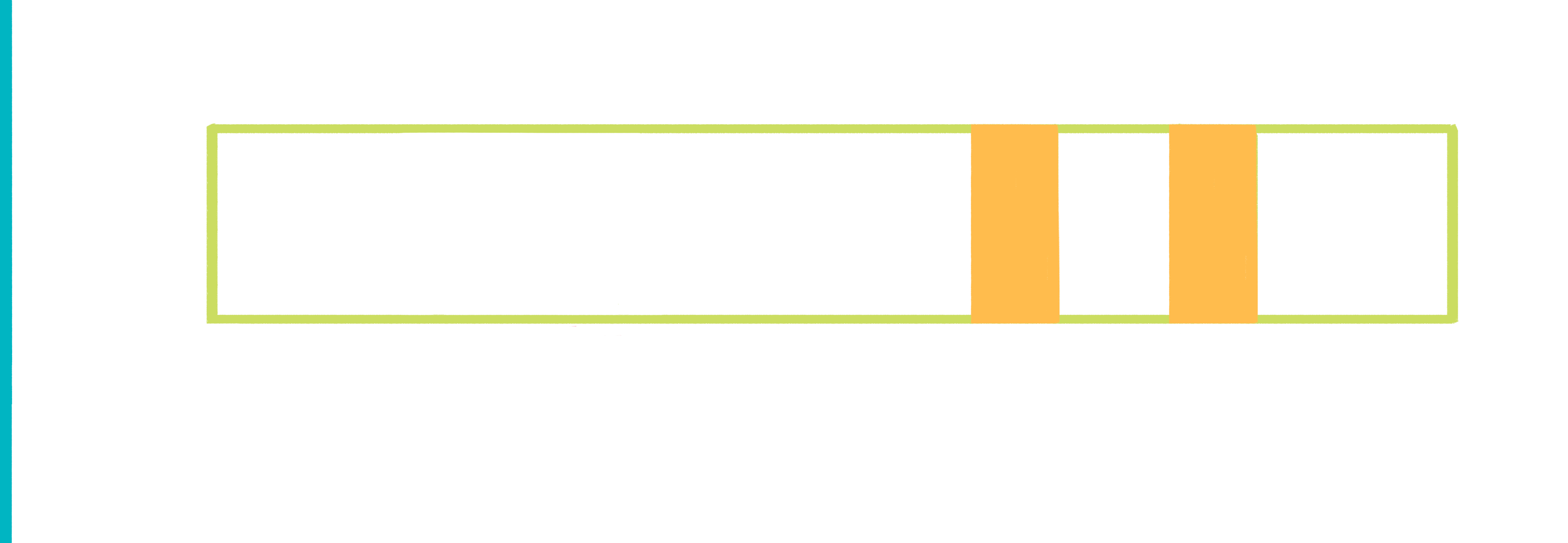
Рисунок 9. Анимированная схема иммунохроматографии. Пояснения — в тексте.
Широко распространенный пример использования иммунохроматографии — тесты для определения беременности. Исследуемой жидкостью в них выступает моча женщины, в которой присутствует белок хорионический гонадотропин человека (ХГЧ) — гормон, вырабатывающийся тканью хориона после имплантации эмбриона в стенку матки. ХГЧ движется по тест-полоске, в результате чего на ней появляются две полосы — это означает, что тест положителен, и женщина беременна.
Иммуногистохимия
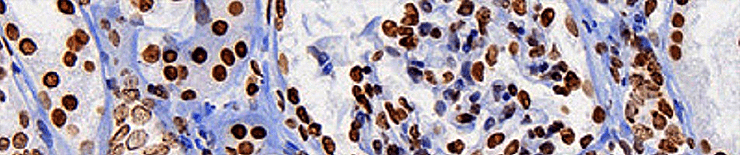
Многие антигены ученым и врачам хотелось бы определять не в сыворотке крови или в других жидкостях, а прямо на исследуемых тканях. Например, на опухолях. Ведь важно знать, экспрессируется ли на онкологической ткани тот или иной антиген: таким образом можно определить тип опухоли, предположить характер ее метастазирования и так далее. Способ, с помощью которого можно «увидеть» антигены на целой ткани, называется иммуногистохимией.
Она очень часто используется в медицинской диагностике, помогая врачам определить принадлежность опухоли к тому или иному типу и подобрать необходимое лечение [16]. Еще ее часто используют, чтобы диагностировать онкологические и иммунологические заболевания. Ученые иммуногистохимией тоже не пренебрегают. Например, с ее помощью можно определить, начался ли в ткани апоптоз, или исследовать нейродегенеративные заболевания [16].
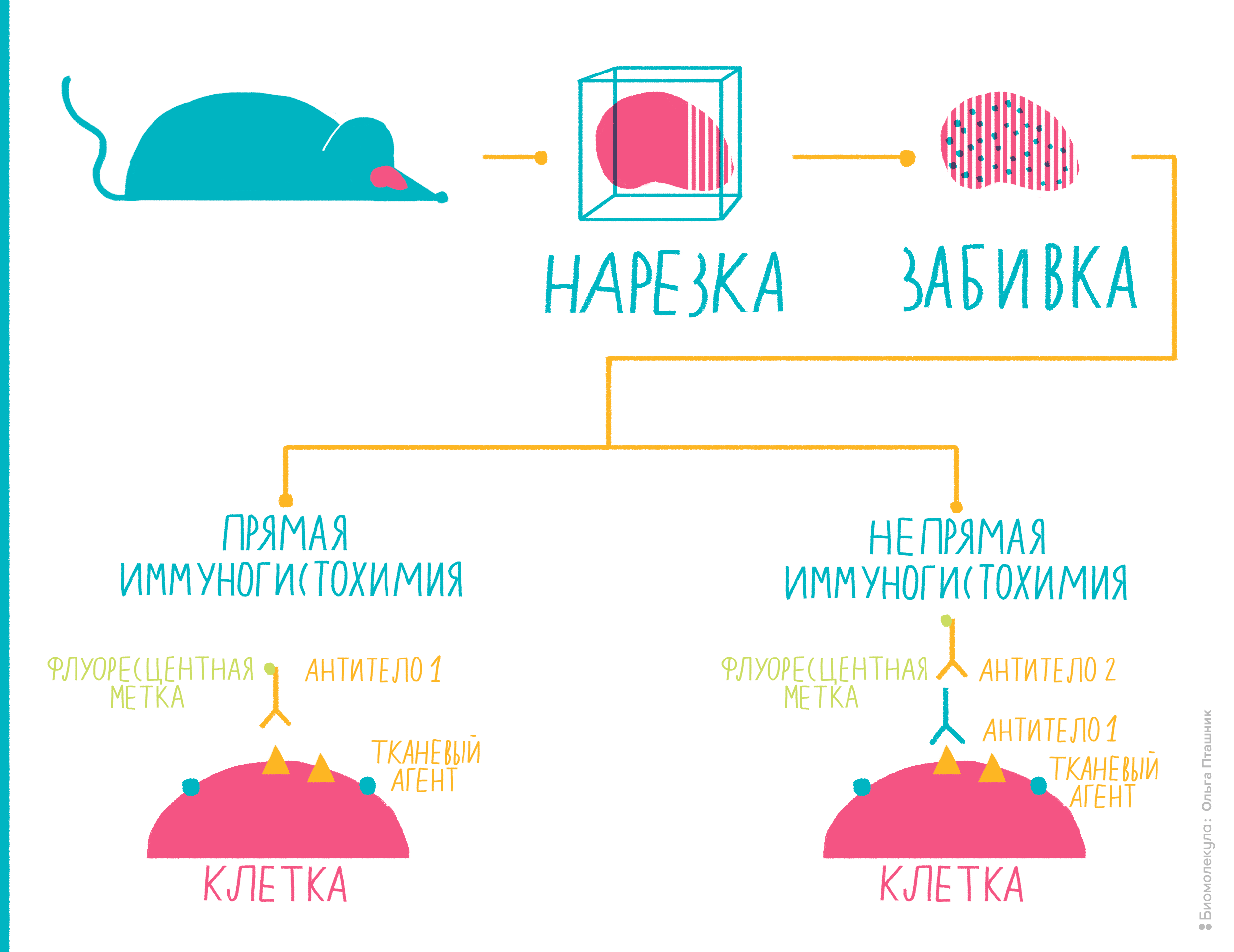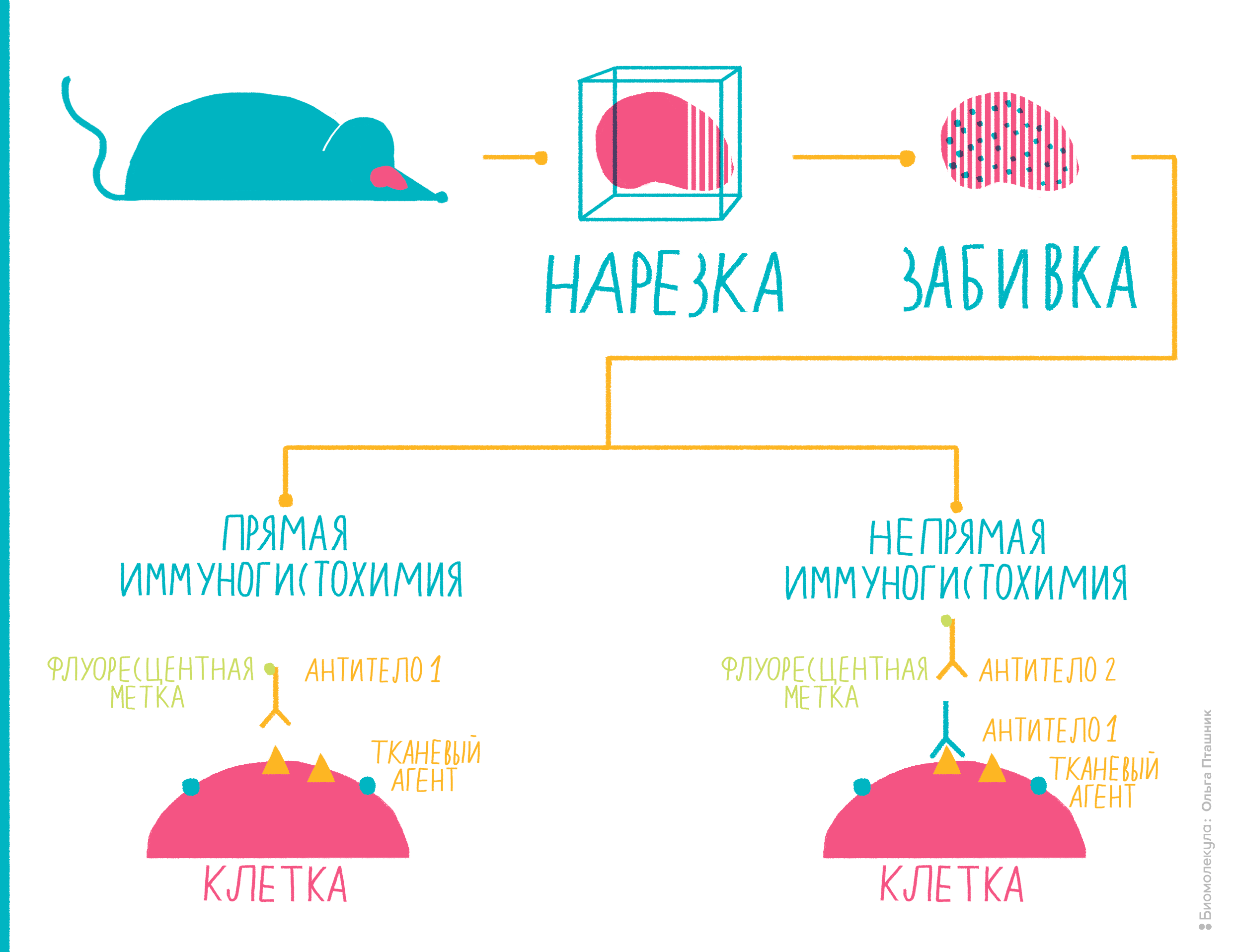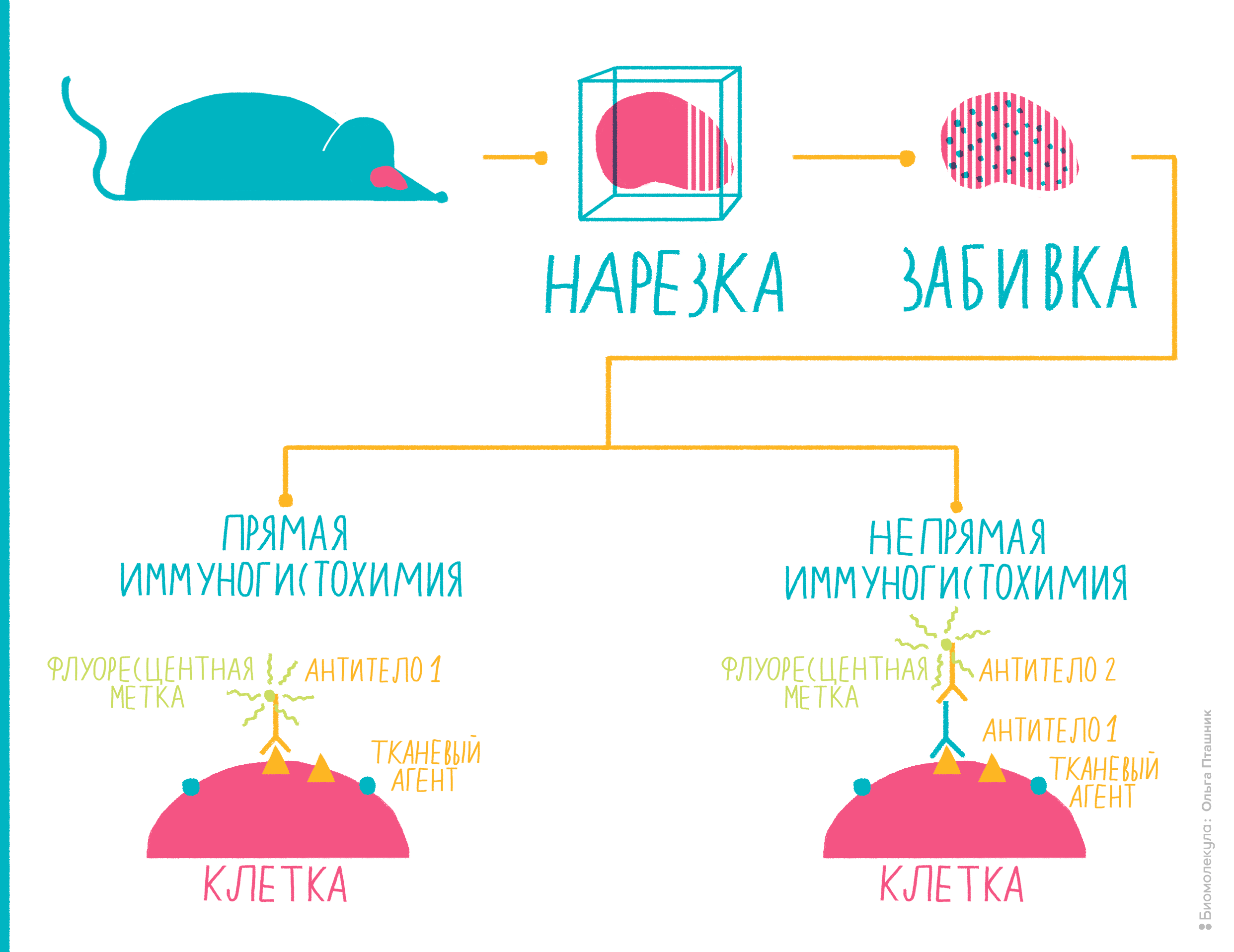
Рисунок 10. Иммуногистохимия представляет собой комбинацию иммунологических, анатомических и биохимических техник исследования. Пояснения — в тексте.
Вот как проводят иммуногистохимию (рис. 10):
Помимо иммуногистохимии существует еще один метод с похожим принципом действия — иммуноцитохимия. Как можно заключить из названия, разница в том, что антигены определяют не на ткани, не на поверхности ее клеток, а непосредственно внутри клеток, то есть, отыскиваются внутриклеточные антигены. Для этого исследуемые клетки надо пермеабилизировать — то есть продырявить им мембрану, — а в остальном методика похожа на иммуногистохимию.
Иммуногисто- и иммуноцитохимия — это очень удобные методы для медицинской диагностики и научных исследований, при помощи которых можно отличать друг от друга ткани по внутри- и внеклеточным антигенам.
Реагенты для иммуно-гистохимического окрашивания:
Справочники, видеолекции, протоколы:
Материал предоставлен партнёром — компанией «Диаэм»
ChIP-сhip и ChIP-seq
Эти методы нужны для выяснения, с какими последовательностями ДНК в клетке связываются исследуемые белки (например, гистоны) [17]. Методы очень похожи, и отличаются только последним этапом. ChIP расшифровывается как chromatin immunoprecipitation, то есть иммунопреципитация хроматина.
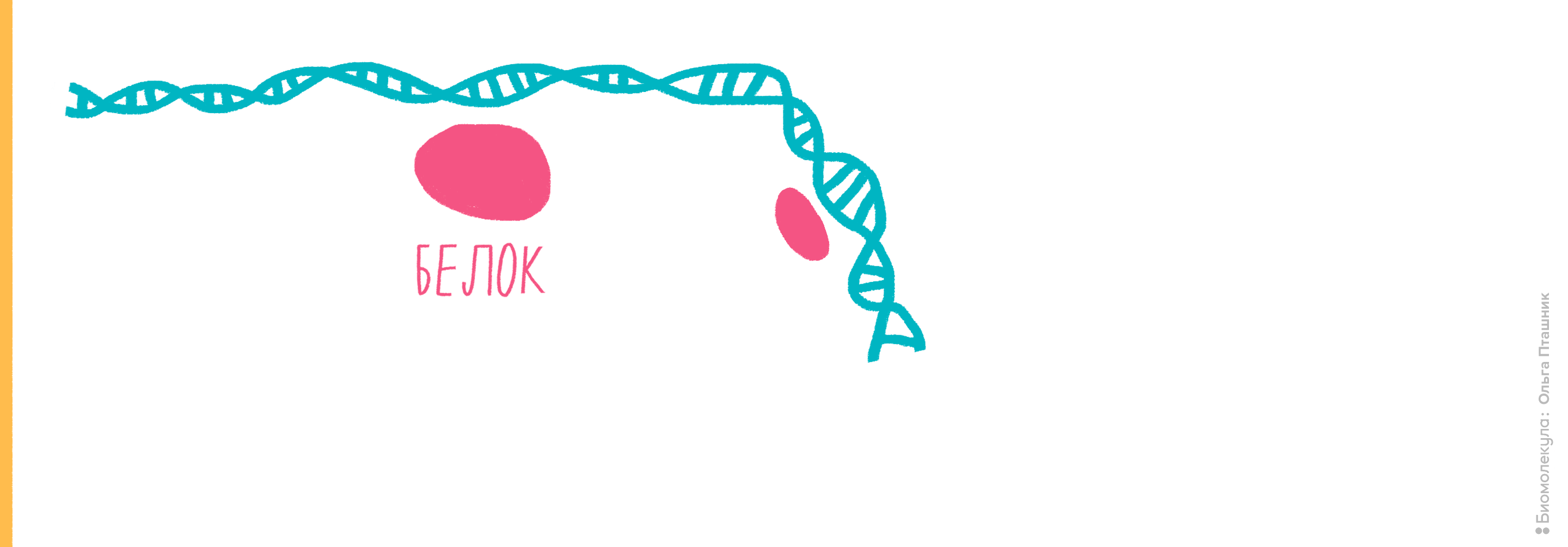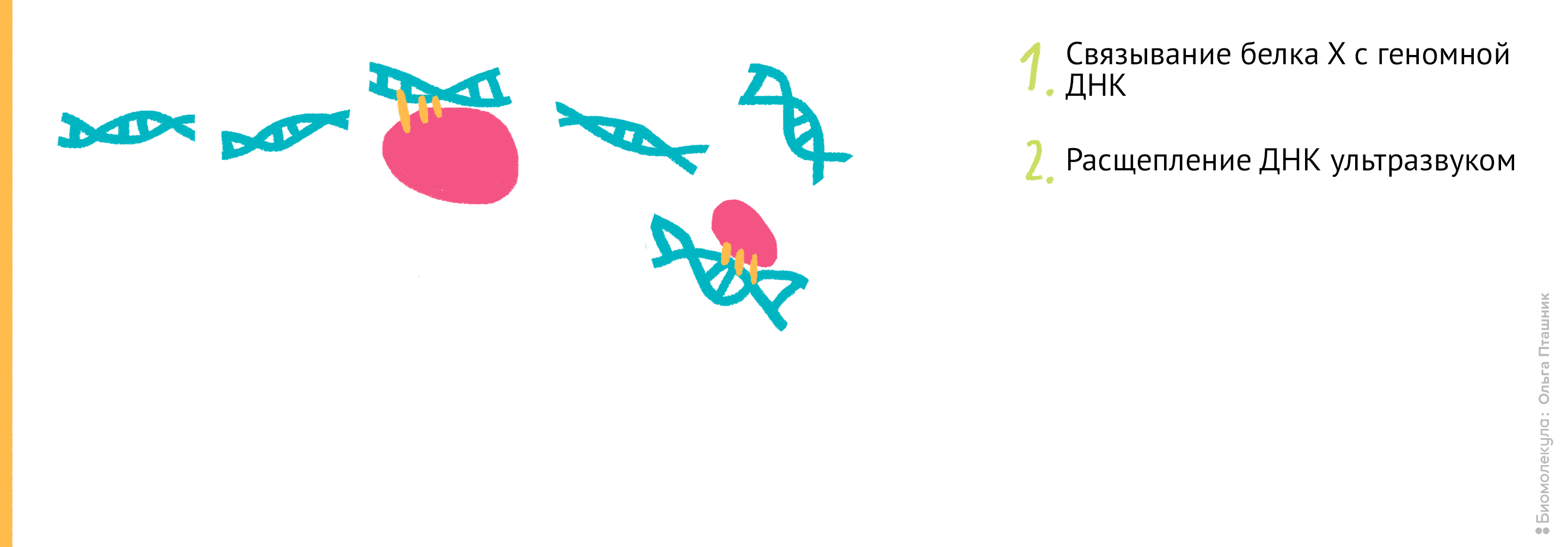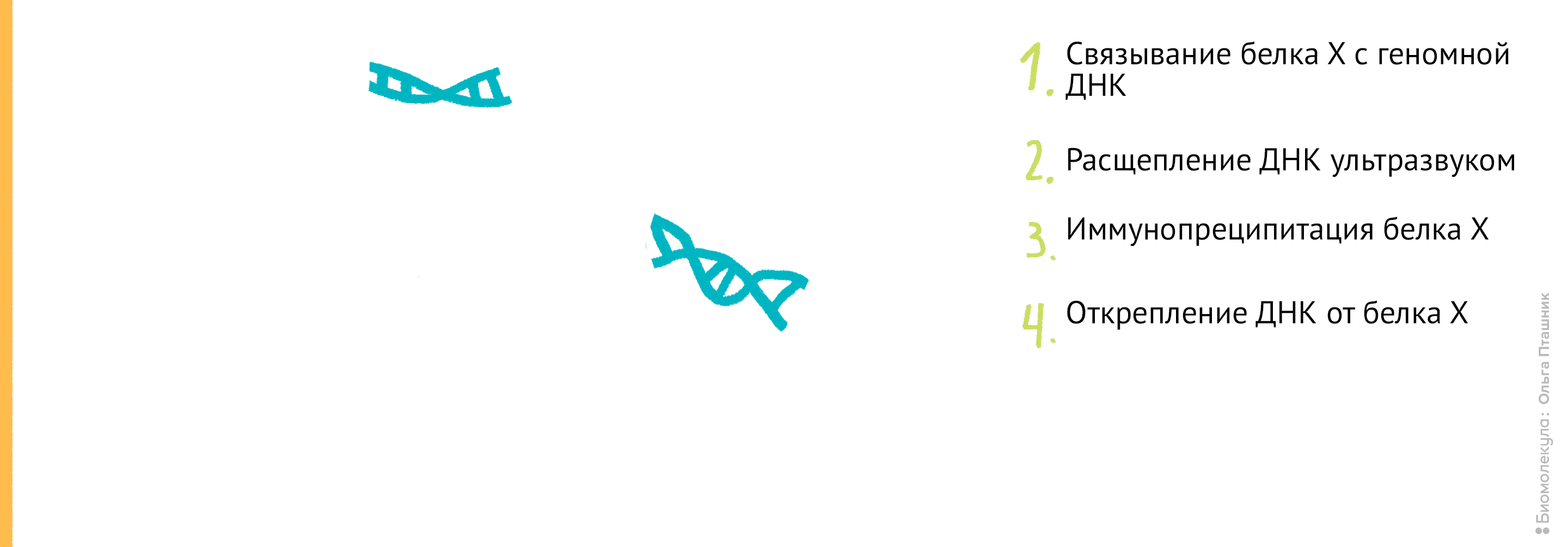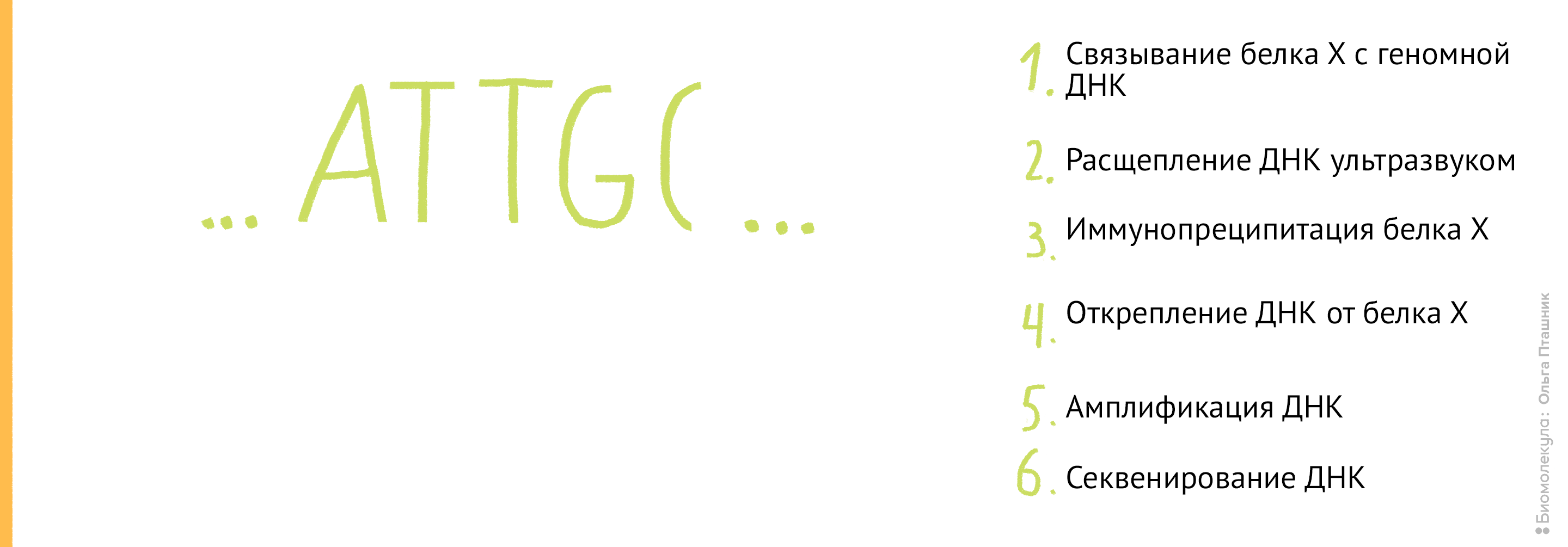
Рисунок 11. Проведение анализа ChIP-seq. Первым делом Белок Х связывается с геномной ДНК, после чего ДНК во всей клетке расщепляется при помощи ультразвука. Для иммунопреципитации искомого белка добавляются полимерные шарики с антителами к нему. После нескольких стадий отмывки белок отсоединяется от ДНК, и ее анализируют при помощи секвенирования для определения нуклеотидной последовательности, которая связывается с Белком Х.
Начнем с методики ChIP-sequencing (СhIP-seq) (рис. 11).
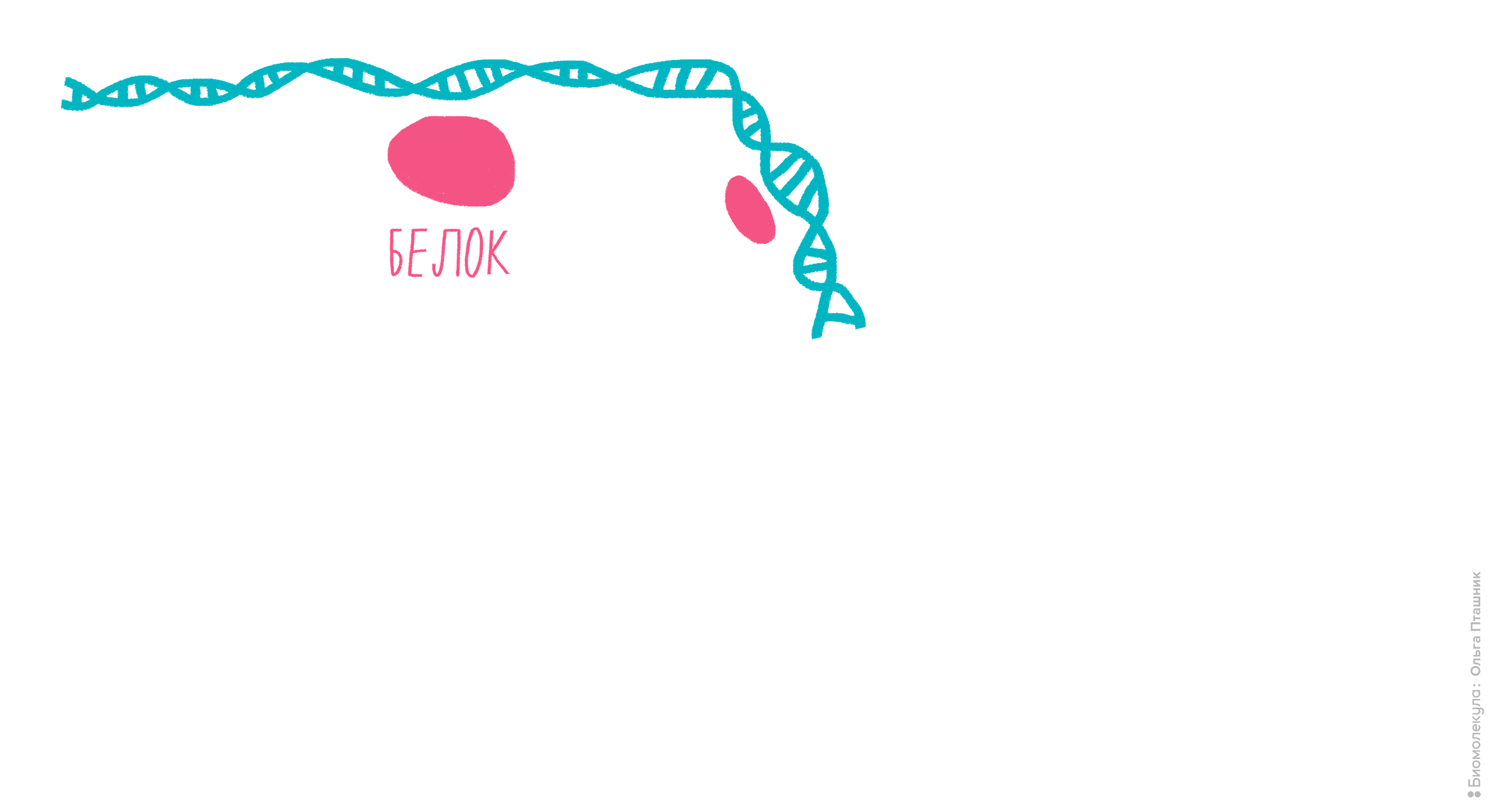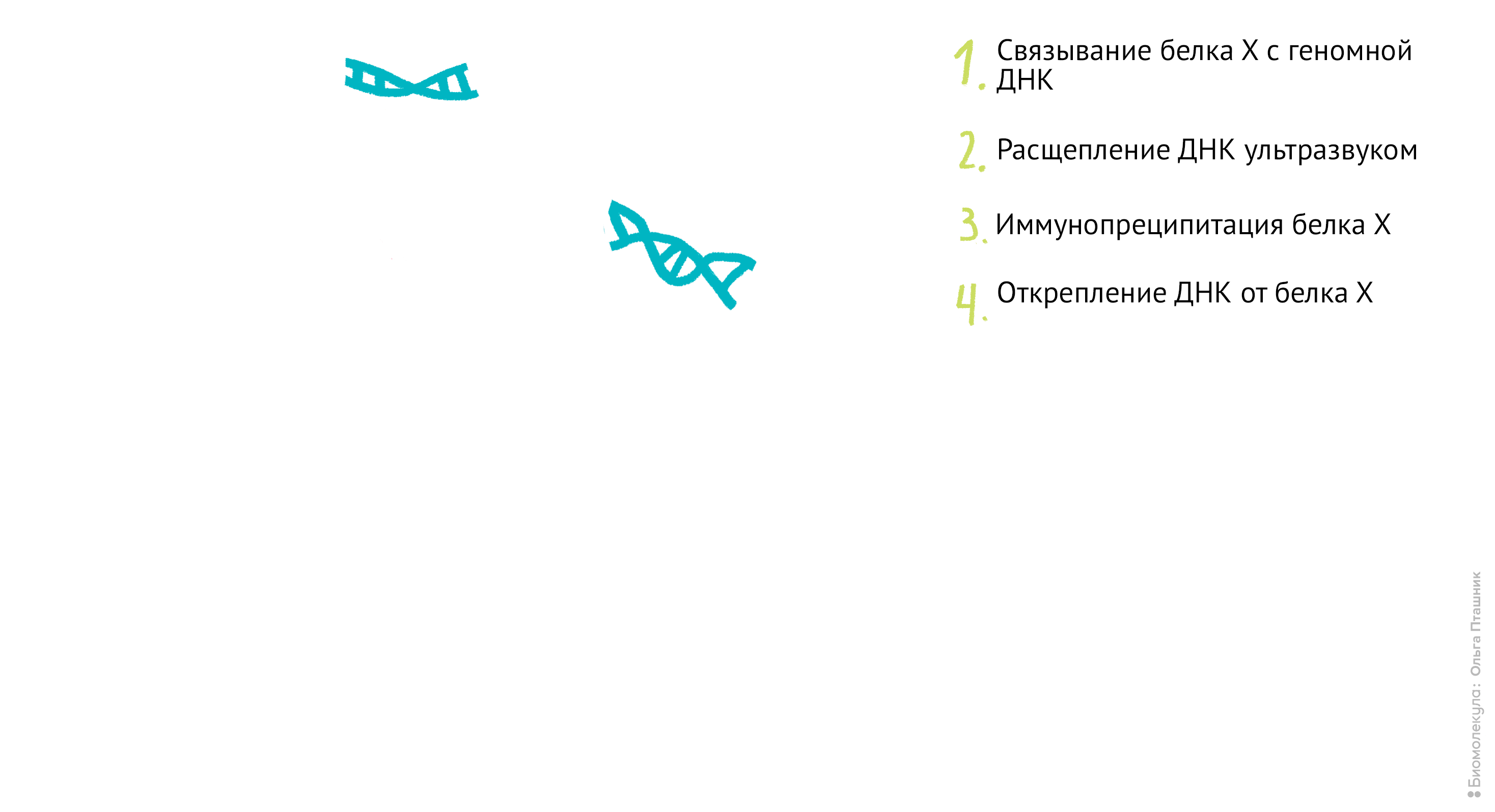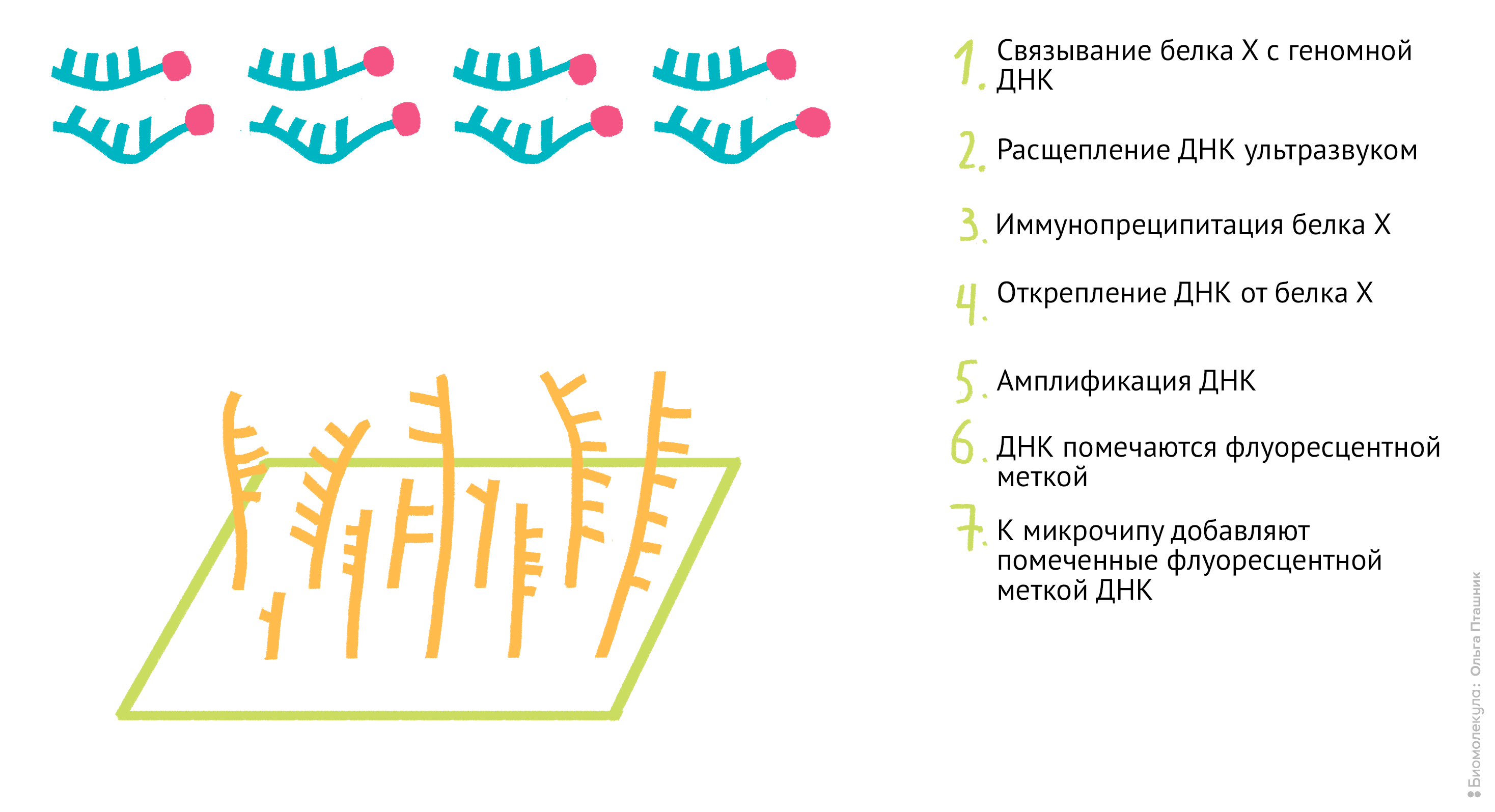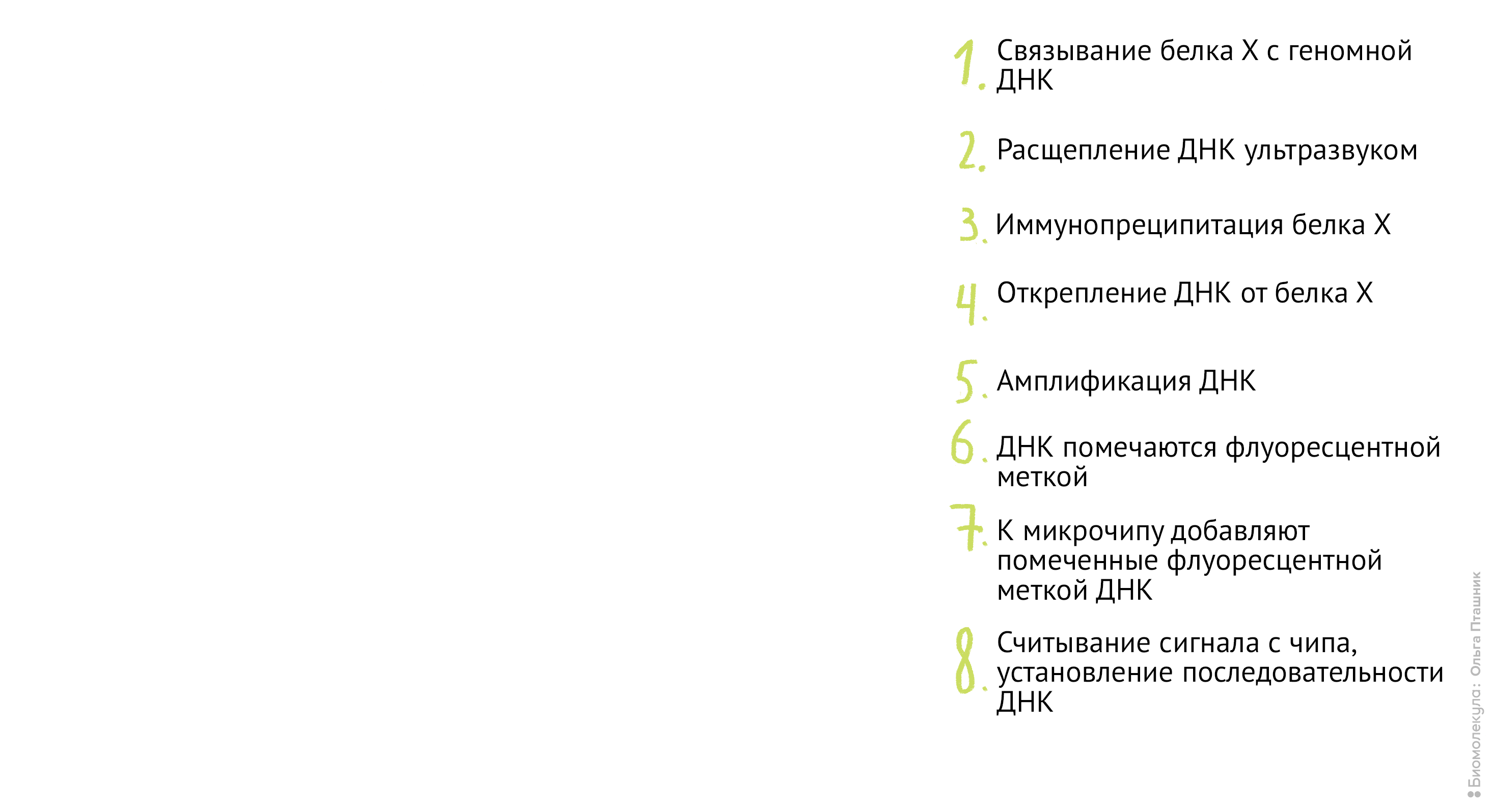
Если же мы используем метод ChIP-chip (иммунопреципитация хроматина на чипе), то последние шаги будут немного другие: анализом последовательности ДНК будут заниматься биоинформатики, а не «мокрые» биологи. А именно (рис. 12):
Рисунок 12. Методика ChiP-chip. Белок Х связывается с геномной ДНК в местах специфического связывания при помощи обратимой реакции с формальдегидом. Затем, по методике коиммунопреципитации (о которой мы уже говорили) геномная ДНК разрезается на кусочки и Белки Х связываются с антителами к ним. После этого геномная ДНК отделяется от Белка Х, амплифицируется, очищается и метится флуоресцентной меткой. Помеченные меткой олигонуклеотиды связываются с олигонуклеотидами на специальном чипе (к нему прикреплены различные олигонуклеотиды и связывание происходит между комплементарными последовательностями). Там, где произошло связывание, возникает флуоресцентный сигнал, который потом анализируется в биоинформатической лаборатории. В результате мы узнаем, с какими именно участками ДНК связывается наш белок.
Фабрика инструментов
А теперь, когда мы узнали, какие волшебные перспективы открывают перед учеными иммунологические методики, поговорим немного о том, как же можно получить главные молекулы для этих методик — антитела.
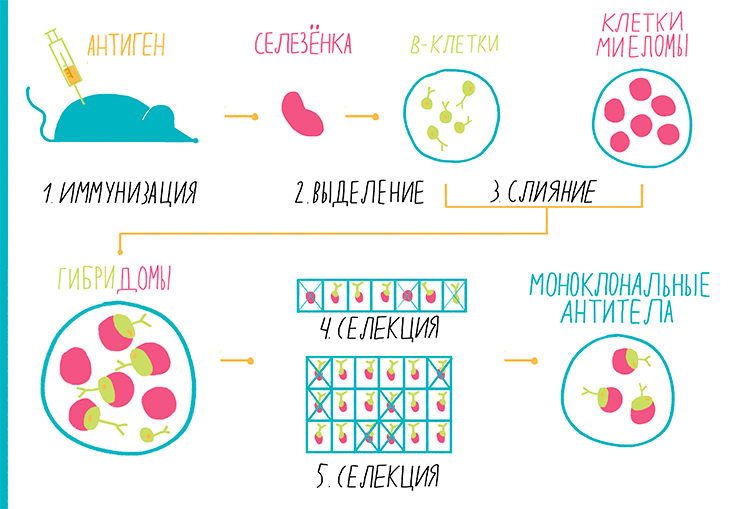
Гибридомная технология
Как мы уже говорили выше, технологичность иммунным методикам обеспечивает применение моноклональных антител (то есть, тех, молекулы которых абсолютно идентичны друг другу). Впервые этого удалось достичь с помощью гибридомной технологии, разработанной Жоржем Келером и Сезаром Мильштейном в 1975 году. За это изобретение в 1984 году они получили Нобелевскую премию по физиологии. Методика заключается в создании бессмертной линии гибридных клеток, производящих нужные антитела: такая линия называется гибридомой. Подробности можно прочесть в статье «Моноклональные антитела» [10]. Производство гибридомы состоит из нескольких этапов (рис. 13):
Рисунок 13. Гибридомная технология. Пояснения — в тексте.
Антитела Abcam — идеальное решение для высокочувствительных иммунных методов анализа
Недостаток поликлональных антител, полученных из животных, в том, что фактически это смесь иммуноглобулинов G (IgG) с различными идиотопами, которые садятся на несколько фрагментов (эпитопов) введенного антигена. В итоге при использовании таких поликлональных антител есть риск получить ложноположительный результат, если в образце присутствует молекула другого белка с аналогичными эпитопами.
Кроме того, животные-продуценты смертны, и есть риск, что, получив хорошие результаты с антителами от одной особи, вы не получите такие же с антителами, полученными от другой.
Преимущество моноклональных (гибридомных) антител в том, что они позволяют получать антитела, которые связываются только с одним эпитопом, и продуценты их практически бессмертны. Наиболее специфичными являются моноклональные антитела, полученные из лимфоцитов кролика.
Антитела RabMAb от Abcam — это годами проверенная технология производства кроличьих моноклональных антител. Преимущества антител RabMAb от Abcam:
Материал предоставлен партнёром — компанией «Диаэм»
Биотехнологическое производство в эукариотических рекомбинантных системах
Этот метод постепенно оттесняет гибридому в деле производства промышленных количеств антител. «Биотехнологическое производство белков», как уже говорилось в соответствующей главе статьи «Методы в картинках: клеточные технологии» [21], это производство белков в «неродной» клетке с помощью специальных генетических инструментов — векторов со вставленными в них участками с генами необходимых антител (о том, как получают эти участки, рассказано ниже, в разделе «Фаговый дисплей»).
Антитела — чрезвычайно капризный материал для биотехнологического производства. Во-первых, они состоят из двух типов цепей, а, во-вторых, содержат в своей структуре несколько дисульфидных связей, которые могут быть построены только специальными ферментами. Поэтому производство полноразмерных антител — дело не из легких, и с ним справится далеко не каждая система экспрессии рекомбинантных белков [22].
95% применяемых в клинике антител производится в клеточных линиях млекопитающих. Это дорого и долго, но другого выхода нет — только клетка млекопитающего хорошо понимает, как именно провести посттрансляционную модификацию полноценного антитела. Есть несколько клеточных линий, которые могут продуцировать антитела. Самые известные из них — клетки яичника китайского хомячка (chinese hamster ovary, CHO) и линия человеческой эмбриональной почки (human embryonic kidney, HEK293). Они пригодны как для получения линии, стабильно экспрессирующей нужное антитело, так и для производящей продукт лишь некоторое время (транзиентная экспрессия).
Для получения антител можно использовать и целые организмы — так называемые трансгенные растения и животные. Растения немного отличаются от животных по паттернам гликозилирования, поэтому для того, чтобы синтезированные растительной клеткой белки тяжелой и легкой цепи антитела правильно соединились между собой, ученым приходится применять множество сложных уловок. Тем не менее использование трансгенных растений существенно снижает себестоимость получения антител, и хотя сейчас на рынок еще не вышло ни одно антитело, произведенное таким образом, несколько из них уже проходят клинические испытания.
Еще одна заманчивая перспектива для производства антител — использование трансгенных животных, ведь в этом случае нужные нам белки можно будет получать, например, в молоке мышей, кроликов, коров и овец или даже в яйцах кур. В настоящее время такой способ получения антител активно исследуется, однако пока он далек от реального использования в медицине [23], [24].
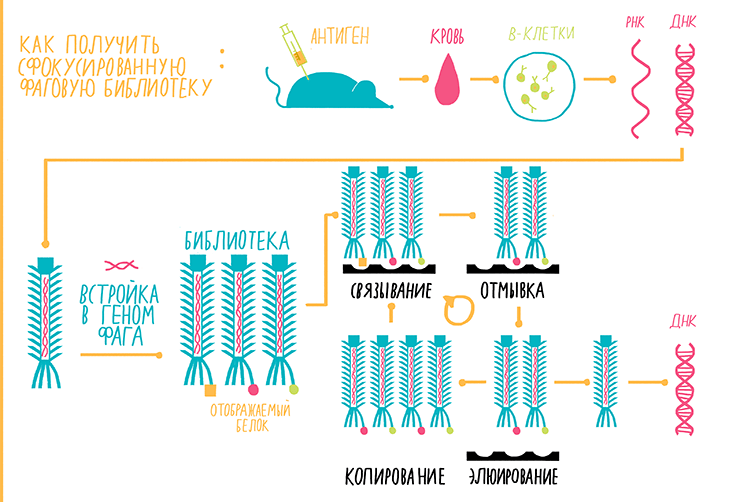
Фаговый дисплей
Фаговый дисплей (рис. 14) — это, строго говоря, не метод наработки антител, а лишь подготовительная методика для их промышленной наработки, а именно, получения векторных вставок для последующего биотехнологического производства (о котором мы только что рассказали).
Метод основан на работе бактериальных вирусов — бактериофагов. Суть метода заключается в следующем факте: если в ген, который отвечает за синтез оболочки бактериофага, встроить ген какого-либо другого белка, то фаг будет «отображать» (display) этот другой белок на своей поверхности. Если фагов с разными генами много, мы получаем фаговую библиотеку. Фаговая библиотека антител представляет собой популяцию бактериофагов, каждый из которых несет на себе либо Fab-фрагмент антитела, либо sdAb. Существует несколько типов фаговых библиотек. Библиотеки на основе ДНК иммунных клеток здоровых людей называются наивными. Сфокусированные библиотеки создают из клеток иммунизированного животного. В этом случае происходит увеличение числа вариантов антител к антигену, которым иммунизируют животных. Синтетические библиотеки состоят из генов, синтезированных искусственно [25].
Рисунок 14. Схема фагового дисплея (на примере сфокусированной библиотеки). Пояснения — в тексте.
Разберем схему фагового дисплея на примере сфокусированной библиотеки (рис. 14).
Несколько слов об аптамерах
Как ни парадоксально это звучит, но иммунные методики не ограничиваются исключительно использованием иммунных молекул — антител. «Ловить» белковые молекулы можно и с помощью особым образом подобранных нуклеиновых кислот — аптамеров.
Открытие структуры и механизмов биосинтеза основных полимеров живых клеток, а вместе с тем — регуляции генной активности, например, в формате оперонов, донесло до людей полезную мысль, что белки могут со значительным сродством связываться с определенными последовательностями нуклеиновых кислот, так называемыми мотивами [26]. Многие белковые факторы транскрипции имеют свою характерную последовательность ДНК, с которой они связываются наиболее прочно, сохраняя слабое сродство к остальным участкам нуклеиновой кислоты. Разумеется, на выяснение того, с какими последовательностями связываются разные регуляторные белки, брошены существенные усилия исследователей, и здесь достигнуты значительные успехи [27].
Наблюдения за механизмами специфичного связывания белками нуклеиновых кислот породили обратную постановку задачи: а нельзя ли подобрать особую последовательность, связывающую произвольный белок? Было бы удобно использовать такую последовательность ДНК или РНК (особенно первую из-за более высокой химической стабильности), которую можно легко амплифицировать путем полимеразной цепной реакции [18] для связывания интересующих нас белковых молекул. Если удастся достичь достаточно избирательного и прочного связывания, то такие последовательности нуклеиновой кислоты, наподобие антител, способны сослужить хорошую службу в методах качественного и количественного анализа белков.
Так разработали метод отбора связующих нуклеиновых молекул, которые назвали аптамерами. Метод назвали SELEX (от английского systematic evolution of ligands by exponential enrichment, то есть систематическая эволюция путем экспоненциального обогащения), или просто селекцией in vitro [28], [29]. Вначале осуществляют синтез фрагментов нуклеиновой кислоты, которые представляют собой набор случайных последовательностей, но каждая по краям содержит постоянные элементы, необходимые впоследствии для амплификации. Интересующий нас белок-мишень укрепляют на твердом носителе и дают получившейся смеси полинуклеотидов связываться с этой мишенью. Носитель тщательно промывают, а то, что осталось связанным на белке, амплифицируют путем ПЦР. По идее, ненужное мы отмыли, а оставшееся — это именно то, что хорошо связывается с нашим белком. Но для хороших аналитических характеристик связующего вещества ему еще нужно эволюционировать в пробирке. Циклы SELEX повторяют много раз, в ходе чего смесь обогащается наиболее прочно связывающейся последовательностью нуклеиновой кислоты. Ее можно отсеквенировать и затем синтезировать в любых нужных количествах.
Все здорово, правда? Насколько лучше по сравнению с трудностями получения антител! Однако в разработке аптамеров, конечно, имеется значительное количество подводных камней. Один из самых главных — химические свойства нуклеиновой кислоты. Поскольку это кислота, связываться она может только со щелочными белками. Если белок кислый или даже нейтральный, аптамер к нему подобрать, скорее всего, не удастся. Однако изощренный научный подход частично решает и эту проблему. Созданы аптамеры из нуклеиновой кислоты, содержащей не естественные азотистые основания, а химически модифицированные. Так одному из биотехнологических стартапов удалось получить хорошие аптамеры к более чем тысяче белков человека. Эти агенты назвали специальным словом — somamer. На основе сомамеров созданы чипы для полуколичественного анализа примерно тысячи белков плазмы крови [30]. Их в последние годы часто используют в исследованиях для поиска биомаркеров. Чипы на основе сомамеров — хорошая альтернатива протеомике, использующей масс-спектрометрию.
Итак, аптамеры могут в ряде случаев заменять антитела. Их легче синтезировать, а детектирование связанных белков или даже других молекул осуществляется за счет амплификации связавшегося материала. Аптамеры, как и антитела, рассматривают в качестве лекарственных средств. Дошло до того, что одно из лекарств на основе аптамера, пегаптаниб, уже вышло на рынок и используется для лечения атрофии сетчатки глаза.
Заключение
Иммунные методы — это незаменимая в современном мире группа методик, которая позволяет «поймать» практически любую сложную молекулу, определить ее количество, местоположение в клетке или ткани и даже иногда «поймать» те молекулы, с которыми наша молекула связывается. Кроме того, эти методики очень широко представлены в повседневной жизни: от анализа крови на антитела до теста на беременность.
Календарь
На основе статей спецпроекта мы решили сделать календарь «12 методов биологии» на 2019 год. Эта статья представляет ноябрь.