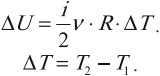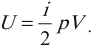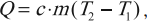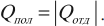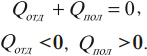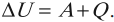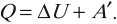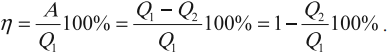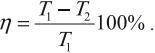Что не является началом термодинамики
Три начала термодинамики
Аналогами трех законов Ньютона в механике, являются три начала в термодинамике, которые связывают понятия «тепло» и «работа»:
Общее (нулевое) начало термодинамики
Общее (нулевое) начало термодинамики гласит, что два тела находятся в состоянии теплового равновесия, если они могут передавать друг другу теплоту, но этого не происходит.
Нетрудно догадаться, что два тела не передают друг другу теплоту в том случае, если их температуры равны.
Например, если измерить температуру человеческого тела при помощи термометра (в конце измерения температура человека и температура градусника будут равны), а затем, этим же термометром измерить температуру воды в ванной, и при этом окажется, что обе температуры совпадают (наблюдается тепловое равновесие человека с термометром и термометра с водой), можно говорить о том, что человек находится в тепловом равновесии с водой в ванной.
Из сказанного выше, можно сформулировать нулевое начало термодинамики следующим образом: два тела, находящиеся в тепловом равновесии с третьим, также находятся в тепловом равновесии между собой.
С физической точки зрения нулевое начало термодинамики устанавливает точку отсчета, поскольку, между двумя телами, которые имеют одинаковую температуру, тепловой поток отсутствует.
Другими словами, можно сказать, что температура есть не что иное, как индикатор теплового равновесия.
Первое начало термодинамики
Первое начало термодинамики есть закон сохранения тепловой энергии, утверждающий, что энергия никуда не девается бесследно.
Система может либо поглощать, либо выделять тепловую энергию Q, при этом система выполняет над окружающими телами работу W (или окружающие тела выполняют работу над системой), при этом внутренняя энергия системы, которая имела начальное значение Uнач, будет равна Uкон:
Тепловая энергия, работа и внутренняя энергия определяют общую энергию системы, которая является постоянной величиной. Если системе передать (забрать) некое кол-во тепловой энергии Q, при отсутствии работы кол-во внутренней энергии системы U, увеличится (уменьшится) на Q.
Второе начало термодинамики
Третье начало термодинамики
Третье начало термодинамики гласит, что любой процесс, состоящий из конечного числа этапов, не позволит достичь температуры абсолютного нуля (хотя к нему можно существенно приблизиться).
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Термодинамика
Термодинамика – это раздел физики, изучающий тепловые свойства макроскопических тел и систем тел, находящихся в состоянии теплового равновесия, на основе закона сохранения энергии, без учета внутреннего строения тел, составляющих систему.
Термодинамика не рассматривает микроскопические величины – размеры атомов и молекул, их массы и количество.
Законы термодинамики устанавливают связи между непосредственно наблюдаемыми физическими величинами, характеризующими состояние системы, такими как давление \( p \) , объем \( V \) , температура \( T \) .
Внутренняя энергия
Внутренняя энергия – это физическая величина, равная сумме кинетической энергии теплового движения частиц тела и потенциальной энергии их взаимодействия друг с другом.
Обозначение – \( U \) , в СИ единица измерения – Джоуль (Дж).
В термодинамике внутренняя энергия зависит от температуры и объема тела.
Внутренняя энергия тел зависит от их температуры, массы и агрегатного состояния. С ростом температуры внутренняя энергия увеличивается. Наибольшая внутренняя энергия у вещества в газообразном состоянии, наименьшая – в твердом.
Внутренняя энергия идеального газа представляет собой только кинетическую энергию теплового движения его частиц; потенциальная энергия взаимодействия частиц равна нулю.
Внутренняя энергия идеального газа прямо пропорциональна его температуре, а от объема не зависит (молекулы идеального газа не взаимодействуют друг с другом):
где \( i \) – коэффициент, равный числу степеней свободы молекулы, \( \nu \) – количество вещества, \( R \) – универсальная газовая постоянная, \( T \) – абсолютная температура.
Число степеней свободы равно числу возможных движений частицы.
Важно!
Для одноатомных газов коэффициент \( i \) = 3, для двухатомных газов \( i \) = 5.
На практике часто важно уметь находить изменение внутренней энергии:
При решении задач можно записать формулу для вычисления внутренней энергии, используя уравнение Менделеева–Клапейрона:
где \( p \) – давление, \( V \) – объем газа.
Внутренняя энергия реальных газов зависит как от температуры, так и от объема.
Изменить внутреннюю энергию можно за счет изменения температуры (при теплопередаче) и за счет изменения давления и объема (при совершении работы).
Тепловое равновесие
Тепловое равновесие – это состояние системы, при котором все ее макроскопические параметры остаются неизменными сколь угодно долго.
Величины, характеризующие состояние макроскопических тел без учета их молекулярного строения, называются макроскопическими параметрами. К ним относятся давление и температура, объем, масса, концентрация отдельных компонентов смеси газа и др. В состоянии теплового равновесия отсутствует теплообмен с окружающими телами, отсутствуют переходы вещества из одного агрегатного состояния в другое, не меняются температура, давление, объем.
Любая термодинамическая система переходит самопроизвольно в состояние теплового равновесия. Каждому состоянию теплового равновесия, в которых может находиться термодинамическая система, соответствует определенная температура.
Важно!
В состоянии теплового равновесия объем, давление могут быть различными в разных частях термодинамической системы, и только температура во всех частях термодинамической системы, находящейся в состоянии теплового равновесия, является одинаковой. Микроскопические процессы внутри тела не прекращаются и при тепловом равновесии: меняются положения молекул, их скорости при столкновениях.
Теплопередача
Теплопередача – процесс изменения внутренней энергии тела без совершения работы.
Существуют три вида теплопередачи: теплопроводность, конвекция и излучение (лучистый теплообмен). Теплопередача происходит между телами, имеющими разную температуру. Тепло передается от тела с более высокой температурой к телу с более низкой температурой.
Теплопроводность – это процесс переноса энергии от более нагретых тел (частей тела) к менее нагретым в результате движения и взаимодействия частиц тела. Высокую теплопроводность имеют металлы – так, лучшие проводники тепла – медь, золото, серебро. Теплопроводность жидкостей меньше, а газы являются плохими проводниками тепла. Пористые тела плохо проводят тепло, так как в порах содержится воздух. Вещества с низкой теплопроводностью используют в качестве теплоизоляторов. Теплопроводность невозможна в вакууме. При теплопроводности не происходит переноса вещества.
Явление теплопроводности газов аналогично явлению диффузии. Быстрые молекулы из слоя с более высокой температурой перемещаются в более холодный слой, а молекулы из холодного слоя перемещаются в более нагретый. За счет этого средняя кинетическая энергия молекул более теплого слоя уменьшается, и его температура становится ниже.
В жидкостях и твердых телах при повышении температуры какого-либо участка твердого тела или жидкости его частицы начинают колебаться сильнее. Соударяясь с соседними частицами, где температура ниже, эти частицы передают им часть своей энергии, и температура этого участка возрастает.
Конвекция – перенос энергии потоками жидкости или газа.
Объяснить механизм конвекции можно на основе теплового расширения тел и закона Архимеда. При нагревании объем жидкости увеличивается, а плотность уменьшается. Нагретый слой под действием силы Архимеда поднимается вверх, а холодный опускается вниз. Это естественная конвекция. Она возникает при неравномерном нагревании жидкости или газа снизу в поле тяготения.
При вынужденной конвекции перемещение вещества происходит под действием насосов, лопастей вентилятора. Такая конвекция применяется в состоянии невесомости. Интенсивность конвекции зависит от разности температур слоев среды и агрегатного состояния вещества. Конвекционные потоки поднимаются вверх. При конвекции происходит перенос вещества.
В твердых телах конвекция невозможна, так как частицы не могут из-за сильного взаимодействия покидать свои места. В вакууме конвекция также невозможна.
Примером конвективных потоков в природе являются ветры (бризы дневной и ночной, муссоны).
Излучение (лучистый теплообмен) – перенос энергии электромагнитными волнами. Перенос тепла излучением возможен в вакууме. Источником излучения является любое тело, температура которого отлична от нуля К. При поглощении энергия теплового излучения переходит во внутреннюю энергию. Темные тела быстрее нагреваются излучением, чем тела с блестящей поверхностью, но и остывают быстрее. Мощность излучения зависит от температуры тела. С увеличением температуры тела энергия излучения увеличивается. Чем больше площадь поверхности тела, тем интенсивнее излучение.
Количество теплоты. Удельная теплоемкость вещества
Количество теплоты – это скалярная физическая величина, равная энергии, которую тело получило или отдало при теплопередаче.
Обозначение – \( Q \) , в СИ единица измерения – Дж.
Удельная теплоемкость – это скалярная физическая величина, численно равная количеству теплоты, которое тело массой 1 кг получает или отдает при изменении его температуры на 1 К.
Обозначение – \( c \) , в СИ единица измерения – Дж/(кг·К).
Удельная теплоемкость определяется не только свойствами вещества, но и тем, в каком процессе осуществляется теплопередача. Поэтому выделяют удельную теплоемкость газа при постоянном давлении – \( c_P \) и удельную теплоемкость газа при постоянном объеме – \( c_V \) . Для нагревания газа на 1 К при постоянном давлении требуется большее количество теплоты, чем при постоянном объеме – \( c_P > c_V \) .
Формула для вычисления количества теплоты, которое получает тело при нагревании или отдает при охлаждении:
где \( m \) – масса тела, \( c \) – удельная теплоемкость, \( T_2 \) – конечная температура тела, \( T_1 \) – начальная температура тела.
Важно!
При решении задач на расчет количества теплоты при нагревании или охлаждении можно не переводить температуру в кельвины. Так как 1К=1°С, то \( \Delta T=\Delta t \) .
Работа в термодинамике
Работа в термодинамике равна изменению внутренней энергии тела.
Обозначение работы газа – \( A’ \) , единица измерения в СИ – джоуль (Дж). Обозначение работы внешних сил над газом – \( A \) .
Работой расширения идеального газа называют работу, которую газ совершает против внешнего давления.
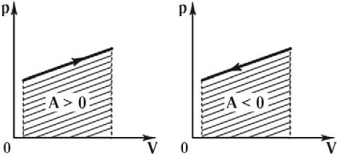
Работа газа положительна при расширении и отрицательна при его сжатии. Если объем газа не изменяется (изохорный процесс), то работы газ не совершает.
Графически работа газа может быть вычислена как площадь фигуры под графиком зависимости давления от объема в координатных осях \( (p,V) \) , ограниченная графиком, осью \( V \) и перпендикулярами, проведенными из точек начального и конечного значений объема.
Формула для вычисления работы газа:
в изобарном процессе \( A’=p\cdot\Delta V. \)
в изотермическом процессе \( A’=\frac
Уравнение теплового баланса
При любых процессах, происходящих в теплоизолированной системе, ее внутренняя энергия не изменяется (закон сохранения внутренней энергии).
Рассмотрим теплоизолированную систему из двух тел с разными температурами. При контакте между ними будет проходить теплообмен. Тело с большей температурой будет отдавать некоторое количество теплоты, а тело с меньшей температурой – получать, пока температуры тел не станут равными. Так как суммарная внутренняя энергия не должна изменяться, то, на сколько уменьшится внутренняя энергия более нагретого тела, на столько должна увеличиться внутренняя энергия второго тела. Так как работа не совершается, то изменение внутренней энергии равно количеству теплоты.
Количество теплоты, отданное при теплообмене телом с большей температурой, равно по модулю количеству теплоты, полученному телом с меньшей температурой:
Другая формулировка: если тела образуют замкнутую систему и между ними происходит только теплообмен, то алгебраическая сумма отданных \( Q_ <отд>\) и полученных \( Q_ <пол>\) количеств теплоты равна нулю:
Первый закон термодинамики
Закон сохранения и превращения энергии, распространенный на тепловые явления, называется первым законом (началом) термодинамики.
Можно дать формулировку этого закона исходя из способов изменения внутренней энергии.
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
Если рассматривать работу самой системы над внешними телами, то закон может быть сформулирован так:
количество теплоты, переданное системе, идет на изменение ее внутренней энергии и совершение системой работы над внешними телами:
Если система изолирована и над ней не совершается работа и нет теплообмена с внешними телами, то в этом случае внутренняя энергия не изменяется. Если к системе не поступает теплота, то работа системой может совершаться только за счет уменьшения внутренней энергии. Это значит, что невозможно создать вечный двигатель – устройство, способное совершать работу без каких-либо затрат топлива.
Первый закон термодинамики для изопроцессов
Изотермический процесс: \( Q=A’\,(T=const, \Delta U=0) \)
Физический смысл: все переданное газу тепло идет на совершение работы.
Изобарный процесс: \( Q=\Delta U+A’ \)
Физический смысл: подводимое к газу тепло идет на увеличение его внутренней энергии и на совершение газом работы.
Изохорный процесс: \( Q=\Delta U\,(V=const, A’=0) \)
Физический смысл: внутренняя энергия газа увеличивается за счет подводимого тепла.
Адиабатный процесс: \( \Delta U=-A’ \) или \( A=\Delta U\,\mathbf <(Q=0)>\)
Физический смысл: внутренняя энергия газа уменьшается за счет совершения газом работы. Температура газа при этом понижается.
Задачи об изменении внутренней энергии тел
Такие задачи можно разделить на группы:
При решении задач первой группы:
При решении задач второй группы:
Второй закон термодинамики
Все процессы в природе протекают только в одном направлении. В обратном направлении самопроизвольно они протекать не могут. Необратимым называется процесс, обратный которому может протекать только как составляющая более сложного процесса.
Примеры необратимых процессов:
Первый закон термодинамики ничего не говорит о направлении процессов в природе.
Второй закон термодинамики выражает необратимость процессов, происходящих в природе. Существует несколько его формулировок.
Второй закон термодинамики (формулировка Клаузиуса):
невозможно перевести тепло от более холодной системы к более горячей при отсутствии одновременных изменений в обеих системах или окружающих телах.
Второй закон термодинамики (формулировка Кельвина):
невозможно осуществить такой периодический процесс, единственным результатом которого было бы получение работы за счет теплоты, взятой от одного источника.
Эта формулировка говорит также и о том, что невозможно построить вечный двигатель второго рода, то есть двигатель, совершающий работу за счет охлаждения какого-либо одного тела.
Важно!
В формулировке второго закона термодинамики большое значение имеют слова «единственным результатом». Если процессы, о которых идет речь, не являются единственными, то запреты снимаются. Например, в холодильнике происходит передача тепла от более холодного тела к нагретому и при этом осуществляется компенсирующий процесс превращения механической энергии окружающих тел во внутреннюю энергию.
Второй закон термодинамики выполняется для систем с огромным числом частиц. В системах с малым количеством частиц возможны флуктуации – отклонения от равновесия.
КПД тепловой машины
Коэффициентом полезного действия (КПД) тепловой машины (двигателя) называется отношение работы \( A \) , совершаемой двигателем за цикл, к количеству теплоты \( Q_1 \) , полученному за цикл от нагревателя:
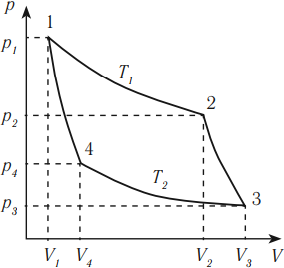
Тепловая машина с максимальным КПД была создана Карно. В машине осуществляется круговой процесс (цикл Карно), при котором после ряда преобразований система возвращается в начальное состояние.
Цикл Карно состоит из четырех стадий:
КПД цикла Карно:
Из уравнения следуют выводы:
Цикл Карно обратим, так как все его составные части являются равновесными процессами.
КПД тепловых двигателей: двигатель внутреннего сгорания — 30%, дизельный двигатель — 40%, паровая турбина — 40%, газовая турбина — 25–30%.
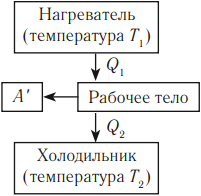
Принципы действия тепловых машин
Тепловым двигателем называют устройство, преобразующее внутреннюю энергию топлива в механическую энергию.
Основные части теплового двигателя:
Любая тепловая машина получает от нагревателя некоторое количество теплоты \( Q_1 \) и передает холодильнику количество теплоты \( Q_2 \) . Так как \( Q_1 > Q_2 \) , то совершается работа \( A’ = Q_1 – Q_2 \) .
Тепловой двигатель должен работать циклически, поэтому расширение рабочего тела должно сменяться его сжатием. Работа расширения газа должна быть больше работы сжатия, совершаемой внешними силами (условие совершения полезной работы). Температура газа при расширении должна быть выше, чем температура при сжатии. Тогда давление газа во всех промежуточных состояниях при сжатии будет меньше, чем при расширении.
В реальных тепловых машинах нагревателем является камера сгорания. В них рабочее тело нагревается за счет тепла, выделяющегося при сгорании топлива. Количество теплоты, выделяющееся при сгорании топлива, вычисляется по формуле:
где \( q \) – удельная теплота сгорания топлива, \( m \) – масса топлива.
Холодильником чаще всего у реальных двигателей служит атмосфера.
Виды тепловых двигателей:
Тепловые двигатели широко используются на всех видах транспорта: на автомобилях – двигатели внутреннего сгорания; на железнодорожном транспорте – дизельные двигатели (на тепловозах); на водном транспорте – турбины; в авиации – турбореактивные и реактивные двигатели. На тепловых и атомных электростанциях тепловые двигатели приводят в движение роторы генераторов переменного тока.
Проблемы энергетики и охрана окружающей среды
Тепловые двигатели широко применяются на транспорте и в энергетике (тепловые и атомные электростанции). Использование тепловых двигателей сильно влияет на состояние биосферы Земли. Можно выделить следующие вредные факторы:
Решение проблемы охраны окружающей среды от вредного воздействия предприятий тепловой энергетики требует комплексного подхода. Массовыми загрязнителями при работе тепловых электростанций являются летучая зола, диоксид серы и оксиды азота. Методы сокращения выбросов зависят от свойств топлива и условия его сжижения. Предотвращение загрязнения летучей золой достигается очисткой всего объема продуктов сгорания твердого топлива в высокоэффективных золоуловителях. Сокращение выбросов оксидов азота с продуктами сгорания топлива на тепловых электростанциях, а также в парогазовых и газотурбинных установках обеспечивается, главным образом, технологией сжигания топлива. Уменьшение выброса диоксида серы может быть достигнуто различными методами облагораживания и переработки топлива вне тепловых электростанций либо непосредственно на тепловых электростанциях, а также очисткой дымовых газов.
Контроль за выбросом вредных веществ электростанций осуществляется специальными приборами.
В ряде случаев достаточно эффективным решением вопросов очистки выбросов в атмосферу остается сооружение фильтров-уловителей и дымовых труб. У дымовой трубы два назначения: первое — создавать тягу и тем самым заставлять воздух — обязательный участник процесса горения — в нужном количестве и с должной скоростью входить в топку; второе — отводить продукты горения (вредные газы и имеющиеся в дыме твердые частицы) в верхние слои атмосферы. Благодаря непрерывному турбулентному движению вредные газы и твердые частицы уносятся далеко от источника их возникновения и рассеиваются.
Для рассеивания сернистого ангидрида, содержащегося в дымовых трубах тепловых электростанций, сооружаются дымовые трубы высотой 180, 250 и 320 м. Тепловые электростанции России, работающие на твердом топливе, за год выбрасывают в отвалы около 100 млн т золы и шлаков. Зола и шлаки занимают большие площади земель, неблагоприятно влияют на окружающую среду.
Более половины всех загрязнений создает транспорт. Один из путей решения проблемы защиты окружающей среды заключается в переходе на дизельные двигатели, электродвигатели, повышение КПД.
Алгоритм решения задач раздела «Термодинамика»:
Что не является началом термодинамики
Термодина́мика (греч. θέρμη — «тепло», δύναμις — «сила») — раздел физики, изучающий соотношения и превращения теплоты и других форм энергии. Термодинамика — это феноменологическая наука, опирающаяся на обобщения опытных фактов. Она изучает макроскопические системы, состоящие из огромного числа частиц —термодинамические системы. Процессы, происходящие в таких системах, описываются макроскопическими величинами, такими как давление или температура, которые не применимы к отдельным молекулам и атомам.
Современная феноменологическая термодинамика является строгой теорией, развиваемой на основе нескольких постулатов. Однако обоснование этих постулатов и их связь со свойствами и законами взаимодействия частиц, из которых построены термодинамические системы, даётся статистической физикой. Статистическая физика позволяет выяснить также и границы применимости термодинамики.
Законы термодинамики носят общий характер и не зависят от конкретных деталей строения вещества на атомарном уровне. Поэтому термодинамика успешно применяется в широком круге вопросов науки и техники, таких как энергетика, двигатели, фазовые переходы,химические реакции, явления переноса и даже чёрные дыры. Термодинамика имеет важное значение для самых разных областей физики и химии, химической технологии, аэрокосмической техники, машиностроения, клеточной биологии, биомедицинской инженерии,материаловедения и находит своё применение даже в таких областях, как экономика.
Разделы термодинамики
Современную феноменологическую термодинамику принято делить на равновесную (или классическую) термодинамику, изучающую равновесные термодинамические системы и процессы в таких системах, и неравновесную термодинамику, изучающую неравновесные процессы в системах, в которых отклонение от термодинамического равновесия относительно невелико и ещё допускает термодинамическое описание.
В равновесной термодинамике вводятся такие переменные, как внутренняя энергия, температура, энтропия, химический потенциал. Все они носят название термодинамических параметров (величин). Классическая термодинамика изучает связи термодинамических параметров между собой и с физическими величинами, вводимыми в рассмотрение в других разделах физики, например, с гравитационным или электромагнитным полем, действующим на систему. Химические реакции и фазовые переходы также входят в предмет изучения классической термодинамики. Однако изучение термодинамических систем, в которых существенную роль играют химические превращения, составляет предмет химической термодинамики, а техническими приложениями занимается теплотехника.
В системах, не находящихся в состоянии термодинамического равновесия, например, в движущемся газе, может применяться приближение локального равновесия, в котором считается, что соотношения равновесной термодинамики выполняются локально в каждой точке системы. Однако в неравновесной термодинамике переменные рассматриваются как локальные не только в пространстве, но и во времени, то есть в её формулы время может входить в явном виде. Отметим, что посвящённая вопросам теплопроводности классическая работа Фурье «Аналитическая теория тепла» (1822) опередила не только появление неравновесной термодинамики, но и работу Карно «Размышления о движущей силе огня и о машинах, способных развивать эту силу» (1824), которую принято считать точкой отсчёта в истории классической термодинамики.
Классическая термодинамика включает в себя следующие разделы:
Кроме этого, современная термодинамика включает также следующие направления:
Основы термодинамики
Термодинамика изучает системы, состоящие из очень большого числа частиц. Описание таких систем методами классической механики не только не представляется возможным, но и фактически лишено смысла. Особенности термодинамического описания возникают вследствие того, что поведение больших ансамблей частиц подчиняется статистическим закономерностям и не может быть сведено к анализу детерминированной эволюции динамических систем. Однако исторически термодинамика развивалась без опоры на представления статистической теории, и основные положения термодинамики могут быть сформулированы на основе ограниченного числа постулатов, являющихся обобщениями опытных фактов. Число этих постулатов варьируется у разных авторов в соответствии с тем, как строится аксиоматика термодинамики, но традиционно считается, что можно выделить четыре начала термодинамики.
Основные понятия термодинамики
Термодинамические системы
Термодинамическое равновесие
Фундаментальным для классической термодинамики является понятие термодинамического равновесия, которое тоже плохо поддаётся логическому определению и формулируется как обобщение экспериментальных фактов. Утверждается, что любая замкнутая термодинамическая система, для которой внешние условия остаются неизменными, с течением времени переходит в равновесное состояние, в котором прекращаются все макроскопические процессы. При этом в системе на микроскопическом уровне могут происходить самые разные процессы, например, химические реакции, которые могут протекать и в прямом, и в обратном направлении, однако в среднем эти процессы компенсируют друг друга, и макроскопические параметры системы остаются неизменными, флуктуируя относительно равновесного значения. Флуктуации изучаются в статистической физике.
Термодинамические параметры
Термодинамика не рассматривает особенности строения тел на молекулярном уровне. Равновесные состояния термодинамических систем могут быть описаны с помощью небольшого числа макроскопических параметров, таких как температура, давление, плотность, концентрации компонентов и т. д., которые могут быть измерены макроскопическими приборами. Описанное таким образом состояние называется макроскопическим состоянием, и законы термодинамики позволяют установить связь между макроскопическими параметрами. Если параметр имеет одно и то же значение, не зависящее от размера любой выделенной части равновесной системы, то он называется неаддитивным или интенсивным, если же значение параметра пропорционально размеру части системы, то он называется аддитивным или экстенсивным. Давление и температура — неаддитивные параметры, а внутренняя энергия и энтропия — аддитивные параметры.
Макроскопические параметры могут подразделяться на внутренние, характеризующие состояние системы как таковой, и внешние, описывающие взаимодействие системы с окружающей средой и силовыми полями, воздействующими на систему, однако это разделение достаточно условно. Так, если газ заключен в сосуд с подвижными стенками и его объём определяется положением стенок, то объём является внешним параметром, а давление газа зависит от скоростей теплового движения молекул и является внутренним параметром. Напротив, если задаётся внешнее давление, то его можно считать внешним параметром, а объём газа — внутренним параметром. Постулируется, что в состоянии термодинамического равновесия каждый внутренний параметр может быть выражен через внешние параметры и температуру системы. Такая функциональная связь называется обобщённым уравнением состояния системы.
Термодинамические процессы
Начала термодинамики
Нулевое начало термодинамики
Нулевое начало термодинамики названо так потому, что оно было сформулировано уже после того, как первое и второе начало вошли в число устоявшихся научных понятий. Оно утверждает, что изолированная термодинамическая система с течением времени самопроизвольно переходит в состояние термодинамического равновесия и остаётся в нём сколь угодно долго, если внешние условия сохраняются неизменными. Оно также называется общим началом. Термодинамическое равновесие предполагает наличие в системе механического, теплового и химического равновесия, а также равновесия фаз. Классическая термодинамика постулирует лишь существование состояния термодинамического равновесия, но ничего не говорит о времени его достижения.
В литературе в нулевое начало также часто включают положения о свойствах теплового равновесия. Тепловое равновесие может существовать между системами, разделёнными неподвижной теплопроницаемой перегородкой, то есть перегородкой, позволяющей системам обмениваться внутренней энергией, но не пропускающей вещество. Постулат о транзитивности теплового равновесия утверждает, что если два тела, разделённые такой перегородкой (диатермической), находятся в тепловом равновесии между собой, то любое третье тело, находящееся в тепловом равновесии с одним из этих тел, будет находиться также и в тепловом равновесии с другим телом.
Иначе говоря, если две замкнутые системы A и B приведены в тепловой контакт друг с другом, то после достижения термодинамического равновесия полной системой A+B системы Aи B будут находиться в состоянии теплового равновесия друг с другом. При этом каждая из систем A и B сама по себе также находится в состоянии термодинамического равновесия. Тогда если системы B и C находятся в тепловом равновесии, то системы A и C также находятся в тепловом равновесии между собой.
В иноязычной и переводной литературе часто нулевым началом называют сам постулат о транзитивности теплового равновесия, а положение о достижении термодинамического равновесия могут называть «минус первым» началом. Важность постулата о транзитивности состоит в том, что он позволяет ввести некоторую функцию состояния системы, обладающую свойствами эмпирической температуры, то есть создавать приборы для измерения температуры. Равенство эмпирических температур, измеренных с помощью такого прибора — термометра, есть условие теплового равновесия систем (или частей одной и той же системы).
Первое начало термодинамики
Первое начало термодинамики выражает универсальный закон сохранения энергии применительно к задачам термодинамики и исключает возможность создания вечного двигателяпервого рода, то есть устройства, способного совершать работу без соответствующих затрат энергии.
Внутреннюю энергию U термодинамической системы можно изменить двумя способами, совершая над ней работу или посредством теплообмена с окружающей средой. Первое начало термодинамики утверждает, что теплота, полученная системой, идёт на увеличение внутренней энергии системы и на совершение этой системой работы, что можно записать как δQ = δA + dU. Здесь dU — полный дифференциал внутренней энергии системы, δQ — элементарное количество теплоты, переданное системе, а δA — бесконечно малая или элементарнаяработа, совершённая системой. Так как работа и теплота не являются функциями состояния, а зависят от способа перехода системы из одного состояния в другое, применяется запись с символом δ, чтобы подчеркнуть, что δQ и δA — это бесконечно малые величины, которые нельзя считать дифференциалами какой-либо функции.
Знаки при δQ и δA в приведённом выше соотношении выражают соглашение о том, что положительной считают работу, совершаемую системой, и теплоту, получаемую системой, принятое в большинстве современных работ по термодинамике.
Работу, связанную с изменением количества вещества в системе (химическую работу), могут выделять из общего выражения для работы в отдельное слагаемое.
Второе начало термодинамики
Второе начало термодинамики задаёт ограничения на направление процессов, которые могут происходить в термодинамических системах, и исключает возможность создания вечного двигателя второго рода. Фактически к этому результату пришёл уже Сади Карно в сочинении «О движущей силе огня и о машинах, способных развивать эту силу». Однако Карно опирался на представления теории теплорода и не дал ясной формулировки второго начала термодинамики. Это было сделано в 1850—1851 годах независимо Клаузиусом иКельвином. Имеется несколько различных, но в то же время эквивалентных формулировок этого закона.
Постулат Кельвина: «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счёт охлаждения теплового резервуара». Такой круговой процесс называется процессом Томсона-Планка, и постулируется, что такой процесс невозможен.
Постулат Клаузиуса: «Теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому». Процесс, при котором не происходит никаких других изменений, кроме передачи теплоты от холодного тела к горячему, называется процессом Клаузиуса. Постулат утверждает, что такой процесс невозможен. Теплота может переходить самопроизвольно только в одном направлении, от более нагретого тела к менее нагретому, и такой процесс является необратимым.
Приняв за постулат невозможность процесса Томсона-Планка, можно доказать, что процесс Клаузиуса невозможен, и наоборот, из невозможности процесса Клаузиуса следует, что процесс Томсона-Планка также невозможен.
Третье начало термодинамики
Нулевые значения температуры и энтропии при абсолютном нуле приняты как удобные соглашения для устранения неоднозначности в построении шкалы для термодинамических величин. Нулевое значение температуры служит реперной точкой для построения термодинамической шкалы температур. Энтропия, обращающаяся в ноль при абсолютном нуле температуры, называется абсолютной энтропией. В справочниках термодинамических величин часто приводятся значения абсолютной энтропии при температуре 298,15 К, которые соответствуют увеличению энтропии при нагреве вещества от 0 К до 298,15 К.
Термодинамическое состояние
Динамическое, микро- и макросостояние
Моделирование всякой физической системы подразумевает указание полного набора параметров, необходимого для описания всех её возможных состояний и наблюдаемых величин. Описание термодинамических систем, состоящих из огромного числа частиц, варьируется в зависимости от того, какая степень детализации принимается для выбора набора параметров. Наиболее подробное описание в классической механике требует указания координат и импульсов всех частиц системы в какой-либо начальный момент времени и законов взаимодействия частиц, определяющих их эволюцию во времени. Описанное таким образом состояние системы называется динамическим. Для практических целей динамическое описание систем большого числа частиц непригодно. Следующим, более огрубленным уровнем описания является статистическое описание, когда динамические состояния усредняются по ячейкам фазового пространства в классической механике. В квантовой механике состояния различаются набором квантовых чисел и могут усредняться, например, по небольшим интервалам на шкале энергии. Такие состояния называются микросостояниями и изучаются в классической или квантовой статистической механике. Выбор способа описания системы зависит от характерных временных масштабов, на которых изучается эволюция системы.
Термодинамика имеет дело с макросостояниями, наиболее общим уровнем описания, где для указания состояния системы требуется минимальное число макроскопических параметров. Вообще говоря, проблема определения микро- и макросостояний и описания их статистических свойств относится к наиболее фундаментальным и пока не получившим окончательного решения вопросам статистической физики.
Функции состояния и уравнение состояния
При описании макросостояний используются функции состояния — это функции, однозначно определённые в состоянии термодинамического равновесия и не зависящие от предыстории системы и способа её перехода в равновесное состояние. Важнейшими функциями состояния при аксиоматическом построении термодинамики являются температура, внутренняя энергия и энтропия, вводимые в началах термодинамики, а также термодинамические потенциалы. Однако функции состояния не являются независимыми, и для однородной изотропной системы любая термодинамическая функция может быть записана как функция двух независимых переменных. Такие функциональные связи называются уравнениями состояния. Различают термическое уравнение состояние, выражающее связь между температурой, давлением и объёмом (или, что тоже самое, плотностью), калорическое уравнение состояние, выражающее внутреннюю энергию как функцию от температуры и объёма, и каноническое уравнение состояние, записываемое как термодинамический потенциал в соответствующих естественных переменных, из которого можно получить и термическое, и калорическое уравнения состояния. Знание уравнения состояния необходимо для применения общих принципов термодинамики к конкретным системам. Для каждой конкретной термодинамической системы её уравнение состояния определяется из опыта или методами статистической механики, и в рамках термодинамики оно считается заданным при определении системы.
Термическое уравнение состояния
Для многокомпонентной системы число термических уравнений состояния равно числу компонентов, например, для смеси идеальных газов эти уравнения состояния выглядят как p iV = ν iRT, где ν i — число молей i-го компонента смеси. Общее давление при этом будет равно сумме парциальных давлений компонентов, p=Σp i. Это соотношение называется законом Дальтона.
Термическое уравнение состояния фотонного газа устанавливает зависимость давления электромагнитного излучения от температуры и не содержит других переменных.
Для пространственно однородного элемента упругой среды при его продольной деформации примером термического уравнения состояния служит закон Гука; в термодинамике деформируемого твёрдого тела термические уравнения состояния, связывающие температуру и компоненты тензоров напряжений и деформаций, входят в число определяющих уравнений; для магнитных сред используют магнитное уравнение состояния M = M(H,T), примером которого может служить закон Кюри; для диэлектриков уравнение состояния имеет вид P = P(E,T); здесь M — магнитный момент вещества, H — напряжённость магнитного поля, P — поляризация, E — напряжённость электрического поля.
Существование термического уравнения состояния вытекает из закона транзитивности термического равновесия, однако сама термодинамика ничего не говорит относительно вида функциональной зависимости между входящими в это уравнение переменными, за исключением того, что уравнение состояния должно удовлетворять определённым условиям устойчивости.
Основные формулы термодинамики
Условные обозначения
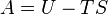

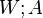

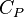


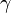

Формулы термодинамики идеального газа
| Уравнение состояния идеального газа (уравнение Клапейрона—Менделеева) | 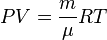 |
| Изменение внутренней энергии газа | 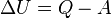 |
| Работа газа |  |
| Средняя энергия молекулы газа | 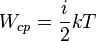 |
| Средняя кинетическая энергия молекулы газа: | 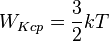 |
| Внутренняя энергия газа |  |
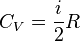
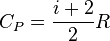
Выражение основных величин через термодинамические потенциалы
Все термодинамические потенциалы имеют свои канонические наборы переменных и используются для анализа процессов при соответствующих условиях. Так, для изотермических изохорических процессов (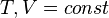
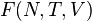
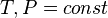
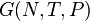


S(N,U,V) (энтропия)
F(N,T,V) (свободная энергия Гельмгольца)
G(N,T,P) (энергия Гиббса)
U(N,S,V) (внутренняя энергия)
Уравнение Гиббса и уравнение Гиббса—Дюгема
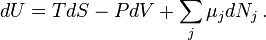
Значимость этого уравнения (и его более общих вариантов) состоит в том, что оно представляет собой тот фундамент, на котором базируется весь математический аппарат современной феноменологической термодинамики, как равновесной, так и неравновесной. По большому счёту, рассмотренные выше законы (начала) термодинамики нужны были именно для обоснования этого соотношения. Всю аксиоматику равновесной термодинамики можно свести к постулированию самого этого уравнения и свойств входящих в него термодинамических переменных.
С использованием других термодинамических потенциалов уравнение Гиббса можно переписать в следующих эквивалентных формах:

Среди термодинамических величин выделяют экстенсивные (внутренняя энергия, энтропия, объём и др.) и интенсивные (давление, температура и др.) величины. Величина называется экстенсивной, если ее значение для системы, сложенной из нескольких частей, равно сумме значений этой величины для каждой части. Предположением об экстенсивности термодинамических величин, однако, можно пользоваться, если рассматриваемые системы достаточно большие и можно пренебречь различными краевыми эффектами при соединении нескольких систем, например, энергией поверхностного натяжения. Пусть U (экстенсивная величина) является однородной функцией первого порядка от своих экстенсивных аргументов (математическое выражение аксиомы экстенсивности): для любого 0″ src=»http://upload.wikimedia.org/math/7/c/5/7c51dee4cd461ebcbbecf8fcee8d236a.png» style=»border:none;vertical-align:middle;margin:0px» />
Для любой дифференцируемой однородной функции первого порядка 
Для энергии 
Отсюда легко следует уравнение Гиббса — Дюгема:
Это уравнение показывает, что между интенсивными переменными существует одна связь, являющаяся следствием предположения об аддитивности свойств системы. В частности, непосредственным следствием соотношений Гиббса-Дюгема является выражение для термодинамического потенциала Гиббса через химические потенциалы 
Термодинамика сплошных сред
Приведённые выше формулировки аксиом термодинамики и соотношения для термодинамических потенциалов имеют место для простых систем — изотропных сред. Для более сложных сред — анизотропных жидкостей и твёрдых тел, сред с электромагнитными свойствами и других, законы термодинамики имеют более сложную формулировку, а термодинамические потенциалы формулируются в обобщенном виде с использованием тензоров. В физике сплошных сред (физике континуума) термодинамика рассматривается как её составная часть, вводящая в рассмотрение переменные, характеризующие тепловые (термические) и химические свойства среды, и их связь с другими физическими величинами, а аксиомы термодинамики включаются в общую систему аксиом.