Что не входит в состав нефротического синдрома
Нефротический синдром – сигнал о нарушении в работе почек
Нефротический синдром – состояние, характеризующееся богатой клинической картиной. Синдром свидетельствует о нарушении работы почек и мочевыделительной системы, требует основательной диагностики. Сопровождает большинство хронических и острых почечных заболеваний.
Нефротический синдром – причины
Состояние провоцируют инфекционные и системные заболевания, патологии внутренних органов. К нефротическому синдрому приводит:
Состояние проявляется при лечении некоторыми медикаментами: антибиотиками, противосудорожными. При наличии хронических патологий важно отслеживать свое состояние и сразу обращаться к врачу, обнаружив изменения.
Симптомы нефротического синдрома
Для нефротического синдрома характерна достаточно яркая симптоматика, чтобы обнаружить его в домашних условиях и обратиться к врачу своевременно:
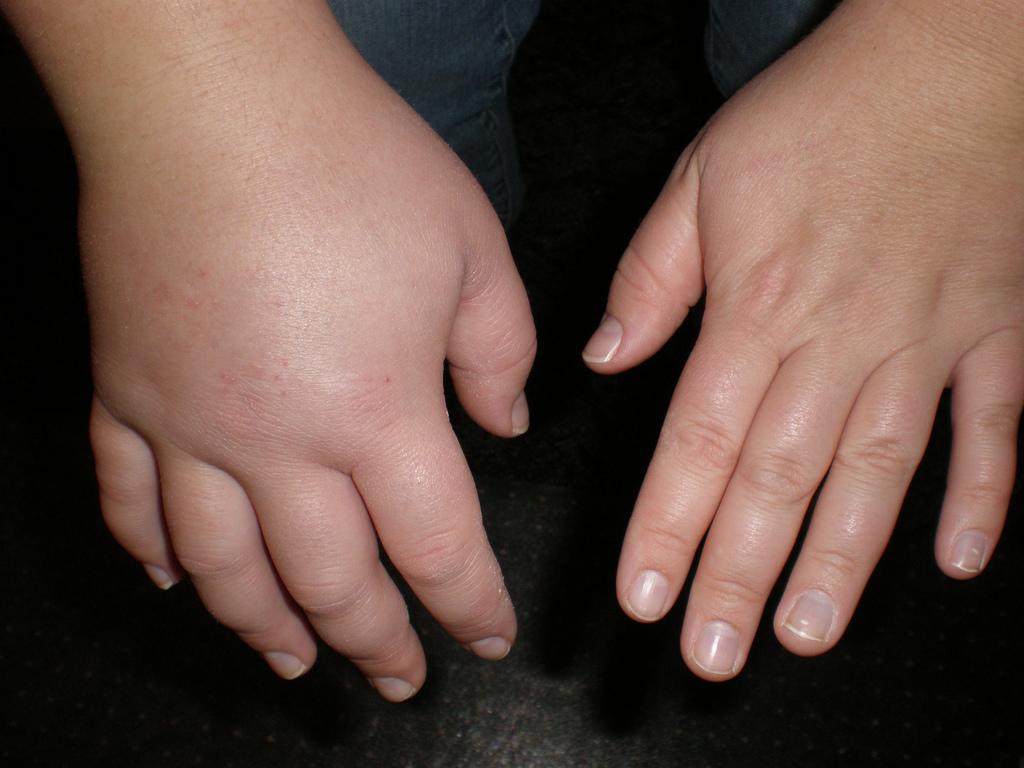
Из трещинок может сочиться жидкость. Отеки распространяются по всему телу, если вовремя не начать лечение. Самый опасный признак – скопление жидкости во внутренних органах: перикарде, плевральной и брюшной полости.
Во время лабораторной диагностики определяется низкое содержание белка в крови и высокое – в моче. Характерна повышенная свертываемость крови и низкая концентрация альбумина. Если вы обнаружили у себя один или несколько симптомов, запишитесь на прием к урологу, чтобы не допустить осложнений.
Формы патологии
Хронический и острый нефротический синдром не считаются отдельными типами заболеваний. Классификация создана на основе первопричин заболевания:
Лечение нефротического синдрома и чувствительность состояния к терапии определяют еще несколько групп – гормоночувствительные и гормонорезистентные. Первый диагноз устанавливается, если ощутим прогресс от применения гормонов, второй – если состояние не изменяется при назначении гормонотерапии.
Диагностика
Опытный врач начинает диагностику нефротического синдрома со сбора анамнеза. Для установки диагноза показаны такие исследования:
При подозрении на новообразования показана биопсия для дифференциальной диагностики.
Сотрудники Клиники урологии имени Р. М. Фронштейна Первого Московского Государственного Медицинского Университета имени И.М. Сеченова специализируются на диагностике и лечении нефротического синдрома. Врачи высшей категории готовы прийти на помощь в терапии первичных и вторичных синдромов. Диагностика и прием в одной клинике для экономии вашего времени – не откладывайте лечение, позаботьтесь о здоровье всего организма!
Нефротический синдром
дерматовенеролог / Стаж: 24 года
Дата публикации: 2019-03-27
уролог / Стаж: 28 лет
Он включает обширную протеинурию, нарушения процесса обмена белков и липидов, отеки. Отдельно отмечается рост гипоальбунемии и гиперлипидемии во время нефротического синдрома. Также наблюдаются массивные отеки, выражающиеся в распространении на самые разнообразные полости, включая анасарку и водянку серозных полостей. Таким образом, нередко при нефротическом синдроме проявляется дистрофия кожного покрова и слизистых оболочек. Если симптоматика нефротического синдрома не выявляет нескольких характерных признаков болезни, диагностируется неполный или редуцированный нефротический синдром.
Причинами для развития нефротического синдрома чаще всего являются заболевания урологии, а также — системные, нагноительные, воспалительные и хронические инфекции, на фоне которых проявляется и развивается нефротический синдром. Специалисты-урологи отмечают, что каждый пятый случай заболевания почек осложняется данным синдромом. Присутствует и возрастная подверженность данному заболеванию: чаще этот синдром сопровождает взрослых (в возрасте около 30-40 лет), намного реже он проявляется у детей или пожилых людей.
Диагностика нефротического синдрома должна проводиться с рассмотрением клинико-лабораторной картины больного. Отслеживаются изменения, происходящие в результатах биохимических анализов крови и мочи. Анализируется ренальная и экстраренальная симптоматика. Отдельно изучаются данные, полученные с помощью биопсии почек.
Лечение нефротического синдрома включает широкий спектр медицинских методов. Назначается диета, прием диуретиков, антибиотиков, стероидов и цитостатиков. Проводится инфузионная терапия.
Профилактика и прогноз нефротического синдрома
Как будет развиваться и протекать нефротический синдром, часто зависит от того, какое именно первичное заболевание присутствует у пациента. Если говорить о прогнозе нефротического синдрома в целом, то стоит отметить, что лечение, назначенное верно и вовремя, способно полностью восстановить функцию почек, а также добиться полноценной ремиссии, стабильной по состоянию.
Если причина развития нефротического синдрома не установлена, есть опасность того, что заболевание примет иной ход течения: персистирующий или рецидивирующий. В конечном итоге это приводит к появлению хронического заболевания почечной недостаточности.
Профилактика нефротического синдрома — это, прежде всего, ранняя диагностика заболевания, после которого наступает тщательное и усиленное лечение почечной и внепочечной патологии. Любое заболевание почек должно быть пролечено препаратами, прием которых ведется аккуратно и под контролем врача, особенно над теми, что вызывают побочное нефротоксическое и аллергическое действие. Запущенное течение заболевания почек, неверное назначение препаратов, несвоевременное обращение к врачу — все это способно привести к развитию нефротического синдрома.
Причины развития нефротического синдрома
Разделяют типы нефротического синдрома, поскольку берут во внимание происхождение заболевания. Таким образом, нефротический синдром может быть:
Отдельно выделяют идиопатический тип нефротического синдрома, который означает, что причину его появления выявить не удалось. Такая форма постановки диагноза чаще всего сопровождает заболевание нефротическим синдромом в детском возрасте.
Существует несколько теорий, рассматривающих, анализирующих и объясняющих причины появления и развития заболевания. Среди них наиболее вероятной является иммунологическая концепция патогенеза нефротического синдрома. Ее правильность подтверждает высокая частота проявления заболевания у тех пациентов, которые уже страдают от аллергических и аутоимунных болезней. Также иммунологическая теория подтверждается высоким количеством положительных реакций на лечение иммуносупрессорами. В процессе развития заболевания в крови пациента образуются иммунные комплексы. Они являются прямым результатом взаимодействия внутренних (белки, ДНК, криоглобулины) и внешних (вирусы, бактерии) антигенов с антителами.
Образованные иммунные комплексы могут оседать в почечных тканях, что приводит к ответной воспалительной реакции. Нарушается микроциркуляция крови в клубочковых капиллярах. Повышается внутрисосудистая коагуляция.
Клубочковый фильтр таким образом изменяет свою проницаемость. В свою очередь, это приводит к нарушениям в процессе обмена белка, и он попадает в мочу, что выводит его из организма. Большая потеря белка, как известно, приводит к развитию заболеваний гипопротеинемии, гиперлипидемии и т.д.
Нефротический синдром изменяет внешний вид почек. Она будет увеличена в размерах, иметь гладкую, ровную поверхность. На разрезе почки будет видно, что мозговой слой отличается красным оттенком, а корковый — серым.
Микроскопическое исследование почки служит не только для того, чтобы определить наличие и степень развития нефротического синдрома. Также оно показывает степень распространения патологии на ткани и организм человека. Патологии здесь включают амилоидоз, коллагенозы, туберкулез. Сам же по себе нефротический синдром характеризуется нарушениями в структуре клеток капсулы клубочков и базальных мембран кровеносных сосудов.
Симптомы нефротического синдрома
Нефротический синдром, симптомы которого относительно однотипны, проявляется примерно одинаково, независимо от причины, его вызвавшей.
Главным симптомом является протеинурия, которая означает выведение из организма большого объема белка. Достигать она может 3-3,5 грамма в сутки, 90% этой массы составляют альбумины. Соответственно, с процессом потери белка в организме пациента снижается общий уровень сывороточного белка: до 60-40 грамма/литр и меньше.
Задержка жидкости в организме пациента проявляется в периферических отеках, асците, генерализированном отеке подкожной клетчатки.
Дальнейшее развитие нефротического синдрома также характеризуется множеством симптомов: проявляется общая слабость организма, потеря аппетита, жажда и постоянное ощущение сухости во рту. Кроме того, пациент ощущает тяжесть в поянице и вздутие живота. Могут быть рвота и понос.
Возможны проявления нефротического синдрома в форме судорог, миалгии, парестезии. Развивается гидроперикард и гидроторакс, это сопровождается одышкой как в состоянии покоя, так и движения. Появление и развитие периферических отеков, безусловно, сковывает движения пациента, поэтому больные часто малоподвижные и бледные, неактивные и вялые. Появляется шелушение кожи, сухость покрова. Становятся ломкими волосы и ногти.
Развитие нефротического синдрома может быть постепенным, медленным или же бурным и активным. Симптоматика проявляется по-разному и не всегда выявляет себя в полном спектре.
По ходу клинического течения заболевания разделяют на:
Осложения заболевания включают вирусные, грибковые, бактериальные инфекции, а также отек мозга, сетчатки, гиповолемический шок.
Дигностика нефротического синдрома
Для диагностики нефротического синдрома используются методы лабораторного и клинического анализа.
Осмотр выявляет изменения кожного покрова, который становится бледным, холодным и сухим. Доктор может обнаружить обложенность языка, увеличенный живот, отеки.
Если присутствует гидроперикард, то это проявляется в расширении границ сердца, приглушении тонов. Присутствие гидроторакса выражается в слабом дыхании, мелкопузырчатых хрипах, укорочении перкуторного звука.
Общий клинический анализ мочи определяет повышенную плотность, наличие в осадке капель нейтрального жира и холестерина.
При исследовании периферической крови выявляют увеличенное значение СОЭ (60-80), количества тромбоцитов, сниженный уровень эритроцитов и гемоглобина. Проявляется ДВС-синдром, который обнаруживается во время проведения коагулограммы — проверки свертываемости крови.
Биохимия крови во время нефротического синдрома проявляет гипопротеинемию, а также гипоальбунемию.
При диагностике нефротического синдрома широко применяется ультразвуковая методика исследования, назначаемая для осмотра почек, сосудов. Также проводится нефросцинтиграфия.
Безусловно, из-за необходимости определить причину развития нефротического синдрома, проводится углубленное изучение заболевания. Для этого назначаются иммунологические и ангиографические анализы, биопсии почек, десны, прямой кишки. Материал, полученный после биопсии, подлежит морфологическому анализу.
Лечение нефротического синдрома
Лечение нефротического синдрома проводится под наблюдением врача в условиях стационара. Лечебные методики включают применение широкого спектра инструментов. На первом этапе назначается бессолевая диета, ограниченный прием жидкости, соблюдение постельного режима. Также проводится терапия медикаментами: прием диуретиков, калия, витаминов, антибиотиков, сердечных средств, антигистаминов, гепарина. Отдельно вводится альбумин и реополиглюкин – инфузионным способом.
Если причину развития болезни выявить не удалось, или же она состоит в поражении почек токсинами, аутоиммунным синдромом, тогда проводится лечение стероидами, например, преднизолоном. Такая иммуносупрессивная терапия нацелена на подавление процесса создания антител, улучшение кровообращения в почках, клубочковую фильтрацию.
Цитостатическая терапия, заключающаяся в приеме циклофосфамида и хлорамбуцила, проводящаяся специфическими пульс-курсами, показывает хороший результат при лечении устойчивого к гормонам нефротического синдрома.
Введите ваши данные, и наши специалисты свяжутся с Вами, и бесплатно проконсультируют по волнующим вас вопросам.
Нефротический синдром
Что провоцирует / Причины Нефротического синдрома:
Патогенез (что происходит?) во время Нефротического синдрома:
Патогенез нефротического синдрома тесно связан с основным заболеванием. Большинство перечисленных выше болезней имеют иммунологическую основу, т. е. возникают вследствие осаждения в органах (и почке) фракций комплемента, иммунных комплексов или антител против антигена базальной мембраны клубочка с сопутствующими нарушениями клеточного иммунитета.
Все остальные многочисленные нарушения при нефротическом синдроме являются вторичными по отношению к массивной протеинурии. Так, в результате гипоальбуминемии, снижения коллоидно-осмотического давления плазмы, гиповолемии, уменьшения почечного кровотока, усиленной продукции АДГ, ренина и альдостерона с гиперреабсорбцией натрия развиваются отеки.
Гистологические и цитологические исследования прежде всего выявляют изменения, характерные для нефропатий, вызвавших развитие нефротического синдрома. К гистологическим признакам самого нефротического синдрома относятся слияние ножковых отростков и распластывание тел подоцитов в клубочках, гиалиновая и вакуольная дистрофия клеток проксимальных канальцев, наличие «пенистых» клеток, содержащих липиды.
Симптомы Нефротического синдрома:
Клиническая картина нефротического синдрома, ломимо отеков, дистрофических изменений кожи и слизистых оболочек, может осложняться периферическими флоботромбозами, бактериальной, вирусной, грибковой инфекцией различной локализации, отеком мозга, сетчатки глазного дна, нефротическим кризом (гиповолемический шок). В некоторых случаях признаки нефротического синдрома сочетаются с артериальной гипертензией (смешанная форма нефротического синдрома).
Диагностика Нефротического синдрома:
Артериальное кровяное давление обычно нормальное, лишь у до10% детей может быть кратковременная артериальная гипертензия. Уровень альбумина в сыворотке крови у таких детей менее 10 г/л.
Клиническая картина, течение и исход нефротического синдрома, осложнившего диффузный гломерулонефрит, отличаются от клиники МИНС.
Мочевой синдром при МИНС слагается из следующих симптомов:
1. протеинурия,
2. олигурия с высокой относительной плотностью мочи,
3. цилиндрурия.
Протеинурия при МИНС, как правило, селективная, т. е. в моче находят белки плазмы крови с молекулярной массой менее 85 000 (альбумин и его полимеры, преальбумины, сидерофилин, гаптоглобин, трансферрин, a1- и b-глобулины, a1- и a2-гликопротеины и др.). В большинстве случаев у детей с селективной протеинурией прогноз лучше, и они чувствительны к терапии глюкокортикоидами. В генезе протеинурии имеет значение и нарушение реабсорбции белка в почечных канальцах. Неселективная протеинурия, когда в моче есть много крупномолекулярных белков, как правило, следствие фибропластического процесса, склероза, т. е. для МИНС нехарактерна. Напомним, что у здорового ребенка старше 4 лет в суточной моче может быть до 100–150 мг белка.
Олигурия связана с гиповолемией, гиперальдостеронизмом, поражением канальцев. Из-за протеинурии относительная плотность мочи увеличена, достигает 1,040. Высока активность в крови больных и АДГ.
Иногда при нефротическом синдроме отмечается массивная лейкоцитурия, обусловленная иммунопатологическим процессом в почках. Лейкоцитурия чаще кратковременная и не связана с бактериальной инфекцией, т. е. пиелонефритом. Частота выявления лейкоцитурий и эритроцитурий при МИНС по данным разных авторов не превышает 10%.
Отеки. Массивная и длительная альбуминурия у больного с нефротическим синдромом в конце концов неизбежно вызывает гипопротеинемию, так как потери белка превышают интенсивность его синтеза. Гипопротеинемия ведет к нарушению старлингова равновесия между гидродинамическим, фильтрационным и коллоидно-осмотическим давлением. Это приводит к преобладанию оттока жидкости из артериального русла над притоком. Отеки начинают появляться, когда уровень альбумина снижается ниже 27 г/л плазмы и развиваются всегда, если гипоальбуминемия достигает 18 г/л.
В патогенезе отеков важную роль играет и вторичный гиперальдостеронизм, типичный для нефротического синдрома. В результате его в организме задерживается натрий, а следовательно, и вода, хотя в крови имеется гипонатриемия.
Гиперлипидемия. Некоторые авторы связывают увеличение уровня липопротеинов низкой и очень низкой плотности, холестерина и липидов (свободные жирные кислоты, триглицериды, фосфолипиды и др.) при нефротическом синдроме с нарушением функции печени, другие объясняют это явление понижением функции щитовидной железы. В связи с тем, что внутривенное введение раствора альбумина препятствует нарастанию гиперхолестеринемии, предполагают, что увеличение уровня холестерина в крови происходит компенсаторно вследствие уменьшения содержания альбуминов. Поскольку липидемию в эксперименте можно получить после перевязки мочеточников, высказывают мысль о том, что гиперхолестеринемия и липидемия при МИНС имеют почечное происхождение и зависят от повреждения интермедиарного обмена в ферментной системе канальцев. В генезе гиперлипидемии имеет значение также низкий уровень в крови лецитин-холестеринацетилтрансферазы, в больших количествах выделяющейся с мочой, и низкая активность липопротеидлипазы. При МИНС обычно диагностируют IIа и IIб типы гиперлипидемий.
Нарушения фосфорно-кальциевого обмена (гипокальциемия, остеопороз, остеомаляция) обусловлены нарушением функции почек, а также метаболизма витамина D.
Вязкость крови при МИНС повышена за счет гиперлипидемии, повышенной адгезивности тромбоцитов. В то же время уровни факторов свертывания крови (прокоагулянтов) и антисвертывания (антитромбин III, протеины С и S) снижены, что и объясняет сравнительно низкую частоту декомпенсированного ДВС-синдрома при МИНС.
Лечение Нефротического синдрома:
мочегонные средства играют большую роль в лечении заболевания почек, однако при бесконтрольном и длительном их применении могут наступить резкая потеря натрия и снижение объема циркулирующей крови, гипокалиемия и метаболический ацидоз. Форсированный диурез с помощью больших доз диуретиков, как и ультрафильтрация, в условиях резкой гипоальбуминемии или выраженной почечной недостаточности может осложниться трудноуправляемым гиповолемическим шоком или дальнейшим снижением клубочковой фильтрации. Поэтому лечение диуретиками рекомендуется проводить максимально кратковременно и возобновлять только в случаях заметного снижения диуреза и нарастания отеков.
Для лечения нефротических отеков обычно применяют фуросемид – 20 – 400 мг внутрь, 20 – 1200 мг внутривенно), который оказывает достаточно мощное и быстрое, хотя и кратковременное, действие. Подобно фуросемиду действует и этакриновая кислота (50 – 200 мг/сут). Слабее действует гипотиазид, диуретический эффект которого наблюдается через 1 – 2 ч после приема 25 – 100 мг препарата. Важную роль в борьбе с отеками играют калийсберегающие диуретики – триамтерен, амилорид, особенно спиронолактоны (альдактон, верошпирон). Верошпирон применяют в дозе от 25 до 200 – 300 мг в сутки, Он наиболее эффектииен в сочетании с тиазидовыми диуретиками, фуросемидом. Отеки – при нефротическом синдроме, обусловленном амилоидозом, отличаются большой. резистентностью к мочегонным средствам.
• Гепарин
• Антибактериальная терапия
• Кортикостероиды
Постоянный пероральный прием ПЗ в дозе 1–2 мг/кг в 2–4 приема с учетом суточной активности коры надпочечников (максимальные дозы препарата в утренние часы с последующим снижением, последний прием не позднее 16.00) назначается в начале лечения для достижения ремиссии.
Пульс-терапия МП используется для достижения очень высоких концентраций ГК в плазме. Заключается во внутривенном капельном введении в течение 20–40 мин около 30 мг/кг МП (не более 1 г на пульс) один раз в 48 ч. Количество введений, а также разовая и суммарная доза определяются выбранной схемой терапии данной патологии.
Побочные эффекты глюкокортикоидов могут быть следующими: бессонница, эйфория, психоз, повышение аппетита, отеки, ожирение, миопатия, стрии, атрофия кожи, гирсутизм, акне, остеопороз, катаракта, повышение АД, стероидный диабет, адреналовый криз (острая надпочечниковая недостаточность при резкой отмене препарата)
Хлорамбуцил принимается per os в дозе 0,15–0,2 мг/кг/сут в течение 8–10 нед для лечения гормонозависимого и часто рецидивирующего нефротического синдрома, реже при гормонорезистентном нефротическом синдроме, на фоне альтернирующего курса ПЗ с постепенным снижением.
Эффективность терапии определяется характером основного заболевания и морфологическими особенностями нефропатии. Курортное лечение (санатории Байрам-Али, Ситораи-Махи-Хаса, Бухары в период ремиссии и Южного берега Крыма) показано больным с нефротическим синдромом в зависимости от вида основного заболевания и степени его активности.
Прогноз при своевременном и адекватном лечении основного заболевания может быть благоприятным.
К каким докторам следует обращаться если у Вас Нефротический синдром:
Нефротический синдром у детей: определение и принципы терапии
Нефротический синдром (НС) — клинико-лабораторный симптомокомплекс, клинически характеризующийся периферическими или генерализованными отеками вплоть до асцита и анасарки, а лабораторно — протеинурией более 2,5 г/сут или более 50 мг/кг/сут, гипопротеинем
Нефротический синдром (НС) — клинико-лабораторный симптомокомплекс, клинически характеризующийся периферическими или генерализованными отеками вплоть до асцита и анасарки, а лабораторно — протеинурией более 2,5 г/сут или более 50 мг/кг/сут, гипопротеинемией, гипоальбуминемией (ниже 40 г/л), диспротеинемией, гиперлипидемией и липидурией.
Гипопротеинемия при нефротическом синдроме развивается вследствие потери с мочой белков (прежде всего альбуминов) из-за нарушения проницаемости гломерулярного фильтра. Гипопротеинемия приводит к снижению онкотического давления плазмы, из-за чего жидкость не полностью возвращается в сосудистое русло, а задерживается в тканях, что и обусловливает развитие нефротических отеков. В их возникновении немаловажное значение имеет состояние лимфатических капилляров, так как гипергидратация ткани вызывает по механизму обратной связи компенсаторное усиление лимфооттока и удаление с лимфой тканевых белков, что снижает онкотическое давление межтканевой жидкости. Подобный компенсаторный механизм способен до определенного предела препятствовать развитию отека при гипопротеинемии.
Несмотря на доказанную роль гипоальбуминемии в развитии нефротических отеков, четкой математической зависимости между уровнем гипопротеинемии и степенью отеков не прослеживается. Более того, отеки могут вовсе не развиваться, даже при выраженном снижении уровня альбуминов в крови. Так, у больных с врожденной гипоальбуминемией, связанной с врожденным же дефектом скорости синтеза альбуминов, отеки могут не возникать даже при практически полном отсутствии альбуминов в крови. Это, возможно, связано с включением различных компенсаторных механизмов (усиление лимфооттока, шунтирование крови через артериоловенулярные анастомозы). Кроме того, примерно в 10% случаев при нефротическом синдроме развитие отеков происходит по альтернативному пути, при котором ведущей является первичная почечная ретенция натрия.
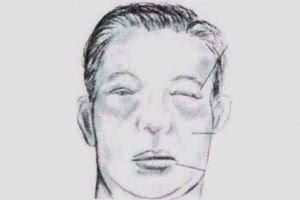
Клинически нефротические отеки, как правило, определяются как генерализованные. Начинаются они с глаз и лодыжек, затем распространяются на туловище и достигают степени анасарки и полостных отеков (асцит, гидроторакс). Отеки мягкие, подвижные (смещаются с изменением положения тела больного), часто ассиметричные из-за положения тела или тромбоза поверхностных вен. При выраженном отечном синдроме могут наблюдаться разрывы кожи, стрии, увеличение печени.
Нефротический синдром в ряде случаев может быть проявлением первичного гломерулонефрита (ГН). Выделяют также врожденный нефротический синдром (финского типа) и семейный нефротический синдром. Помимо этого, нефротический синдром может иметь вторичный характер и сопровождать многие заболевания, протекающие с поражением почек (системная красная волчанка, геморрагический васкулит, ревматоидный артрит, микроскопический полиангиит, сахарный диабет, амилоидоз почек и др.).
В некоторых случаях нефротический синдром не сопровождается развитием отеков и носит название неполного нефротического синдрома. Для классического нефротического синдрома не характерно наличие гематурии или гипертензии — это «чистый» нефротический синдром, который соответствует нефротической форме острого или хронического гломерулонефрита по Винницкой классификации (1980). Смешанный нефротический синдром определяется при сочетании НС с гематурией (чаще) и/или гипертензией, что соответствует смешанной форме ГН.
Для обозначения нефротического синдрома, развивающегося при первичном гломерулонефрите, применяется термин «идиопатический нефротический синдром». Морфологически в основе идиопатического НС у детей лежат минимальные изменения (МИ) — до 85%, фокально-сегментарный гломерулосклероз (ФСГС) — до 5–7%, мезангиопролиферативный гломерулонефрит (МзПГН), как правило, иммунонегативный — 4–6%) и мембранозный гломерулонефрит (МГН) — до 1–2%. В последующие возрастные периоды это соотношение меняется (см. табл.). При нефротическом синдроме с минимальными изменениями (НСМИ) гломерулярная базальная мембрана проницаема преимущественно для низкомолекулярных белковых молекул (альбумин, трансферрин и др.), поэтому протеинурия носит селективный характер. Более выраженные изменения гломерулярного фильтра приводят к фильтрации крупных белков (глобулинов), что обусловливает неселективность протеинурии. В силу выраженного преобладания в детском возрасте НСМИ, особенно до 8–10 лет, биопсия почки детям с впервые возникшим «чистым» НС с селективной протеинурией не показана. Наличие смешанного НС (с артериальной гипертензией и/или гематурией) и резистентность к кортикостероидной терапии указывают на иные варианты ГН, требующие морфологического уточнения.
Осложнения нефротического синдрома
Осложнения нефротического синдрома связаны прежде всего с потерей белков, выполняющих различные функции, и гиповолемией. Потеря альбуминов, помимо указанных выше эффектов, повышает токсичность препаратов, связанных с альбумином. Потеря иммуноглобулинов и составляющих системы комплемента приводит к снижению иммунитета и частым инфекциям. Низкая концентрация белка-переносчика железа — трансферрина — имеет следствием развитие гипохромной микроцитарной железодефицитной анемии, резистентной к терапии препаратами железа. Дефицит липопротеинов высокой плотности приводит к нарушению транспорта холестерина, а потеря орозомукоида и снижение уровня липопротеинлипа-зы — к триглицеридемии, что повышает риск атеросклероза. Помимо этого, возможно развитие рахитоподобного синдрома вследствие потери витамин-Д-связывающего белка, повышенной кровоточивости из-за дефицита прокоагулянтов (факторы IX, X, XII), функционального гипотиреоидизма из-за потери тироидсвязывающего глобулина и повышения свободного тироксина в крови, склонности к экзогенному гиперкортицизму вследствие дефицита транскортина и повышения концентрации свободного кортизола и др.
Иммуносупрессивная терапия идиопатического НС
Основой патогенетического лечения идиопатического НС является иммуносупрессивная терапия. В качестве иммуносупрессивных препаратов используются традиционные, неселективные препараты (глюкокортикоиды, цитостатики и антиметаболиты) и селективные иммунодепрессанты (циклоспорин А, такролимус, мофетила микофенолат).
Глюкокортикоиды (ГК) — преднизолон (ПЗ) (медопред, преднизол, преднизолон) и метилпреднизолон (МП) (метипред, солу-медрол) — являются первыми препаратами выбора при иммуносупрессивном лечении ГН. ГК влияют на перераспределение иммунокомпетентных и воспалительных клеток, препятствуя их поступлению в очаг воспаления, подавляют их чувствительность к медиаторам воспаления, угнетают секрецию таких провоспалительных цитокинов, как ФНО-α, ИЛ-1, ИЛ-2, ИЛ-6. ГК запускают процессы глюконеогенеза, способствуя включению антител в углеводный обмен и тем самым снижая их количество, тонизируют капиллярную стенку и снижают гиперемию за счет активации и набухания перицитов. Введение больших доз ГК в виде «пульсов» МП угнетает образование ДНК-антител, приостанавливает образование иммунных комплексов, уменьшает их массу и способствует выходу из субэндотелиальных слоев гломерулярной базельной мембраны, повышает клубочковую фильтрацию и почечный кровоток.
В зависимости от ответа на гормональную терапию выделяют гормоно(стероидо)чувствительный и гормоно(стероидо)резистентный нефротический синдром. При первичном нефротическом синдроме, в основе которого лежат минимальные изменения в гломерулах, организм пациента в абсолютном большинстве случаев (до 90%) хорошо отвечает на терапию преднизолоном (развивается полная клинико-лабораторная ремиссия). Резистентность к глюкокортикоидной терапии или частичная ремиссия (неполная резистентность или чувствительность) заставляет предположить иные, не минимальные, изменения в гломерулах при первичном гломерулонефрите либо вторичный характер поражения почек.
ГК назначаются детям во всех случаях впервые возникшего НС, при рецидивах гормоночувствительного НС (как правило, НСМИ), при прогрессирующем течении ГН, в сочетании с другими иммунодепрессантами и пр.
На практике применяются три режима ГК терапии.
Постоянный пероральный прием ПЗ в дозе 1–2 мг/кг в 2–4 приема с учетом суточной активности коры надпочечников (максимальные дозы препарата в утренние часы с последующим снижением, последний прием не позднее 16.00) назначается в начале лечения для достижения ремиссии.
Альтернирующий (альтернативный) режим приема ПЗ используется при переходе на поддерживающую терапию. Заключается в приеме суточной дозы ПЗ через день, что позволяет при сохранении клинического эффекта значительно снизить побочные явления: острые — бессонницу, эйфорию, психоз, повышение аппетита; хронические — отеки, ожирение, миопатию, стрии, атрофию кожи, гирсутизм, aкне, остеопороз, катаракту, повышение АД, стероидный диабет; адреналовый криз — острую надпочечниковую недостаточность при резкой отмене препарата. Также существует вариант альтернирующего режима с приемом ПЗ ежедневно в течение 3 дней, затем 3–4 дня перерыва. По эффективности оба режима альтернирующего приема ПЗ примерно одинаковы.
Пульс-терапия МП используется для достижения очень высоких концентраций ГК в плазме. Заключается во внутривенном капельном введении в течение 20–40 мин около 30 мг/кг МП (не более 1 г на пульс) один раз в 48 ч. Количество введений, а также разовая и суммарная доза определяются выбранной схемой терапии данной патологии.
Побочные эффекты глюкокортикоидов могут быть следующими: бессонница, эйфория, психоз, повышение аппетита, отеки, ожирение, миопатия, стрии, атрофия кожи, гирсутизм, акне, остеопороз, катаракта, повышение АД, стероидный диабет, адреналовый криз (острая надпочечниковая недостаточность при резкой отмене препарата).
Цитостатические (цитотоксические) препараты (ЦС). Алкилирующие агенты: циклофосфамид (циклофосфан, цитоксан) и хлорамбуцил (хлорбутин, лейкеран) — нарушают деление клеток за счет связывания с нуклеиновыми кислотами ядерной ДНК. Поступают в организм в неактивном состоянии, активизируются в печени. Действуют неизбирательно на все делящиеся клетки (неселективные иммуносупрессанты).
Циклофосфамид назначается внутрь или в виде «пульсов». Внутрь препарат назначается из расчета 2,0–2,5 мг/кг/сут на 8–12 нед при лечении гормонозависимого или часторецидивирующего НС на фоне постепенного снижения дозы альтернирующего режима ПЗ, а также при гормонорезистентности.
Пульс-терапия циклофосфамидом проводится на фоне альтернирующего курса ПЗ при гормонозависимом и гормонорезистентном НС из расчета 12–17 мг/кг внутривенно капельно. Количество «пульсов» и временной интервал между ними зависят от выбранной схемы терапии. Другой вариант — «пульс» 1 раз в месяц в течение 6–12 мес, в кумулятивной дозе не выше 250 мг/кг.
Хлорамбуцил принимается per os в дозе 0,15–0,2 мг/кг/сут в течение 8–10 нед для лечения гормонозависимого и часторецидивирующего НС, реже при гормонорезистентном НС, на фоне альтернирующего курса ПЗ с постепенным снижением.
Антиметаболиты — азатиоприн и метотрексат — в настоящее время при лечении ГН используются редко. Из побочных действий цитостатиков возможны: при применении циклофосфана — тошнота, рвота, лейкопения, геморрагический цистит, недостаточность гонад; хлорбутина — легочный фиброз, дерматит, судороги, гепатопатия, лейкопения.
Селективные иммунодепрессанты
Циклоспорин А (ЦиА) — сандимун, сандимун неорал, консупрен, биорал, экорал и др. — подавляет продукцию ИЛ-2, ИЛ-3, ИЛ-4, g-ИФ активность (CD4+)Т-хелперов в момент представления антигена, пролиферацию цитотоксических Т-лимфоцитов. На развившийся антительный ответ не влияет.
Применяется при гормонозависимом и часто рецидивирующем НС, в 95% случаев эффективен у больных с чувствительностью к ГК. Начальная доза — 5–6 мг/кг. Дальнейшая доза определяется переносимостью препарата и концентрацией в крови (не выше 80–150 нг/мл). Перед назначением ЦиА необходимо проведение биопсии почки, через 1–1,5 года терапии ЦиА проводится повторная биопсия (из-за нефротоксического эффекта и склерозирующего влияния на канальцы и интерстиций). Необходим постоянный контроль уровня креатинина в крови и концентрации препарата. При передозировке возможно развитие: гипертрихоза, гипертрофического гингивита, диспепсии, лимфопролиферативных заболеваний, гипертензии, нарушений функции почек и печени. Повышают концентрацию ЦиА в крови ГК, антагонисты кальция, кетоконазол, макролиды (при сочетании с ГК доза ЦиА может быть уменьшена). Понижают концентрацию ЦиА в крови барбитураты, алкоголь, рифампицин, триметаприм и другие сульфаниламиды.
Мофетила микофенолат (селсепт) — новый селективный иммуносупрессант — ингибирует инозинмонофосфат дегидрогеназу, истощает запасы гуанозиновых нуклеотидов в клетках. Селективно ингибирует пролиферацию Т- и В-лимфоцитов, образование цитотоксических Т-лимфоцитов и продукцию антител. В настоящее время только начал применяться в детской нефрологии для лечения гормонозависимых и гормонорезистентных вариантов НС, однако первые результаты оцениваются как положительные.
Такролимус (FK-506) — новый селективный иммуносупрессант, как и селсепт, зарекомендовавший себя в трансплантологии. Сходен по механизмам действия с ЦиА. Подавляет Т-хелперы, продукцию (или высвобождение) ФНО-α и ИЛ-1. Пока не получил широкого применения в лечении ГН у детей.
Новые направления иммуносупрессивной терапии ГН
В настоящее время активно разрабатываются два направления терапии ГН:
Эффективность этих методов доказана экспериментально. Их внедрение в клиническую практику способно значительно улучшить прогноз больных с ГН. Данные методики позволяют, определив индивидуальный цитокиновый профиль больного, с помощью моноклональных антител и простимулированных провоспалительными цитокинами макрофагов точечно коррегировать нарушения межклеточной коммуникации, избирательно подавляя или активизируя те или иные факторы, ликвидировать диспропорции в течении иммуновоспалительной реакции у конкретного больного. Таким же образом можно предупреждать развитие просклеротической активности при ГН.
При развитии ремиссии НС (обычно в течение 1–4 нед при МИ) лечение в максимальной дозе продолжается до 6 нед, затем прием ПЗ переводится на альтернирующий курс из расчета 1,5 мг/кг в течение 48 ч на 6 нед, с последующим постепенным (медленным!) снижением дозы в течение нескольких месяцев.
Необходимо помнить, что дальнейшее течение идиопатического НС на 90% зависит от правильного лечения первого эпизода. При этом следует учитывать следующее.
Затруднения при лечении больных с идиопатическим НС могут быть связаны со следующими факторами.
Критерии выявления стероидорезистентности: отсутствие ремиссии НС после лечения ПЗ в полной дозе 2 мг/кг или 60 мг/м 2 в течение 8 нед или отсутствие ремиссии НС после лечения ПЗ в полной дозе в течение 6 нед и трех «пульсов» МП.
Стероидорезистентность заставляет предположить, что в основе идиопатического НС лежат не МИ, а ФСГС, МзПГН или более редкие варианты нефрита.
Выявленная стероидорезистентность служит показанием к проведению нефробиопсии. Дальнейшее лечение НС строится на основе морфологической картины ГН.
Лечение первого рецидива НСМИ: ПЗ в дозе 60 мг/м 2 (2 мг/кг) до исчезновения протеинурии (отсутствие белка в трех последовательно взятых анализах) + 3 дня; затем альтернирующий курс — 1,5 мг/кг в течение 48 ч в течение 6 нед; затем медленное снижение дозы на альтернирующем курсе. При частом рецидивировании или развитии гормонозависимости целесообразна терапия цитостатиками на фоне альтернирующего курса ПЗ или назначение ЦиА.
Принципы лечения первичного ФСГС
Начало лечения ФСГС проходит как терапия идиопатического НС. Достижение ремиссии при адекватной терапии ПЗ — очень хороший прогностический признак: 10-летняя выживаемость таких больных составляет около 95%.
При достижении ремиссии НС дальнейшее лечение аналогично терапии НСМИ.
При установлении гормонорезистентности показано проведение нефробиопсии. Собственно лечение именно ФСГС в детской практике начинается только на этом этапе, так как до этого осуществляется терапия идиопатического НС (без морфологического уточнения). Цель терапии ФСГС — достичь ремиссии (улучшается прогноз); если это не удается, снижение протеинурии — единственный шанс замедлить развитие ХПН. При значениях протеинурии ниже 2 г/сут 10-летняя выживаемость больных составляет около 90%; при нефротической протеинурии (2,5–5,0) 10-летняя выживаемость около 45%; при протеинурии, равной или более 14 г/сут, максимальный срок жизни больных примерно 6 лет (без заместительной терапии).
У взрослых применяются высокие дозы ПЗ (1 мг/кг/сут) в течение не менее 4 мес, после чего в отсутствие ремиссии больной может быть признан гормонорезистентным. В детской практике, поскольку лечение ПЗ было проведено до биопсии и гормонорезистентность была доказана, к терапии подключаются алкилирующие агенты (циклофосфамид) на фоне альтернирующего режима приема ПЗ, возможны «пульсы» МП или циклофосфамида. Сочетание ЦС и ГК в лечении ФСГС дает наиболее выраженный эффект: 10-летняя почечная выживаемость составляет около 80%, в отличие от монотерапии ГК (около 40%) или ЦС (около 20%). У взрослых пациентов показана зависимость частоты ремиссий при ФСГС от кумулятивной дозы ГК: при 8 — 9-месячном курсе ГК частота ремиссий близка к 100%.
Принципы лечения МзПГН
Изначально лечение МзПГН, манифестирующего в виде НС, проводится так же, как и терапия идиопатического НС.
Единого подхода к лечению морфологически установленного МзПГН (IgA-нефропатии) не существует. Учитывая частую гормонорезистентность МзПГН, обычно назначаются преднизолон и цитостатики (чаще циклофосфамид) по тем же схемам, что и при ФСГС.
Общие рекомендации к ведению больных с IgA-нефропатией.
Принципы терапии МГН
Иммуносупрессивная терапия при МГН не показана больным без НС и с нормальной функцией почек. Однако такие больные должны находиться под постоянным наблюдением. Коррекция артериальной гипертензии (в случае ее развития) и протеинурии (более 1 г/сут) осуществляется путем назначения ингибиторов ангиотензинпревращающего фермента, коррекция гиперлипидемии — с помощью диеты.
В случае манифестации МГН в виде НС (или более позднем его развитии) лечение осуществляется как при идиопатическом НС. При частом рецидивировании НС, гормонозависимости или резистентности к терапии подключаются МП, хлорамбуцил или ЦиА (схемы C. Ponticelli, de Santo и др.). Комбинированное применение ГК и ЦС снижает частоту рецидивирования в дальнейшем, хотя для достижения ремиссии назначение ГК с ЦС по эффективности мало отличается от монотерапии ГК.
При выборе терапевтической тактики в отношении МГН важно помнить, что, по мнению C. Ponticelli, МГН является потенциально излечимым заболеванием.
Таким образом, иммуносупрессивная терапия служит основой патогенетического лечения идиопатического нефротического синдрома. Помимо иммуносупрессивной терапии, не менее важное значение имеют диетические и режимные мероприятия, санация очагов хронической инфекции, лечение интеркурентных заболеваний, элиминация аллергенов и др. И все же своевременное назначение, адекватная доза и длительность терапии глюкокортикоидами, которые можно считать основными условиями достижения ремиссии, благоприятно влияют на прогноз заболевания.
Литература
С. В. Бельмер, доктор медицинских наук, профессор
А. В. Малкоч, кандидат медицинских наук
РГМУ, Москва