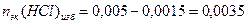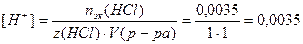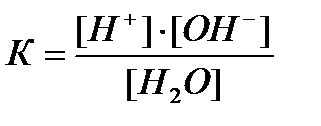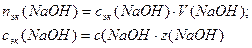Что называют водородным показателем гидроксильным показателем
Водородный и гидроксильный показатели: рН и рОН



1) нейтральная среда :
Чтобы избежать неудобств, связанных с применением чисел с отрицательными показателями степени, концентрацию водородных ионов принято выражать через водородный показатель и обозначать символом рН.
Водородным показателем рН называют десятичный логарифм концентрации водородных ионов, взятый с обратным знаком:
где [Н + ] – концентрация ионов водорода, моль/л.
Понятие «водородный показатель» было введено датским химиком Серенсеном в 1909 г.: буква «р» – начальная буква датского слова potenz – математическая степень, буква Н – символ водорода.
С помощью рН реакция растворов характеризуется так:
нейтральная рН=7, кислая рН 7.
С помощью рОН реакция растворов характеризуется так:
нейтральная рОН=7, кислая рОН>7, щелочная рОН
Водородный и гидроксидный показатели
Концентрацию ионов H + в растворах принято выражать водородным показателем. Водородный показатель– это безразмерное число, которое характеризует концентрацию катионов водорода в растворах. Обозначение водородного показателя – рН (читается «пэ-аш»). Водородный показатель связан с молярной концентрацией катионов водорода соотношением
рН = –lg[H + ], или рН = –lgC(Н + )
Пользоваться водородным показателем вместо концентрации катионов водорода очень удобно, так как он равен небольшому безразмерному числу в интервале от 0 до14.
Величина рН характеризует среду раствора, которая может быть кислотной, щелочной или нейтральной.
Если рН –7 моль/л, т.е. больше, чем в чистой воде; такой раствор имеет кислотную(часто говорят: кислую) среду. Если рН > 7, то концентрация катионов водорода в растворе менее чем 10 –7 моль/л, т.е. меньше, чем в чистой воде; такой раствор имеет щелочнуюсреду. При рН = 7 среда нейтральная.
pОН = –lg[OH – ], или рОН = –lgC(ОН – )
Cумма водородного и гидроксидного показателей равна отрицательной величине десятичного логарифма ионного произведения воды, то есть числу 14:
Водородный показатель свежеприготовленной дистиллированной воды равен 7,00, но при стоянии она насыщается углекислым газом из воздуха, и в результате реакции
значение рН постепенно снижается до 5,5. Водородный показатель морской воды около 8,0. Сок большинства фруктов и ягод имеет кислую среду с рН = 2,6–4,4. Физиологические жидкости организма имеют различное значение рН: плазма крови – 7,36, слёзы – 7,7, пот – 7,4, слюна – 6,51, моча – 5,8, желудочный сок – 1,65.
Пример 20. Вычислите водородный показатель растворов соляной кислоты (С = 0,005 М) и гидроксида калия (С = 4,2·10 –3 М).
Решение. Оба данных раствора – это растворы сильных электролитов, которые диссоциируют необратимо:
HCl = H + + Cl – ; KOH = K + + OН –
1) Вычисляем рН раствора соляной кислоты:
рН = –lg[H + ] = –lg0,005 = 2,30
2) Вычисляем рОН раствора гидроксида калия:
рОН = –lg[ОH – ] = –lg4,2∙10 –3 = 2,38
3) Вычисляем рН раствора гидроксида калия:
рН = 14 – рОН = 14,00 – 2,38 = 11,62
Пример 21. Вычислите рН раствора циановодородной кислоты (константа диссоциации К = 6,2·10 –10 ) с молярной концентрацией 0,17 М.
Решение. Циановодородная кислота, как слабый электролит, диссоциирует обратимо:
1) Степень электролитической диссоциации вычисляем по закону разбавления Оствальда:
a = 
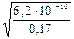
2) Определяем концентрацию катионов водорода:
[H + ] = α∙С(HCN) = 6,0·10 –5 ·0,17 = 1,0·10 –5
3) Вычисляем водородный показатель: рН = –lg[H + ] = –lg1,0∙10 –5 = 5
Для экспериментального определения рН используются индикаторы, специальные приборы (рН-метры) и метод титрования растворов. В качестве индикаторов используются органические вещества, окраска которых меняется в зависимости от концентрации ионов водорода. Использование индикаторов и метод титрования вы изучаются на лабораторном занятии.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Понятие водородного и гидроксильного показателей
Равновесной концентрацией ионов водорода или гидроксила можно количественно охарактеризовать степень кислотности или щёлочности любого раствора. Чаще принято характеризовать растворы концентрацией ионов водорода:
Для удобства проведения расчётов – избавление от отрицательных степеней – в значениях концентраций ионов водорода и гидроксила предложено применять вместо подлинных значений концентраций [Н + ] и [ОН – ] их отрицательные логарифмы.
При увеличении концентрации водородных ионов величина рН уменьшается, при увеличении концентрации гидроксил-ионов величина рН увеличивается, т.е. в кислой среде рН 7.
Индикаторы – вещества, изменяющие свою окраску при взаимодействии с одним из реагирующих веществ реакции. Под интервалом (областью перехода) индикатора понимают промежуток значений рН, в котором происходит заметное изменение окраски индикатора. В таблице приведены интервалы некоторых индикаторов.
| Индикатор |  Область перехода ∆ Область перехода ∆ |  Цвет индикатора в средах кислой щелочной Цвет индикатора в средах кислой щелочной |
| Метиловый оранжевый | 3,2 – 4,4 | красный жёлтый |
| Лакмус | 5 – 8 | красный синий |
| Фенолфталеин | 8,2 – 10,0 |  бесцветный малиновый бесцветный малиновый |
| Метиловый красный | 4,2 – 6,2 | красный жёлтый |
Буферные растворы
Растворы, сохраняющие практически неизменными величины рН при разбавлении, либо при добавлении к ним небольших количеств кислот или щелочей называются буферными. Буферные растворы именуются часто буферными смесями, так как по составу они представляют смеси электролитов с одноимёнными ионами:
1. Слабой кислоты и одноимённой её соли. Например, ацетатный буфер:
СН3СООН и СН3СООNa.
2. Слабого основания и соли с одноимёнными катионами. Например, аммиачный буфер: NH4OH и NH4Cl.
3. Гидросолей многоосновных кислот с одноимёнными катионами. Например, NaН2РО4 и Na2НРО4.
4. Составы буферных смесей разнообразны и могут быть ещё более сложными.
Регулирующий механизм рН буферных растворов основан на смещении устанавливающихся в них равновесий. Например, в аммиачном буфере имеются следующие равновесные процессы: NH4OH D NH4 + + OH –
Расчётные формулы для вычисления рН буферных растворов представлены в таблице 3 приложения.
Гидролиз солей
Гидролизом называется ионообменное взаимодействие соли с водой, в результате которого образуются малодиссоциирующие соединения (ионы или молекулы). Продуктами гидролиза могут быть слабая кислота (или кислотные остатки) и слабое основание (или основные остатки).
При рассмотрении солей как продуктов взаимодействия кислоты с основанием в зависимости от силы их можно выделить 4 типа солей, образованных:
1) сильной кислотой и сильным основанием;
2) сильным основанием и слабой кислотой;
3) слабым основанием и сильной кислотой;
4) слабым основанием и слабой кислотой.
В зависимости от типов солей возможны 4 случая их гидролиза:
1. Соли, образованные сильным основанием и сильной кислотой (например, K2SO4, NaNO3, KCl, NaCl) гидролизу не подвергаются, так как при взаимодействии их с водой слабые электролиты не образуются. В таких растворах равновесие в процессе диссоциации воды не нарушается, реакция среды остаётся нейтральной.
Катионы натрия с водой не взаимодействуют.
Na2CO3 + Н2О D NaНCO3 +NaОН.
Анионы NO3 – сильной кислоты с водой не взаимодействуют. Катион Fe 3+ является катионом слабого основания Fe(ОН)3, основной остаток FeOH +2 взаимодействует с молекулами воды с образованием малодиссоциирующего продукта – основного остатка FeOH +2 :
Fe(NO3)3 + Н2О D (FeOH)( NO3)2 + НNO3.
Итак, при растворении в воде солей, образованных слабым основанием и
4. Если соль образована слабым основанием и слабой кислотой, происходит гидролиз её по катиону слабого основания и по аниону слабой кислоты – полный необратимый гидролиз до конечных продуктов гидролиза. Например, если сульфид алюминия Аl2S3, полученный сжиганием алюминия в порошке серы, бросить в воду, то моментально произойдёт бурная реакция гидролиза
Аl2S3: Аl2S3 + 6Н2О = 2Al(OH)3 + 3H2S.
В результате образуется осадок Al(OH)3 и выделится сероводород. Этот гидролиз необратим, поэтому реакцией обмена в растворе Аl2S3 получить нельзя. Вместо него образуются продукты гидролиза.
Уравнения необратимого гидролиза составляют только в молекулярной форме.
Расчётные формулы для вычисления рН растворов гидролизующихся солей представлены в таблице 3 приложения.
Дата добавления: 2016-09-06 ; просмотров: 4142 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Ионное произведение воды. Водородный показатель. Гидроксильный показатель.



Вода, являясь весьма слабым электролитом, в очень малой степени диссоциирует на ионы:
Данный равновесный процесс описывается константой равновесия:
Так как степень диссоциации воды очень мала, то в уравнении (1) концентрацию воды [Н2О] можно считать величиной постоянной
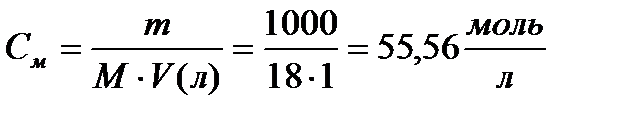
где Кw – ионное произведение воды.
Подставляя значения К и [Н2О] в уравнение (2), получим численное значение ионного произведения воды при 22 0 С.
Зависимость КW от температуры демонстрируется следующими данными:
t, C 0 10 22 30 50 100
Таким образом, КW— величина постоянная лишь при данной температуре.
Чтобы избежать неудобств, связанных с применением чисел с отрицательными показателями степени, концентрацию водородных ионов принято выражать через водородный показатель и обозначать символом рН.
Водородным показателем рН называют десятичный логарифм концентрации водородных ионов, взятый с обратным знаком:
Гидроксильным показателем рОН называют десятичный логарифм концентрации гидроксид-ионов, взятый с обратным знаком:
Наглядно зависимость между концентрацией ионов водорода, величиной рН и реакцией раствора можно выразить схемой
IV.Водородный и гидроксильный показатели растворов



Расчет pH и pOH растворов сильных кислот.
Cильные кислоты в растворе диссоциируют полностью:
c(B) – молярная концентрация кислоты, моль/л;
α – степень диссоциации;
Кислотность среды водного раствора сильной кислоты характеризуют водородным показателем рН:
Водородный и гидроксильный показатели взаимосвязаны:
Пример 11.ОпределитеpOH 0,1н раствора Н2SO4, степень электролитической диссоциации которой равна 90%.
Решение. Н2SO4 – сильный электролит, процесс диссоциации описывается уравнением: H2SO4 = 2H + + SO4 2- ; NH + = 2;
1. Определим молярную концентрацию кислоты:
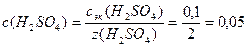
3.Определим рН раствора кислоты:
4. pOH = 14 – pH = 14 – 1,05= 12,95
Пример 12. Определите концентрацию гидроксид-ионов 5%-ного раствора HCl, степень электролитической диссоциации HCl равна 80%, плотность раствора 1,03 г/мл.
1. Определим молярную концентрацию HCl:
Примем m(р-ра)=100г, тогда m(HCl)= 5г,
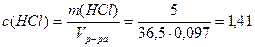
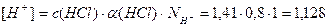
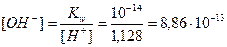
Пример 13. В 3л раствора содержится 0,015 моль HCl и 0,075 моль H2SO4, a(HCl)=1, a(H2SO4)=1. Определите pOH раствора.
Решение.Раствор содержит две сильные кислоты, уравнения их диссоциации:
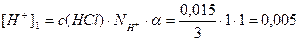
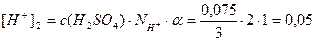
[H + ] = [H + ]1 + [H + ]2 = 0,005 + 0,05 = 0,055 моль/л;
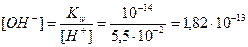
Пример 14.Рассчитайте pH раствора, полученного при смешивании 50 мл 0,1М HCl, 15мл 0,1M NaOH и 935мл H2O.
Решение. При смешивании щелочи и кислоты в растворе происходит реакция нейтрализации:
NaOH + HCl = NaCl + H2O
Реакция среды раствора будет определяться избытком
кислоты или щелочи, оставшейся после реакции.
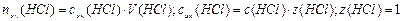
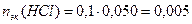
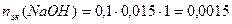
3. Взаимодействующие в ходе реакции вещества подчиняются закону эквивалентов: nэк(HCl) = nэк(NaOH). Следовательно, после реакции в растворе останется избыток HCl в количестве: