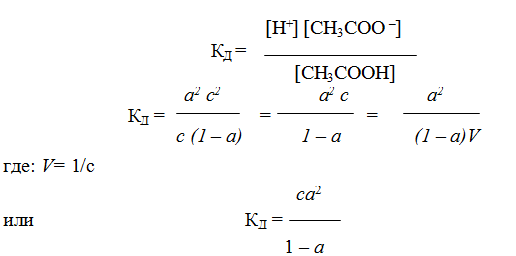Что называют степенью диссоциации электролита
Что называют степенью диссоциации электролита
Ключевые слова конспекта: электролитическая диссоциация, теория, электролиты, неэлектролиты, определения основаниям, кислотам и солям как электролитам, степень диссоциации, степень электролитической диссоциации.
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Электрический ток – это направленное движение заряженных частиц. В металлах такое направленное движение осуществляется за счёт относительно свободных электронов. Но проводить электрический ток могут не только металлы.
Вещества, растворы или расплавы которых проводят электрический ток, называются электролитами. Вещества, растворы или расплавы которых не проводят электрический ток, называются неэлектролитами.
Почему же электролиты проводят электрический ток?
В 1887 г. шведский учёный Сванте Аррениус сформулировал положения теории электролитической диссоциации. Основная идея этой теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. Электропроводность электролитов обусловлена именно наличием в растворе свободных ионов, которые и являются носителями зарядов.
В дальнейшем теория электролитической диссоциации совершенствовалась. Современная теория водных растворов электролитов, кроме теории С. Аррениуса, включает в себя представления о гидратации ионов (И. А. Каблуков, В. А. Кистяковский) и теорию сильных электролитов (П. Й. Дебай, Э. А. Хюккель, 1923 г.).
Основными положениями теории электролитической диссоциации являются следующие:
ОПРЕДЕЛЕНИЯ ОСНОВАНИЙ, КИСЛОТ И СОЛЕЙ
В свете теории электролитической диссоциации можно дать определения основаниям, кислотам и солям как электролитам.
Основания – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид анионов – гидроксид-анионы OH – :
КОН = К + + OH –
Са(ОН)2 = Са 2+ + 2 OH –
Кислоты – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид катионов – катионы водорода Н + (точнее – катионы гидроксония H3O + ).
Катион гидроксония образуется при взаимодействии Н + с молекулой H2O. В результате образуется ещё одна ковалентная связь кислорода с водородом по донорно-акцепторному механизму:
Примеры диссоциации кислот:
НCl = Н + + Cl – или НCl + H2O = H3O + + Cl –
НСlO4 = Н + + СlO4 – или НСlO4 + H2O = H3O + + СlO4 –
Многоосновные кислоты диссоциируют ступенчато:
Соли – это электролиты, диссоциирующие в водном растворе на катионы металлов и анионы кислотного остатка.
Средние соли диссоциируют с образованием только катионов металла и анионов кислотного остатка. Например:
Соли аммония вместо катиона металла содержат катион аммония. Например:
NH4Cl = NH4 + + Cl –
Основные соли диссоциируют с образованием катионов металла, анионов ОН– и анионов кислотного остатка:
Суммарное уравнение: AlOНCl2 = Al 3+ + ОН – + 2Cl –
Кислые соли диссоциируют с образованием катионов металла, катионов водорода (гидроксония) и анионов кислотного остатка. Например:
Суммарное уравнение: Са(НСO3)2 + 2H2O = Са 2+ + 2H3O + + 2СО3 2–
Двойные соли – соли, в результате диссоциации которых образуются катионы нескольких металлов (или аммония и какого–либо металла) и анионы одного кислотного остатка. Например, сульфат калия–хрома (хромокалиевые квасцы):
Смешанные соли – соли, в результате диссоциации которых образуются катионы какого-либо металла и анионы нескольких кислотных остатков. Например, хлорид-гипохлорит кальция (хлорная известь):
СаСlOCl = Са 2+ + Cl – + СlO –
При растворении одних электролитов диссоциация происходит практически полностью. Такие электролиты называют сильными. При растворении других электролитов диссоциация происходит в незначительной мере, их называют слабыми.
СТЕПЕНЬ ДИССОЦИАЦИИ
Для количественной оценки силы электролита введено понятие степени электролитической диссоциации.
Степень электролитической диссоциации (α) – отношение количества вещества электролита, распавшегося на ионы (nрасп.), к количеству вещества электролита, поступившего в раствор (nобщ.):
Степень диссоциации также выражают в процентах, тогда 0%
Конспект урока «Электролитическая диссоциация. Степень диссоциации».
Электролитическая диссоциация. Степень и константа диссоциации
По способности проводить электрический ток в водном растворе или в расплаве, вещества делятся на электролиты и неэлектролиты.
Электролитами называются вещества, растворы или расплавы которых проводят электрический ток. К электролитам относятся соли, кислоты, основания. В молекулах этих веществ имеются ионные или ковалентные сильно полярные химические связи.
Неэлектролитами называются вещества, растворы или расплавы которых не проводят электрический ток. К неэлектролитам относятся, например, кислород, водород, многие органические вещества (сахар, эфир, бензол и др.). В молекулах этих веществ существуют ковалентные неполярные или малополярные связи.
Для объяснения электропроводности растворов и расплавов солей, кислот и оснований шведский ученый С. Аррениус создал теорию электролитической диссоциации (1887 г.):
1.Молекулы электролитов при растворении или расплавлении распадаются на ионы.
Процесс распада молекул электролитов на ионы в растворе или в расплаве называется электролитической диссоциацией, или ионизацией.
Ионы — это атомы или группы атомов, имеющие положительный или отрицательный заряд.
2.В растворе или расплаве электролитов ионы движутся хаотически. При пропускании через раствор или расплав электрического тока, положительно заряженные ионы движутся к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы движутся к положительно заряженному электроду (аноду). Поэтому положительные ионы называются катионами, отрицательные ионы — анионами.
3.Диссоциация — процесс обратимый. Это значит, что одновременно идут два противоположных процесса: распад молекул на ионы (ионизация, или диссоциация) и соединение ионов в молекулы (ассоциация, или моляризация).
Диссоциацию молекул электролитов выражают уравнениями, в которых вместо знака равенства ставят знак обратимости. В левой части уравнения записывают формулу молекулы электролита, в правой — формулы ионов, которые образуются в процессе электролитической диссоциации. Например:
Каждая молекула нитрата магния диссоциирует на ион магния и два нитрат-иона. Следовательно, в результате диссоциации одной молекулы Mg(NO3)2 образуются три иона.
Общая сумма зарядов катионов равна общей сумме зарядов анионов и противоположна по знаку (так как растворы электролитов электронейтральны).
Механизм электролитической диссоциации. Гидратация ионов
Причины и механизм диссоциации электролитов объясняются химической теорией раствора Д. И. Менделеева и природой химической связи. Как известно, электролитами являются вещества с ионной или ковалентной сильно полярной связями. Растворители, в которых происходит диссоциация, состоят из полярных молекул. Например, вода — полярный растворитель. Диссоциация электролитов с ионной и полярной связями протекает различно. Рассмотрим механизм диссоциации электролитов в водных растворах.
I. Механизм диссоциации электролитов с ионной связью
В результате этого взаимодействия между молекулами растворителя и ионами электролита притяжение между ионами в кристаллической решетке вещества ослабевает. Кристаллическая решетка разрушается, и ионы переходят в раствор. Эти ионы в водном растворе находятся не в свободном состоянии, а связаны с молекулами воды, т. е. являются гидратированными ионами.
Диссоциация ионных соединений в водном растворе протекает полностью. Так диссоциируют соли и щелочи: KCl, LiNO3, Ba(OH)2 и др.
II. Механизм диссоциации электролитов, которые состоят из полярных молекул
При растворении в воде веществ с полярной ковалентной связью происходит взаимодействие дипольных молекул электролита с дипольными молекулами воды. Например, при растворении в воде хлороводорода происходит взаимодействие молекул НСl с молекулами Н2O. Под влиянием этого взаимодействия изменяется характер связи в молекуле HCl: сначала связь становится более полярной, а затем переходит в ионную связь. Результатом процесса является диссоциация электролита и образование в растворе гидратированных ионов.
Так диссоциируют кислородсодержащие и бескислородные кислоты: H2SO4, HNO3, НI и др. Диссоциация электролитов с полярной связью может быть полной или частичной. Это зависит от полярности связей в молекулах электролитов.
Таким образом, главной причиной диссоциации в водных растворах является гидратация ионов. В растворах электролитов все ионы находятся в гидратированном состоянии. Например, ионы водорода соединяются с молекулой воды и образуют ионы гидроксония Н3O+ по донорно-акцепторному механизму:
Свойства ионов
Ионы по физическим, химическим и физиологическим свойствам отличаются от нейтральных атомов, из которых они образовались. Например, ионы натрия Na + и хлорид-ионы Сl — не взаимодействуют с водой, не имеют цвета, запаха, неядовиты.
Атомы натрия Na 0 энергично взаимодействуют с водой. Вещество хлор C12 в свободном состоянии — газ желто-зеленого цвета, ядовит, сильный окислитель.
Различные свойства атомов и ионов одного и того же элемента объясняются разным электронным строением этих частиц. Химические свойства свободных атомов металлов определяются валентными электронами, которые атомы металлов легко отдают и переходят в положительно заряженные ионы. Атомы неметаллов легко присоединяют электроны и переходят в отрицательно заряженные ионы. Ионы находятся в более устойчивых электронных состояниях, чем атомы.
Степень диссоциации
В водных растворах некоторые электролиты полностью распадаются на ионы. Другие электролиты распадаются на ионы частично, часть их молекул остается в растворе в недиссоциированном виде.
Число, показывающее, какая часть молекул распалась на ионы, называется степенью электролитической диссоциации (степенью ионизации).
Степень электролитической диссоциации (α) равна отношению числа молекул, которые распались на ионы, к общему числу молекул в растворе:
где n — число молекул, распавшихся на ионы; N — общее число растворенных молекул.
Например, степень диссоциации (α) уксусной кислоты СН3СООН в 0,1 М растворе равна 1,36%. Это означает, что из 10000 молекул СН3СООН 136 молекул распадаются на ионы по уравнению:
Степень диссоциации зависит от природы растворителя и природы растворяемого вещества, концентрации раствора, температуры и других факторов.
Различные вещества диссоциируют в разной степени. Например, муравьиной кислоты НСООН при одинаковых условиях больше α уксусной кислоты СН3СООН.
При уменьшении концентрации электролита, т. е. при разбавлении раствора, степень диссоциации увеличивается, так как увеличиваются расстояния между ионами в растворе и уменьшается возможность соединения их в молекулы.
При повышении температуры степень диссоциации, как правило, увеличивается.
В зависимости от степени диссоциации электролиты делятся на сильные и слабые.
Сильные электролиты — это такие электролиты, которые в водных растворах полностью диссоциируют на ионы, т. е. их степень диссоциации равна 1 (100%). К сильным электролитам относятся: 1) соли; 2) сильные кислоты (HClO4, НСlO3, НNО3, H2SO4, HCl, НВr, HI и др.); 3) щелочи (LiОН, NaOH, КОН, RbOH, СsОН, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Слабые электролиты — это такие электролиты, которые в водных растворах не полностью диссоциируют на ионы, т. е. их степень диссоциации меньше 1 (100%). К слабым электролитам относятся: 1) слабые кислоты (НСlO2, HClO, HNO2, H2SO3, Н2СO3, H2SiO3, Н3РО4, H3РО3, H3BO3, СН3СООН, Н2S, HCN, HF и др.); 2) слабые нерастворимые в воде основания Fe(OH)2, Pb(OH)2, Cu(OH)2 и др.); 3) гидроксид аммония (NH4OH); 4) вода (Н2О).
Константа диссоциации (ионизации)
Для характеристики слабых электролитов применяют константу диссоциации (Kд). Вследствие того, что слабые электролиты диссоциируют на ионы не полностью, в их растворах устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Для слабого электролита общей формулы АnВm уравнение диссоциации имеет вид:
Применяя закон действующих масс, запишем выражение константы равновесия:
Константу равновесия в этом случае называют константой диссоциации (Kд), или константой ионизации.
Константа ионизации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем легче электролит распадается на ионы, тем больше ионов в его растворе, тем сильнее электролит. Например:
Следовательно, уксусная кислота СН3СООН более сильный электролит, чем циановодородная кислота HCN.
Для слабого электролита константа диссоциации — постоянная величина при данной температуре, которая не зависит от концентрации раствора. Константа диссоциации зависит от природы электролита, природы растворителя и температуры. Константы диссоциации некоторых слабых электролитов приведены в таблице.
Значение электролитов для живых организмов
Степень диссоциации. Сильные и слабые электролиты
В растворах некоторых электролитов диссоциирует лишь часть молекул. Способность вещества к электролитической диссоциации называется степенью диссоциации. Она показывает отношение числа молекул, продиссоциированных на ионы, к общему числу молекул растворенного электролита:

где α— степень диссоциации;
п — количество ионов в растворе;
N— общее число молекул в растворе.
По степени диссоциации в растворах все электролиты делятся на две группы. К первой группе относят электролиты, степень диссоциации которых в растворах α > 30 % и почти не зависит от концентрации раствора. Их называют сильными электролитами. К сильным электролитам в водных растворах относятся щелочи: КОН, NaOH, Ba(OH)2, Са(ОН)2; кислоты: HNO3, НСl, H2SO4, НClO4, а также их соли.
Электролиты, степень диссоциации которых в растворах α Читайте также: Понижение давления насыщенного пара над раствором. Осмос
В растворах слабых электролитов процесс диссоциации протекает обратимо и его можно представить в виде обратимой химической реакции. Так, для процесса диссоциации уксусной кислоты:
константа равновесия этого процесса будет равна:

где [СНзСОО-], [Н+] — концентрация ионов;
[СН3СООН] — концентрация непродиссоциированных молекул.
Константа равновесия, соответствующая диссоциации слабого электролита, называется константой диссоциации.
Константа диссоциации зависит от природы диссоциирующего вещества и растворителя, температуры и не зависит от концентрации раствора.
Константа диссоциации показывает устойчивость молекул вещества к диссоциации. Чем меньше значение константы диссоциации в данном растворе, тем слабее диссоциирует электролит.
Степень диссоциации a изменяется с изменением концентрации раствора. Рассмотрим эту зависимость на примере слабого электролита уксусной кислоты:
Принимая исходную концентрацию кислоты равной с, а степень диссоциация a, получаем, что концентрация части кислоты, которая диссоциирована, будет равна aс. Так как при диссоциации одной молекулы кислоты образуется по одному иону Н+ и СНзСОО-, то их концентрации будут равны aс. Концентрация кислоты, оставшейся в недиссоциированном состоянии, будет равна с — aс = с(1 — a). Подставив значения равновесных концентраций ионов и кислоты в уравнение (5.2), получим:

Уравнение (5.3) было получено В. Ф. Оствальдом и называется законом Оствальда. Если a Читайте также: Электролиз
Пример 3. Вычислите степень диссоциации хлорноватистой кислоты и концентрацию ионов водорода в растворе с молярной концентрацией 0,05 моль/дм3.
Решение. НСlO — слабый электролит: HCIO « Н+ + СlO-. Следовательно, в соответствии с законом разбавления Оствальда (5.4, б), определяем степень диссоциации:
Кдис(НСlO) = 5×10-8 моль/дм3.
Молярную концентрацию определяем по формуле (5.5). Так как при диссоциации НС1О « Н++ СlO- образуется один ион Н+ (k(Н+) =1), то
с(Н+) = 
Ответ: a(HClO) = 1 ×10-3; с(Н+) = 5×10 5 моль/дм3.
Решение. В уравнение закона разбавления Оствальда (5.3) подставим данные:
Ионное произведение воды, водородный показатель (рН). Вода является слабым электролитом и диссоциирует на ионы в незначительной степени. Процесс диссоциации воды может быть записан уравнением:
Константа диссоциации будет равна:
Преобразуем выражение (5.7) к следующему виду:
Концентрацию молекул воды можно рассчитать, разделив массу 1 дм3 на массу 1 моля:
Произведение двух постоянных величин есть величина постоянная <Кдис[HгО] = const = KH20), тогда уравнение (5.8) принимает вид:
Полученное уравнение показывает, что для воды и разбавленных водных растворов при постоянной температуре произведение концентрации ионов водорода и гидроксила есть величина постоянная.
Эта постоянная величина называется ионным произведением воды.
Численное значение ионного произведения равно:

Таким образом, произведение концентрации ионов водорода и гидроксильных ионов в растворе при температуре 295 К равно 10-14.
Отсюда, для чистой воды концентрация ионов при температуре 295 К равна:

Допустим, что концентрация ионов водорода при добавлении кислоты увеличилась в 1000 раз и стала [Н+] = 10-4 моль/дм3, тогда концентрация ионов [ОН-] в растворе будет равна:

Мы получаем, что в растворах с различной средой всегда присутствуют ионы Н+ и ОН-.
[Н+] Читайте также: Углеводы – классификация и свойства в таблице, общая формула
Для характеристики кислотности (щелочности) среды введен специальный параметр — водородный показатель, или рН. Водородным показателем, или рН, называется взятый с обратным знаком десятичный логарифм концентрации ионов водорода в растворе:
Следовательно, если рН = 7 — нейтральная среда;
Растворы электролитов. Степень диссоциации. Константа диссоциации
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Растворы электролитов.
Примерами растворов электролитов могут служить растворы щелочей, солей и неорганических кислот в воде, растворы ряда солей и жидком аммиаке и некоторых органических растворителях, например ацетонитриле.
Растворы электролитов являются ионными проводниками (проводниками второго рода). В них наблюдаются отклонения от законом Рауля и Вант-Гоффа. Например, согласно закона Рауля, при введении 0,1 моль вещества на 1000 г воды температура замерзания должна снижаться на 0,186 К, а фактически снижается на 0,318 К у NaCl и 0,52 К-у MgCl2. Вант-Гофф ввел поправочный коэффициент i, называемый изотоническим коэффициентом и позволяющий использовать это уравнение для любых разбавленных растворов:
Изотонический коэффициент характеризует отклонение от законов идеальных растворов вследствие электролитической диссоциации электролитов.
7.3.1. Степень диссоциации электролитов.
В растворах некоторых электролитов диссоциирует лишь часть молекул. Для количественной характеристики электролитической диссоциации было введено понятие степени диссоциации. Отношение числа молекул, диссоциированных на ионы, к общему числу молекул растворенного электролита называется степенью диссоциации а. По степени диссоциации в растворах все электролиты делятся на две группы. К первой относят электролиты, степень диссоциации которых в растворах равна единице и почти не зависит от концентрации раствора. Их называют сильными электролитами. К сильным электролитам в водных растворах принадлежит подавляющее большинство солей, щелочей, в также некоторые кислоты.
Электролиты, степень диссоциации которых в растворах меньше единицы и уменьшается с ростом концентрации, называют слабыми электролитами. К ним относят воду, ряд кислот, основания р-, d- и f-элементов. Между этими двумя группами нет четкой границы, одно и то же вещество в одном растворителе проявляет свойства сильного, а в другом — слабого электролита. Например, хлорид лития и иодид натрия, имеющие ионную кристаллическую решетку,
при растворении в воде ведут себя как типичные сильные электролиты,
при растворении же в ацетоне или уксусной кислоте эти вещества
являются слабыми электролитами со степенью диссоциации в раствоpax меньше единицы.
7.3.2. Слабые электролиты. Константа диссоциации.
В растворах слабых электролитов процесс диссоциации протекает обратимо и, следовательно, к нему может быть применен закон действующих масс. Так, для процесса диссоциации кислоты
константа равновесия КС равна
Константа равновесия для процесса диссоциации называется константой диссоциации КД. Например, константа диссоциации уксусной кислоты СН3СООН равна
Константа диссоциации зависит от природы диссоциирующего вещества и растворителя, а также от температурь и не зависит от концентрации раствора. С повышением температуры константа диссоциации обычно уменьшается, что в соответствии с принципом Ле Шателье свидетельствует об экзотермическим характере реакции.
Константа диссоциации указывает на прочность молекул в данном растворе. Чем меньше константа диссоциации в данном растворителе, тем слабее диссоциирует электролит и тем, следовательно, устойчивее его молекулы.
Степень диссоциации изменяется с концентрацией раствора. Рассмотрим зависимость степени диссоциации от концентрации слабого электролита на примере уксусной кислоты:
Концентрация кислоты, оставшейся в недиссоциированном состоянии, будет равна с – ас 2 = с (1 – а). Подставив значения равновесных концентраций ионов и кислоты в уравнение (1), получим:
Уравнение (1) было получено Оствальдом и называется законом Оствальда. Если а « 1, то уравнение упрощается:
Уравнение (2а, 2б) называется законом разбавления Оствальда. Из него следует, что степень диссоциации уменьшается с увеличением концентрации слабого электролита. Аналогичное уравнение можно получить для слабого основания.
Многоосновные слабые кислоты и основания диссоциируют ступенчато, причем константа диссоциации по каждой последующей ступени всегда на несколько порядков ниже, чем по предыдущей.
7.3.3.Сильные электролиты.
Многие свойства растворов, такие, как осмотическое давление, температура кипения и замерзания, давление насыщенного пара, зависят как от концентрации раствора, т. е. от числа растворенных в нем частиц, так и от взаимного влияния этих частиц друг на друга. Степень взаимодействия частиц в растворе тем выше, чем больше плотность их зарядов и чем меньше среднее расстояние между ними.
В растворах слабых электролитов взаимодействие ионов друг с другом относительно невелико вследствие их незначительной концентрации. Сильные электролиты в растворах диссоциированы практически полностью. Поэтому в уравнении диссоциации электролита стрелка указывает только на прямой процесс, например:
В растворах сильных электролитов из-за полной их диссоциации концентрация ионов велика. Поэтому свойства таких растворов существенно зависят от степени взаимодействия входящих в их состав ионов как друг с другом, так и с полярными молекулами растворителя. Взаимодействие ионов в растворах сильных электролитов приводит к тому, что катионы и анионы испытывают взаимное притяжение, а ионы одного знака заряда будут отталкиваться друг от друга. Поэтому в растворе каждый произвольно выбранный ион окружен в среднем во времени преимущественно противоположно заряженными ионами, как, например, в ионных кристаллах. Однако энергия теплового движения ионов в жидких растворах и значительно выше, чем в кристаллах. Поэтому ионы, взаимодействующие с выбранным центральным ионом, располагаются вокруг него не в виде кристаллической решетки, а в виде сферы, которая, согласно П. Дюбая и Э. Хюккеля, называется ионной атмосферой. В состав ионной атмосферы входят катионы и анионы. Однако преобладают ионы, противоположные по знаку заряда центральному иону. Суммарный заряд ионной атмосферы равен по величине заряду центрального иона и противоположен ему по знаку. Все ионы в растворе равноправны, поэтому каждый из них является центральным ионом и одновременно входит в состав ионной атмосферы другого иона. За счет теплового движения ионы, входящие в состав ионной атмосферы, постоянно меняются местами с ионами, находящимися за ее пределами, т. е. ионная атмосфера имеет статистический характер.
Законы Рауля и Вант – Гоффа соблюдаются лишь в разбавленных растворах неэлектролитов. По мере повышения концентрации растворенного вещества возрастают отклонения от законов идеальных растворов. Эти отклонения обусловлены различного рода взаимодействиями между частицами растворенного вещества, а также растворенного вещества и растворителя. Учет влияния на свойства растворов этих взаимодействий очень сложен. Поэтому было предложено сохранить для описания свойств растворов все общие закономерности, применимые к идеальным растворам, но вместо входящих в них концентраций компонентов ввести активности. Активность а связана с концентрацией следующим соотношением:
где γ – коэффициент активности, который формально учитывает все виды взаимодействия частиц в данном растворе, приводящие к отклонению от свойств идеального раствора.
Коэффициенты активности зависят от природы растворителя и растворенного вещества, от концентрации раствора, а также от температуры (табл. 18).
Таблица 18. Коэффициенты активности некоторых электролитов в растворах при 298 К