Что называют продуктами горения
Что называют продуктами горения
При неполном сгорании органических веществ в условиях низких температур и недостатка воздуха образуются более разнообразные продукты – окись углерода, спирты, кетоны, альдегиды, кислоты и другие сложные химические соединения. Они получаются при частичном окислении как самого горючего, так и продуктов его сухой перегонки (пиролиза). Эти продукты образуют едкий и ядовитый дым. Кроме того, продукты неполного горения сами способны гореть и образовывать с воздухом взрывчатые смеси. Такие взрывы бывают при тушении пожаров в подвалах, сушилках и в закрытых помещениях с большим количеством горючего материала. Рассмотрим кратко свойства основных продуктов горения.
Углекислый газ или двуокись углерода (СО2) – продукт полного горения углерода. Не имеет запаха и цвета. Плотность его по отношению к воздуху 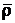
Токсичность углекислого газа незначительна. Концентрация углекислого газа в воздухе 1.5% безвредна для человека длительное время. При концентрации углекислого газа в воздухе, превышающей 3-4.5%, нахождение в помещении и вдыхание газа в течение получаса опасно для жизни. При температуре Т = 0 0 С и давлении р = 3,6 МПа углекислый газ переходит в жидкое состояние. Температура кипения жидкой углекислоты составляет Т = –78 0 С. При быстром испарении жидкой углекислоты газ охлаждается и переходит в твердое состояние. Как в жидком, так и твердом состоянии, капли и порошки углекислоты применяются для тушения пожаров.
Горение
Горе́ние — сложный физико-химический процесс превращения компонентов горючей смеси в продукты сгорания с выделением теплового излучения, света и лучистой энергии. Описать природу горения можно как бурно идущее окисление.
Дозвуковое горение (дефлаграция) в отличие от взрыва и детонации протекает с низкими скоростями и не связано с образованием ударной волны. К дозвуковому горению относят нормальное ламинарное и турбулентное распространения пламени, к сверхзвуковому — детонацию.
Горение подразделяется на тепловое и цепное. В основе теплового горения лежит химическая реакция, способная протекать с прогрессирующим самоускорением вследствие накопления выделяющегося тепла. Цепное горение встречается в случаях некоторых газофазных реакций при низких давлениях.
Условия термического самоускорения могут быть обеспечены для всех реакций с достаточно большими тепловыми эффектами и энергиями активации.
Горение может начаться самопроизвольно в результате самовоспламенения либо быть инициированным зажиганием. При фиксированных внешних условиях непрерывное горение может протекать в стационарном режиме, когда основные характеристики процесса — скорость реакции, мощность тепловыделения, температура и состав продуктов — не изменяются во времени, либо в периодическом режиме, когда эти характеристики колеблются около своих средних значений. Вследствие сильной нелинейной зависимости скорости реакции от температуры, горение отличается высокой чувствительностью к внешним условиям. Это же свойство горения обусловливает существование нескольких стационарных режимов при одних и тех же условиях (гистерезисный эффект).
Содержание
Теория горения
При адиабатическом сжигании горючей смеси могут быть рассчитаны количество выделившегося при горении тепла, температура ТГ, которая была бы достигнута при полном сгорании (адиабатическая температура горения) и состав продуктов, если известны состав исходной смеси и термодинамические функции исходной смеси и продуктов. Если состав продуктов заранее известен, ТГ может быть рассчитана из условия равенства внутренней энергии системы при постоянном объёме или её энтальпии при постоянном давлении в исходном и конечном состояниях с помощью соотношения: ТГ = Т0 + Qr/C, где Т0 — начальная температура смеси, С — средняя в интервале температур от Т0 до ТГ удельная теплоёмкость исходной смеси (с учетом её изменения при возможных фазовых переходах), Qr — удельная теплота сгорания смеси при температуре ТГ. При относительном содержании а0 в смеси компонентов, полностью расходуемых в реакции, QГ = Q*а0 где Q — тепловой эффект реакции горения. Значение ТГ при постоянном объёме больше, чем при постоянном давлении, поскольку в последнем случае часть внутренней энергии системы расходуется на работу расширения. На практике условия адиабатичекого горения обеспечиваются в тех случаях, когда реакция успевает завершиться прежде, чем станет существенным теплообмен между реакционным объёмом и окружающей средой, например в камерах сгорания крупных реактивных двигателей, в больших реакторах, при быстро распространяющихся волнах горения.
Термодинамический расчёт даёт лишь частичную информацию о процессе — равновесный состав и температуру продуктов. Полное описание горения, включающее также определение скорости процесса и критических условий при наличии тепло- и массообмена с окружающей средой, можно провести только в рамках макрокинетического подхода, рассматривающего химическую реакцию во взаимосвязи с процессами переноса энергии и вещества.
В случае заранее перемешанной смеси горючего и окислителя реакция горения может происходить во всём пространстве, занятом горючей смесью (объёмное горение), или в сравнительно узком слое, разделяющем исходную смесь и продукты и распространяющемся по горючей смеси в виде так называемой волны горения. В неперемешанных системах возможно диффузионное горение, при котором реакция локализуется в относительно тонкой зоне, отделяющей горючее от окислителя, и определяется скоростью диффузии реагентов в эту зону.
Описание процессов горения
Важность процесса горения в технических устройствах способствовала созданию различных моделей, позволяющих с необходимой точностью его описывать. Так называемое нулевое приближение включает описание химических реакций, изменение температуры, давления и состава реагентов во времени без изменения их массы. Оно соответствует процессам происходящим в закрытом объёме, в который была помещена горючая смесь и нагрета выше температуры воспламенения. Одно-, двух- и трёхмерные модели уже включает в себя перемещение реагентов в пространстве. Количество измерений соответствует количеству пространственных координат в модели. Режим горения бывает как и газодинамическое течение: ламинарным или турбулентным. Одномерное описанное ламинарного горения позволяет получить аналитически важные выводы о фронте горения, которые затем используются в более сложных турбулентных моделях.
Объёмное горение
Объемное горение происходит, например, в теплоизолированном реакторе идеального перемешивания, в который поступает при температуре Т0 исходная смесь с относительным содержанием горючего а0; при другой температуре горения реактор покидает смесь с иным относительным содержанием горючего а. При полном расходе G через реактор условия баланса энтальпии смеси и содержания горючего при стационарном режиме горения могут быть записаны уравнениями:
где w(а, Т) — скорость реакции горения, V — объём реактора. Используя выражение для термодинамической температуры ТГ, можно из (1) получить:
и записать (2) в виде:
где q—T = GC(T — Т0) — скорость отвода тепла из реактора с продуктами сгорания, q+T = Qw(a, Т)V — скорость выделения тепла при реакции. Для реакции n-ного порядка с энергией активации:
Диффузионное горение
Характеризуется раздельным подачей в зону горения горючего и окислителя. Перемешивание компонентов происходит в зоне горения. Пример: горение водорода и кислорода в ракетном двигателе, горение газа в бытовой газовой плите.
Горение предварительно смешанной среды
Как следует из названия, горение происходит в смеси, в которой одновременно присутствуют горючее и окислитель. Пример: горение в цилиндре двигателя внутреннего сгорания бензиново-воздушной смеси после инициализации процесса свечой зажигания.
Особенности горения в различных средах
Беспламенное горение
В отличие от обычного горения, когда наблюдаются зоны окислительного пламени и восстановительного пламени, возможно создание условий для беспламенного горения. Примером может служить каталитическое окисление органических веществ на поверхности подходящего катализатора, например, окисление этанола на платиновой черни.
Твердофазное горение
Это автоволновые экзотермические процессы в смесях неорганических и органических порошков, не сопровождающиеся заметным газовыделением, и приводящие к получению исключительно конденсированных продуктов. В качестве промежуточных веществ, обеспечивающих массо-перенос, образуются газовые и жидкие фазы, не покидающие, однако, горящую систему. Известны примеры реагирующих порошков, в которых образование таких фаз не доказано (тантал-углерод).
Как синонимы используются тривиальные термины «безгазовое горение» и «твердопламенное горение».
Примером таких процессов служит СВС (самораспространяющийся высокотемпературный синтез) в неорганических и органических смесях.
Тление
Вид горения, при котором пламя не образуется, а зона горения медленно распространяется по материалу. Тление обычно наблюдается у пористых или волокнистых материалов с высоким содержанием воздуха или пропитанных окислителями.
Автогенное горение
Самоподдерживающиеся горение. Термин используется в технологиях сжигания отходов. Возможность автогенного (самоподдерживающегося) горения отходов определяется предельным содержанием балластирующих компонентов: влаги и золы. На основе многолетних исследований шведский учёный Таннер предложил для определения границ автогенного горения использовать треугольник-схему с предельными значениями: горючих более 25 %, влаги менее 50 %, золы менее 60 %.
Продукты горения (сгорания)
Продукты горения – это вещества (газообразные, жидкие или твердые вещества) и соединения, образующиеся в результате сложного физико-химического процесса горения веществ (материалов).
Под продуктами горения чаще всего понимают дым, токсичные продукты горения, сажу и другие.
Продукты горения сухой травы
Состав
Состав их зависит от состава горящего вещества и условий его горения. В условиях пожара чаще всего горят органические вещества (древесина, ткани, бензин, керосин, резина и др.), в состав которых входят главным образом углерод, водород, кислород и азот. При горении их в достаточном количестве воздуха и при высокой температуре образуются продукты полного сгорания: СО2, Н2О, N2. При горении в недостаточном количестве воздуха или при низкой температуре кроме продуктов полного сгорания образуются продукты неполного сгорания: СО, С (сажа).
Продукты сгорания называют влажными, если при расчете их состава учитывают содержание паров воды, и сухими, если содержание паров воды не входит в расчетные формулы.
Реже во время пожара горят неорганические вещества, такие как сера, фосфор, натрий, калий, кальций, алюминий, титан, магний и др. Продуктами сгорания их в большинстве случаев являются твердые вещества, например Р2О5, Na2O2, CaO, MgO. Образуются они в дисперсном состоянии, поэтому поднимаются в воздух в виде плотного дыма. Продукты сгорания алюминия, титана и других металлов в процессе горения находятся в расплавленном состоянии.
При неполном сгорании органических веществ в условиях низких температур и недостатка воздуха образуются более разнообразные продукты – окись углерода, спирты, кетоны, альдегиды, кислоты и другие сложные химические соединения. Они получаются при частичном окислении как самого горючего, так и продуктов его сухой перегонки (пиролиза). Эти продукты образуют едкий и ядовитый дым. Кроме того, продукты неполного горения сами способны гореть и образовывать с воздухом взрывчатые смеси. Такие взрывы бывают при тушении пожаров в подвалах, сушилках и в закрытых помещениях с большим количеством горючего материала. Рассмотрим кратко свойства основных продуктов горения.
Углекислый газ
Углекислый газ или двуокись углерода (СО2) – продукт полного горения углерода. Не имеет запаха и цвета. Плотность его по отношению к воздуху равна 1,52. Плотность углекислого газа при температуре Т = 0 ° С и при нормальном давлении р = 760 миллиметров ртутного столба (мм Hg) равна 1,96 кг/м 3 (плотность воздуха при этих же условиях равна ρ = 1,29 кг/м 3 ). Углекислый газ хорошо растворим в воде (при Т = 15 °С в одном литре воды растворяется один литр газа). Углекислый газ не поддерживает горение веществ, за исключением щелочных и щелочно-земельных металлов. Горение магния, например, происходит в атмосфере углекислого газа по уравнению:
Токсичность углекислого газа незначительна. Концентрация углекислого газа в воздухе 1,5 % безвредна для человека длительное время. При концентрации углекислого газа в воздухе, превышающей 3-4,5 %, нахождение в помещении и вдыхание газа в течение получаса опасно для жизни. При температуре Т = 0 °С и давлении р = 3,6 МПа углекислый газ переходит в жидкое состояние. Температура кипения жидкой углекислоты составляет Т = –78 °С. При быстром испарении жидкой углекислоты газ охлаждается и переходит в твердое состояние. Как в жидком, так и твердом состоянии, капли и порошки углекислоты применяются для тушения пожаров.
Оксид углерода
Всем известная вода – Н2О – также выделяется во время горения виде газа – как пар. Вода является продуктом горения газа метана – СН4. Вообще, вода и углекислота в основном выделяются при полном сгорании всех органических веществ.
Цианистый водород
Акролеин
Пропеналь, акролеин, акрилальдегид – все это названия одного вещества, ненасыщенного альдегида акриловой кислоты: СН2=СН-СНО. Этот альдегид тоже является сильно летучей жидкостью. Акролеин бесцветен, с резким запахом, очень ядовит. При попадании жидкости или ее паров на слизистые, особенно в глаза, вызывает сильное раздражение. Пропеналь является высокореакционным соединением, и это объясняет его высокую токсичность.
Формальдегид
Подобно акролеину, формальдегид принадлежит к классу альдегидов и является альдегидом муравьиной кислоты. Также это соединение известно как метаналь. Это токсичный, бесцветный газ с резким запахом.
Азотсодержащие вещества
Чаще всего во время горения веществ, содержащих азот, выделяется чистый азот – N2. Этот газ и так содержится в атмосфере в большом количестве. Азот может быть примером продукта горения аминов. Но при термическом разложении, к примеру, солей аммония, а в некоторых случаях и при самом горении, в атмосферу выбрасываются и его оксиды, со степенью окисления азота в них плюс один, два, три, четыре, пять. Оксиды – газы, имеют бурый цвет и чрезвычайно токсичны.
Сернистый газ
При горении многих веществ, кроме рассмотренных выше продуктов сгорания выделяется дым – дисперсная система, состоящая из мельчайших твердых частиц, находящихся во взвешенном состоянии в каком-либо газе. Диаметр частиц дыма составляет от 10 −4 до 10 −6 см (от 1 до 0,01 мкм). Отметим, что 1 мкм (микрон) равен 10 −6 м или 10 −4 см. Более крупные твердые частицы, образующиеся при горении, быстро оседают в виде копоти и сажи. При горении органических веществ дым содержит твердые частицы сажи, взвешенные в CO2, CO, N2, SO2 и других газах. В зависимости от состава и условий горения вещества получаются различные по составу и по цвету дымы. При горении дерева, например, образуется серовато-черный дым, ткани – бурый дым, нефтепродуктов – черный дым, фосфора – белый дым, бумаги, соломы – беловато-желтый дым.
В составе дыма, образующегося на пожарах при горении органических веществ, кроме продуктов полного и неполного сгорания, содержатся продукты термоокислительного разложения горючих веществ. Образуются они при нагреве еще негорящих горючих веществ, находящихся в среде воздуха или дыма, содержащего кислород. Обычно это происходит перед факелом пламени или в верхних частях помещений, где находятся нагретые продукты сгорания.
Состав продуктов термоокислительного разложения зависит от природы горючих веществ, температуры и условий контакта с окислителем. Так, исследования показывают, что при термоокислительном разложении горючих веществ, в молекулах которых содержатся гидроксильные группы, всегда образуется вода. Если в составе горючих веществ находятся углерод, водород и кислород, продуктами термоокислительного разложения чаще всего являются углеводороды, спирты, альдегиды, кетоны и органические кислоты. Если в составе горючих веществ, кроме перечисленных элементов, есть хлор или азот, то в дыме находятся также хлористый и цианистый водород, оксиды азота и другие соединения. Так, в дыме при горении капрона содержится цианистый водород, при горении линолеума «Релин» – сероводород, диоксид серы, при горении органического стекла – оксиды азота. Продукты неполного сгорания и термоокислительного разложения в большинстве случаев являются токсичными веществами, поэтому тушение пожаров в помещениях производят только в кислородных изолирующих противогазах.
Пепел, зола, копоть, сажа, уголь
Копоть, или сажа – остатки углерода, который не вступил в реакцию, по разным причинам. Сажу называют также амфотерным углеродом. Зола, или пепел – мелкие частицы неорганических солей, не сгоревших или не разложившихся при температуре горения. При выгорании топлива эти микросоединения переходят во взвешенное состояние или скапливаются внизу. А уголь – это продукт неполного сгорания дерева, то есть не сгоревшие его остатки, но при этом еще способные гореть. Конечно, это далеко не все соединения, которые выделятся при сгорании тех или иных веществ. Перечислить их всех нереально, да и не нужно, потому что другие вещества выделяются в ничтожно малых количествах, и только при окислении определенных соединений.
Классификация
Большинство продуктов горения являются отравляющими веществами. Поэтому, говоря об их классификации, будет правильным ознакомить вас со следующим термином:
Классификация опасности веществ по степени воздействия на организм – это установление (ранжирование) уровней опасности веществ по их поражающему и повреждающему воздействию на организм человека и (или) животного. Более подробно о данной классификации читайте в материале по ссылке >>
Также ознакомьтесь с познавательным материалом по теме:
Формулы для расчета объема
Вид формулы для расчета объема продуктов полного сгорания при теоретически необходимом количестве воздуха зависит от состава горючего вещества.
Индивидуальное химическое соединение
В этом случае расчет ведут, исходя из уравнения реакции горения. Объем влажных продуктов сгорания единицы массы (кг) горючего вещества при нормальных условиях рассчитывают по формуле:
Vп.с. – объем влажных продуктов сгорания, м 3 /кг; 
Например, чтобы определить объем сухих продуктов сгорания 1 кг ацетона при нормальных условиях, составляем уравнение реакции горения ацетона в воздухе:
Определяем объем сухих продуктов сгорания ацетона:
Объем влажных продуктов сгорания 1 м 3 горючего вещества (газа) можно рассчитать по формуле:
Vп.с. – объем влажных продуктов сгорания 1 м 3 горючего газа, м 3 /м 3 ; 
Сложная смесь химических соединений
Если известен элементный состав сложного горючего вещества, то состав и количество продуктов сгорания 1 кг вещества можно определить по уравнению реакции горения отдельных элементов. Для этого составляют уравнения реакции горения углерода, водорода, серы и определяют объем продуктов сгорания, приходящийся на 1 кг горючего вещества. Уравнение реакции горения имеет вид:
С + О 2 + 3,76N 2 = СО 2 + 3,76N 2
При сгорании 1 кг углерода получается 22,4 / 12 = 1,86 м 3 СО 2 и 22,4 × 3,76/12 = 7,0 м 3 N 2.
Аналогично определяют объем (в м 3 ) продуктов сгорания 1 кг серы и водорода. Полученные данные приведены ниже:
| СО2 | N2 | Н2О | SO2 | |
| Углерод | 1,86 | 7,00 | – | – |
| Водород | – | 21,00 | 11,2 | – |
| Сера | – | 2,63 | – | 0,7 |
При горении углерода, водорода и серы кислород поступает из воздуха. Однако в состав горючего вещества может входить кислород, который также принимает участие в горении. В этом случае воздуха на горение вещества расходуется соответственно меньше.
В составе горючего вещества могут находиться азот и влага, которые в процессе горения переходят в продукты сгорания. Для их учета необходимо знать объем 1 кг азота и паров воды при нормальных условиях.
На основании приведенных данных определяют состав и объем продуктов сгорания 1 кг горючего вещества.
Например, чтобы определить объем и состав влажных продуктов сгорания 1 кг каменного угля, состоящего из 75,8 % С, 3,8 % Н, 2,8 % О, 1,1 % N, 2,5 % S, W = 3,8 %, A = 11,0 %.
Объем продуктов сгорания будет следующий, м 3 :
| Состав продуктов сгорания | СО2 | Н2О | N2 | SO2 |
| Углерод | 1,86 × 0,758 = 1,4 | – | 7 × 0,758 = 5,306 | – |
| Водород | – | 11,2 × 0,038 = 0,425 | 21 × 0,038 = 0,798 | – |
| Сера | – | – | 2,63 × 0,025 = 0,658 | 0,7 × 0,025 = 0,017 |
| Азот в горючем веществе | – | – | 0,8 × 0,011 = 0,0088 | – |
| Влага в горючем веществе | – | 1,24 × 0,03 = 0,037 | – | – |
| Сумма | 1,4 | 0,462 | 6,7708 – 0,0736 = 6,6972 | 0,017 |
Vп.с. = 1,4 + 0,462 + 6,6972 + 0,017 = 8,576 м 3 /кг.
Смесь газов
Количество и состав продуктов сгорания для смеси газов определяют по уравнению реакции горения компонентов, составляющих смесь. Например, горение метана протекает по следующему уравнению:
СН 4 + 2О 2 + 2 × 3,76N 2 = СО 2 + 2Н 2О + 7,52N 2
Согласно этому уравнению, при сгорании 1 м 3 метана получается 1 м 3 диоксида углерода, 2 м 3 паров воды и 7,52 м 3 азота. Аналогично определяют объем (в м 3 ) продуктов сгорания 1 м 3 различных газов:
| СО2 | Н2О | N2 | SO2 | |
| Водород | – | 1,0 | 1,88 | – |
| Окись углерода | 1,0 | – | 1,88 | – |
| Сероводород | – | 1,0 | 5,64 | 1,0 |
| Метан | 1,0 | 2,0 | 7,52 | – |
| Ацетилен | 2,0 | 1,0 | 9,54 | – |
| Этилен | 2,0 | 2,0 | 11,28 | – |
На основании приведенных цифр определяют состав и количество продуктов сгорания смеси газов.
Анализ продуктов сгорания, взятых на пожарах в различных помещениях, показывает, что в них всегда содержится значительное количество кислорода. Если пожар возникает в помещении с закрытыми оконными и дверными проемами, то пожар при наличии горючего может продолжаться до тех пор, пока содержание кислорода в смеси воздуха с продуктами сгорания в помещении не снизится до 14-16 % (об.). Следовательно, на пожарах в закрытых помещениях содержание кислорода в продуктах сгорания может быть в пределах от 21 до 14 % (об.). Состав продуктов сгорания во время пожаров в помещениях с открытыми проемами (подвал, чердак) показывает, что содержание в них кислорода может быть ниже 14 % (об.):
| СО | СО2 | О2 | |
| В подвалах | 0,15-0,5 | 0,8-8,5 | 10,6-19 |
| На чердаках | 0,1-0,6 | 0,3-4,0 | 16,0-20,2 |
По содержанию кислорода в продуктах сгорания на пожарах можно судить о коэффициенте избытка воздуха, при котором происходило горение.
Действие на организм человека
Степень токсичности веществ связана с их физической и химической природой. Взаимодействуя с организмом, продукты горения вызывают патологические синдромы.
Международная классификация болезней десятого пересмотра МКБ-10 определяет отравление продуктами горения кодом Т59 – «Токсическое действие других газов, дымов и паров».
По механизму действия на человека отравляющие компоненты в составе дыма делятся на пять групп.
Многие токсины, образующие в продуктах горения «универсальны», так как вызывают поражение сразу нескольких систем организма.
Первая помощь при отравлении
Симптомы интоксикации разными веществами могут отличаться, но принципы оказания первой помощи всегда одинаковые.
Большинство ядов поступает через дыхательные пути. Первое, что необходимо сделать при отравлении – прекратить поступление продуктов горения в организм. Для этого необходимо:
Острая интоксикация требуют оказания экстренной помощи. Действия при отравлении продуктами горения, следующие:
Некоторые ингаляционные отравления продуктами горения имеют период мнимого благополучия. Даже при отсутствии патологических симптомов, стоит внимательно следить за состоянием тех, кто может быть отравлен. При первых же признаках неблагополучия необходимо вызывать соответствующих специалистов.
Отравление продуктами горения у детей развивается быстрее, чем у взрослых. Это объясняется более высоким уровнем кислородного обмена. У малышей появляются жалобы на головную боль, сонливость, слезотечение, тошноту. При осмотре заметны изменения цвета кожи, учащение и затруднение дыхания, нарушения координации. Принципы оказания первой помощи для детей те же, что и для взрослых. При отсутствии специализированной медицинской помощи, пострадавшему ребенку угрожают необратимые изменения центральной нервной системы.
Источник: Пожаровзрывобезопасность веществ и материалов и средства их тушения: Справочник. Баратов А.Н., Корольченко А.Я. –М., 1990.




