Что называют кристаллической решеткой
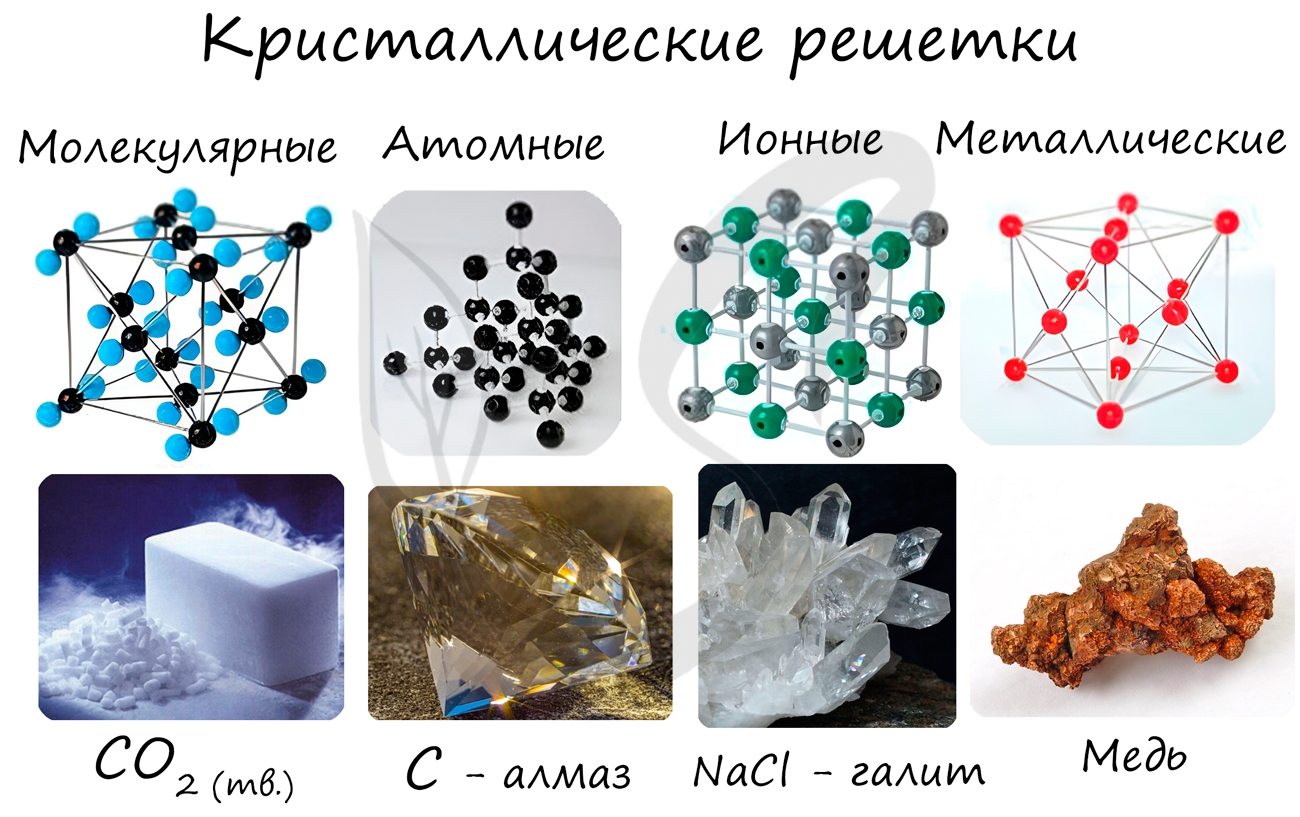
Кристаллические решетки
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают пространственное расположение атомов.
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей. Связи чаще всего ковалентные полярные или неполярные.
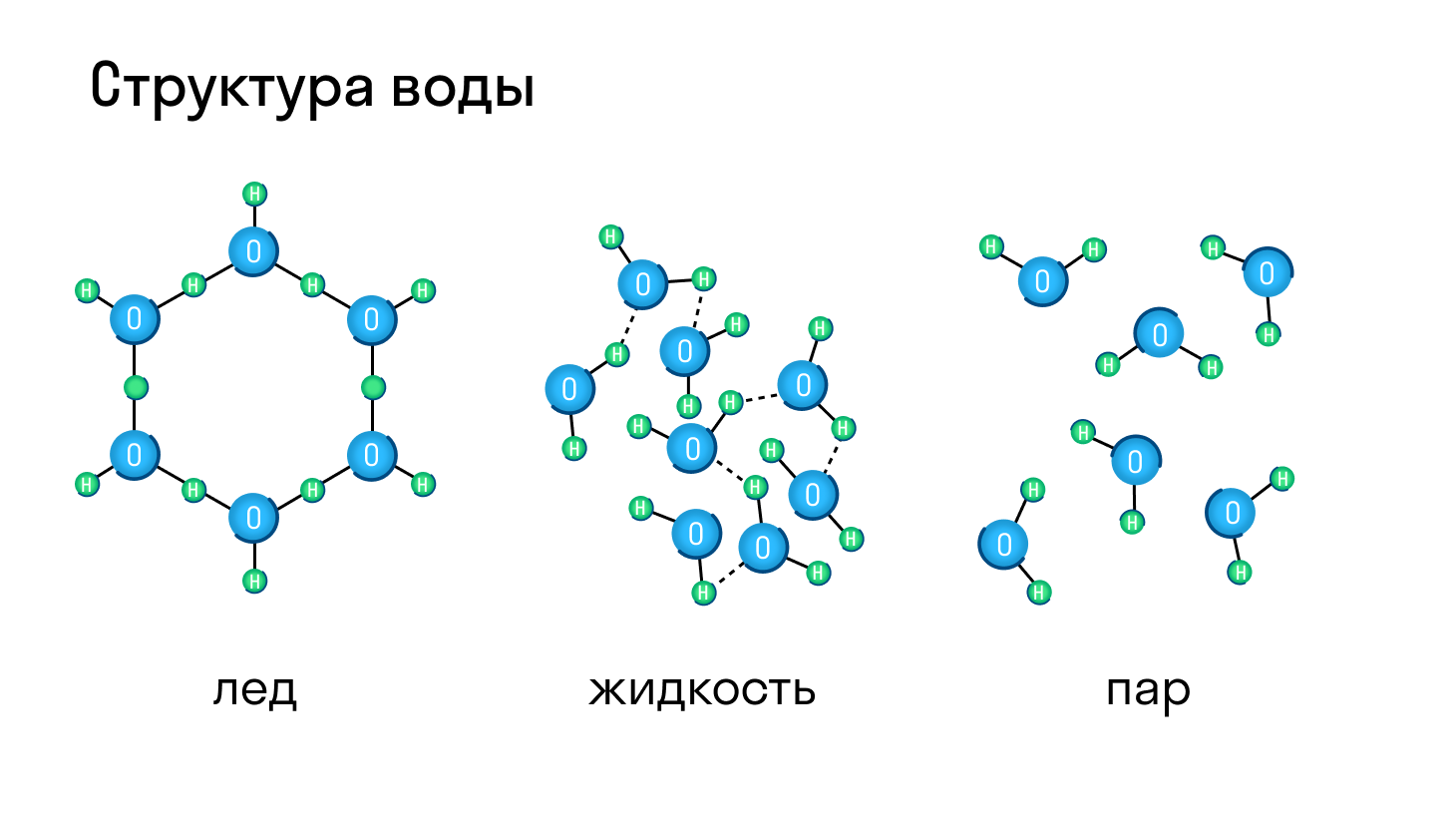
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие температуры кипения.
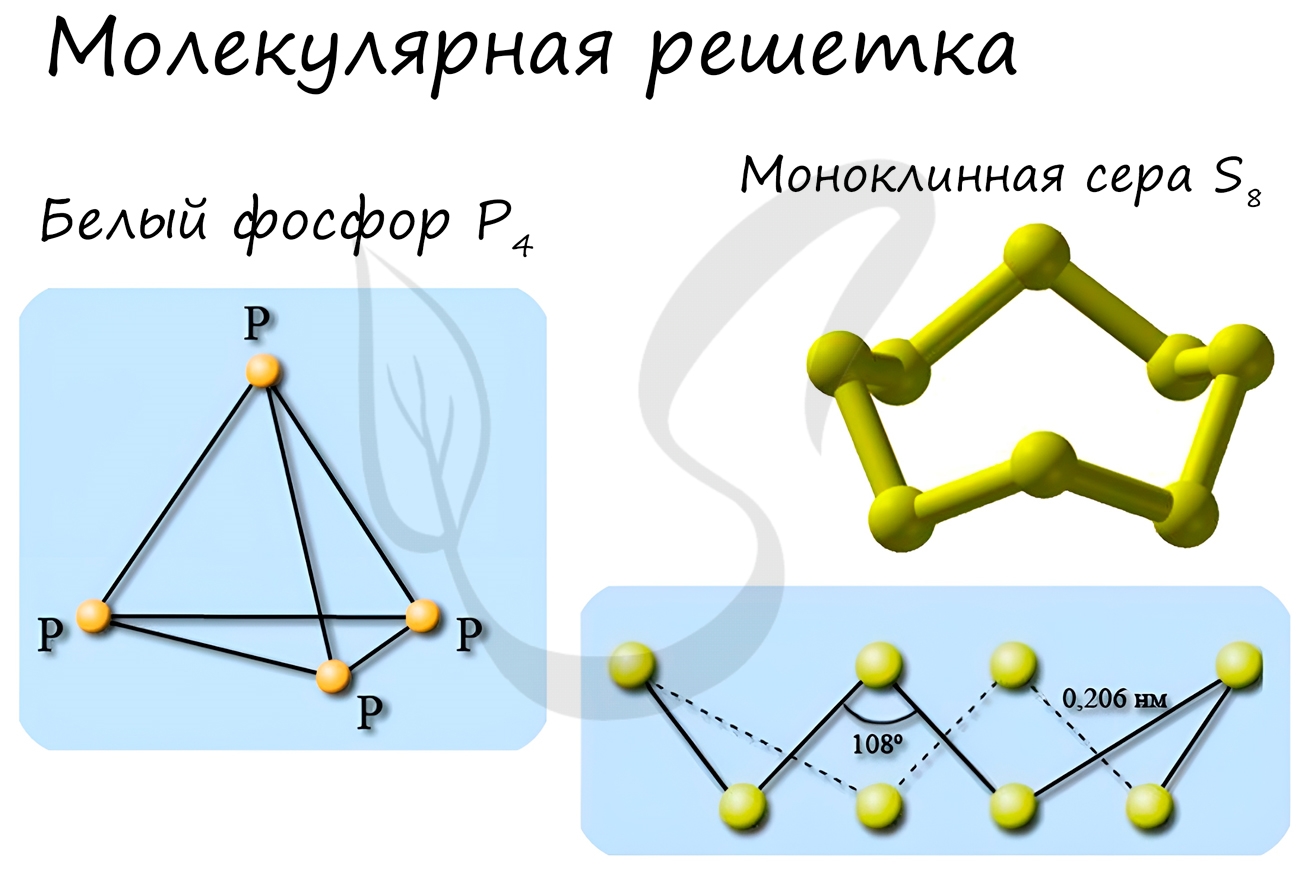
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2. Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли, оксиды и гидроксиды металлов.
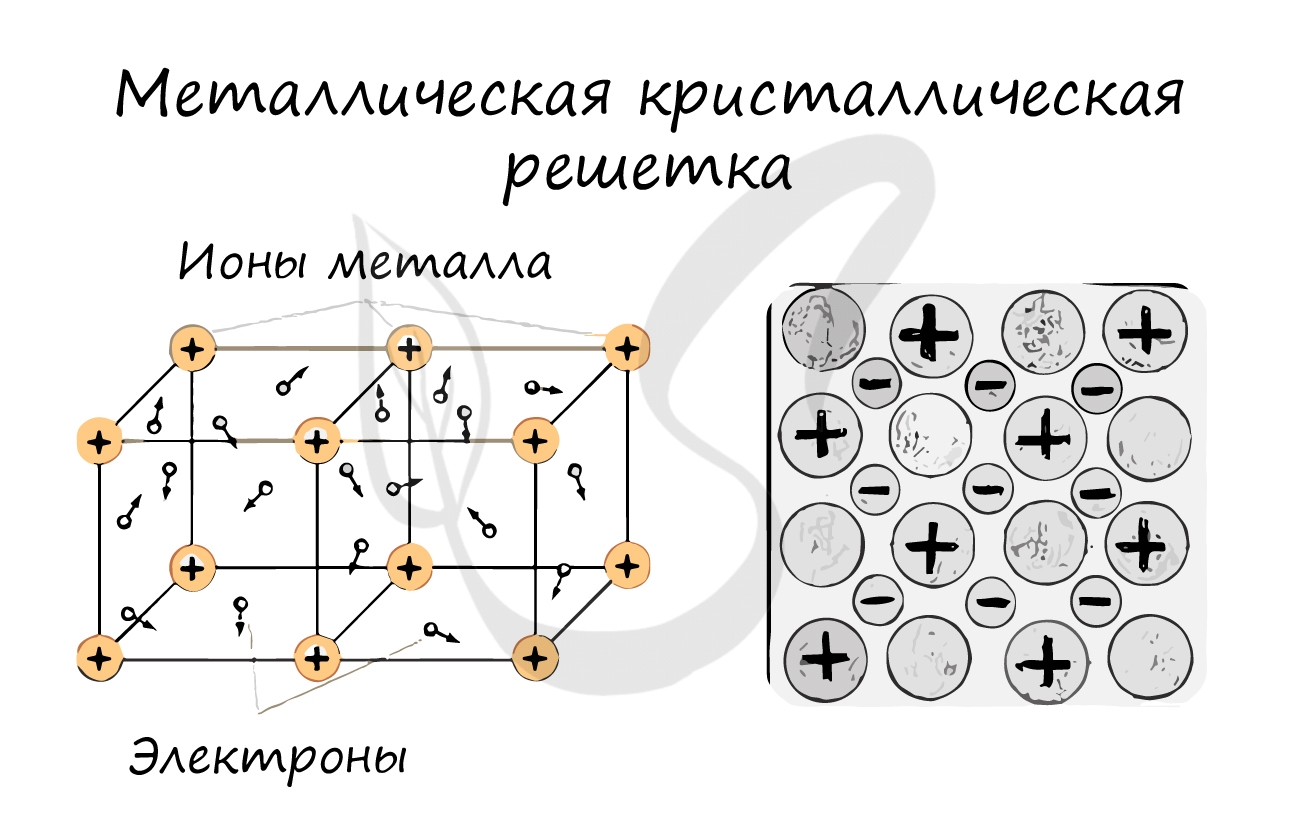
Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные, нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Кристаллическая решетка
Кристалли́ческая решётка — пространственное периодическое расположение атомов или ионов в кристалле. Для описания кристаллической решётки достаточно знать расположение частиц в элементарной ячейке кристалла, повторением которой образуется вся кристаллическая решётка.
Содержание
Общая характеристика
Существует огромное количество кристаллических структур. Их объединяет главное свойство кристаллического состояния вещества — закономерное положение атомов в кристаллической решётке. Одно и то же вещество может кристаллизоваться в разных кристаллических решётках и обладать весьма различными свойствами (классический пример графит — алмаз). В случае простых веществ это явление называется аллотропией, в общем случае любых химических соединенй — полиморфизмом. В то же время, разные вещества могут образовывать однотипные, или изоморфные, решётки, как, например, решётки многих металлов: меди, алюминия, серебра, золота. Иногда происходит замещение атомов в кристаллической решётке на атомы другого химического элемента с образованием твёрдого раствора.
В зависимости от пространственной симметрии, все кристаллические решётки подразделяются на семь кристаллических систем. По форме элементарной ячейки они могут быть разбиты на шесть сингоний. Все возможные сочетания имеющихся в кристаллической решётке поворотных осей симметрии и зеркальных плоскостей симметрии приводят к делению кристаллов на 32 класса симметрии, а с учётом винтовых осей симметрии и скользящих плоскостей симметрии на 230 пространственных групп.
Помимо основных трансляций, на которых строится элементарная ячейка, в кристаллической решётке могут присутствовать дополнительные трансляции, называемые решётками Браве. В трёхмерных решётках бывают гранецентрированная (F), объёмноцентрированная (I), базоцентрированная (A, B или C), примитивная (P) и ромбоэдрическая (трансляций состоит из множества векторов (a, b, c), во все остальные входят одна или несколько дополнительных трансляций. Так, в объёмноцентрированную систему трансляций Браве входит четыре вектора (a, b, c, ½(a+b+c)), в гранецентрированную — шесть (a, b, c, ½(a+b), ½(b+c), ½(a+c)). Базоцентрированные системы трансляций содержат по четыре вектора: A включает вектора (a, b, c, ½(b+c)), B — вектора (a, b, c, ½(a+c)), а C — (a, b, c, ½(a+b)), центрируя одну из граней элементарного объёма. В системе трансляций Браве R дополнительные трансляции возникают только при выборе гексагональной элементарной ячейки и в этом случае в систему трансляций R входят вектора (a, b, c, 1 /3(a+b+c), — 1 /3(a+b+c)).
Кристаллическая решётка
Кристалли́ческая решётка — вспомогательный геометрический образ, вводимый для анализа строения кристалла. Решётка имеет сходство с канвой или сеткой, что даёт основание называть точки решётки узлами. Решёткой является совокупность точек, которые возникают из отдельной произвольно выбранной точки кристалла под действием группы трансляции. Это расположение замечательно тем, что относительно каждой точки все остальные расположены совершенно одинаково. Применение к решётке в целом любой из присущих ей трансляций приводит к её параллельному переносу и совмещению. Для удобства анализа обычно точки решётки совмещают с центрами каких-либо атомов из числа входящих в кристалл, либо с элементами симметрии.
Содержание
Общая характеристика
В зависимости от пространственной симметрии, все кристаллические решётки подразделяются на семь кристаллических систем. По форме элементарной ячейки они могут быть разбиты на шесть сингоний. Все возможные сочетания имеющихся в кристаллической решётке поворотных осей симметрии и зеркальных плоскостей симметрии приводят к делению кристаллов на 32 класса симметрии, а с учётом винтовых осей симметрии и скользящих плоскостей симметрии на 230 пространственных групп.
Помимо основных трансляций, на которых строится элементарная ячейка, в кристаллической решётке могут присутствовать дополнительные трансляции, называемые решётками Браве. В трёхмерных решётках бывают гранецентрированная (F), объёмноцентрированная (I), базоцентрированная (A, B или C), примитивная (P) и ромбоэдрическая (R) решётки Браве. Примитивная система трансляций состоит из множества векторов (a, b, c), во все остальные входят одна или несколько дополнительных трансляций. Так, в объёмноцентрированную систему трансляций Браве входит четыре вектора (a, b, c, ½(a+b+c)), в гранецентрированную — шесть (a, b, c, ½(a+b), ½(b+c), ½(a+c)). Базоцентрированные системы трансляций содержат по четыре вектора: A включает вектора (a, b, c, ½(b+c)), B — вектора (a, b, c, ½(a+c)), а C — (a, b, c, ½(a+b)), центрируя одну из граней элементарного объёма. В системе трансляций Браве R дополнительные трансляции возникают только при выборе гексагональной элементарной ячейки и в этом случае в систему трансляций R входят вектора (a, b, c, 1 /3(a+b+c), — 1 /3(a+b+c)).
Кристаллическая решетка
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Что такое кристаллическая решетка
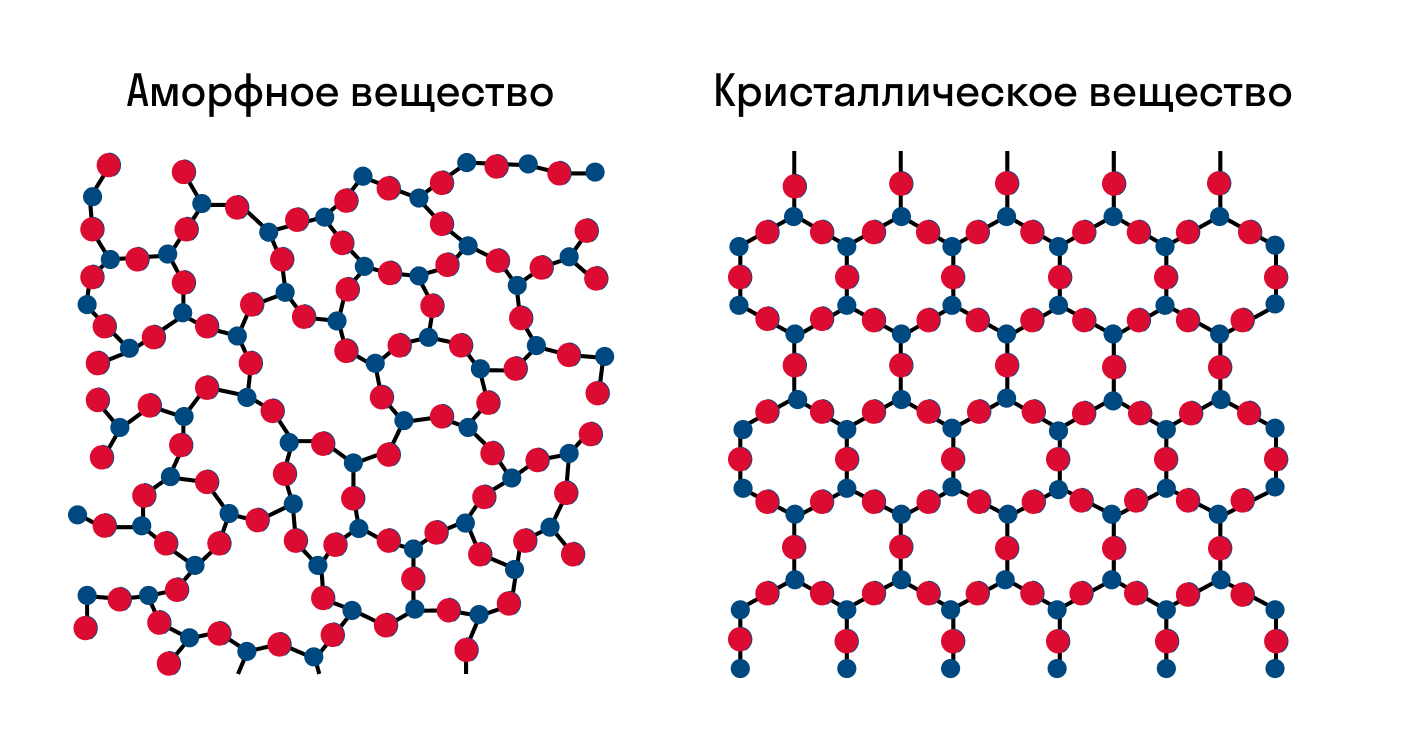
Как известно, все вещества состоят из частиц — атомов, которые могут располагаться хаотично или в определенном порядке. У аморфных веществ частицы расположены беспорядочно, а у кристаллических они образуют определенную структуру. Эта структура называется кристаллической решеткой. Она определяет такие характеристики вещества, как твердость, хрупкость, температура кипения и/или плавления, пластичность, растворимость, электропроводность и т. д.
Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки.
Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток:
атомная (ковалентные связи),
молекулярная (ковалентные связи и притяжение между молекулами),
металлическая (металлические связи),
ионная (ионные связи).
Строение и агрегатное состояние веществ
Выделяют три агрегатных состояния: твердое тело, жидкость и газ. Каждое из них предполагает определенное расположение частиц. Ниже мы расскажем подробнее, как связаны в химии кристаллическая решетка и агрегатное состояние вещества, а пока осветим общие закономерности.
Если частицы хаотично движутся, а расстояние между ними многократно превышает их собственные размеры — это газ. За счет большой удаленности друг от друга молекулы и атомы в таком веществе слабо взаимодействуют между собой.
Если частицы расположены все так же беспорядочно, но на небольшом расстоянии друг от друга — это жидкость. В жидком состоянии вещества его молекулы и атомы имеют более прочные связи, которые сложнее разорвать.
Если частицы собраны близко друг к другу и в определенном порядке — это твердое тело. В таком состоянии связи между ними наиболее прочны. Частицы могут двигаться только в пределах своего расположения и почти не перемещаются в пространстве.
Большинство веществ могут находиться и в твердом, и в жидком, и газообразном состоянии, а в зависимости от давления и температуры легко переходить из одного в другое. Типичный пример — вода, которая при нагревании превращается в пар, а при остывании становится твердым льдом.
Атомная кристаллическая решетка
Согласно своему названию, атомная кристаллическая решетка — это структура, в узлах которой расположены атомы. Они взаимодействуют с помощью ковалентных связей, то есть один атом отдает другому свободный электрон или же электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы прочно связаны, что обуславливает ряд физических характеристик.
Свойства веществ с атомной решеткой:
неспособность к растворению в воде,
высокая температура кипения и плавления.
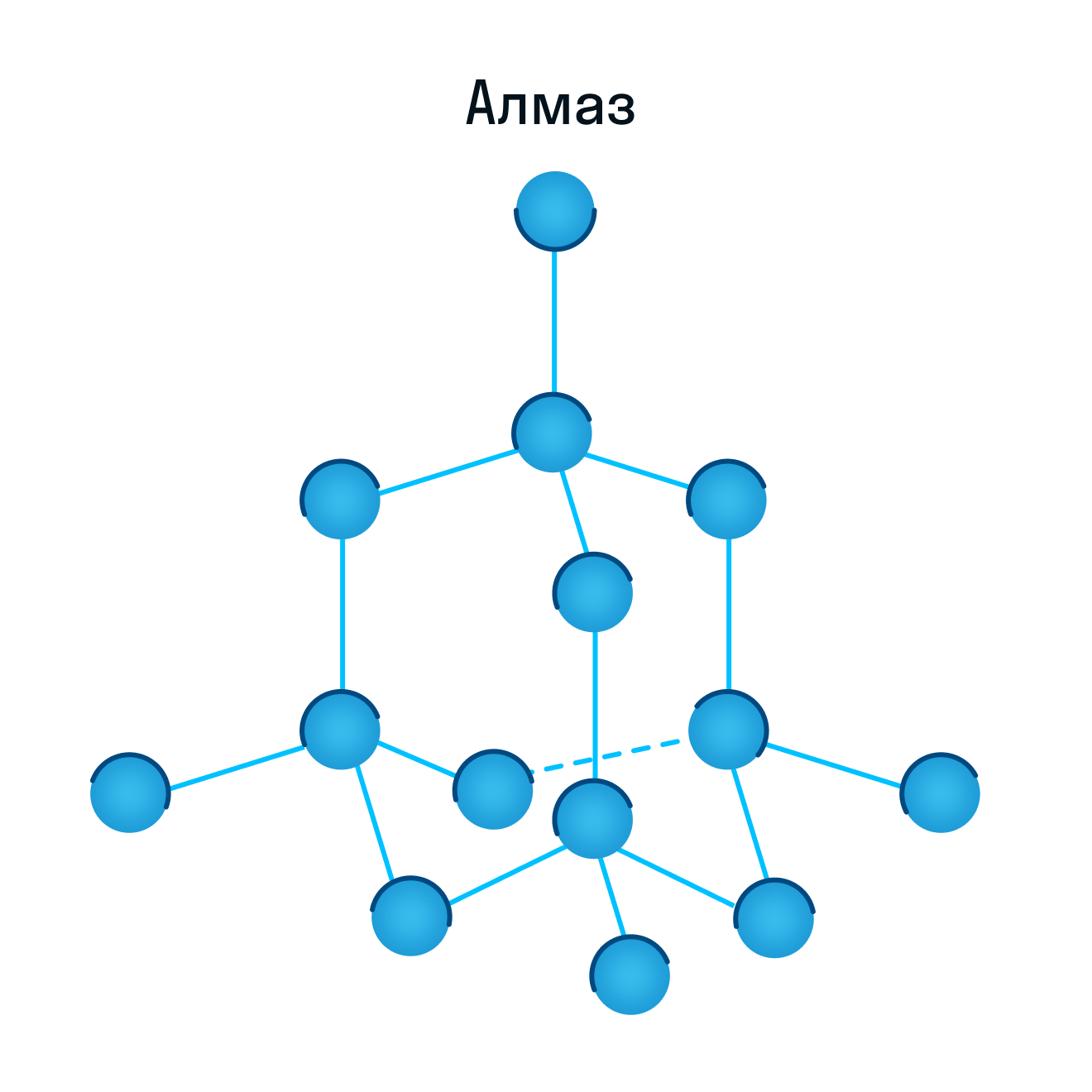
К примеру, атомную кристаллическую решетку имеет алмаз — самый твердый минерал в мире.
Другие примеры: германий Ge, кремний Si, нитрид бора BN, карборунд SiC. Типичный представитель этой группы — обычный песок, который по сути является оксидом кремния SiO2.
Молекулярная кристаллическая решетка
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
Некоторые молекулярные вещества — например, сухой лед CO2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).
Свойства молекулярных веществ:
у некоторых — наличие запаха.
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH3, гелий He, радон Rn, йод I, азот N2 и другие. Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).
Ионная кристаллическая решетка
Как известно, в ходе ионной химической связи один атом отдает другому ионы и приобретает положительный заряд, в то время как принимающий атом заряжается отрицательно. В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
Ионная решетка — это кристаллическая структура, в узловых точках которой находятся ионы, связанные взаимным притяжением.
Ионную кристаллическую решетку имеют практически все соли, типичным представителем можно считать поваренную соль NaCl. О ней стоит вспомнить, если нужно перечислить физические характеристики этой группы. Также ионную решетку имеют щелочи и оксиды активных металлов.
Свойства веществ с ионной структурой:
способность растворяться в воде.
Примеры веществ с ионной кристаллической решеткой: оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.
Металлическая кристаллическая решетка
Для начала вспомним, как проходит металлическая химическая связь. В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
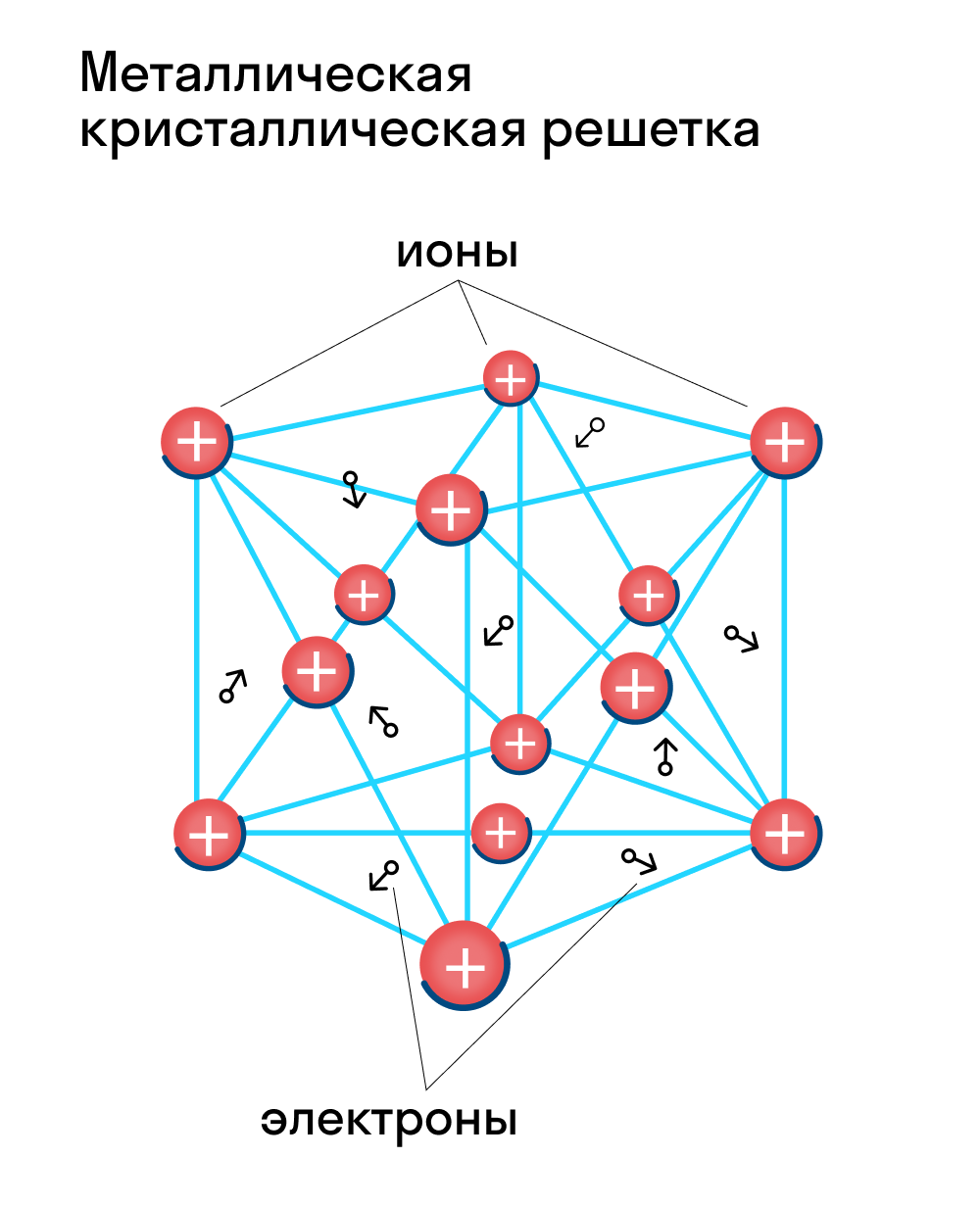
Металлическая кристаллическая решетка — это структура, которая состоит из ионов и атомов металла, а между ними свободно передвигаются электроны. Как несложно догадаться, она характерна лишь для металлов и сплавов.
Свободные электроны, мигрирующие между узлами решетки, образуют электронное облако, которое под воздействием электротока приходит в направленное движение. Это объясняет такое свойство металлов, как электрическая проводимость.
В химии типичным примером вещества, которое имеет металлическую кристаллическую решетку, считается медь. Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.
Свойства веществ с металлической кристаллической решеткой:
При этом температура плавления веществ может существенно различаться. Например, у ртути это −38,9°С, а у бериллия целых +1287°С.
Подведем итог: о характеристиках разных типов кристаллических решеток расскажет таблица.
Частицы в узлах решетки
Тип связи между частицами
Физические свойства веществ
Как определить кристаллическую решетку
Как понятно из предыдущего материала, строение вещества, его состав и физические характеристики тесно связаны. Поэтому для определения вида кристаллической решетки можно руководствоваться теми данными, которые у нас есть. Как правило, известен состав вещества, а значит, мы можем сделать вывод о химических связях внутри его молекулы, что позволит в свою очередь предположить тип решетки.
Также можно провести быстрый анализ:
если это неметалл, который при комнатной температуре представляет собой твердое тело — скорее всего он имеет атомную решетку;
если в обычных условиях это жидкость или газ либо речь об органическом веществе — предполагаем молекулярную решетку;
если это соль либо щелочь — кристаллы имеют ионную решетку;
если это металл или сплав — решетка точно будет металлической.
Вопросы для самопроверки:
Назовите виды кристаллических решеток.
Чем отличается кристаллическая решетка от химической связи?
Назовите примеры веществ с металлической кристаллической решеткой, с ионной, атомной и молекулярной.
Выберите лишнее вещество: молекулярную кристаллическую решетку имеет вода, поваренная соль, аргон, криптон.
Какое строение вещества придает ему высокую электропроводность?
Какое строение кристалла может придать веществу способность к возгонке?
Кристаллическая решетка
Твердые кристаллы можно представить как трехмерные конструкции, в которых четко повторяется один и тот же элемент структуры во всех направлениях. Геометрически правильная форма кристаллов обусловлена их строго закономерным внутренним строением. Если центры притяжения атомов, ионов или молекул в кристалле изобразить в виде точек, то получим трехмерное регулярное распределение таких точек, которое называется кристаллической решеткой, а сами точки — узлы кристаллической решетки. Определенная внешняя форма кристаллов является следствием их внутренней структуры, которая связана именно с кристаллической решеткой.
Кристаллическая решетка — это воображаемый геометрический образ для анализа строения кристаллов, который представляет собой объемно-пространственную сетчатую структуру, в узлах которой располагаются атомы, ионы или молекулы вещества.
Для характеристики кристаллической решетки используют следующие параметры:
Основой кристаллической решетки является элементарная ячейка, которая повторяется в кристалле бесконечное количество раз.
Элементарная ячейка — это наименьшая структурная единица кристаллической решетки, которая обнаруживает все свойства ее симметрии.
Упрощенно элементарную ячейку можно определить как малую часть кристаллической решетки, которая еще выявляет характерные особенности ее кристаллов. Признаки элементарной ячейки описываются с помощью трех правил Бреве :
Для описания формы кристаллов используют систему трех кристаллографических осей а, b, с, которые отличаются от обычных координатных осей тем, что они являются отрезками определенной длины, углы между которыми a, b, g могут быть как прямыми, так и непрямыми.
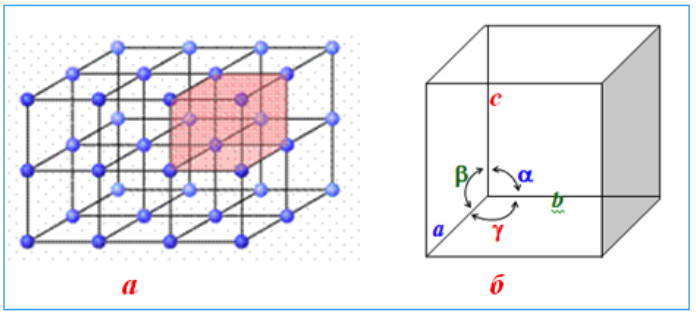
Форму кристалла изучает наука геометрическая кристаллография, одним из основных положений которой является закон постоянства гранных углов: для всех кристаллов данного вещества углы между соответствующими гранями всегда остаются одинаковыми.
Если взять большое количество элементарных ячеек и заполнить ими плотно друг к другу определенный объем, сохраняя параллельность граней и ребер, то образуется монокристалл идеальной строения. Но на практике чаще всего встречаются поликристаллов, в которых регулярные структуры существуют в определенных пределах, по которым ориентация регулярности резко меняется.
В зависимости от соотношения длин ребер а, b, с и углов a, b, g между гранями элементарной ячейки различают семь систем — так называемых сингоний кристаллов. Однако элементарная ячейка может быть построенной и таким образом, что она имеет дополнительные узлы, которые размещаются внутри ее объема или на всех ее гранях — такие решетки называются соответственно объемноцентрированными и гранецентрированными. Если дополнительные узлы находятся только на двух противоположных гранях (верхний и нижний), то это базоцентрированная решетка. С учетом возможности дополнительных узлов существует всего 14 типов кристаллических решеток.
Внешняя форма и особенности внутреннего строения кристаллов определяются принципом плотной «упаковки»: наиболее устойчивой, а потому и наиболее вероятной структурой будет такая, которая соответствует наиболее плотному расположению частиц в кристалле и в которой остается наименьшее по объему свободное пространство.
Типы кристаллических решеток
В зависимости от природы частиц, содержащихся в узлах кристаллической решетки, а также от природы химических связей между ними, различаются четыре основных типа кристаллических решеток.
Ионные решетки
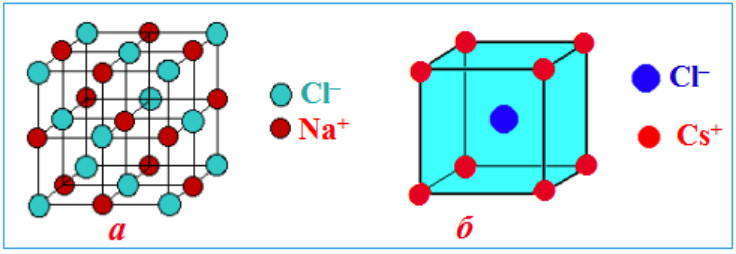
Вещества с ионными кристаллическими решетками имеют сравнительно высокую твердость, они достаточно тугоплавкие, нелетучие. В отличие от металлов ионные соединения очень хрупкие, поэтому даже небольшой сдвиг в кристаллической решетке приближает друг к другу одноименно заряженные ионы, отталкивания между которыми приводит к разрыву ионных связей и как следствие — к появлению в кристалле трещин или к его разрушению. В твердом состоянии вещества с ионной кристаллической решеткой относятся к диэлектрикам и не проводят электрический ток. Однако при расплавлении или растворении в полярных растворителях нарушается геометрически правильная ориентировка ионов относительно друг друга, сначала ослабляются, а затем разрушаются химические связи, поэтому меняются и свойства. Как следствие, электрический ток начинают проводить как расплавы ионных кристаллов, так и их растворы.
Атомные решетки
Эти решетки построены из атомов, соединенных между собой ковалентной связью. Они, в свою очередь, делятся на три типа: каркасные, слоистые и цепочечные структуры.
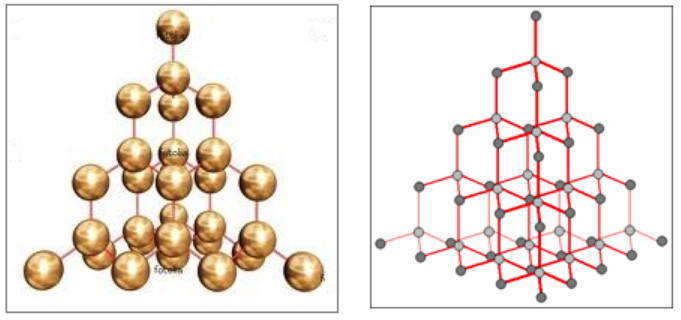
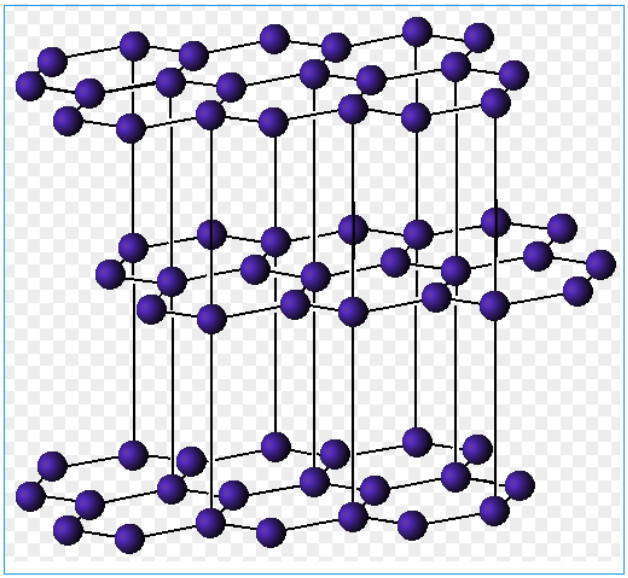
Слоистые структуры можно рассматривать как огромные двумерные молекулы. Для слоистых структур присущи ковалентные связи внутри каждого слоя и слабое вандерваальсовское взаимодействие между соседними слоями.
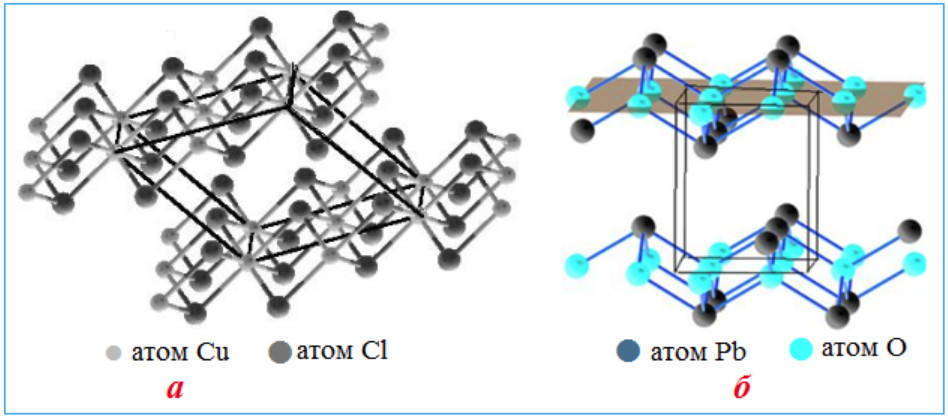
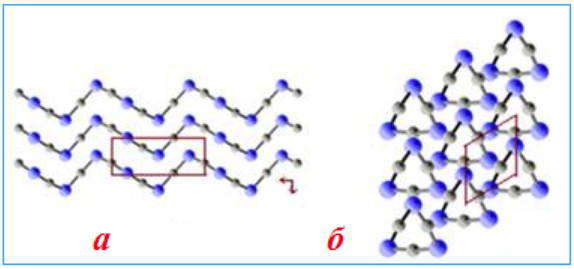
Веществ с атомной строением кристаллических решеток сравнительно немного. Это, как правило, простые вещества, образованные элементами IIIА- и IVA-подгрупп (Si, Ge, B, C). Нередко соединения двух разных неметаллов имеют атомные решетки, например, некоторые полиморфные модификации кварца (оксид кремния SiO2 ) и карборунда (карбид кремния SiC).
Все атомные кристаллы отличаются высокой прочностью, твердостью, тугоплавкостью и нерастворимостью практически ни в одном растворителе. Такие свойства обусловлены прочностью ковалентной связи. Вещества с атомной кристаллической решеткой имеют широкий диапазон электрической проводимости от изоляторов и полупроводников до электронных проводников.
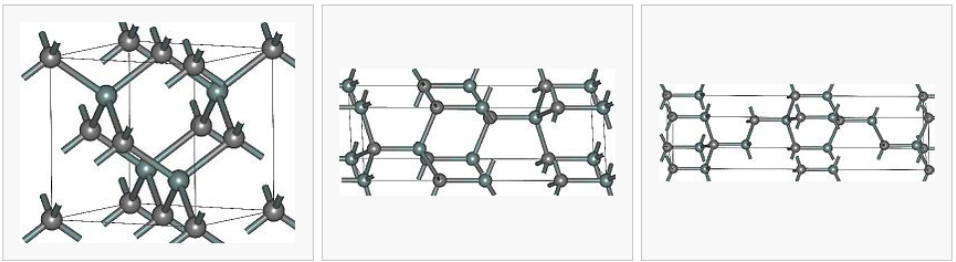
Металлические решетки
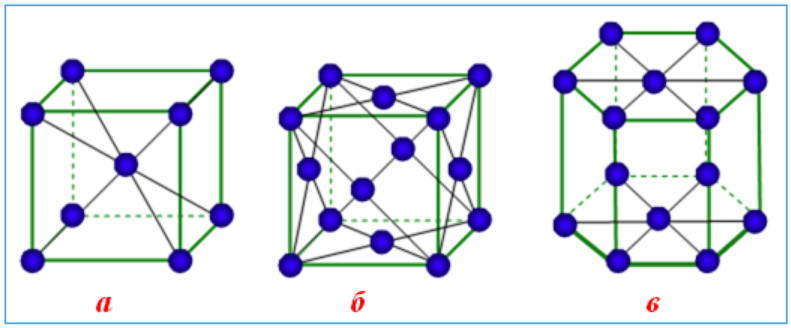
Эти кристаллические решетки содержат в узлах атомы и ионы металлов, между которыми свободно движутся общие для них всех электроны (электронный газ), которые образуют металлическую связь. Особенность кристаллических решеток металлов заключается в больших координационных числах (8-12), которые свидетельствуют о значительной плотность упаковки атомов металлов. Это объясняется тем, что «остовы» атомов, лишены внешних электронов, размещаются в пространстве как шарики одинакового радиуса. Для металлов чаще всего встречаются три типа кристаллических решеток: кубическая гранецентрированная с координационным числом 12 кубическая объемноцентрированная с координационным числом 8 и гексагональная, плотной упаковки с координационным числом 12.
Особые характеристики металлического связи и металлических решеток обусловливают такие важнейшие свойства металлов, как высокие температуры плавления, электро- и теплопроводность, ковкость, пластичность, твердость.
Молекулярные решетки
Молекулярные кристаллические решетки содержат в узлах молекулы, соединенные между собой слабыми межмолекулярными силами — вандерваальсовскими или водородными связями. Например, лед состоит из молекул воды, удерживающихся в кристаллической решетке водородными связями. К тому же типу относятся кристаллические решетки многих веществ, переведенных в твердое состояние, например: простые вещества Н2, О2, N2, O3, P4, S8, галогены (F2, Cl2, Br2, I2), «сухой лед» СО2, все благородные газы и большинство органических соединений.
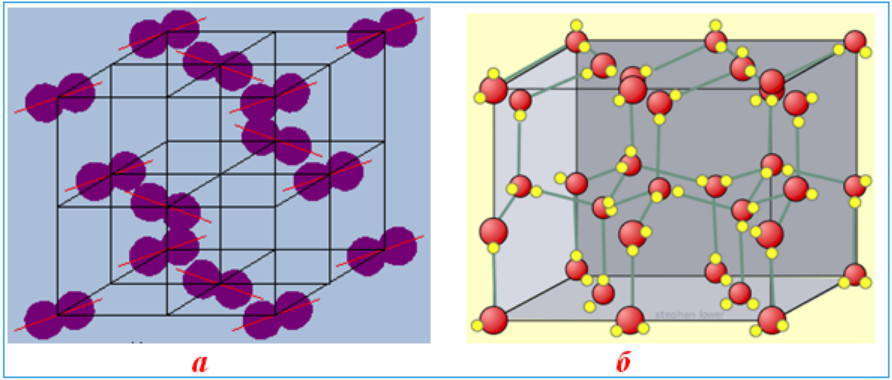
Поскольку силы межмолекулярного взаимодействия слабее, чем силы ковалентной или металлической связи, молекулярные кристаллы имеют небольшую твердость; они легкоплавкие и летучие, нерастворимые в воде и не проявляют электропроводности.