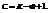Что называют компонентом фазой системой
Понятие сплав. Компоненты сплава. Фазы и структурные составляющие



Сплав – вещество, полученное сплавлением нескольких элементов. Другими словами, сплав – это твердое вещество, обладающее всеми признаками металлов и состоящее из 2-х и более химических элементов. Состоят из основы (одного или нескольких металлов), малых добавок специально вводимых в сплавлегирующих и модифицирующих элементов, а также из неудалённых примесей (природных, технологических и случайных).
Компонент – элемент или химическое соединение, входящее в состав сплава (элементы или химические соединения, образующие сплав). Компонент, преобладающий в сплаве количественно, называется основным. Компоненты, вводимые в сплав для придания ему нужных свойств, называются легирующими.
Фазовая составляющая (фаза) – однородная часть сплава, характеризующаяся определенным составом, свойствами, типом кристаллической решетки и отделенная от других частей сплава поверхностью раздела (при переходе через которую химический состав, структура, а, следовательно, свойства меняются скачкообразно).
Сплавы могут быть и однофазными и многофазными. Однофазные сплавы всегда состоят из кристаллов твердого раствора одного вида (состава).
В многофазных сплавах может одновременно присутствовать несколько структурных составляющих: 1) кристаллы твердого раствора (одного или нескольких составов), 2) кристаллы химических соединений, 3) кристаллы компонент сплава, 4) эвтектики и 5) эвтектоиды.
Основными структурами, составляющими железоуглеродистые сплавы, являются следующие.
Феррит – твердый раствор углерода в α-Fe. При температуре 723° С предельное содержание углерода 0,02 %. При отсутствии примесей не корродирует.
Цементит – карбид железа Fe3C – химическое соединение, содержащее 6,67 % углерода. Является составной частью эвтектической смеси, а также самостоятельной структурной составляющей. Способен образовывать твердые растворы путем замещения атомами других металлов, неустойчив, распадается при термической обработке. Цементит очень тверд (НВ 800) и хрупок.
Аустенит – твердый раствор углерода в γ–Fe. Атомы углерода внедряются в кристаллическую решетку, причем насыщение может быть различным в зависимости от температуры и примесей. Устойчив только при высокой температуре, а с примесями Mn, Сг – при обычных, даже низких температурах. Твердость аустенита НВ 170. 220.
Перлит – эвтектоидная смесь феррита и цементита, образуется при распаде аустенита при температуре 723° С и содержании углерода 0,83 %. Примеси Si и Мn способствуют образованию перлита и при меньшем содержании углерода. Твердость перлита НВ 160. 260. Структура перлита может быть пластинчатой и глобулярной (зернистой).
Ледебурит – эвтектическая смесь аустенита и цементита, образующаяся при 1130° С и содержании углерода 4,3 % Структура неустойчивая: при охлаждении аустенит, входящий в состав ледебурита, распадается на вторичный цементит и перлит. Ледебурит очень тверд (НВ 700) и хрупок.
Графит – мягкая и хрупкая составляющая чугуна, состоящая из разновидностей углерода. Встречается в серых и ковких чугунах.
1. В жидком состоянии компоненты сплава обычно неограниченно растворяются друг в друге, образуя жидкие растворы.
Химическая термодинамика. Основные понятия термодинамики: термодинамическая система, процесс, фаза, компонент параметры состояния, функции состояния и их уравнения
Теплота, работа, термодинамическая система, параметры и уравнение состояния?, открытая, закрытая и изолированная системы
Фазой называется термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества.
Компонент– химически индивидуальные вещества, наименьшего числа которых достаточно для образования всех фаз, т. е. гомогенных частей данной системы.
Системой называют отдельное тело или группу тел, фактически или мысленно отделенных от окружающей среды.Систему называют термодинамической, если между телами ее составляющими может происходить обмен теплотой, веществом, и если система полностью описывается термодинамическими параметрами (кипящий чайник).
Открытая термодинамическая система – это такая система, которая может обмениваться с окружающей средой энергией и веществом, (например, кипящий чайник).
Закрытой системой называют систему, которая не может обмениваться веществом с окружающей средой, но может обмениваться теплотой и работой. ( плотно закрытая колба с раствором, которая нагревается или охлаждается окружающей средой.)
Изолированной термодинамической системой называют систему, не имеющую обмена веществом и энергией с окружающей средой. Внутри системы может происходить передача теплоты от более нагретой части системы к более холодной, взаимное превращение энергий, выравнивание концентраций, однако внутренняя энергия системы остается постоянной. Примером такой системы является химическая реакция, идущая в термостате.
Основными параметрами состояния системы называются параметры, которые измеряются напрямую и определяются экспериментально. Это температура, давление, теплоемкость, концентрация.
Зависимость между параметрами состояния термодинамической системы выражается уравнением состояния, которое позволяет определять одни параметры состояния через другие. Если состояние системы может быть полностью описано с помощью трех параметров: давления 


 |
Обобщение многочисленных экспериментальных данных показывает, что большинство газов при комнатной температуре и давлении порядка одной атмосферы (при нормальных условиях) с достаточно высокой точностью могут быть описаны уравнением состояния, называемым уравнением Клапейрона-Менделеева:
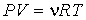 , , | (2.2) |
где: P- давление газа,V- занимаемый им объем, ν- количество молей газа,R- универсальная газовая постоянная,T- абсолютная температура.
2.Закон Рауля. Криоскопический метод определения молекулярной массы. Изотонический коэффициент. 29. Понятие идеального раствора.
Первый закон Рауля:
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
Для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) удобнее использовать другую формулировку:
Относительное понижение парциального давления пара растворителя над раствором не зависит от природы растворённого вещества и равно его мольной доле в растворе.
Предельно разбавленный раствор получают путем последовательного разбавления исследуемого раствора чистым растворителем.
Рис. 2. Зависимость парциальных и общего давлений пара идеальных (штриховая линия) и реальных (сплошная линия) бинарных растворов от состава при положительных (слева) и отрицательных (справа) отклонениях от закона Рауля.
Криоскопия – это метод физико-химического исследования, основанный на измерении понижения температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя.
Для разбавленного идеального бинарного раствора понижение температуры замерзания пропорционально моляльности раствора и зависит от природы растворителя
где Т0 – температура замерзания растворителя,
m – моляльная концентрация раствора,
К – коэффициент пропорциональности.
Если m = 1, т.е. 1 моль вещества растворен в 1000 г растворителя, то DТ = К, поэтому постоянную К в уравнении (IV) называют моляльным понижением температуры замерзания раствора, или криоскопической постоянной. Она зависит только от природы растворителя и не зависит от концентрации раствора и химического состава растворенного вещества.
Для экспериментального определения К следует измерить понижение температуры замерзания в разбавленных растворах, а затем пересчитать эти данные на 1 моль:


Криоскопическую постоянную можно вычислить теоретически, зная температуру замерзания растворителя Т0, его молярные массу М0 НDи теплоту плавления пл., по уравнению:

Криоскопические постоянные некоторых растворителей приведены в таблице:
Если из раствора при замерзании выпадают кристаллы чистого растворителя, то понижение температуры замерзания раствора используют для определения молярной массы растворенного вещества (М).
Если в q0 г растворителя растворено q г вещества, то моляльность полученного раствора (m) равна:

Подставляя это выражение в формулу (1), получим:

откуда молярная масса растворенного вещества (М) равна:

Массы q0 и q находят взвешиванием; К (для данного растворителя) – постоянная величина. Следовательно, опыт сводится Т,Dк определению т.е. к определению понижения температуры замерзания раствора, приготовленного из q0 г растворителя и q г растворенного вещества.
Криоскопический метод применим только к разбавленным ТDрастворам, вследствие чего для получаются очень небольшие значения. При выполнении этой работы пользуются термометрами, позволяющими делать отсчет с точностью.
Изотонический коэффициент показывает во сколько раз реальное число частиц растворенного вещества больше чем теоретически ожидаемое (если предполагать, что вещество в растворе присутствует только в виде молекул).
Для идеальных растворов электролитов i>1.
Коэффициент Вант-Гоффа показывает также во сколько раз наблюдаемое опытное значение росм.,Dtкип.,Dtзам., 
Дата добавления: 2018-04-04 ; просмотров: 1017 ; Мы поможем в написании вашей работы!
Понятия: Сплав, компонент, фаза, механические смеси, твёрдые растворы, химические соединения
Сплав — макроскопически однородный металлический материал, состоящий из смеси двух или большего числа химических элементов с преобладанием металлических компонентов.
Компоненты — вещества, образующие систему. В качестве компонентов выступают чистые вещества и химические соединения, если они не диссоциируют на составные части в исследуемом интервале температур.
Фаза — однородная часть системы, отделенная от других частей системы поверхностного раздела, при переходе через которую структура и свойства резко меняются.
Твёрдые растворы — фазы переменного состава, в которых атомы различных элементов расположены в общей кристаллической решётке.
Хими́ческое соедине́ние — сложное вещество, состоящее из химически связанных атомов двух или более элементов (гетероядерные молекулы). Некоторые простые вещества также могут рассматриваться как химические соединения, если их молекулы состоят из атомов, соединённых ковалентной связью (азот, кислород, иод, бром, хлор, фтор, предположительно астат).
Кристаллизация металлов и сплавов
Процессы кристаллизации металлов и сплавов, являющиеся процессами перехода их из жидкого состояния в твердое, связаны с выделением скрытой теплоты кристаллизации. Для того чтобы происходил процесс кристаллизации металла или сплава, его необходимо все время охлаждать (отводить, отнимать от него тепло).
При рассмотрении процессов кристаллизации мы прежде всего должны иметь в виду определенный объем жидкого металла или сплава, который отдает тепло, и форму, которая принимает его. Передача тепла от жидкого металла и сплава форме проходит не мгновенно, так как теплопроводность жидкого металла или сплава и формы имеет определенные конечные значения. Поэтому одновременная кристаллизация всего объема металла или сплава в форме невозможна даже при одинаковых температурах во всех точках его объема.
Правила фаз и отрезков
Фазами могут быть жидкие растворы, твердые растворы и химические соединения. Следовательно, однородная жидкость представляет собой однофазную систему, механическая смесь двух видов кристаллов — двухфазную систему и т. д.
Под числом степеней свободы (вариантностью) системы понимают число внешних и внутренних факторов (температура, давление и концентрация), которые можно изменять без изменения числа фаз в системе.
Количественную зависимость между числом степеней свободы системы, находящейся в равновесном состоянии, и числом компонентов и фаз принято называть правилом фаз (закон Гиббса). Правило фаз для металлических систем выражается уравнением
где С —число степеней свободы системы; К —число компонентов; Ф — число фаз; т — число внешних факторов (температура, давление).
Пользуясь правилом фаз, рассмотрим, как происходит изменение числа степеней свободы однокомпонентной системы для случая расплавленного чистого металла (К=1; Ф=1) С = 1-1 + 1 = 1, т.е. температуру можно изменять не меняя числа фаз. Такое состояние системы называют моновариантным (одновариантным). В процессе кристаллизации Ф = 2 (две фазы — жидкая и твердая), а К=1, тогда С= 1-2+1=0. Это значит, что две фазы находятся в равновесии при строго определенной температуре (температура плавления), и она не может быть изменена, пока одна из фаз не пропадет. Такое состояние системы называют нонвариантным (безвариантным).Для диухкомпонентной системы, находящейся в жидком состоянии (К = 2; Ф=1), правило фаз имеет вид С = 2-1 + 1=2, такая система называется бивариантной (двухвариантной). В этом случае возможно изменение двух факторов равновесия (температуры и концентрации), число фаз при этом не меняется. Для этой же системы при существовании двух фаз (жидкой и твердой) К=2, Ф = 2, согласно правилу фаз С = 2—2+1 = 1, т.е. с изменением температуры концентрация должна быть строго определенной.
Применение правила фаз для диаграммы состояния первого типа(см. рис. ). Пользуясь этой диаграммой, можно определить фазовое состояние сплавов любого состава при любой температуре. Так, например, в области 1 существует одна фаза — жидкий раствор. Правило фаз запишется в виде С = К – Ф + 1 = 2- 1 + 1 = 2, т. е. система имеет две степени свободы. Для остальных областей 2, 3, 4 и 5 система характеризуется одной степенью свободы (С = 2 – 2 + 1 = 1).
Дата добавления: 2018-04-04 ; просмотров: 2356 ; Мы поможем в написании вашей работы!
Сплавы. Основные понятия и термины
10. Сплавы. Основные понятия и термины: сплав, компонент, фаза, структура, равновесное и неравновесное состояния.
Сплавы – это вещества, состоящие из двух или более элементов периодической системы. Получают их с помощью спекания или сплавлением. Компонент – вещество, образующее сплав. Фаза – пространственно ограниченная и отличная от других часть системы, имеющая свою кристаллическую решётку и свои свойства. Гомогенные вещества имеют одну фазу, а гетерогенные – несколько фаз. Структура – строение металла, в котором можно различать отдельные фазы, их форму, размеры и взаимное расположение. Структура влияет на свойства. Равновесное состояние – когда в сплаве все фазы, присущие этой системе оформлены. Это состояние обеспечивается при медленном охлаждении, можно различать размеры и формы фаз. Неравновесное состояние – процесс образования и обособления фаз не закончился, образуется при быстром охлаждении.
11. Сплавы. Классификация сплавов. Зависимость структуры сплава от положения компонентов в периодической системе Д.И. Менделеева.
Химические соединения, твёрдые растворы, смеси (механические). Если оба компонента теряют свою кристаллическую решётку, и у сплава образуется новая решётка, то это хим. соединение. Если один из компонентов сохраняет кристаллическую решётку, а другие её теряют, такие сплавы наз. твёрдыми растворами. Если оба компонента сохраняют кристаллическую решётку и свойства, то сплавы называются смесями. Хим. соединения: металлы обладают восстановительными свойствами, а неметаллы – окислительными. Сплавы: стали, чугуны, медные, алюминиевые, магниевые, титановые, оловянистые и свинцовые сплавы.
12. Диаграммы состояния двойных сплавов (основные типы). Закономерности Н.С. Курнакова.


13. Диаграммы состояния сплавов. Правило отрезков.

14. Сплавы. Деформируемые и литейные сплавы. Особенности строения и свойства.
Литейный сплав в твёрдом состоянии хрупок, происходит разрушении в условиях растяжения или изгиба (ударного). Деформируемый сплав пластичен.


15. Способы упрочнения сплавов.
Наклёп – упрочнение металлов и сплавов в результате измельчения зерна при холодной пластической деформации. Перекристаллизация – упрочнение в результате измельчения зерна при полиморфном превращении. Дисперсионное твердение – упрочнение сплавов в результате выделения мелких частиц второй фазы из пересыщенного твёрдого раствора.
16. Деформация упругая и пластическая. Упрочнения металлов при пластической деформации.
Деформация может быть упругой, исчезающей после снятия нагрузки, и пластической, остающейся после снятия нагрузки. При упругом деформировании под действием внешней силы изменяется расстояние между атомами в крист. решётке. Снятие нагрузки устраняет причину, вызвавшую изменение межатомного расстояния, атомы становятся на прежние места и деформация исчезает. При пластическом деформировании одна часть кристалла перемещается по отношению к другой. Если нагрузку снять, то перемещённая часть кристалла не возвратится на старое место, деформация сохранится. Наклёп. Перекристаллизация. Дисперсионное твердение.
17. Холодная и горячая пластические деформации. Условия деформирования. Влияние на структуру и свойства металлов и сплавов.
Если пластическая деформация осуществляется при температуре выше Tр, то наклёпа нет. Эта деформация называется горячей пластической деформацией. Холодная пластическая деформация (давление) происходит при температуре ниже Tр, возникает упрочнение.
18. Рекристаллизация сплавов, влияние на структуру и свойства. Температура рекристаллизации по А.А. Бочвару.
Рекристаллизация – возвращение свойств в первоначальное состояние в процессе нагрева наклёпанного металла. Процессы: уменьшение количества дефектов, рост зерна (до исходного). А.А. Бочвар показал: Tр = a·TплК (в Кельвинах). Чем выше Tпл, тем выше Tр. Вольфрам, молибден – самые тугоплавкие Me. Если чистый Me – a ≈ 0,2, механические смеси – a ≈ 0,4, твёрдые растворы – a ≈ 0,6, химические соединения – a ≈ 0,8.
19. Диффузионные и бездиффузионные процессы в металлических сплавах, влияние на свойства.
Бездиффузионные характеризуются перемещением атомов в пределах элементарной ячейки крист. решётки, высокой скоростью. Диффузионные превращения характеризуются перемещением атомов на большие расстояния. Они ускоряются с повышением температуры. К таким процессам относят частичный расплав твёрдого раствора α1 → α2 +β.
Составные части системы и компоненты. Правило фаз.



Составные части системы – химически индивидуальные вещества, составляющие данную систему и способные к самостоятельному существованию.
В равновесной системе 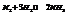
Константа равновесия:
Если известны парциальные давления двух участников реакции, система определена.
Независимые компоненты – индивидуальные вещества, наименьшее число которых необходимо и достаточно для образования всех фаз системы.
Число независимых компонентов – разница между числом составных частей и числом связывающих уравнений.
В данном примере: 3-1=2.
Степени свободы – независимые переменные, которые можно произвольно менять, не нарушая состояния системы (числа и характера фаз).
Правило фаз позволяет определить число фаз в системе при равновесии и изменение этого числа при изменении какого-либо параметра.
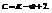
Если 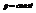
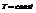
Пример. Определить кол-во фаз в системе
С=К-Ф+2=4-Ф. Максимальное число фаз=минимум С.