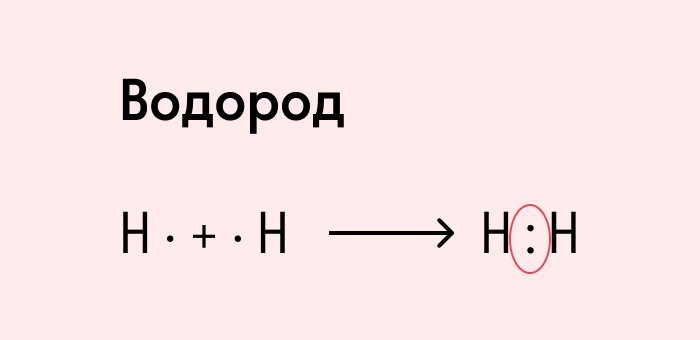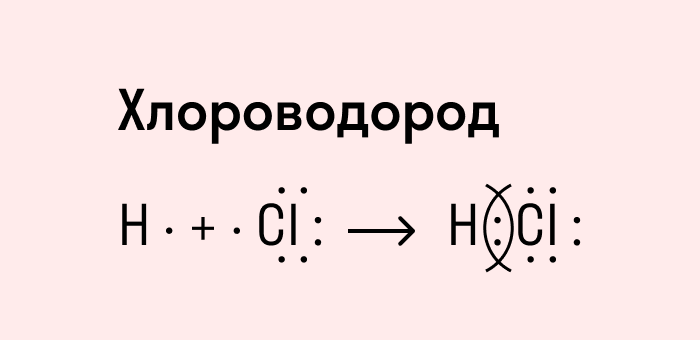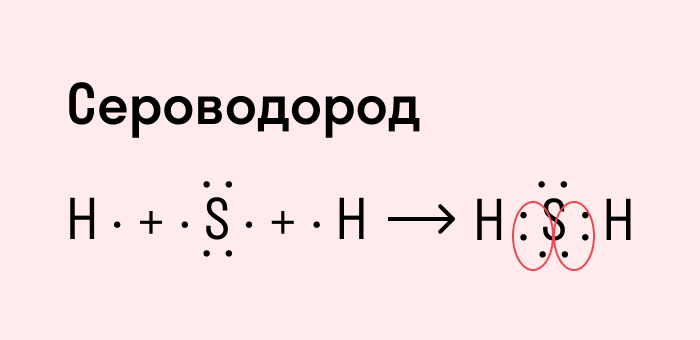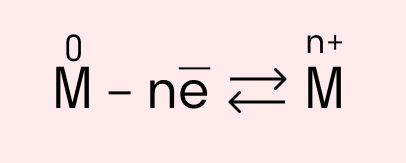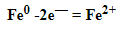Что называют химической связью
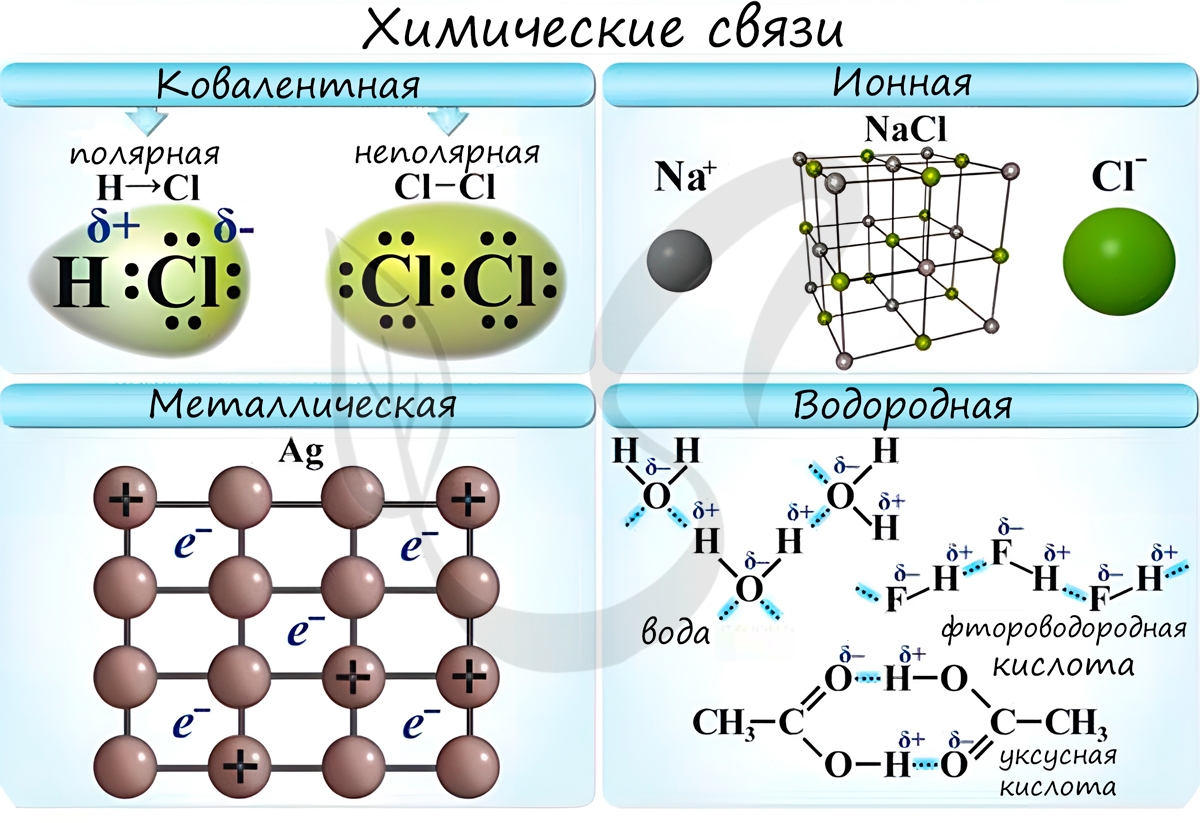
Химические связи
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
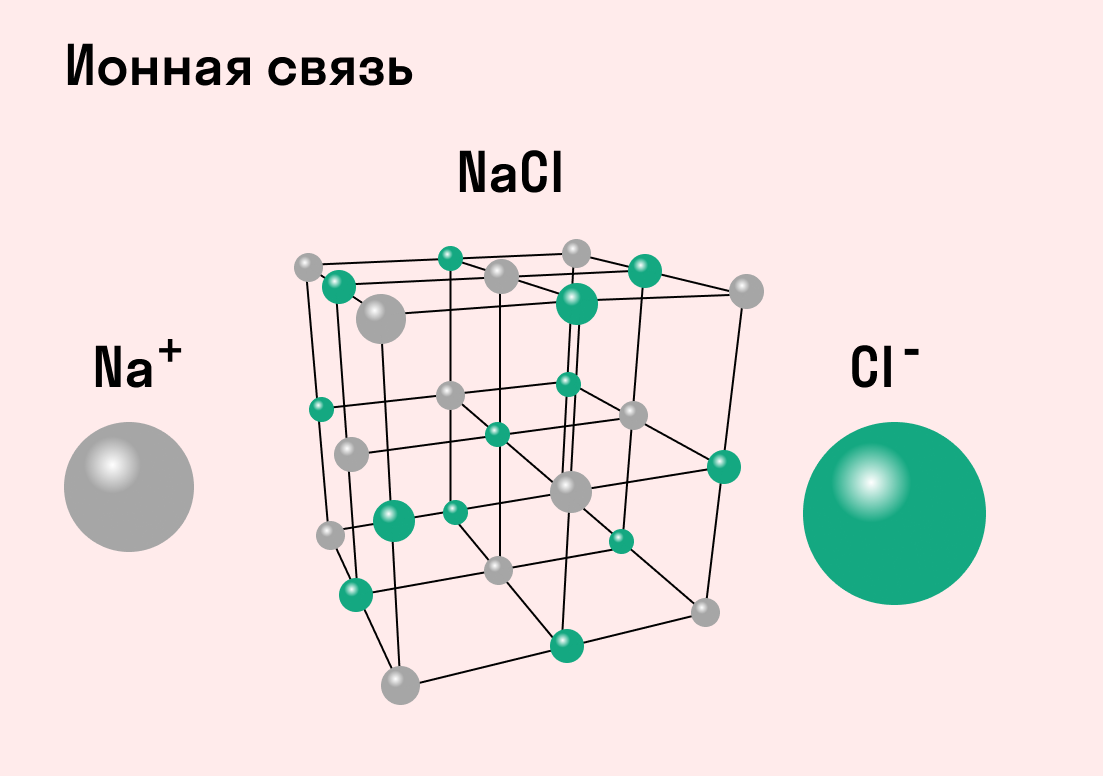
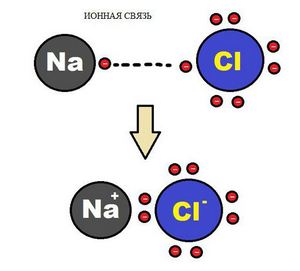
Ионная связь
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
Металлическая связь
«Облако» электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.
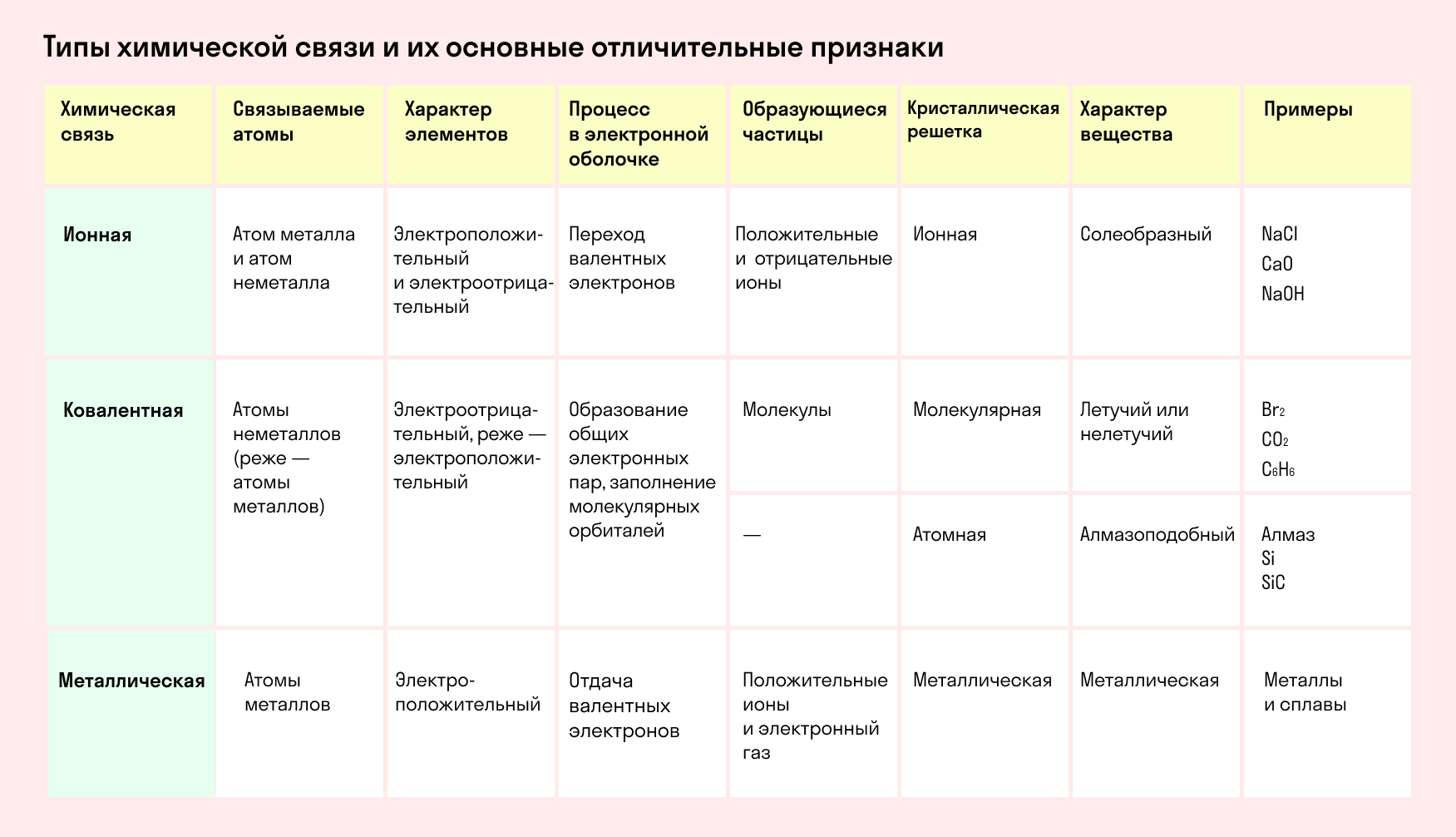
Водородная связь
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химическая связь
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Химическая связь и строение вещества
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики. Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону. Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку. Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Механизм образования химической связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
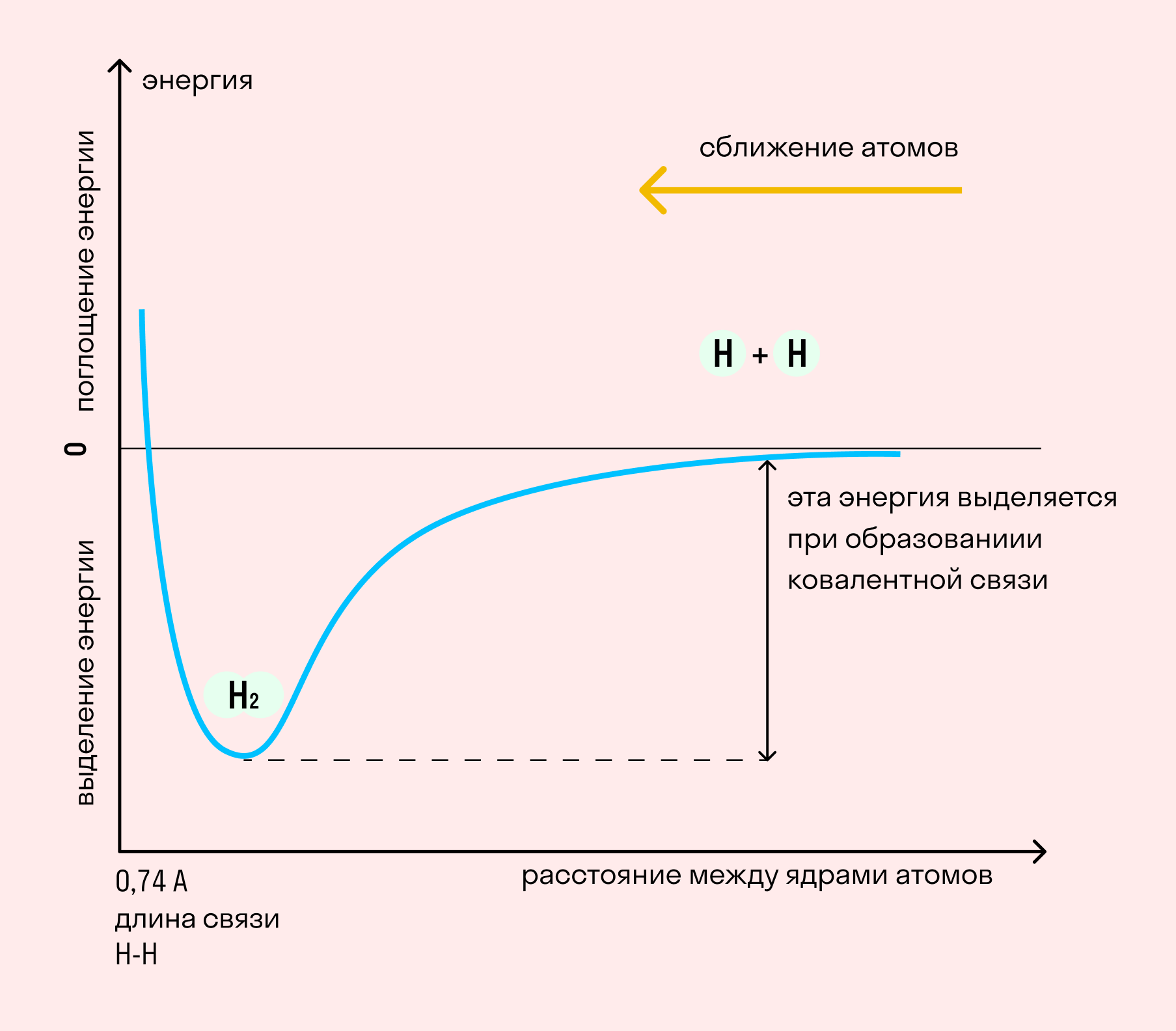
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
Основные типы химических связей
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Если это ковалентная связь — образуется атомная решетка, если водородная — молекулярная решетка, а если ионная или металлическая — соответственно, будет ионная или металлическая решетка. Таком образом, влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
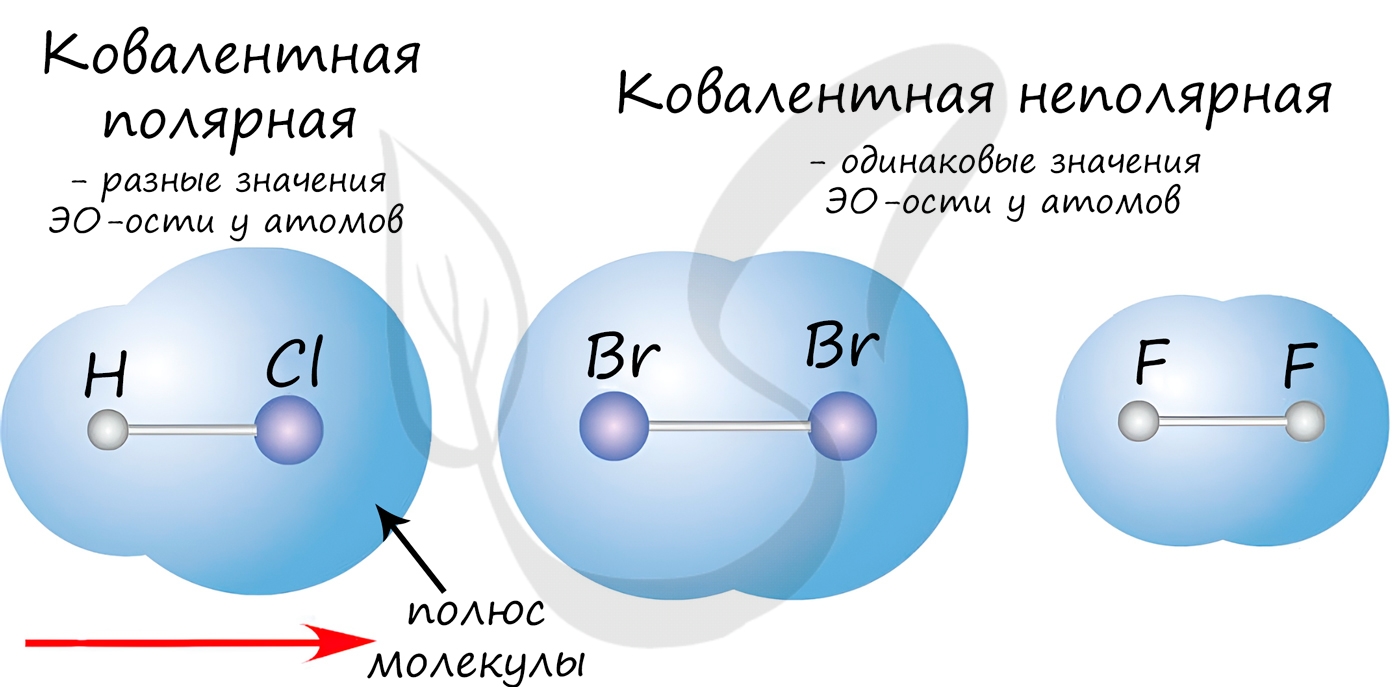
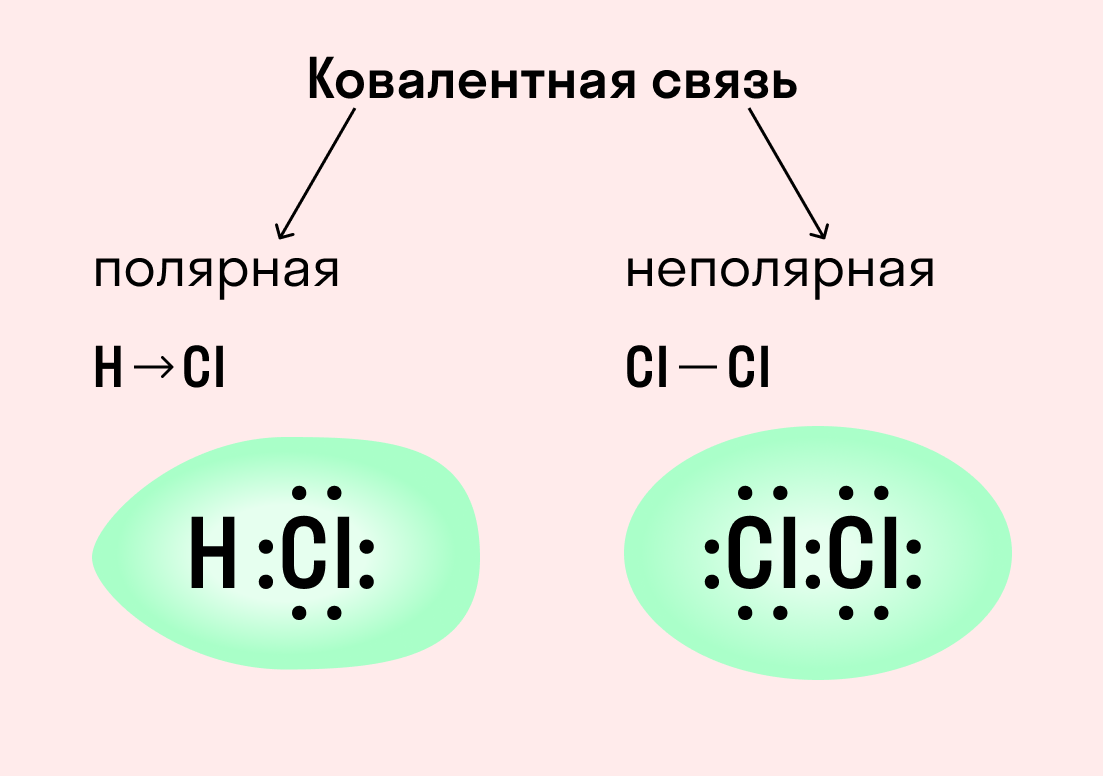
| Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью.
Характеристики ковалентной связи:
Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд. В результате этого процесса образуются ионы.
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
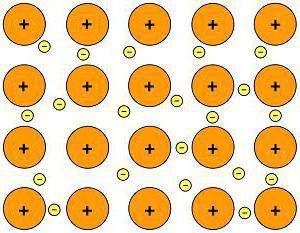
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.
Характеристики ионной связи:
не имеет направленности.
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Характеризуется появлением электронных пар, принадлежащих обоим атомам.
Характеризуется появлением и взаимным притяжением ионов.
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов.
Ионы с противоположными зарядами подвержены кулоновскому притяжению.
Имеет направленность и насыщенность.
Ненасыщенна и не имеет направленности.
Количество связей, образуемых атомом, называется валентностью.
Количество ближайших соседей атома называется координационным числом.
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО.
Образуется между металлами и неметаллами — веществами со значимо разной ЭО.
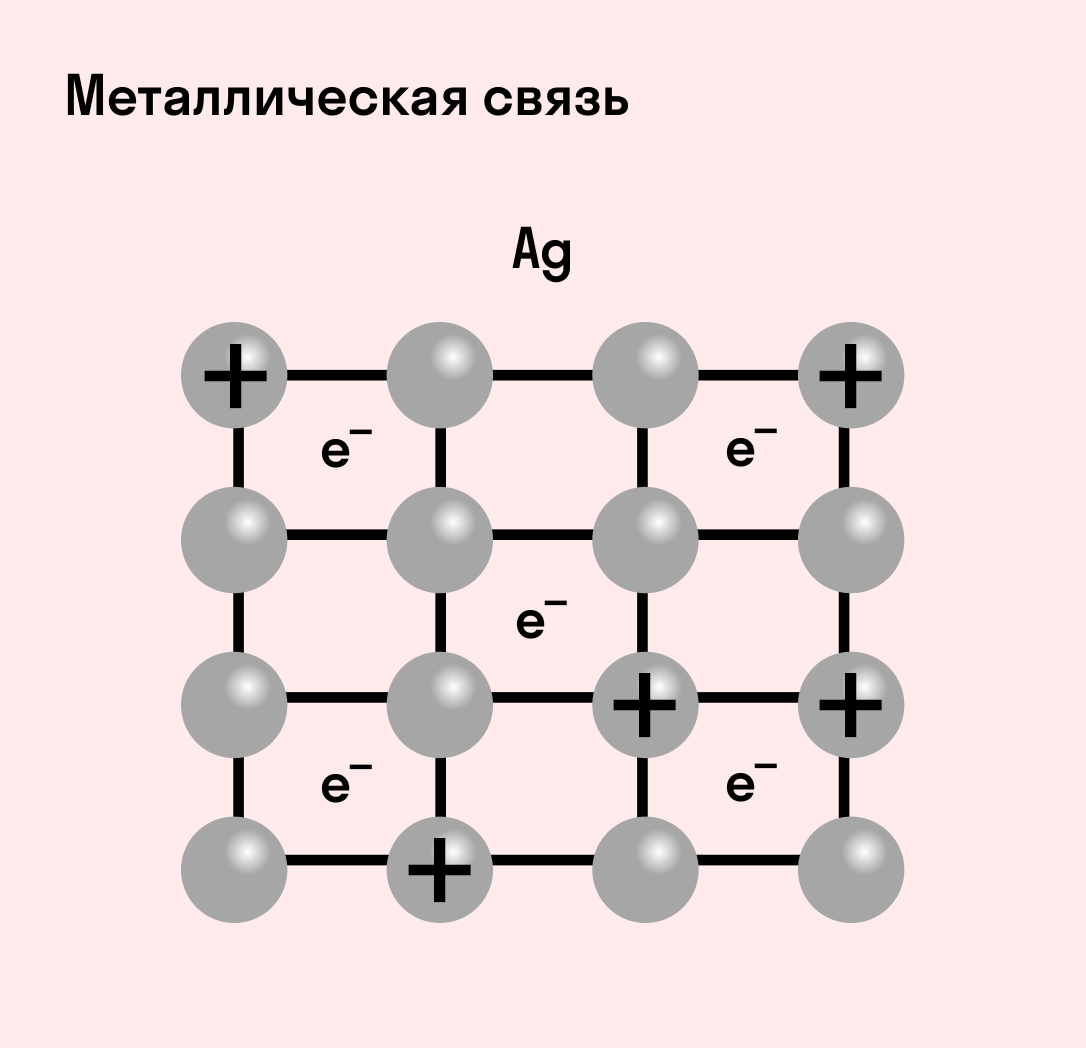
Металлическая связь
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
| Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества. |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
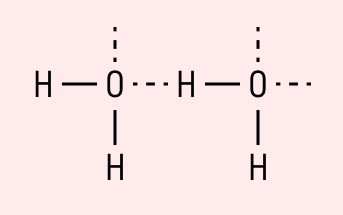
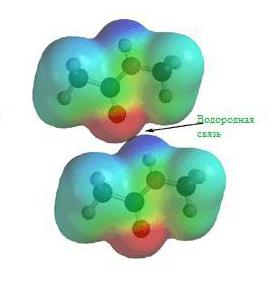
Водородная связь
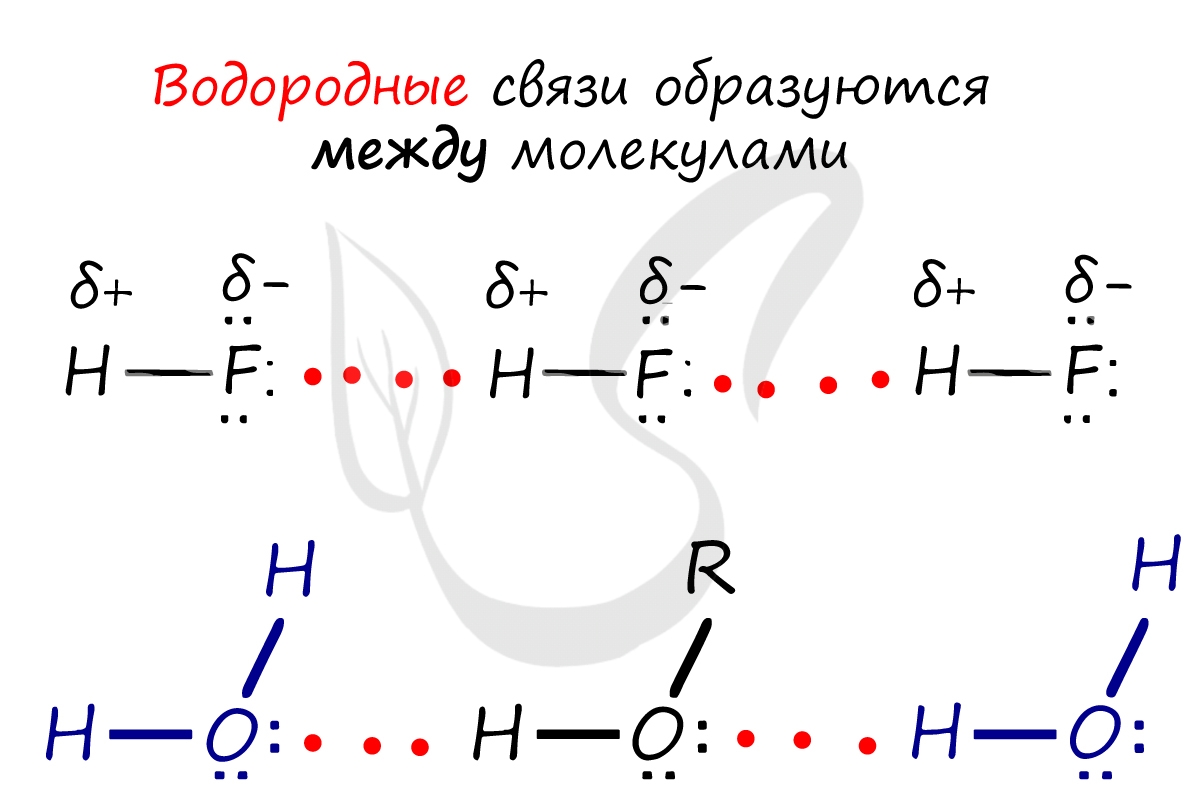
Данный тип связи в химии стоит отдельно, поскольку он может быть как внутри молекулы, так и между молекулами. Как правило, у неорганических веществ эта связь происходит между молекулами.
| Водородная связь образуется между молекулами, содержащими водород. Точнее, между атомами водорода в этих молекулах и атомами с большей ЭО в других молекулах вещества. |
Объясним подробнее механизм этого вида химической связи. Есть молекулы А и В, содержащие водород. При этом в молекуле А есть электроотрицательные атомы, а в молекуле В водород имеет ковалентную полярную связь с другими электроотрицательными атомами. В этом случае между атомом водорода в молекуле В и электроотрицательным атомом в молекуле А образуется водородная связь.
Такое взаимодействие носит донорно-акцепторный характер. Донором электронов в данном случае выступают электроотрицательные элементы, а акцептором — водород.
Графически водородная связь обозначается тремя точками. Ниже приведена схема такого взаимодействия на примере молекул воды.
Характеристики водородной связи:
Кратко о химических связях
Итак, самое главное. Химической связью называют взаимодействие атомов, причиной которого является стремление системы приобрести устойчивое состояние. Во время взаимодействия свободные внешние электроны атомов объединяются в пары либо внешний электрон одного атома переходит к другому.
Образование химической связи сопровождается выделением энергии. Эта энергия растет с увеличением количества образованных электронных пар и с сокращением расстояния между ядрами атомов.
Основные виды химических связей: ковалентная (полярная и неполярная), ионная, металлическая и водородная. В отличие от всех остальных водородная ближе к молекулярным связям, поскольку может быть как внутри молекулы, так и между разными молекулами.
Как определить тип химической связи:
Ковалентная полярная связь образуется в молекулах неметаллов между атомами со сходной ЭО.
Ковалентная неполярная связь имеет место между атомами с разной ЭО.
Ионная связь ведет к образованию и взаимному притяжению ионов. Она происходит между атомами металла и неметалла.
Металлическая связь бывает только между атомами металлов. Это взаимодействие положительных ионов в кристаллической решетке и свободных отрицательных электронов. Масса рассеянных по всему объему свободных электронов представляет собой «электронное облако».
Водородная связь появляется при условии, что есть атом с высокой ЭО и атом водорода, связанный с другой электроотрицательной частицей ковалентной связью.
Химическая связь и строение молекулы: типом химической связи определяется кристаллическая решетка вещества: ионная, металлическая, атомная или молекулярная.
Определить тип химической связи в 8 классе поможет таблица.
Химическая связь: определение, типы, свойства
Содержание:
Химическая связь, ее типы, свойства, наряду с химическими реакциями является одним из краеугольных камней интересной науки под названием химия. В этой статье мы разберем все аспекты химических связей, их значение в науке, приведем примеры и многое другое.
Определение
Под химической связью в химии понимается взаимное сцепление атомов в молекуле и кристаллической решетке, в результате действия силы притяжения, существующей между атомами. Именно благодаря химическим связям происходит образование различных химических соединений, в этом заключается природа химической связи.
Типы связей
Механизм образования химической связи сильно зависит от ее типа или вида, в целом различаются такие основные виды химической связи:
Что касается ковалентной химической связи, то на нашем сайте ей посвящена отдельная статья, и более детально вы можете почитать по ссылке. Далее же мы разберем более детально все другие основные типы химических связей.
Ионная связь
Образование ионной химической связи возникает при взаимном электрическом притяжении двух ионов, имеющих разные заряды. Ионы обычно при таких химических связях простые, состоящие из одного атома вещества.
Схема ионной химической связи.
Характерной особенностью ионного типа химичечкой связи является отсутствие у нее насыщенности, и как результат, к иону или даже целой группе ионов может присоединиться самое разное количество противоположно заряженных ионов. Примером ионной химической связи может служить соединение фторида цезия CsF, в котором уровень «ионости» составляет практически 97%.
Водородная связь
Еще задолго до появления современной теории химических связей в ее современном виде учеными химиками было замечено, что соединения водорода с неметаллами обладают различными удивительными свойствами. Скажем, температура кипения воды и вместе со фтороводородом гораздо выше, чем это могло бы быть, вот вам готовый пример водородной химической связи.
На картинке схема образования водородной химической связи.
Природа и свойства водородной химической связи обусловлены способностью атома водорода H образовывать еще одну химическую связь, отсюда собственно и название этой связи. Причиной образования такой связи являются свойства электростатических сил. Например, общее электронное облако в молекуле фтороводорода настолько смещено в сторону фтора, что пространство вокруг атома этого вещества насыщено отрицательным электрическим полем. Вокруг атома водорода, тем более лишенного своего единственного электрона, все с точностью до наоборот, его электронное поле значительно слабее и как следствие имеет положительный заряд. А положительные и отрицательные заряды, как известно, притягиваются, таким нехитрым образом и возникает водородная связь.
Связь металлов
Какая химическая связь характерна для металлов? У этих веществ есть свой собственный тип химической связи – атомы всех металлов расположены не абы как, а определенным образом, порядок их расположения называется кристаллической решеткой. Электроны различных атомов образуют общее электронное облако, при этом они слабо взаимодействуют друг с другом.
Так выглядит металлическая химическая связь.
В качестве примера металлической химической связи могут выступать любые металлы: натрий, железо, цинк и так далее.
Как определить вид связи
В зависимости от веществ, принимающих в ней участие, если метал и неметалл, то связь ионная, если два метала, то металлическая, если два неметалла то ковалентная.
Свойства связей
Чтобы провести сравнение разных химических реакций используются разные количественные характеристики, такие как:
Разберем их подробнее.
Длина связи – равновесное расстояние между ядрами атомов, которые соединены химической связью. Обычно измеряется экспериментально.
Энергия химической связи определяет ее прочность. В данном случае под энергией подразумевается усилие, необходимое, для того, чтобы разорвать химическую связь и разъединить атомы.
Полярность химической связи показывает, насколько электронная плотность смещена к одному из атомов. Способность атомов смещать к себе электронную плотность или говоря простым языком «тянуть одеяло на себя» в химии называют электроотрицательностью.
Порядок химической связи (другими словами кратность химической связи) – это число электронных пар, вступающих в химическую связь. Порядок может быть, как целым, так и дробным, чем он выше, тем большее число электронов осуществляют химическую связь и тем труднее ее разорвать.
Видео
И в завершение познавательное видео об разных видах химической связи.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Похожие посты:
Один комментарий
Для такой коротенькой статьи многовато мелких неточностей. Если трудно пересказать всего лишь школьный учебник, то хотя бы перепишите его один в один. Но тогда в чем ваша роль как популяризатора науки на сайте? В разделе математика у вас значительно выше процентное содержание интересных и более качественных статей. За что вы так невзлюбили химию?
Химическая связь
Химическая связь — явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы.
При образовании ковалентной химической связи важную роль в уменьшении полной энергии играет обменное взаимодействие.
Содержание
Теория химического строения Бутлерова
Термин «химическое строение» впервые ввёл А. М. Бутлеров в 1861 году. Также он заложил основы классической теории химического строения. Главные положения этой теории следующие:
Типы связи
Простейшая одноэлектронная ковалентная химическая связь
Простейшая одноэлектронная химическая связь создаётся единственным валентным электроном. Оказывается, что один электрон способен удерживать в едином целом два положительно заряженных иона. В одноэлектронной связи кулоновские силы отталкивания положительно заряженных частиц компенсируются кулоновскими силами притяжения этих частиц к отрицательно заряженному электрону. Валентный электрон становится общим для двух ядер молекулы.
| Элемент | H | Li | Na | K | Rb | Cs |
|---|---|---|---|---|---|---|
| Электронная конфигурация | 1S 1 | [He]2S 1 | [Ne]3S 1 | [Ar]4S 1 | [Kr]5S 1 | [Xe]6S 1 |
| Межъядерное расстояние | 1,06 | 3,14 | 3,43 | 4,18 | 4,44 | 4,70 |
| Орбитальный радиус атома, Å | 0,53 | 1,57 | 1,715 | 2,09 | 2,22 | 2,35 |
Существование молекулярных ионов водорода и щелочных металлов, в которых химическую связь создаёт единственный валентный электрон, расширяет и дополняет понятие химической связи. В перечисленных ионах ни о каком взаимодействии спинов электронов и перекрывания электронных облаков речи быть не может. Единственный связывающий электрон локализуется в пространстве между ядрами атомов и удерживает их в едином целом, образуя устойчивую химическую систему (рис.1).
Одинарная ковалентная связь
Одинарная ковалентная химическая связь создаётся связывающей электронной парой. Во всех существующих теориях (теория валентных связей, теория молекулярных орбиталей, теория отталкивания валентных электронных пар, боровская модель химической связи) связывающая электронная пара располагается в пространстве между атомами молекулы. Различают полярную и неполярную ковалентную связи.
Неполярная ковалентная связь имеет место в гомоядерных двухатомных молекулах, в которых связывающая электронная пара равноудалена от обоих ядер молекулярной системы (рис.2). Расстояние d между атомными ядрами можно рассматривать как сумму ковалентных радиусов соответсвующих атомов.
Расстояние между атомными ядрами в одинарной двухэлектронной ковалентной связи короче аналогичного расстояния в простейшей одноэлектронной химической связи.
| Молекула | H2 | Li2 | Na2 | K2 | Rb2 | Cs2 |
|---|---|---|---|---|---|---|
| Межъядерное расстояние, Å [2] | 0,74 | 2,67 | 3,08 | 3,92 | 4,10 | 4,30 |
| Ковалентный радиус, Å | 0,37 | 1,335 | 1,54 | 1,96 | 2,05 | 2,15 |
| Орбитальный радиус, Å | 0,53 | 1,57 | 1,715 | 2,09 | 2,22 | 2,35 |
| Радиус связывающей электронной пары, Å | 0,379 | 0,826 | 0,755 | 0,726 | 0,852 | 0,949 |
| Энергия разрыва связи, кДж/моль [2] | 436 | 102 | 73 | 57 | 49 | 42 |
Разность между орбитальными и ковалентными радиусами характеризует степень перекрытия атомных орбиталей атомов, образующих химическую связь, и отражает деформацию электронной оболочки атомов.
Полярная ковалентная связь возникает в гетероядерных двухатомных молекулах (рис.3). Связывающая электронная пара в полярной химической связи приближена к атому с более высоким первым потенциалом ионизации. [3]
Характеризующее пространственную структуру полярных молекул расстояние d между атомными ядрами можно приближённо рассматривать как сумму ковалентных радиусов соответствующих атомов. [4]
Характеристика некоторых полярных веществ [2]
| Молекула | LiH | NaH | KH | RbH | CsH |
|---|---|---|---|---|---|
| Межъядерное расстояние, Å | 1,60 | 1,89 | 2,24 | 2,37 | 2,49 |
| Энергия разрыва связи, кДж/моль | 236 | 200 | 182 | 165 | 176 |
Сдвиг связывающей электронной пары к одному из ядер полярной молекулы приводит к появлению электрического диполя (электродинамика) (рис.4).
Расстояние между центрами тяжести положительного и отрицательного зарядов называют длиной диполя. Полярность молекулы, как и полярность связи, оценивают величиной дипольного момента μ, представляющего собой произведение длины диполя l на величину электронного заряда:
Кратные ковалентные связи
Кратные ковалентные связи представлены непредельными органическими соединениями, содержащими двойную и тройную химические связи. Для описания природы непредельных соединений Л.Полинг вводит понятия сигма- и π-связей, гибридизации атомных орбиталей.
В случае молекулы ацетилена в гибридизации принимают участие (по Полингу) всего лишь одна S- и одна p-орбитали, при этом образуются две Sp-орбитали, расположенные под углом в 180° и направленные в противоположные сороны. Две «чистые» p-орбитали атомов углерода попарно перекрываются во взаимоперпендикулярных плоскостях, образуя две π-связи линейной молекулы ацетилена (рис.6).
Однако физический смысл избирательной гибридизации атомных орбиталей оставался неясным, гибридизация представляла собой алгебраические преобразования, которым не могла быть приписана физическая реальность.
Могут найтись химики, полагающие что чрезвычайно важным новшеством… явилось описание σ,π- описания для двойной или тройной связи и сопряжённых систем вместо описания с помощью изогнутых связей. Я же утверждаю, что σ,π- описание менее удовлетворительно, чем описание с помощью изогнутых связей, что это нововведение является только переходящим и вскоре отомрёт. [6]
В новой теории Полинга все связывающие электроны становились равноценными и равноудалёнными от линии, соединяющей ядра молекулы. Теория изогнутой химической связи Полинга учитывала статистическую интерпретацию волновой функции М.Борна, кулоновскую электронную корреляцию электронов. Появился физический смысл — природа химической связи полностью определяется электрическим взаимодействием ядер и электронов. Чем больше связывающих электронов, тем меньше межъядерное расстояние и прочнее химическая связь между атомами углерода.
| Кратность связи | Структура связи | Межъядерное расстояние, Å | Энергия связи, кДж/моль |
|---|---|---|---|
| Одинарная (C-C) | Двухэлектронная двухцентровая | 1,54 | 348 |
| Двойная (C=C) | Четырёхэлектронная двухцентровая | 1,34 | 614 |
| Тройная (C=C) | Шестиэлектронная двухцентровая | 1,20 | 839 |
Трёхцентровая химическая связь
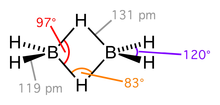
Дальнейшее развитие представлений о химической связи дал американской физикохимик У.Липскомб, разработавший теорию двухэлектронных трёхцентровых связей и топологическую теорию, позволяющую предсказывать строение ещё некоторых гидридов бора (бороводородов).
Электронная пара в трёхцентровой химической связи становится общей для трёх ядер атомов. В простейшем представителе трёхцентровой химической связи — молекулярном ионе водорода H3 + электронная пара удерживает в едином целом три протона (рис.6).
Трёхцентровые связи могут реализоваться не только в треугольнике из двух атомов бора и одного атома водорода, но и между тремя атомами бора, например в каркасных бороводородах (пентаборан — B5H9, декаборан — B10H4 и др.). В этих структурах есть обычные (концевые) и входящие в трёхцентровую связь (мостиковые) атома водорода и треугольники из атомов бора. [7]
Существование боранов с их двухэлектронными трёхцентровыми связями с «мостиковыми» атомами водорода нарушало каноническое учение о валентности. Атом водорода, считавшийся ранее стандартным одновалентным элементом, оказался связанным одинаковыми связями с двумя атомами бора и стал формально двухвалентным элементом. Работы У.Липскомба по расшифровке строения боранов расширяли представления о химической связи. Нобелевский комитет удостоил Уильяма Нанна Липскомба премии по химии за 1976 год с формулировкой «За исследования структуры боранов (боргидритов), проясняющие проблемы химических связей).
Многоцентровая химическая связь
В 1951 году Т.Кили и П.Посон неожиданно при синтезе дициклопентадиенила получили совершенно новое железоорганическое соединение. Получение неизвестного ранее исключительно устойчивого жёлто-оранжевого кристаллического соединения железа сразу привлекло к себе внимание.
Э.Фишер и Д.Уилкинсон независимо друг от друга установили структуру нового соединения — два кольца циклопентадиенила расположены параллельно, слоями, или в виде «сэндвича» с атомом железа, расположенным между ними по центру (рис.8). Название «ферроцен» было предложено Р.Вудвордом (вернее, сотрудником его группы Д.Уайтингом). В нём отражено наличие в соединении атома железа и десяти углеродных атомов (zehn — десять). [7]
Все десять связей (C-Fe) в молекуле ферроцена равноценны, величина межъядерного расстояния Fe-c — 2,04 Å. Все атомы углерода в молекуле ферроцена структурно и химически эквивалентны, длина каждой связи C-C 1,40 — 1,41 Å (для сравнения, в бензоле длина связи C-C 1,39 Å). Вокруг атома железа возникает 36- электронная оболочка. [7]
В 1973 году Эрнст Отто Фишер и Джефри Уилкинсон были удостоены Нобелевской премии по химии с формулировкой «За новаторскую, проделанную независимо друг от друга работу, в области металлоорганических, так называемых сандвичевых соединений». Индвар Линдквист, член Шведской королевской академии наук, в своей речи при презентации лауреатов, заявил, что «открытие и доказательство новых принципов связей и структур, имеющихся в сандвичевых соединениях, являются значительным достижением, практическую значимость которых в настоящее время ещё невозможно предсказать».
Синтезирован также ураноцен [бис(циклооктатетраен)уран], в котором атом урана удерживает два восьмичленных кольца (рис.10). Все 16 связей уран-углерод в ураноцене идентичны. Ураноцен получают взаимодействием UCl4 со смесью циклооктатетраена и калия в тетрагидрофуране при минус 30 0 C. [8]
Динамика химической связи
Химическая связь достаточно динамична. Так, металлическая связь трансформируется в ковалентную в процессе фазового перехода при испарении металла. Переход металла из твёрдого в парообразное состояние требует затраты больших количеств энергии. [9]
| Металл | Li | Na | K | Rb | Cs |
|---|---|---|---|---|---|
| Теплота возгонки (ккал/г-атом) | 36 | 26 | 22 | 21 | 19 |
В парах указанные металлы состоят практически из гомоядерных двухатомных молекул и свободных атомов. При конденсации паров металла ковалентная связь превращается в металлическую.
Испарение солей с типичной ионной связью, например фторидов щелочных металлов, приводит к разрушению ионной связи и образованию гетероядерных двухатомных молекул с полярной ковалентной связью. При этом имеет место образование димерных молекул с мостиковыми связями.
Характеристика химической связи в молекулах фторидов щелочных металлов и их димерах. [2] [10]