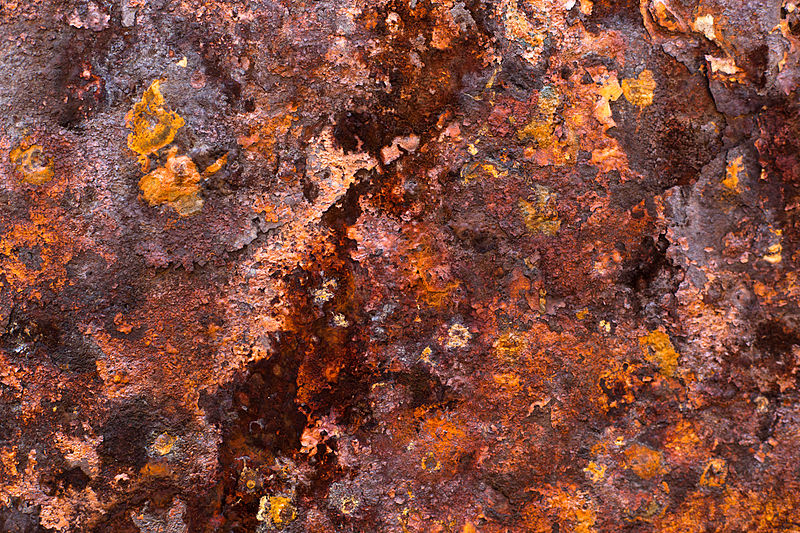Что называют химическим явлением
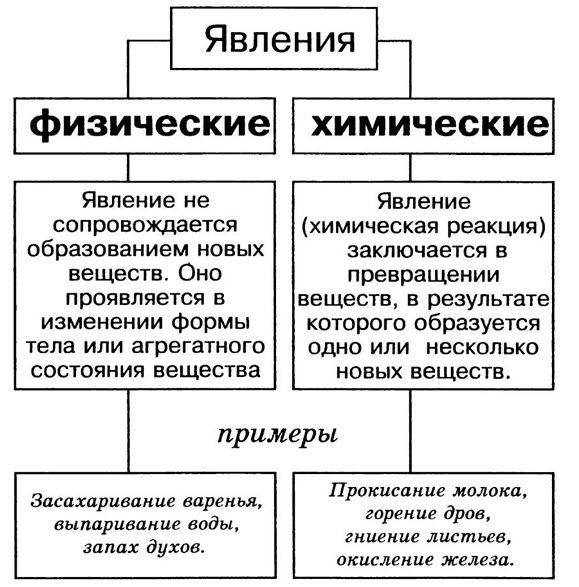
Физические и химические явления
Различные изменения, происходящие с веществами, называются явлениями.
Пример. Испарение воды, плавление стекла, ржавление металлов — явления.
Явления делятся на физические и химические.
Физические явления — это явления, при которых не происходит превращения одних веществ в другие.
Пример. Изменение формы тела или агрегатного состояния вещества — физические явления.
Химические явления — это явления, в результате которых из одних веществ образуются другие, новые вещества с новыми химическими и физическими свойствами. Химические явления иначе ещё называются химическими реакциями или химическими превращениями.
Пример. Ржавление железа, горение веществ, разложение воды при высокой температуре на водород и кислород — химические явления.
О веществах, вступающих в химическую реакцию, говорят, что они реагируют, взаимодействуют между собой или одни вещества превращаются в другие.
Вещества, которые вступают в химическую реакцию, называются исходными веществами или реагентами. Новые вещества, которые образуются в результате химической реакции, называются продуктами реакции.
Пример. При взаимодействии натрия и воды образуются гидроксид натрия и водород. Натрий и вода — реагенты, а гидроксид натрия и водород — продукты реакции.
Признаки химических реакций
О том, что происходит химическая реакция можно узнать по внешним признакам. Возможные признаки протекания химических реакций:
Пример. Горение веществ часто сопровождается излучением света, выделением запаха и теплоты.
Вещества и их свойства. Физические и химические явления.
Разнообразие веществ
За последние 200 лет человечество изучило свойства веществ лучше, чем за всю историю развития химии. Естественно, количество веществ так же стремительно растет, это связано, прежде всего, с освоением различных методов получения веществ.
В повседневной жизни мы сталкиваемся с множеством веществ. Среди них – вода, железо, алюминий, пластмасса, сода, соль и множество других. Вещества, существующие в природе, например, кислород и азот, содержащиеся в воздухе, вещества, растворенные в воде, и имеющие природное происхождение, называются природными веществами. Алюминия, цинка, ацетона, извести, мыла, аспирина, полиэтилена и многих других веществ в природе не существует.
Их получают в лаборатории, и производит промышленность. Искусственные вещества не встречаются в природе, их создают из природных веществ. Некоторые вещества, существующие в природе, можно получить и в химической лаборатории.
Так, при нагревании марганцовки выделяется кислород, а при нагревании мела – углекислый газ. Ученые научились превращать графит в алмаз, выращивают кристаллы рубина, сапфира и малахита. Итак, наряду с веществами природного происхождения существует огромное множество и искусственно созданных веществ, не встречающихся в природе.
Вещества, не встречающиеся в природе, производятся на различных предприятиях: фабриках, заводах, комбинатах и т.п.
В условиях исчерпания природных ресурсов нашей планеты, сейчас перед химиками стоит важная задача: разработать и внедрить методы, при помощи которых можно искусственно, в условиях лаборатории, или промышленного производства, получать вещества, являющиеся аналогами природных веществ. Например, запасы топливных ископаемых в природе на исходе.
Может настать тот момент, когда нефть и природный газ закончатся. Уже сейчас ведутся разработки новых видов топлива, которые были бы такими же эффективными, но не загрязняли окружающую среду. На сегодняшний день человечество научилось искусственно получать различные драгоценные камни, например, алмазы, изумруды, бериллы.
Агрегатное состояние вещества
Вещества могут существовать в нескольких агрегатных состояниях, три из которых вам известны: твердое, жидкое, газообразное. Например, вода в природе существует во всех трех агрегатных состояниях: твердом (в виде льда и снега), жидком (жидкая вода) и газообразном (водяной пар). Известны вещества, которые не могут существовать в обычных условиях во всех трех агрегатных состояниях. Например, таким веществом является углекислый газ. При комнатной температуре это газ без запаха и цвета. При температуре –79°С данное вещество «замерзает» и переходит в твердое агрегатное состояние. Бытовое (тривиальное) название такого вещества «сухой лед». Такое название дано этому веществу из-за того, что «сухой лед» превращается в углекислый газ без плавления, то есть, без перехода в жидкое агрегатное состояние, которое присутствует, например, у воды.
Таким образом, можно сделать важный вывод. Вещество при переходе из одного агрегатного состояния в другое не превращается в другие вещества. Сам процесс некоего изменения, превращения, называется явлением.
Физические явления. Физические свойства веществ.
Явления, при которых вещества изменяют агрегатное состояние, но при этом не превращаются в другие вещества, называют физическими. Каждое индивидуальное вещество обладает определенными свойствами. Свойства веществ могут быть различными или сходными друг с другом. Каждое вещество описывают при помощи набора физических и химических свойств. Рассмотрим в качестве примера воду. Вода замерзает и превращается в лед при температуре 0°С, а закипает и превращается в пар при температуре +100°С. Данные явления относятся к физическим, так как вода не превратилась в другие вещества, происходит только изменение агрегатного состояния. Данные температуры замерзания и кипения – это физические свойства, характерные именно для воды.
Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
Испарение спирта, как и испарение воды – физические явления, вещества при этом изменяют агрегатное состояние. После проведения опыта можно убедиться, что спирт испаряется быстрее, чем вода – это физические свойства этих веществ.
К основным физическим свойствам веществ можно отнести следующие: агрегатное состояние, цвет, запах, растворимость в воде, плотность, температура кипения, температура плавления, теплопроводность, электропроводность. Такие физические свойства как цвет, запах, вкус, форма кристаллов, можно определить визуально, с помощью органов чувств, а плотность, электропроводность, температуру плавления и кипения определяют измерением. Сведения о физических свойствах многих веществ собраны в специальной литературе, например, в справочниках. Физические свойства вещества зависят от его агрегатного состояния. Например, плотность льда, воды и водяного пара различна.
Газообразный кислород бесцветный, а жидкий – голубой Знание физических свойств помогает «узнавать» немало веществ. Например, медь – единственный металл красного цвета. Соленый вкус имеет только поваренная соль. Иод – почти черное твердое вещество, которое при нагревании превращается в фиолетовый пар. В большинстве случаев для определения вещества нужно рассматривать несколько его свойств. В качестве примера охарактеризуем физические свойства воды:
Кристаллические и аморфные вещества
При описании физических свойств твердых веществ принято описывать структуру вещества. Если рассмотреть образец поваренной соли под увеличительным стеклом, можно заметить, что соль состоит из множества мельчайших кристаллов. В соляных месторождениях можно встретить и весьма крупные кристаллы. Кристаллы – твердые тела, имеющие форму правильных многогранников Кристаллы могут иметь различную форму и размер. Кристаллы некоторых веществ, таких как поваренная соль – хрупкие, их легко разрушить. Существуют кристаллы довольно твердые. Например, одним из самых твердых минералов считается алмаз. Если рассматривать кристаллы поваренной соли под микроскопом, можно заметить, что все они имеют похожее строение. Если же рассмотреть, например, частицы стекла, то все они будут иметь различное строение – такие вещества называют аморфными. К аморфным веществам относят стекло, крахмал, янтарь, пчелиный воск. Аморфные вещества – вещества, не имеющие кристаллического строения
Химические явления. Химическая реакция.
Если при физических явлениях вещества, как правило, лишь изменяют агрегатное состояние, то при химических явлениях происходит превращение одних веществ в другие вещества. Приведем несколько простых примеров: горение спички сопровождается обугливанием древесины и выделением газообразных веществ, то есть, происходит необратимое превращение древесины в другие вещества. Другой пример: со временем бронзовые скульптуры покрываются налетом зеленого цвета. Дело в том, что в состав бронзы входит медь. Этот металл медленно взаимодействует с кислородом, углекислым газом и влагой воздуха, в результате на поверхности скульптуры образуются новые вещества зеленого цвета Химические явления – явления превращений одних веществ в другие Процесс взаимодействия веществ с образованием новых веществ называют химической реакцией. Химические реакции происходят повсеместно вокруг нас. Химические реакции происходят и в нас самих. В нашем организме непрерывно происходят превращения множества веществ, вещества реагируют друг с другом, образуя продукты реакции. Таким образом, в химической реакции всегда есть реагирующие вещества, и вещества, образовавшиеся в результате реакции.
Любые химические явления (реакции) сопровождаются определенными признаками, при помощи которых химические явления можно отличить от физических. К таким признакам можно отнести изменение окраски веществ, выделение газа, образование осадка, выделение тепла, излучение света.
Многие химические реакции сопровождаются выделением энергии в виде тепла и света. Как правило, такими явлениями сопровождаются реакции горения. В реакциях горения на воздухе вещества реагируют с кислородом, содержащимся в воздухе. Так, например, металл магний вспыхивает и горит на воздухе ярким слепящим пламенем. Именно поэтому вспышку магния использовали при создании фотографий в первой половине ХХ века. В некоторых случаях возможно выделение энергии в виде света, но без выделения тепла. Один из видов тихоокеанского планктона способен испускать ярко-голубой свет, хорошо заметный в темноте. Выделение энергии в виде света – результат химической реакции, которая протекает в организмах данного вида планктона.
Итог статьи:
Что называют химическим явлением
Ключевые слова конспекта: Физические явления, химические явления, химические реакции, признаки химических реакций, значение физических и химических явлений.
Физические явления — это явления, при которых обычно изменяется только агрегатное состояние веществ. Примеры физических явлений — плавление стекла, испарение или замерзание воды.
Химические явления — это явления, в результате которых из данных веществ образуются другие вещества. При химических явлениях исходные вещества превращаются в другие вещества, обладающие другими свойствами. Примеры химических явлений — сгорание топлива, гниение органических веществ, ржавление железа, скисание молока.
Химические явления иначе называют химическими реакциями.
Условия возникновения химических реакций
О том, что при химических реакциях одни вещества превращаются в другие, можно судить по внешним признакам: выделению теплоты (иногда света), изменению окраски, появлению запаха, образованию осадка, выделению газа.
Для начала многих химических реакций необходимо привести в тесное соприкосновение реагирующие вещества. Для этого их измельчают и перемешивают; площадь соприкосновения реагирующих веществ при этом увеличивается. Наиболее тонкое дробление веществ происходит при их растворении, поэтому многие реакции проводят в растворах.
Измельчение и перемешивание веществ — только одно из условий возникновения химической реакции. Например. при соприкосновении древесных опилок с воздухом при обычной температуре опилки не загораются. Для того чтобы началась химическая реакция, во многих случаях необходимо нагревание веществ до определённой температуры.
Следует различать понятия «условия возникновения» и «условия течения химических реакций». Так, например, чтобы началось горение, нагревание нужно только вначале, а затем реакция протекает с выделением теплоты и света, и дальнейшее нагревание не требуется. А в случае разложения воды приток электрической энергии необходим не только для начала реакции, но и для дальнейшего её протекания.
Важнейшие условия возникновения химических реакций — это:
Значение физических и химических явлений
Большое значение имеют химические реакции. Они используются для получения металлов, пластмасс, минеральных удобрений, медикаментов и т. д., а также служат источником различных видов энергии. Так, при сгорании топлива выделяется теплота, которую используют в быту и в промышленности.
Все процессы жизнедеятельности (дыхание, пищеварение, фотосинтез и др.), протекающие в живых организмах, также связаны с различными химическими превращениями. Например, химические превращения веществ, содержащихся в пище (белков, жиров, углеводов), протекают с выделением энергии, которая используется организмом для обеспечения процессов жизнедеятельности.
Конспект урока «Физические и химические явления ( химические реакции)».
Химические явления: примеры в природе и повседневной жизни
Физические изменения не связаны с химическими реакциями и созданием новых продуктов, например, таяние льда. Как правило, такие преобразования являются обратимыми. Кроме примеров физических явлений, в природе и в повседневной жизни встречаются также химические трансформации, при которых образуются новые продукты. Такие химические явления (примеры будут рассмотрены в статье) являются необратимыми.
Химические изменения
Химические изменения можно рассматривать как любое явление, которое позволяет ученым измерять химические свойства. Многие реакции также являются примерами химических явлений. Хотя не всегда легко сказать, что произошло именно химическое изменение, есть некоторые контрольные признаки. Что такое химические явления? Приведем примеры. Это может быть изменение цвета вещества, температуры, образование пузырьков или (в жидкостях) выпадение осадка. Можно привести следующие примеры химических явлений в жизни:
И это далеко не весь список. Можно рассмотреть некоторые из этих пунктов более подробно.
Наружный огонь с использованием дерева
Огонь — это тоже пример химического явления. Это быстрое окисление материала в экзотермическом химическом процессе горения, высвобождение тепла, света и различных продуктов реакции. Огонь является горячим, потому что происходит конверсия слабой двойной связи в молекулярном кислороде O2 к более сильным связям в продуктах сгорания углекислого газа и воды. Выделяется большая энергия (418 кДж на 32 г O2); энергии связи топлива играют лишь второстепенную роль здесь. В определенный момент реакции горения, называемой точкой воспламенения, образуются пламя.
Это видимая часть огня, которая состоит в основном из двуокиси углерода, водяного пара, кислорода и азота. Если температура достаточно высокая, газы могут стать ионизированными для получения плазмы. В зависимости от того, какие вещества загораются и какие примеси подаются снаружи, цвет пламени и интенсивность огня будут разными. Огонь в его наиболее распространенной форме может привести к пожару, который может нанести физический ущерб при горении. Огонь является важным процессом, который затрагивает экологические системы по всему миру. Положительные эффекты пожара включают стимулирующий рост и поддержание различных экологических систем.
Ржавчина
Так же, как и огонь, процесс ржавления является также окислительным процессом. Вот только не таким быстропротекающим. Ржавчина представляет собой оксид железа, обычно красный оксид, образованный окислительно-восстановительной реакцией железа и кислорода в присутствии воды или воздуха. Несколько форм ржавчины различаются как визуально, так и спектроскопией и формируются при разных обстоятельствах. Учитывая достаточное время, кислород и воду, всякая масса железа в конечном итоге полностью превращается в ржавчину и разлагается. Поверхностная ее часть является шелушащейся и рыхлой, и она не защищает подстилающее железо, в отличие от образования патины на медных поверхностях.
Такой пример химического явления, как ржавление, является общим термином для коррозии железа и его сплавов, таких как сталь. Многие другие металлы подвергаются аналогичной коррозии, но полученные оксиды обычно не называются ржавчиной. Существуют другие формы этой реакции как результат реакции между железом и хлоридом в среде, лишенной кислорода. Примером может служить арматура, используемая в подводных бетонных столбах, которая генерирует зеленую ржавчину.
Кристаллизация
Еще одним примером химического явления является кристаллический рост. Это процесс, в котором ранее существовавший кристалл становится больше по мере увеличения количества молекул или ионов в их положениях в кристаллической решетке. Кристалл определяется как атомы, молекулы или ионы, расположенные в упорядоченном повторяющемся образце, кристаллической решетке, распространяющейся во всех трех пространственных измерениях. Таким образом, рост кристаллов отличается от роста капли жидкости тем, что во время роста молекулы или ионы должны попадать в правильные положения решетки, чтобы упорядоченный кристалл мог расти.
Когда молекулы или ионы попадают в положение, отличное от положений в идеальной кристаллической решетке, образуются дефекты кристалла. Как правило, молекулы или ионы в кристаллической решетке улавливаются в том смысле, что они не могут двигаться от своих положений, и поэтому рост кристаллов часто необратим, так как когда молекулы или ионы встали на место в растущей решетке, они фиксируются в ней. Кристаллизация является обычным процессом как в промышленности, так и в естественном мире, и кристаллизация обычно понимается как состоящая из двух процессов. Если ранее не существовало кристалла, то новый кристалл должен зарождаться, а затем он должен подвергаться росту.
Химическое происхождение жизни
Химическое происхождение жизни относится к условиям, которые могли бы существовать и, следовательно, способствовали появлению первых дублируемых форм жизни.
Главным примером химических явлений в природе является сама жизнь. Считается, что совокупность физических и химических реакций смогла привести к появлению первых молекул, которые, репродуцируясь, привели к появлению жизни на планете.
Изучаем химию. 8 класс
Физические и химические явления
Все происходящие превращения с веществами можно разделать на два вида.
| ЯВЛЕНИЯ | |
| Физические | Химические |
| Физическими называют такие явления, при которых не происходит превращений одних веществ в другие, а меняются их агрегатные состояния, форма и размеры тел. Примеры:плавление льда, вытягивание проволоки, измельчение гранита, испарение воды. | Химическими называют такие явления, при которых происходит превращения одних веществ в другие. Примеры:горение дров, почернение меди,ржавление железа. В дальнейшем химические явления мы будем называть химическими реакциями. |
Итак, физические явления не сопровождаются превращением одних веществ в другие. Например.
2. Длина медных проводов изменяется летом и зимой: увеличивается при нагревании и уменьшается при охлаждении.
3. Объем воздуха в шаре увеличивается в теплом помещении.
Новых веществ, несмотря на их изменения, не образовалось.
К химическим явлениям относят такие явления, при которых одни вещества превращаются в другие. Химические явления называют иначе химическими реакциями.
Признаки химических реакций