Что называют гидролизом солей
Гидролиз солей
Водные растворы солей имеют разные значения рН и показывают различную реакцию среды — кислую, щелочную, нейтральную.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОН — или ионами водорода Н + из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
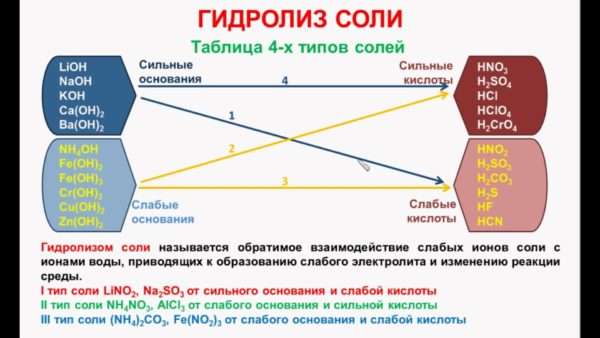
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу
Рассмотрим примеры гидролиза различных типов солей.
I. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону. Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н + молекулы воды, образуя слабый электролит (кислоту).
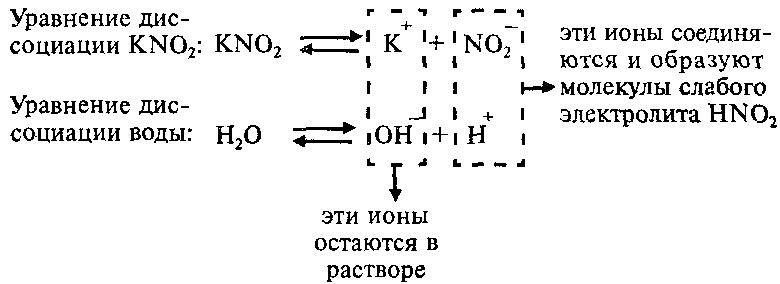
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
Соль KNO2 образована слабой одноосновной кислотой HNO2 и сильным основанием KОН, что можно изобразить схематически так:
Напишем уравнение гидролиза соли KNO2:
Каков механизм гидролиза этой соли?
Вывод: Соли, образованные сильным основанием и слабой кислотой, при растворении в воде показывают щелочную реакцию среды, pН > 7.
II. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН — воды, образуя слабый электролит (основание).
Пример: Составим молекулярное и ионное уравнения гидролиза йодида аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой НI:
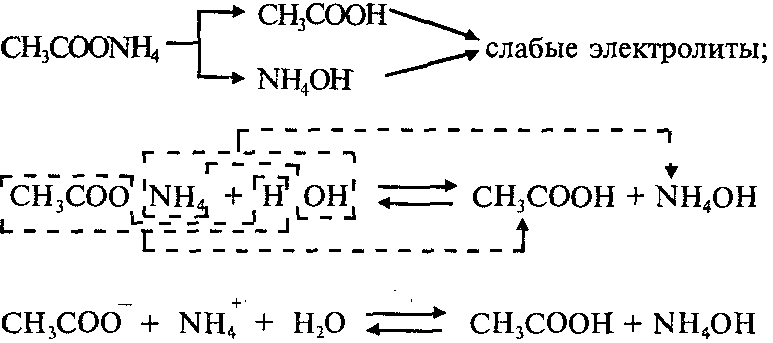
Пример 1: Составим уравнения гидролиза ацетата аммония CH3COONH4. Эта соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4ОH:
Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Kд(СН3СООН)=Kд(NH4ОH).
Пример 2: Составим уравнения гидролиза цианида аммония NH4CN. Эта соль образована слабой кислотой HCN и слабым основанием NH4ОH:
Реакция раствора соли NH4CN — слабощелочная (pН > 7), потому что Kд(NH4ОH)> Kд(HCN).
Как уже было отмечено, для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз является необратимым.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, К ним, например, относятся:
Пример: Составим уравнение гидролиза сульфида алюминия Al2S3:
Гидролиз сульфида алюминия протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S.
Поэтому в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей (нераствориой) кислоты. Например:
Суммируя эти уравнения, получаем:
IV. Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н + или ОН — воды, т. е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается. Среда растворов этих солей — нейтральная (рН = 7,0), так как концентрации ионов Н + и ОН — в их растворах равны, как в чистой воде.
Вывод: Соли, образованные сильной кислотой и сильным основанием, при растворении в воде гидролизу не подвергаются и показывают нейтральную реакцию среды (рН = 7,0).
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Рассмотрим случаи ступенчатого гидролиза.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуюгся соли Na2SO3, Rb2CО3, K2SiO3, Li3PO4 и др.
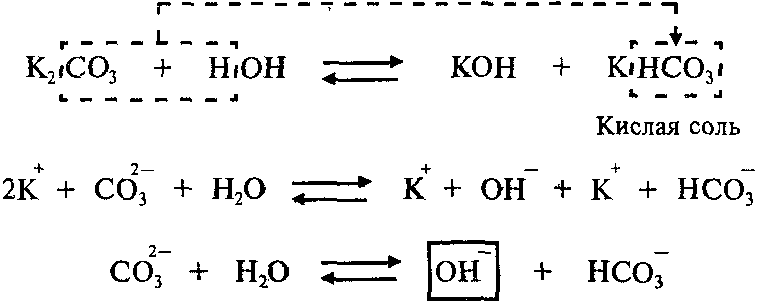
Пример: Составим молекулярное и ионное уравнения гидролиза карбоната калия K2СО3.
Гидролиз соли K2СО3 протекает по аниону, потому что соль карбонат калия образована слабой кислотой Н2СО3 и сильным основанием KОН:
Так как Н2СО3 – двухосновная кислота, гидролиз K2СО3 протекает по двум ступеням.
Продуктами первой ступени гидролиза K2СО3 являются кислая соль KHCO3 и гидроксид калия KОН.
Вторая ступень (гидролиз кислой соли, которая образовалась в результате первой ступени):
Продуктами второй ступени гидролиза K2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени.
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSО4, CoI2, Al2(SO4)3, ZnBr2 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза хлорида никеля (II) NiCl2.
Гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой НСl. Катион Ni 2+ связывает гидроксид-ионы ОН — воды. Ni(OH)2 — двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Продуктами первой ступени гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень (гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НCl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Поэтому можно дать более общее определение процесса гидролиза:
Гидролиз — это реакция обменного разложения веществ водой.
Для чего делают и что это такое гидролиз солей
Вода — самый распространенный на земле растворитель. Особенно хорошо в ней растворяются вещества ионного строения, такие как соли. При попадании в воду растворимые соли диссоциируют — разделяются на ионы. Но некоторые вещества не просто растворяются, а разлагаются водой. При этом возникают новые вещества. Такой процесс называется гидролизом. Что такое гидролиз?
Определение
Реакция между растворителем и растворяемым веществом, при которой они оба разделяются на составные части, а продуктами становятся новые вещества, называется сольволизом. Гидролиз в химии — это частный случай такой реакции, где в роли растворителя выступает вода.

Википедия приводит такое определение гидролиза. Это взаимодействие с водой, в ходе которого вещество разлагается на составные части, и получаются новые соединения. Такие реакции значительно отличаются у органических и неорганических веществ, солей, протеинов, липидов и прочих.

В общем виде уравнение выглядит так:
где MA — соль, HA — кислота, MOH — основание.
Что такое гидролиз солей? Это реакция обмена ионами между Н2О и растворимой солью. Если результат такого взаимодействия соединения, которые плохо диссоциируют, то продуктами такого превращения будут слабые электролиты. Гидролиз как реакция — процесс, противоположный нейтрализации. В отличие от нее он эндотермический. Он может идти обратимо и необратимо.
Какой процесс называется необратимым гидролизом? Реакция гидролиза необратима, если продукт реакции выводится из раствора, то есть осаждается или улетучивается в виде газа, а также если получается и газ, и осадок.
Это интересно! Как отличить металлы и неметаллы в таблице элементов Менделеева
То, как пойдет процесс, зависит от свойств основания и кислоты, образовавших конкретное соединение.
Обратите внимание! Соль сильной кислоты и сильного основания не гидролизуется, раствор будет с нейтральным pH.

Полезное видео: гидролиз солей
Формула
Как делать эту реакцию? Для этого соль нужно поместить в воду, но они могут и не начать реагировать друг с другом. Реакция пойдет при наличии ионов слабого основания или слабой кислоты.
Как записать уравнение реакции? Формула записывается по следующему алгоритму.
Пример — уксуснокислый калий CH3COOK.
Уравнение диссоциации: CH3COOK⇄ CH3COO- + K+
Это соединение состоит из положительного иона сильной щелочи КОН и отрицательного слабой СН3СООН. Реакция гидролиза идет по аниону.
Полное ионное уравнение:
CH3COO- + К+ +НОН ⇄CH3COOН + К+ +ОН-
Остался гидроксид-ион, значит pH щелочной.
Отбрасываем катионы калия с обеих сторон:
CH3COO- +НОН⇄СН3СООН +ОН-
Степень гидролиза
Важно! Степень гидролиза — это его количественная характеристика. Это отношение количества гидролизовавшегося соединения к его общему количеству в процентах. Ее обозначают греческой буквой альфа или h_гидр.
От чего зависит эта величина?
Это интересно! Уроки химии: что это такое галогены
У соединения сильной кислоты и основания степень нулевая (разложения не происходит), а у слабых эта величина велика (почти вся соль гидролизуется).
Еще одна характеристика такого процесса разложения— константа гидролиза К_g. Это константа равновесия для гидролиза. Она показывает, насколько вещество склонно гидролизоваться.
Константу можно выразить через степень:
Обычно h_гидр — очень маленькое число, поэтому соотношение можно упростить: К_g = h_гидр2*С. Это соотношение справедливо для неорганических солей.

Практическое применение и значение
Реакции разложения водой распространены в природе, а человек нашел им применение в быту и в производстве:
Это интересно! Что такое ковалентная связь – полярная и неполярная
Полезное видео: гидролиз солей — классификация солей
Заключение
Гидролиз — это разложение веществ водой с образованием новых соединений. Реакции такого типа многообразны и сильно отличаются для разных классов веществ. Многие из них используются в быту и промышленности. Разложение водой органических веществ происходит при пищеварении. Основные характеристики этого процесса — это его степень и константа.
ГИДРОЛИЗ СОЛЕЙ. Гидролизом соли называется реакция обменного взаимодействия соли с водой, в результате чего нарушается равновесие диссоциации воды:



Гидролизом соли называется реакция обменного взаимодействия соли с водой, в результате чего нарушается равновесие диссоциации воды:
Соли можно рассматривать как продукты реакции нейтрализации:
 |
Кислота + основание соль + вода
Кислоты и основания, образующие соли, могут быть сильными и слабыми, поэтому возможны 4 вида солей:
— сокращенное ионное уравнение;
Рассмотрим гидролиз FeCl3. Он будет протекать по катиону в три ступени:
I ступень Fе 3+ + Н2О ↔ FeОН 2+ + Н + ;
II ступень FeОН 2+ + Н2О ↔ Fe(ОН) + 2 + Н + ;
Рассмотрим гидролиз Na3РО4, он будет протекать по аниону в 3 ступени:
На всех трех ступенях гидролиз идет по аниону, среда щелочная (рН>7). Преобладает I ступень гидролиза.
Гидролиз идет по катиону и по аниону, среда нейтральная (рН=7).
Если смешать растворы двух солей, образованных катионом слабого основания и анионом слабой кислоты, произойдёт совместный необратимый гидролиз:
На равновесие гидролиза влияет температура и концентрация. Смещение равновесия гидролиза происходит в соответствии с принципом Ле-Шателье. Гидролиз – это реакция, обратная нейтрализации, а нейтрализация – экзотермический процесс, следовательно, гидролиз – эндотермический. Поэтому увеличение температуры усиливает гидролиз (т.е. смещает равновесие вправо). Гидролиз усиливается при разбавлении водой и при удалении продуктов гидролиза. Гидролиз подавляется (равновесие смещается влево), если увеличивать концентрацию продуктов гидролиза. Гидролиз может протекать необратимо, если продукты гидролиза уходят из сферы реакции (выпадение осадка, выделение газа):
Гидролиз
Гидро́лиз (от др.-греч. ὕδωρ — вода и λύσις — разложение) — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Механизм гидролиза соединений различных классов: соли, углеводы, белки, сложные эфиры, жиры и др. имеет существенные различия.
Содержание
Гидролиз солей
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей [1] :
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая диссоциация.
Степень гидролиза
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
В качестве примера ниже приводится вывод уравнения константы гидролиза соли, образованной слабой кислотой и сильным основанием:
Уравнение константы равновесия для данной реакции имеет вид:

Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянных 
Численное значение константы гидролиза получим, используя ионное произведение воды 

подставим в уравнение константы гидролиза равна:
В общем случае для соли, образованной слабой кислотой и сильным основанием:


для соли, образованной сильной кислотой и слабым основанием:


для соли, образованной слабой кислотой и слабым основанием:
Гидролиз органических веществ
Живые организмы осуществляют гидролиз различных органических веществ в ходе реакций катаболизма при участии ферментов. Например,в ходе гидролиза при участии пищеварительных ферментов белки расщепляются на аминокислоты, жиры — на глицерин и жирные кислоты, полисахариды (например, крахмал и целлюлоза) — на моносахариды (например, на глюкозу), нуклеиновые кислоты — на свободные нуклеотиды.
При гидролизе жиров в присутствии щёлочей получают мыло; гидролиз жиров в присутствии катализаторов применяется для получения глицерина и жирных кислот. Гидролизом древесины получают этанол, а продукты гидролиза торфа находят применение в производстве кормовых дрожжей, воска, удобрений и др.
См. также
Примечания
Полезное
Смотреть что такое «Гидролиз» в других словарях:
гидролиз — гидролиз … Орфографический словарь-справочник
ГИДРОЛИЗ — ГИДРОЛИЗ, химическая реакция разделения молекул вещества при взаимодействии с водой. Часто происходит в присутствии КАТАЛИЗАТОРА. Например, при пищеварении ФЕРМЕНТЫ катализируют ГИДРОЛИЗ УГЛЕВОДОВ, БЕЛКОВ и ЖИРОВ, и образуются молекулы, которые… … Научно-технический энциклопедический словарь
гидролиз — фотогидролиз, сольволиз Словарь русских синонимов. гидролиз сущ., кол во синонимов: 3 • реакция (33) • … Словарь синонимов
гидролиз — а, м. hydrolyse f. Реакция ионного обмена между веществами и водой. БАС 2. Лекс. Гранат: гидролиз; Уш. 1935: гидро/лиз; БСЭ 2: гидро/лизный … Исторический словарь галлицизмов русского языка
ГИДРОЛИЗ — (от греч. hydor вода и lysis разделение), процессы расщепления молекул сложных хим. соединений за счет присоединения элементов воды. Следует различать Г. электролитов (гидролитическая диссоциация) и Г. органических соединений. Г и д ролитическая… … Большая медицинская энциклопедия
ГИДРОЛИЗ — (от гидро. и. лиз), химическая реакция разложения вещества водой, например превращение солей в основания и кислоты, крахмала в глюкозу, природных жиров в глицерин и карбоновые кислоты (омыление) … Современная энциклопедия
ГИДРОЛИЗ — ГИДРОЛИЗ, гидролиза, муж. (от греч. hydor вода и lysis развязывание) (хим.). Химическое разложение некоторых веществ действием воды. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ГИДРОЛИЗ — ГИДРОЛИЗ, а, муж. (спец.). Реакция обменного разложения соединений с водой. | прил. гидролизный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ГИДРОЛИЗ — реакция обменного разложения между водой и разл. хим. соединениями, способными под действием воды расщепляться на более низкомолекулярные соединения с присоединением элементов воды (Н и ОН) по месту разрыва связей. К числу соединений, способных… … Геологическая энциклопедия
гидролиз — Обменная реакция между веществом и водой, приводящая к изменению рН раствора; количеств. характеризуется константой равновесия реакции гидролиза. Кг и а отношением числа частиц ионов или молекул, подвергшихся гидролизу к общему числу частиц,… … Справочник технического переводчика