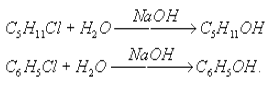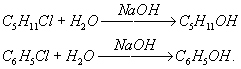Что называют гидролизом какие варианты гидролиза вы знаете
Типы гидролиза
Понятие гидролиз
Если рассматривать гидролиз солей, то гидролизу подвергаются средние и кислые соли, в образовании которых участвовали сильная кислота и слабое основание (FeSO4, ZnCl2), слабая кислота и сильное основание (NaCO3, CaSO3), слабая кислота и слабое основание ((NH4)2CO3, BeSiO3). Если соль получена путем взаимодействия сильных кислоты и основания (NaCl, K2SO4) реакция гидролиза не протекает.
Типы гидролиза
Выделяют несколько типов гидролиза, среди которых наибольшее значение имеют:
а) гидролиз по аниону
Этот тип гидролиза характерен только для неорганических и органических солей, в образовании которых участвовали слабая кислота и сильное основание, например, по аниону гидролизуются метасиликат натрия (Na2SiO3), формиат натрия (HCOONa), ацетат калия (CH3COOK), сульфит кальция (CaSO3) и т.д.
Рассмотрим более подробно на примере ацетата калия (CH3COOK). Данная соль образована сильным основанием — гидроксидом калия (KOH)и слабой кислотой — уксусной (CH3COOH). Уравнение гидролиза будет выглядеть следующим образом:
CH3COOK ↔ СH3COO — + K + (диссоциация соли);
СH3COO — + K + + H2O ↔ CH3COOH + K + + OH — (полное ионное уравнение);
СH3COO — + H2O ↔ CH3COOH + OH — (сокращенное ионное уравнение);
CH3COOK + H2O↔ CH3COOH + KOH (молекулярное уравнение).
Наличие ионов OH — в растворе свидетельствует о щелочном характере среды.
б) гидролиз по катиону
Этот тип гидролиза также характерен только для неорганических солей, в образовании которых участвовали сильная кислота и слабое основание, например, по катиону гидролизуются хлорид железа (III) (FeCl3), сульфат меди (II) (CuSO4), нитрат бериллия (Be(NO3)2) и т.д.
Рассмотрим более подробно на примере нитрата бериллия (Be(NO3)2). Данная соль образована слабым основанием — гидроксидом бериллия (Be(OH)2) и сильной кислотой — азотной (HNO3). Уравнение гидролиза будет выглядеть следующим образом:
Be 2+ + 2NO3 — + H2O ↔ BeOH + + H + + 2NO3 — (полное ионное уравнение);
Be 2+ +H2O ↔ BeOH + + H + (сокращенное ионное уравнение);
Теоретически возможна вторая ступень гидролиза:
Be(OH)NO3 ↔ BeOH + + NO3 — (диссоциация соли);
BeOH + + NO3 — + H2O ↔ Be(OH)2 + H + + NO3 — (полное ионное уравнение);
BeOH + + H2O ↔ Be(OH)2 + H + (сокращенное ионное уравнение);
Наличие ионов H + свидетельствует о кислом характере среды.
в) гидролиз и по катиону, и по аниону
Этот тип гидролиза характерен только для неорганических и органических солей, в образовании которых участвовали слабая кислота и слабое основание. Например, по катиону и аниону гидролизуются сульфит аммония (NH4SO3), сульфид железа (II) (FeS), нитрит меди (II) (Cu(NO2)2) и т.д.
Рассмотрим более подробно на примере сульфида серы. Данная соль образована слабым основанием — гидроксидом железа (II) (Fe(OH)2) и слабой кислотой — сероводородной (H2S). Уравнение гидролиза будет выглядеть следующим образом:
FeS ↔ Fe 2+ + S 2- (диссоциация соли);
FeS — + H2O ↔ Fe(OH)2↓+ H2S↑ (молекулярное уравнение).
г) щелочной гидролиз
Этот тип гидролиза характерен только органических соединений.Вещество гидролизуется под действием щелочей. Рассмотрим более подробно на примере галогенпроизводных:
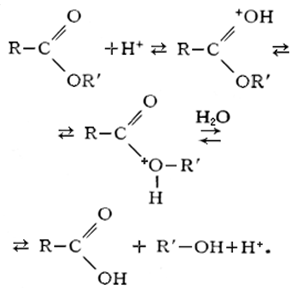
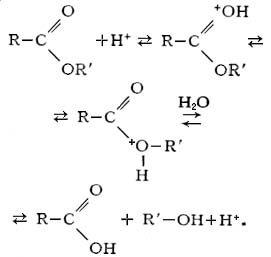
д) кислотный гидролиз
Этот тип гидролиза характерен только органических соединений. Вещество гидролизуется в присутствии сильных минеральных кислот (чаще всего соляной — HCl и серной-H2SO4). Рассмотрим более подробно на примере сложных эфиров:
е) ферментативный гидролиз
Такому типу гидролизу подвергают биополимеры, например, белки и углеводы: на одной из стадий гидролиза для более быстрого расщепления высокомолекулярных соединений в реакционную смесь вводят энзимы (ферменты).
Виды гидролиза
Общие понятия
Под гидролизом понимают процесс, протекающий при взаимодействии веществ с водой. Гидролизу подвергаются соли, а также некоторые органические соединения (жиры, углеводы, белки и др.). Обязательным условием для возможности соли гидролизоваться, является наличие в её «составе» слабого иона, т.е. соль должна быть образована сильным основанием и слабой кислотой, слабым основанием и сильной кислотой или же слабым основанием и слабой кислотой.
Гидролиз по аниону
Гидролизу по аниону подвергаются соли, в образовании которых участвовали слабая кислота и сильное основание (Na2SiO3, HCOONa, CH3COOK, CaSO3 и т.д.).
Рассмотрим на примере ацетата калия (CH3COOK). Соль образована гидроксидом калия (KOH– сильное) и уксусной кислотой (CH3COOH– слабая). Одноосновная. Запишем уравнение гидролиза:
CH3COOK ↔ СH3COO — + K + (диссоциация соли);
СH3COO — + K + + HOH ↔ CH3COOH + K + + OH — (ионное уравнение);
CH3COOK + H2O↔ CH3COOH + KOH (молекулярное уравнение).
Наличие гидроксид ионов свидетельствует о щелочном характере среды.
Гидролиз по катиону
Гидролизу по катиону подвергаются соли, в образовании которых участвовали сильная кислота и слабое основание (FeCl3, CuSO4, Be(NO3)2 и т.д.).
Рассмотрим на примере нитрата бериллия (Be(NO3)2). Соль образована гидроксидом бериллия (Be(OH)2 – слабое) и азотной кислоты (HNO3 – сильная). Запишем уравнение гидролиза:
Be 2+ + 2NO3 — + HOH ↔ BeOH + + H + + 2NO3 — (ионное уравнение);
Be(OH)NO3 ↔ BeOH + + NO3 — (диссоциация соли);
BeOH + + NO3 — + HOH ↔ Be(OH)2 + H + + 2NO3 — (ионное уравнение);
Be(OH)NO3 + HOH ↔ Be(OH)2 + HNO3 (молекулярное уравнение).
Наличие ионов водорода свидетельствует о кислом характере среды.
Гидролиз и по катиону, и по аниону
Гидролизу и по катиону, и по аниону подвергаются соли, в образовании которых участвовали слабая кислота и слабое основание (NH4SO3, FeS, Cu(NO2)2 и т.д.).
Рассмотрим на примере сульфида серы (FeS). Соль образована гидроксидом железа (II) (Fe(OH)2 – слабое) и сероводородной кислоты (H2S – слабая). Запишем уравнение гидролиза:
FeS ↔ Fe 2+ + S 2- (диссоциация соли);
FeS — + HOH ↔ Fe(OH)2↓+ H2S↑ (молекулярное уравнение).
Уравнение в ионной форме в этом случае не записывают. Среда нейтральная.
Щелочной гидролиз
Гидролиз органических соединений протекает при определенных условиях. Так, в случае, если вещество гидролизуется под действием щелочей, то процесс называют щелочным гидролизом. Рассмотрим на примере галогенпроизводных:
Кислотный гидролиз
Кислотный гидролиз характерен для органических соединений. Его проводят в присутствии сильных минеральных кислот (чаще всего соляной — HCl и серной-H2SO4). Рассмотрим на примере сложных эфиров:
Ферментативный гидролиз
Условно выделяют ферментативный тип гидролиза. Это кислотный гидролиз белков и углеводов, на одной из стадий которого для более быстрого расщепления высокомолекулярных соединений в реакционную смесь вводят энзимы (ферменты).
Примеры решения задач
| Задание | Укажите тип гидролиза следующих солей: NH4Cl, NaNO2, CaSO4, ZnS, AlCl3, K2SiO3. |
| Решение | Соли хлорид аммония (NH4Cl) и хлорид алюминия (AlCl3) гидролизуются по катиону, поскольку обе образованы сильной кислотой – соляной (HCl) и слабыми основаниями – гидроксидом алюминия (Al(OH)3) и аммония (NH4OH), соответственно. |
Соли нитрит натрия (NaNO2) и силикат калия (K2SiO3) гидролизуются по аниону, поскольку обе образованы сильными основаниями – гидроксидом натрия (NaOH) и калия (KOH) и слабыми кислотами – азотистой (HNO2) и кремниевой (H2SiO3), соответственно.
Соль сульфид цинка (ZnS)гидролизуется и по катиону, и по аниону, поскольку в её образовании участвовали слабая кислота – сероводородная (H2S) и слабое основание – гидроксид цинка (Zn(OH)2).
Соль сульфат кальция (CaSO4) гидролизу не подвергается, поскольку образована сильными кислотой (серная – H2SO4) и основанием (гидроксид кальция – Ca(OH)2).
Типы гидролиза солей



Химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита и сопровождающееся изменением рН раствора, называется гидролизом солей.
Любую соль можно представить как продукт взаимодействия кислоты и основания. Тип гидролиза соли зависит от природы основания и кислоты, образующих соль. Возможны 3 типа гидролиза солей.
Гидролиз по аниону идет, если соль образована катионом сильного основания и анионом слабой кислоты.
Ионно-молекулярное уравнение гидролиза соли:
Ионы Н + воды связываются с анионами СН3СОО – в слабый электролит СН3СООН, ионы ОН – накапливаются в растворе, создавая щелочную среду (рН>7).
Молекулярное уравнение гидролиза соли:
Гидролиз солей многоосновных кислот протекает по стадиям, образуя в качестве промежуточных продуктов кислые соли.
Например, соль K2S образована сильным основанием КОН и слабой двухосновной кислотой H2S. Гидролиз этой соли протекает в две стадии.
1 стадия: S 2– + HOH « HS – + OH –
Гидролиз по катиону идет, если соль образована катионом слабого основания и анионом сильной кислоты. Например, соль CuSO4 образована слабым двухкислотным основанием Cu(OH)2 и сильной кислотой H2SO4. Гидролиз идет по катиону Cu 2+ и протекает в две стадии с образованием в качестве промежуточного продукта основной соли.
1 стадия: Cu 2+ + HOH « CuOH + + H +
2 стадия: CuOH + + HOH « Cu(OH)2 + H +
Ионы водорода Н + накапливаются в растворе, создавая кислую среду (рН + и аниону СН3СОО – :
Водные растворы такого типа солей, в зависимости от степени диссоциации образующихся слабых электролитов имеют нейтральную, слабокислую или слабощелочную среду.
При смешивании растворов солей, например CrCl3 и Na2S каждая из солей гидролизуется необратимо до конца с образованием слабого основания и слабой кислоты.
Гидролиз соли CrCl3 идет по катиону:
Cr 3+ + HOH « CrOH 2+ + H +
Гидролиз соли Na2S идет по аниону:
При смешивании растворов солей CrCl3 и Na2S происходит взаимное усиление гидролиза каждой из солей, так как ионы Н + и ОН – образуют слабый электролит Н2О и ионное равновесие каждой соли смещается в сторону образования конечных продуктов: гидроксида хрома Cr(OH)3 и сероводородной кислоты H2S.
Ионно-молекулярное уравнение совместного гидролиза солей:
Соли, образованные катионами сильных оснований и анионами сильных кислот, гидролизу не подвергаются, так как ни один из ионов соли не образует с ионами Н + и ОН – воды слабых электролитов. Водные растворы таких солей имеют нейтральную среду.
Гидролиз
Гидро́лиз (от др.-греч. ὕδωρ — вода и λύσις — разложение) — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Механизм гидролиза соединений различных классов: соли, углеводы, белки, сложные эфиры, жиры и др. имеет существенные различия.
Содержание
Гидролиз солей
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей [1] :
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая диссоциация.
Степень гидролиза
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
В качестве примера ниже приводится вывод уравнения константы гидролиза соли, образованной слабой кислотой и сильным основанием:
Уравнение константы равновесия для данной реакции имеет вид:

Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянных 
Численное значение константы гидролиза получим, используя ионное произведение воды 

подставим в уравнение константы гидролиза равна:
В общем случае для соли, образованной слабой кислотой и сильным основанием:


для соли, образованной сильной кислотой и слабым основанием:


для соли, образованной слабой кислотой и слабым основанием:
Гидролиз органических веществ
Живые организмы осуществляют гидролиз различных органических веществ в ходе реакций катаболизма при участии ферментов. Например,в ходе гидролиза при участии пищеварительных ферментов белки расщепляются на аминокислоты, жиры — на глицерин и жирные кислоты, полисахариды (например, крахмал и целлюлоза) — на моносахариды (например, на глюкозу), нуклеиновые кислоты — на свободные нуклеотиды.
При гидролизе жиров в присутствии щёлочей получают мыло; гидролиз жиров в присутствии катализаторов применяется для получения глицерина и жирных кислот. Гидролизом древесины получают этанол, а продукты гидролиза торфа находят применение в производстве кормовых дрожжей, воска, удобрений и др.
См. также
Примечания
Полезное
Смотреть что такое «Гидролиз» в других словарях:
гидролиз — гидролиз … Орфографический словарь-справочник
ГИДРОЛИЗ — ГИДРОЛИЗ, химическая реакция разделения молекул вещества при взаимодействии с водой. Часто происходит в присутствии КАТАЛИЗАТОРА. Например, при пищеварении ФЕРМЕНТЫ катализируют ГИДРОЛИЗ УГЛЕВОДОВ, БЕЛКОВ и ЖИРОВ, и образуются молекулы, которые… … Научно-технический энциклопедический словарь
гидролиз — фотогидролиз, сольволиз Словарь русских синонимов. гидролиз сущ., кол во синонимов: 3 • реакция (33) • … Словарь синонимов
гидролиз — а, м. hydrolyse f. Реакция ионного обмена между веществами и водой. БАС 2. Лекс. Гранат: гидролиз; Уш. 1935: гидро/лиз; БСЭ 2: гидро/лизный … Исторический словарь галлицизмов русского языка
ГИДРОЛИЗ — (от греч. hydor вода и lysis разделение), процессы расщепления молекул сложных хим. соединений за счет присоединения элементов воды. Следует различать Г. электролитов (гидролитическая диссоциация) и Г. органических соединений. Г и д ролитическая… … Большая медицинская энциклопедия
ГИДРОЛИЗ — (от гидро. и. лиз), химическая реакция разложения вещества водой, например превращение солей в основания и кислоты, крахмала в глюкозу, природных жиров в глицерин и карбоновые кислоты (омыление) … Современная энциклопедия
ГИДРОЛИЗ — ГИДРОЛИЗ, гидролиза, муж. (от греч. hydor вода и lysis развязывание) (хим.). Химическое разложение некоторых веществ действием воды. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ГИДРОЛИЗ — ГИДРОЛИЗ, а, муж. (спец.). Реакция обменного разложения соединений с водой. | прил. гидролизный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ГИДРОЛИЗ — реакция обменного разложения между водой и разл. хим. соединениями, способными под действием воды расщепляться на более низкомолекулярные соединения с присоединением элементов воды (Н и ОН) по месту разрыва связей. К числу соединений, способных… … Геологическая энциклопедия
гидролиз — Обменная реакция между веществом и водой, приводящая к изменению рН раствора; количеств. характеризуется константой равновесия реакции гидролиза. Кг и а отношением числа частиц ионов или молекул, подвергшихся гидролизу к общему числу частиц,… … Справочник технического переводчика
Гидролиз солей
Исследуем действие универсального индикатора на растворы некоторых солей
Как мы видим, среда первого раствора — нейтральная (рН=7), второго — кислая (рН 7). Чем же объяснить столь интересный факт? 🙂
Для начала, давайте вспомним, что такое pH и от чего он зависит.
За счет чего же в некоторых водных растворах солей происходит нарушение равенства концентраций ионов водорода и гидроксид-ионов?
Дело в том, что происходит смещение равновесия диссоциации воды вследствие связывания одного из ее ионов ([H + ] или [OH — ]) с ионами соли с образованием малодиссоциированного, труднорастворимого или летучего продукта. Это и есть суть гидролиза.
Слово «гидролиз» означает разложение водой («гидро»-вода, «лизис» — разложение).
В зависимости от того какой ион соли вступает во взаимодействие с водой, различают три типа гидролиза:
Любую соль можно рассматривать как продукт, образованный взаимодействием основания и кислоты:
Гидролиз по аниону
Гидролиз по катиону
1) Ni(NO3)2 = Ni 2+ + 2NO3 − (диссоциация)
2) Ni 2+ + H2O ↔ NiOH + + H + (гидролиз)
Диссоциация соли Ni(NO3)2 протекает нацело, гидролиз катиона Ni 2+ − в очень малой степени (для 0,1М раствора − на 0,001%), но этого оказывается достаточно, чтобы среда стала кислотной (среди продуктов гидролиза присутствует ион H + ).
Катион аммония в результате гидролиза образует слабое основание − гидрат аммиака и катион водорода:
Обратите внимание, что нельзя увеличивать число молекул воды и вместо гидроксокатионов (например, NiOH + ) писать формулы гидроксидов (например, Ni(OH)2). Если бы гидроксиды образовались, то из растворов солей выпали бы осадки, чего не наблюдается (эти соли образуют прозрачные растворы).
Избыток катионов водорода легко обнаружить индикатором или измерить специальными приборами. В концентрированный раствор сильно гидролизующейся по катиону соли, вносится магний или цинк, то последние реагируют с кислотой с выделением водорода.
Если соль нерастворимая — то гидролиза нет, т.к ионы не взаимодействуют с водой.